En los últimos años las técnicas de revascularización de los miembros inferiores (MMII) a nivel infrainguinal han cambiado y siguen cambiando a un ritmo considerable, debido al avance de los procedimientos endovasculares, gracias a la aparición de nuevos materiales y de diversos dispositivos, lo que hace que el cirujano vascular se enfrente a todo un arsenal variado que debe conocer, saber sus indicaciones, así como sus bondades e inconvenientes, de la misma forma que debe saber estar al día de los estudios que avalen los resultados de estas técnicas.
Es por eso que el Capítulo Endovascular de la Sociedad Española de Angiología y Cirugía Vascular (SEACV) decidió elaborar una guía de los diferentes procedimientos endovasculares para la revascularización y tratamiento de los diferentes sectores del árbol vascular, coordinada por su comité científico. En el presente artículo se desarrolla esta guía, en referencia al sector infrainguinal, realizando una actualización y puesta al día de los diferentes procedimientos, vías de abordaje, técnicas, materiales y dispositivos. El objetivo es ofrecer al cirujano vascular una visión global y actualizada de los distintos procedimientos que se pueden llevar a cabo en los MMII, para poder así ofertar a los pacientes la mejor opción en cada caso y poder lograr la mejor tasa de éxitos posible, apoyados en el concepto de emplear el método de la medicina basada en la evidencia.
In the last few years infrainguinal revascularisation techniques on the lower limbs have changed and continue to change at considerable speed due to advances in endovascular procedures. This is mainly due to the appearance of new and diverse materials and devices, which now means that vascular surgeons are currently faced with a varied armamentarium that they must be familiar with, know their indications, as well as their limits and disadvantages. Likewise, they must keep up to date with studies that support the results of these techniques.
It is for these reasons that the Endovascular Chapter of the Spanish Angiology and Vascular Surgery (SEACV) decided to prepare a guide of the different endovascular procedures for the revascularisation and treatment of different sectors of the vascular tree, which was coordinated by its Scientific Committee. The present article describes this guide as regards the infrainguinal sector, reviewing and updating the different procedures, approaches, techniques, material and devices. The aim is to provide the vascular surgeon with an overall and updatedview of the different procedures that can be performed on the lower limbs, in order to offere patients the best option in each case and to achieve the best possible success rate, supported by the concept of using a medical evidence-based method.
La aplicación de las técnicas endovasculares en el sector infrainguinal ha supuesto un cambio en el concepto del tratamiento de la arteriosclerosis obliterante del sector fémoro-poplíteo (FP), ya que la mayoría de los autores hablan de tasa de salvación de extremidad en vez de permeabilidad. Con la aplicación de las distintas técnicas de revascularización (angioplastia simple, recanalización subintimal, stenting, aterectomía, etc.), lo que buscamos es lograr la perfusión suficiente del pie, para curar una lesión trófica o mejorar el estadio clínico del paciente. La posibilidad de realizar la mayoría de estos procedimientos con anestesia local y con técnicas menos invasivas ha hecho que cada vez se vayan abriendo paso con más fuerza, hasta formar parte del arsenal terapéutico del cirujano vascular y que dispositivos como guías y catéteres no nos sean ajenos. Sin embargo, para que estos procedimientos tengan los resultados adecuados, debemos saber la evidencia que nos muestra la literatura y de ahí que sea preciso elaborar unas guías actualizadas, que nos muestren el camino a seguir.
En la actualidad, son diversas las técnicas que podemos utilizar para tratar una lesión en este sector y el arsenal terapéutico y los dispositivos que podemos encontrar son numerosos, de ahí que sea preciso elaborar una guía que sirva para orientarnos en la elección de aquello que en nuestro medio y con nuestra experiencia sea más adecuado. La intención en la redacción de este documento de base ha sido la de hacer una puesta al día en un campo tan cambiante y con un desarrollo tan veloz como es el que nos ocupa.
A lo largo de este documento queremos mostrar los avances en los métodos diagnósticos, los diversos dispositivos disponibles, el comportamiento de estos procedimientos en el sector femoral y en el sector distal, las situaciones especiales, como es la diabetes, los procedimientos combinados y los resultados y costes.
Iniciamos este trabajo con unas breves notas a cerca de la biomecánica de la AFS.
Características biomecánicas del tratamiento endovascular de la arteria femoral superficialLa AFS es la arteria periférica más frecuentemente afectada del árbol arterial. Se puede ver implicada en más del 50% de los casos de patología arterial periférica. Sus características anatomofisiológicas la hacen especialmente vulnerable a esta patología:
- 1.
Se trata de uno de los vasos más largos del cuerpo, rodeado de dos puntos importantes de flexión (proximal, la cadera y distal, la rodilla). El movimiento de los MMII somete a la AFS a fuerzas que la obligan a doblarse, a la compresión, la rotación, el acortamiento y la extensión.
- 2.
Tiene pocas colaterales, lo cual hace que desarrolle lesiones más difusas y extensa, y menos cortas y focales que en otros territorios.
- 3.
Las oclusiones predominan sobre las estenosis.
- 4.
El canal de los aductores desarrolla un flujo no laminar, sobre todo cuando se camina, que afecta a las paredes de este sector concreto de la AFS.
- 5.
Se trata de un sector con un bajo flujo y con una salida de alta resistencia.
Todo este entorno crea un ambiente hostil para la implantación de cualquier tratamiento endovascular. Stents implantados en otro sector del cuerpo no tienen la misma propensión al fallo y la fractura como en éste. Un estudio reciente con stent autoexpandibles de nitinol1 muestra una tasa de fractura del 24,5% en AFS con un seguimiento del 10,7 meses e incluso la tasa de reestenosis de este sector oscila entre el 30 y el 80%2,3. Se cree que la mayor parte de las reestenosis se deben a una mala interacción entre la funcionalidad, los movimientos naturales de la pierna y los dispositivos implantados que inducen traumatismos repetidos sobre la pared arterial.
Las características biomecánicas del sector femoropoplíteo4 son muy específicas. Durante la flexión de la cadera y al doblar la rodilla, la distancia longitudinal entre la cadera y la rodilla disminuye. El segmento arterial se tiene que acortar en longitud hasta en un 15 al 20%: primero se acorta el segmento recto de la AFS, luego se dobla u ondula el segmento más proximal a la rodilla y por último, la arteria poplítea adopta una posición en C5,6. La implantación de stents en estas circunstancias afecta directamente a la rigidez de la arteria e impide esta adaptación natural de la arteria. Los stents se acortan y alargan pobremente en comparación con la propia AFS. La longitud de los tratamientos endovasculares en este sector suelen tener de media unos 20cm. Un acortamiento fisiológico del 15% supone unos 3cm, a los que se tienen que adaptar los stents. Los wallstent iniciales resistían mal o débilmente estas situaciones. Las actuales generaciones de stents han mejorado bastante su resistencia a estas circunstancias, facilitando una mayor acomodación de las arterias al acortamiento, pero aun así todavía tienen importantes defectos. Cuanto más largos y rígidos son los stents, la capacidad de compresión axial se ve más comprometida7. La zona arterial desnuda de stents y adyacente a la zona recubierta tiende a doblarse de una manera exagerada, lo cual contribuye a acelerar la hiperplasia intimal y la oclusión en estos segmentos. Los tests de angulación de la pierna 90° antes y después de los procedimientos en este sector permiten evitar las zonas de mayor flexión, ya que existen importantes diferencias de angulación entre cada individuo. La máxima rigidez se alcanza cuando se colocan stent solapados, de tal modo que en las zonas de solapamiento existe el doble de rigidez y, por tanto, menos acortamiento. Sin embargo, si no se produce el solapamiento y aparece un hueco entre dos stents, al realizar los movimientos se producirá un cizallamiento que plicará a la arteria peligrosamente8. Otros estudios han demostrado que cuando la arteria no ha sido todavía tratada con un stent, es la parte más distal de la AFS/proximal de la arteria poplítea la que sufre la mayor compresión axial, 23% frente a 9% de la AFS media y 14% de la arteria poplítea. Mientras que cuando ya se ha implantado un stent, es la arteria poplítea la que sufre la mayor compresión axial, 11% frente a el 3% en la mitad de la AFS y un 6% para la parte más distal de la AFS/proximal de arteria poplítea9.
La arteria sana, distal a la zona con stents, sufre un mayor grado de plicatura, ya que la zona con stents es más rígida y no se puede acortar ni doblar, lo que obliga a la zona más distal a acortarse todo lo que no ha podido acortarse el segmento más proximal y esto puede dar lugar a una disminución de flujo cuando la pierna se dobla. Se han realizado estudios dinámicos mediante angiografía para identificar los puntos de mayor riesgo cuando se produce la flexión de la rodilla y su relación con las estructuras óseas10.
Por eso es importante para el tratamiento endovascular del sector femoropoplíteo, usar los stents con la mayor adaptabilidad que haya en el mercado y esperar a que se diseñe el stent ideal, que estaría compuesto de varios anillos independientes, no interconectados, que aportan refuerzo axial a la arteria pero que no impide la compresión axial fisiológica durante la deambulación o al doblar la rodilla y que se podría adaptar a los cambios de posición. Un amplio campo de investigación para la ingeniería de materiales y de diseños de nuevos dispositivos para este característico sector.
Exploraciones diagnósticasLa terapéutica de la patología isquémica de las extremidades inferiores mediante técnicas endovasculares precisa de métodos de exploración que permitan establecer una indicación adecuada, una realización correcta del procedimiento y un preciso seguimiento de sus resultados11.
La evaluación clínica y funcional, no invasiva, de los pacientes será la que determine el plan terapéutico. No obstante, la elección de la modalidad terapéutica quirúrgica que se debe aplicar a cada caso con indicación, cirugía convencional o endovascular o combinada, se debe apoyar en métodos de diagnóstico que aporten una exhaustiva información morfológica de la lesión, su localización y extensión, así como el estado de la pared arterial proximal y distal, sin olvidar, en lo concerniente a la permeabilidad, el estado global del flujo proximal (inflow) y los ejes de salida distal (outflow-runoff)12–14. Por lo tanto, a los métodos de diagnóstico de utilidad para la elección, indicación y realización específica de la terapéutica endovascular se les debe exigir: precisión referente a la localización, extensión, morfología, calcificación, grado de estenosis u oclusión de las lesiones y características globales del árbol arterial (tortuosidades, angulaciones, etc.) con el objetivo de la indicación de la técnica endovascular y su planificación preoperatoria detallada, incluida la selección a priori del material que se empleará12.
De los diferentes métodos de exploración disponibles en la actualidad, invasivos y no invasivos, solamente los que aportan información detallada mediante imagen de las lesiones son los que se considerarán válidos para la indicación y planificación de las técnicas endovasculares en los MMII, independientemente de que además aporten alguna información hemodinámica14. Fundamentalmente, se considerarán: ecografía-Doppler, angio-TC, angio-RM y arteriografía.
Ecografía DopplerEn la sistemática de empleo de la ecografía-Doppler para diagnóstico de las lesiones en el sector FP-distal, se recomienda el comienzo de la exploración en la zona proximal, arteria femoral común, y la exploración progresiva en sentido distal. En general, las áreas de estenosis son localizadas con Doppler-color y cuantificadas mediante análisis de velocidades y gradientes a distintos niveles15–22.
- –
Beneficios: permite establecer el diagnóstico de enfermedad arterial oclusiva en MMII asegura la localización anatómica precisa de las lesiones y permite cuantificar el grado de estenosis (evidencia grado A)12. También permite la selección de pacientes para tratamiento endovascular o quirúrgico (evidencia grado B)13.
- –
Inconvenientes: resolutividad diagnóstica deficitaria en sectores aorto-ilíacos en algunos pacientes (obesidad, gas intestinal) en lo referente a la valoración del inflow y a la existencia de angulaciones y tortuosidades, dato importante cuando se planifica una técnica endovascular que se realizará sobre el sector FP empleando la vía contralateral para acceso y navegación. Seguridad diagnóstica limitada ante extensas calcificaciones arteriales. Sensibilidad disminuida en la detección de estenosis distales precedidas de otra proximal12,13.
El punto de controversia actual radica en el papel que debe desempeñar la ecografía-Doppler en lo referente a la sustitución de la arteriografía como método de diagnóstico preoperatorio en pacientes con lesiones proximales a los vasos tibiales15–19. Un metaanálisis23 que analiza 14 estudios encuentra que la sensibilidad y especificidad de esta técnica para estenosis mayores del 50% u oclusiones es del 86 y el 97%, respectivamente, para lesiones localizadas en el sector aorto-ilíaco y del 80 y el 90%, respectivamente, para lesiones en el sector FP. Otros estudios refieren que esta exploración puede determinar que pacientes tienen una anatomía lesional candidata para tratamiento endovascular con una seguridad del 84-94%17,18.
Algunos autores23,25,26 describen el empleo exclusivo de la ecografía-Doppler tanto para la indicación como para el desarrollo técnico intraoperatorio del procedimiento, inclusive cuando se realiza la variante de la recanalización subintimal23, analizan 253 angioplastias en el sector infrainguinal en 196 pacientes, categorizando las lesiones tratadas según el consenso TASC con un 70% del tipo B y describen un 93% de éxito técnico del procedimiento, concluyendo que la angioplastia y stenting del sector infrainguinal guiado por eco-Doppler es una técnica segura y fiable que incluye entre sus ventajas la visualización y realización de punción y acceso ecodirigida, la selección precisa del calibre del balón y del stent, la valoración hemodinámica inmediata del resultado del procedimiento y la evitación de la exposición a radiación ionizante y al empleo de contraste radiológico. En este sentido, no conviene olvidar que todas las técnicas de imagen basadas en la ecografía son explorador/operador dependientes, por lo que este factor es de capital importancia a la hora de validar estas técnicas en lo referente a su aplicabilidad cotidiana en el desarrollo de los procedimientos endovasculares; sin embargo, en equipos con suficiente experiencia puede constituir una alternativa válida para pacientes con alergia a contrastes radiológicos o con riesgo de agravación de una insuficiencia renal previa con el empleo de los mismos.
Angio-TCEste método de obtención de imágenes, sobre todo en la modalidad multicorte, que permite la adquisición con resolución submilimétrica isotrópica del vóxel de la totalidad de las extremidades inferiores y abdomen24. Las ventajas que presenta son: detecta la enfermedad y su extensión anatómica, es capaz de detectar y cuantificar estenosis significativas. Además aporta información acerca de la pared arterial (aneurismas, atrapamientos de arteria poplítea, etc.), se artefacta poco por la presencia de clips metálicos o stents previos y se realiza rápidamente. Todo ello permite su uso para establecer la indicación de la modalidad de tratamiento (quirúrgico o endovascular). Datos iniciales indican que esta técnica aporta similares niveles de sensibilidad y especificidad que la arteriografía25. Se describe una sensibilidad del 95% para la detección de estenosis mayores del 50% u oclusiones, con especificidad del 96%; se describe un 8% de sobreestimación de la estenosis y un 15% de casos en los que subestima el grado de estenosis24.
No obstante, tiene como inconvenientes: menor resolución en la detección de estenosis y su gradación cuando se emplean detectores de baja resolución (< 1,5 T) comparada con la angiografía, menor resolución espacial que ésta, la seguridad y la efectividad no están determinadas tan bien como en la resonancia magnética (RM). No existen publicaciones donde se compare la efectividad del tratamiento indicado usando solo esta técnica respecto a la arteriografía, requiere inyecciones de contraste (limitación de uso en pacientes con alteración de la función renal) y usa radiación ionizante (menor que en la arteriografía).
Según establecen diversas guías, la angio-TC de MMII debe de considerarse como método de diagnóstico para la detección de la enfermedad, su extensión y la presencia y cuantificación de estenosis (evidencia nivel B)13, así como que debe considerarse como medio de diagnóstico sustitutivo de la RM cuando hay contraindicación para ésta (evidencia tipo B)13.
Resonancia magnética nuclearÚtil para el diagnóstico de enfermedad arterial periférica (EAP), localización y extensión de lesiones y cuantificación de estenosis, con clara capacidad para efectuar la indicación de la modalidad de tratamiento (quirúrgico o endovascular) (nivel A de evidencia)12,13,33; posibilita la adquisición de imágenes tridimensionales de alta resolución de aorta abdominal, ilíacas y sectores infrainguinales en un único estudio26–28, que pueden estudiarse en estaciones de procesado de imágenes digitales en múltiples planos. No obstante, tiende a sobreestimar las lesiones estenóticas y decrece su seguridad diagnostica cuando hay stents previos. Se recomienda la realización utilizando gadolinio como potenciador (nivel de evidencia B)13; se le asigna una sensibilidad y especificidad mayor del 93% para el diagnóstico de la EAP comparada con la arteriografía e igualmente su efectividad diagnóstica es mayor que la obtenida con el eco-Doppler color28. La RM de extremidades es útil para el seguimiento de procedimientos de revascularización endovasculares o quirúrgicos (nivel de evidencia B)13. Adolece de la posibilidad de obtener estudios de urgencia en muchos centros y está contraindicada, entre otras, en pacientes con insuficiencia renal crónica por la posibilidad de aparición del síndrome inflamatorio sistémico con el empleo del gadolinio como potenciador.
ArteriografíaEs el método más útil para la evaluación anatómica en la enfermedad arterial de MMII cuando se indica tratamiento quirúrgico o endovascular ya que aporta detallada información de la anatomía arterial (nivel de evidencia B) 12,13,32,33. Se recomienda el uso de la sustracción digital en la realización de los estudios dado que aumenta la resolución de la exploración y disminuye la necesidad de contraste (nivel de evidencia A)13.
El empleo de la cateterización selectiva o supraselectiva podría mejorar la sensibilidad y especificidad de esta exploración y disminuir la necesidad de contraste (nivel de evidencia C)13. Se recomienda la obtención de gradientes de presión y proyecciones anguladas cuando no se pueda precisar las características de la lesión en proyección anteroposterior (nivel de evidencia B)13. Se describe y recomienda que la indicación de tratamiento quirúrgico o endovascular en pacientes con EAP se establezca en base a un conocimiento completo del territorio arterial afectado, así como del estado de las arterias proximales y distales al mismo mediante la arteriografía o combinación de esta y otras técnicas no invasivas (nivel de evidencia B)13. En el estudio multicéntrico de Hessel29 sobre 118.591 arteriografías se refiere una tasa de mortalidad global de 0,025% y una tasa de complicaciones del 3,29% para abordaje axilar, el 2,89% translumbar y el 1,73% en abordaje femoral; otros estudios30 refieren tasas de complicaciones referidas al medio de contraste del 0,1% y riesgo de mortalidad del 0,16%31.
RecomendacionesLas técnicas de exploración no invasivas con obtención de imágenes, RM, TC y ecografía-Doppler color, se deben realizar previamente a la indicación de estudios invasivos (arteriografía) en el establecimiento de un plan terapéutico individualizado, que incluya la selección del lugar de acceso (punción arterial), identificación de lesiones significativas y determinación de la necesidad de realización de estudio arteriográfico (nivel de evidencia B)13.
La arteriografía con visualización desde la aorta infrarrenal hasta las arterias distales, empleando técnicas de sustracción digital, sigue suponiendo la elección mayoritaria como método de diagnóstico para la indicación precisa de tratamiento endovascular, así como para la ejecución del mismo12,33.
Parece razonable la realización de la arteriografía sólo durante la realización del procedimiento endovascular indicado en base a las exploraciones no invasivas (eco-Doppler, angio-RM y angio-TC) siempre que éstas aporten datos suficientes para la selección segura de pacientes y lesiones candidatas a ser tratadas por esta modalidad de tratamiento; no obstante, se precisa de más estudios que definitivamente aclaren esta cuestión.
Materiales y dispositivosDaremos unas pinceladas sobre los principales materiales y dispositivos básicos en la técnica endovascular de una forma genérica.
GuíasSon alambres finos que facilitan la navegación y el posicionamiento de los demás elementos empleados en cirugía endovascular. Se componen de un núcleo de acero habitualmente y de un recubrimiento diferente según el tipo de guía. Su extremo distal suele ser blando (floppy) de mayor o menor longitud para evitar lesionar el vaso y la forma de terminación puede ser recta, angulada o «J». Existen diferentes longitudes de cada una de ellas así como diámetros que se miden en pulgadas. Las de uso habitual en cirugía vascular oscilan entre 0,014” a 0,038” de diámetro y de 150cm a 300cm de longitud.
El recubrimiento puede ser teflón, PTFE o polímeros hidrofílicos.
Otras características importantes son rigidez o cuerpo (normales o regulares, rígidas o stiff, o superrígidas o super-stiff). La guía Amplatz TM presenta un cuerpo rígido con gran capacidad de empuje y torque (capacidad de girar punta al girar el extremo distal).
Las guías hidrofílicas (TerumoTM) adquieren una especial capacidad de navegación en contacto con fluidos, lo que unido a su capacidad de empuje las hace muy útiles en vasos tortuosos o angostos, pero por el contrario tienen la capacidad de disecar fácilmente por lo que su uso debe ser meticuloso.
Existen multitud de guías para realizar determinados procedimientos como NITREXTM, que con un alma de nitinol presenta una punta floppy radioopaca de oro-tungsteno muy visible. Sus características y diámetros, 0,014 y 0,018, la hacen muy útil en procedimientos carotídeos o renales junto con sistemas de intercambio rápido.
Las guías tipo Rosen son de cuerpo intermedio y facilitan el acceso para realizar intercambio y emplear el tipo de guía más adecuado al procedimiento que se debe realizar en función de la navegabilidad del dispositivo y del vaso.
CatéteresSon tubos huecos con diferentes configuraciones y composición que se utilizan con fines diagnósticos (pigtail, recto multiperforado...), terapéuticos (pulsespray) o para facilitar el acceso a otro vaso dando soporte a la guía empleada.
Las formas más conocidas son pigtail, multiuso, Judkins para aortografías, Headhunter y Simmon para ramas cerebrales; Hook, cobra para viscerales, y OmniFlushTM para abordaje contralateral.
Los catéteres guía, a los que se les puede aplicar una válvula hemostática, pueden realizar en sus diferentes configuraciones la misión de un introductor. Una diferencia importante con éstos es que su denominación en French (Fr) hace referencia al diámetro externo.
En los catéteres diagnósticos es importante considerar la presión de rotura o flujo máximo que admiten para evitar su rotura al utilizarlos con bomba inyectora. En esto influye mucho el material del que están construidos; así, el catéter teflonado es más resistente que el de polietileno, pero por el contrario es más rígido desaconsejándose en estudios selectivos. Documento de base para el tratamiento endovascular de patología arterial infrainguinal.
IntroductoresSon catéteres con válvula hemostática que impiden el reflujo de sangre. Presentan asimismo conectores laterales para el lavado del dispositivo. Son de diferentes diámetros en Fr que hace referencia al lumen interno. Existen de diferentes longitudes y su misión es proteger la navegación de los dispositivos y evitar lesiones en el vaso.
Pueden disponer de un soporte externo en forma de malla de diversos materiales, lo que les hace especialmente útiles cuando hay que atravesar ángulos pronunciados (contralateral o carótidas) para evitar el riesgo de plicaturas.
Balones de angioplastiaSon dispositivos para la dilatación de las arterias. Constan de un balón hinchable montado de forma coaxial al final de un catéter. Los balones se caracterizaran por sus cualidades que serán:
- 1.
Material del balón.
- 2.
Perfil.
- 3.
Mecanismo de dilatación.
- 4.
Sistema de navegación.
- 5.
Longitud de la punta más allá del balón (tip).
El cuerpo del catéter es habitualmente de nailon o teflón, que le confiere gran navegabilidad y baja trombogenicidad; el tip es habitualmente menor de 1cm.
Otros materiales empleados son el PET y poliuretano, que hacen que los balones tengan baja compliancia, soportando presiones de insuflado elevadas sin rotura.
En determinadas circunstancias (renales, carótidas, etc.) se emplean los balones de intercambio rápido (monorraíl). La diferencia fundamental de este tipo de balón es que el catéter presenta una sola luz central que es la de inflado, quedando la parte distal de la misma con una luz lateral para soportar la guía, habitualmente de 0,014 y 0,018”. Esto le confiere una gran ventaja que es una disminución importante en rigidez, y el uso de guías más cortas, con lo que el proceso es más rápido. Por el contrario, pierden empuje con respecto a los clásicos coaxiales utilizándose entonces en conjunto con catéteres guía o introductores largos.
StentSon dispositivos que se posicionan dentro de los vasos con la intención de sostener o «entibar» una estenosis. Básicamente son mallas cilíndricas construidas de diversos materiales (acero, nitinol, cromo-cobalto).
Es importante conocer:
- 1.
Método de liberación (pull-back o hinchables con balón).
- 2.
Flexibilidad.
- 3.
Tasa de acortamiento.
- 4.
Fuerza radial (tipo de celda cerrada o abierta).
- 5.
Radioopacidad (se suelen marcas extremos con diversos materiales: oro, tantalio, tungsteno...).
- 6.
Material del stent.
El diámetro final depende del balón sobre el que se montan. Normalmente, están construidos de acero tallado con láser. Tienen buena radioopacidad. Presentan mala adaptación a cambios de calibre en la arteria. Pueden tener una gran dificultad de navegación al estar montados en balón, sobre todo en zonas con estenosis críticas calcificadas. Normalmente, se dilatan los extremos del balón primero para fijar el mismo, por ejemplos, Palmaz, Vipstent, Strecker, Corinthian, Perflex, Express, Onda...
Stent autoexpandibleSon dos tipos de mecanismo de autoexpansión. Por construcción, como es el Wallstent (acero), o por material termosensible (nitinol). Los primeros se acortan al dilatarse pero por su tipo de construcción permiten recoger el stent y recolocarlo hasta un punto determinado en su liberación. Los de nitinol tienen como principal ventaja lo predecible de su distancia final con acortamiento 0, pero su visualización es mala, por lo que se procede a marcar extremos con tantalio, oro, etc.
Suelen ser más flexibles que los de balón expandible y existen multitud de diseños de celda con objeto de conjugar flexibilidad fuerza radial y resistencia.
Al no ir premontados en el balón, puede rebajarse el perfil encontrándonos con stent de 5F actualmente y que navegan en guías de 0,018.
Tipos especiales serían aquellos que están configurados en espiral (Intracoil) que se adaptan bien a zonas de flexión, pero por el contrario vencen mal a placas calcificadas, aquellos que implican algún tipo de recubrimiento con objeto de frenar hiperplasia, o aquellos que incorporan como mecanismo de liberación una tercera vaina para protegerlos y asegurar una posición exacta de los mismos (Absolute), por ejemplo, de nitinol: Luminex, Memotherm, Vascucoil, Smart, Maris, Protege.
En mayo de 2009ha aparecido un nuevo tipo de stent de cobalto autoexpandible multicapa, que sin ser recubierto funciona como tal y la casa comercial (Cardiatis) le confiere la capacidad de excluir aneurismas, manteniendo colaterales permeables, ejerciendo una labor de remodelado y aspiración de aneurismas gracias al efecto Ventury que ejerce por su especial conformación tricapa tridimensional, haciendo desaparecer los aneurismas que se tratan con él.
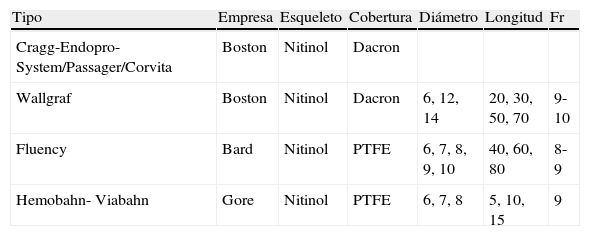
Stent recubiertoExiste además un tipo de stents que se encuentran recubiertos de tejido biocompatible para no permitir el flujo a través de la malla del stent y así poder utilizarlos en tratamiento de fístulas arteriovenosas, seudoaneurismas, aneurismas, por ejemplo Wallgraft (PET de baja porosidad con stent interno), Hemobahn (PTFE expandible con stent externo) Jostent, Fluency (PTFE ultrafino con stent entre dos capas del mismo), Passager (poliéster entrelazado Meadox con stent interno).
Técnicas endovasculares especialesA pesar de que en los centros de referencia el éxito técnico de la angioplastia simple ronda el 95%, en la mayoría de centros esta cifra se ve sensiblemente reducida por diversos motivos, curvas de aprendizaje, selección de material, protocolos establecidos... La aparición de diferentes técnicas auxiliares de la angioplastia simple nos permite aumentar el éxito técnico de las intervenciones, sin tener evidencia actualmente de que mejoren los resultados a largo plazo.
Son múltiples las técnicas auxiliares que se han desarrollado desde la descripción inicial de la angioplastia simple (fibrinólisis, cutting balloon, crioplastia, angioplastia asistida por láser, aterectomía remota...), pero son los llamados debulking devices, la endarterectomía remota percutánea y la angioplastia asistida por láser los que en los últimos años más se han desarrollado. No obstante, sólo disponemos de series de pacientes para valorar sus resultados, y se nos antoja difícil la posibilidad de desarrollar un ensayo clínico que pueda darnos un mayor nivel de evidencia. En ambos casos los objetivos de la técnica son, por un lado, disminuir las complicaciones derivadas del barotrauma que implica la angioplastia con balón (disecciones, rotura de pared arterial con la consecuente reacción inflamatoria, elastic recoil...) y, por otro, disminuir la cantidad de material ateromatoso para disminuir el grado de estenosis residual.
FibrinólisisFibrinólisis arterialUna alternativa terapéutica válida en el tratamiento de la isquemia de miembros cuando la situación clínica lo permite es la perfusión intraarterial de sustancias fibrinolíticas:
- 1.
Uroquinasa.
- 2.
Rt-Pa: activador tisular del plasminógeno recombinante.
Las sustancias fibrinolíticas están indicadas en el caso de trombosis aguda que ocasiona una isquemia no crítica y que puede esperar a ser tratada mediante perfusión intraarterial a través de un catéter colocado en el seno del trombo recién formado, o lo más cerca posible de éste. Realizaremos controles angiográficos para evaluar el resultado que vamos obteniendo y haremos progresar el catéter hasta conseguir la lisis total del trombo y así se pondrá en evidencia la lesión causante del cuadro de isquemia y que podrá ser tratada mediante el procedimiento endovascular que consideremos oportuno.
Una variedad de este tratamiento es la perfusión del fibrinolítico a través de un catéter perforado mediante una bomba generadora de impulsos (pulse-spray), para lo cual el catéter deberá de colocarse en el seno del trombo. Con esta técnica, podremos disminuir la dosis de fibrinolítico.
En una revisión de estudios aleatorizados y controlados realizada por el Grupo Cochrane de enfermedad vascular periférica sobre la eficacia de agentes fibrinolíticos para esta patología se encontró una mayor evidencia cuando agentes como el rt-Pa y la uroquinasa se emplean de forma intraarterial en lugar de intravenosa. Sin embargo, no se encontró diferencia en la eficacia entre el rt-Pa y la uroquinasa, así como tampoco en cuanto a sus complicaciones hemorrágicas34.
Dosificación- –
Uroquinasa: 240.000 U/h durante 4h y luego 120.000 U/h hasta un máximo de 48h12.
- –
Rt-PA: 1mg/ h. En los estudios realizados no influye el empleo de dosis máximas en la resolución del fenómeno tromboembólico.
Se debe de controlar los niveles de fibrinógeno cada 4-6h y suspender la fibrinólisis si éste es menor de 1g/dl, ya que el riesgo de hemorragia sería elevado. Habrá que controlar otros parámetros como son los PDF, plaquetas, actividad de protrombina TTPA, hemoglobina y hematocrito.
Las vías de infusión pueden ser:
- –
Paso a paso: se coloca el catéter en la proximidad del trombo y se inicia el proceso, tras un período de tiempo determinado se avanza el catéter y así hasta finalizar el proceso.
- –
Infusión continua: usando una bomba de inyección a una determinada dosis.
- –
Infusión gradual: inicialmente, se infunden dosis altas del fibrinolítico en período corto y esto es seguido por una infusión continua a menor dosis.
- –
Infusión periódica de pulsos: es la técnica del pulse-spray. Inyecta el trombolítico mediante jet en el trombo, de modo que lo fragmenta e incrementa la superficie de contacto.
- –
Isquemia aguda: si la situación del miembro lo permite, siempre a dosis bajas. En embolias suprainguinales y en aquellas infrainguinales donde no haya extensión del rombo, la cirugía es una alternativa primaria frente a la fibrinólisis. Si por el contrario existe trombo fragmentado que ocluye varias ramas tronculares o existe propagación del trombo, la fibrinólisis puede ser la terapéutica de elección.
- –
Isquemia crónica: la cirugía revascularizadora clásica o endovascular ha tenido mejores resultados que la fibrinólisis.
- –
Trombosis de by-pass: es la opción preferida en casos de oclusión menor de 14 días y la situación clínica del miembro lo permite. Siempre debe haber transcurrido más de 3 semanas desde la realización del procedimiento quirúrgico.
- –
Fibrinólisis intraoperatoria: útil para eliminar trombo residual tras tromboembolectomía quirúrgica.
- –
Trombosis durante técnicas endovasculares: como coadyuvante de las trombosis periprocedimentales. Excepto aquellas que ocurren en el lugar del acceso-punción que se resuelven mediante técnicas quirúrgicas.
- –
Aneurismas poplíteos trombosados: su objetivo es simplemente asegurar runoff. Si los vasos de salida no se encuentran trombosados esta terapéutica no está indicada.
- –
Embolizaciones distales (trash foot): existen estudios anecdóticos que la sugieren como útil, pero actualmente no hay evidencia al respecto.
La capacidad lítica de los fármacos utilizados hace que puedan tener importantes y graves efectos secundarios, así como un manejo e indicación exquisita:
- –
Absolutas: eventos cerebrovasculares ocurridos en los 2 últimos meses, diátesis hemorrágica activa, sangrado gastrointestinal en las dos últimas semanas, intervenciones neuroquirúrgicas o traumatismo craneoencefálico en los tres últimos meses.
- –
Relativas: a) mayores: reanimación cardiopulmonar o cirugía mayor en los últimos 10 días, tensión arterial no controlada (sistólica>180 o diastólica>110), cirugía ocular reciente, punción de vaso no compresible o tumor intracraneal, y b) menores: fallo hepático, endocarditis bacteriana, embarazo, retinopatía hemorrágica diabética.
La trombosis venosa afecta entre el 2,5 y el 5% de la población en algún momento de su vida. Causa como secuela más importante el síndrome postrombótico, cuyo desarrollo va a estar en función de la extensión de la trombosis, lesión del aparato valvular venoso y obstrucción residual tras la fibrinólisis endógena desencadenada por el fenómeno trombótico35.
Las consecuencias del síndrome postrombótico son edema persistente y alteraciones disestésicas, que afectarán a dos tercios de los pacientes llegando hasta el desarrollo de ulceras en un 5% de los pacientes36.
La incidencia de síndrome postrombótico ha sido documentada sobre todo cuando existe afectación venosa proximal, en rangos amplios (16-82%)37.
La lisis precoz del trombo se ha relacionado con indemnidad del aparato valvular y menor secuela postrombótica38.
Para prevenir la morbilidad del síndrome postrombótico se han propuesto terapias intervencionistas sobre el trombo en un intento de eliminarlo. La fibrinólisis venosa ofrece la idea de lisar precozmente el trombo y así preservar el aparato valvular para lograr una menor tasa de síndrome postrombótico. Comerota et al39 así lo reflejan en una revisión de 13 estudios donde encuentran una lisis completa o significativa en un 4% de los pacientes sometidos a terapia anticoagulante frente a un 45% de los que se sometieron a terapia fibrinolítica.
Otro dato importante que se desprende de estos estudios primeros es la precocidad con la que debe ser realizado el procedimiento. D’Angelo y Mannucci40 reportan mejores resultados en aquellas trombosis de menos de 8 días y en especial en los casos donde la terapia fibrinolítica fue iniciada con anterioridad a los 5 días.
Sillesen hace referencia a la teórica ventaja frente a anticoagulación y trombectomía quirúrgica en cuanto a suponer menos daño al endotelio venoso41.
Existen múltiples agentes líticos estudiados con estudios a favor y en contra de cada uno de ellos. En estudios de revisión se ha encontrado eficacia similar entre la uroquinasa y los activadores del plasminógeno42.
Fármacos y dosificaciónNo existen criterios sobre qué fármaco es el más eficaz. La uroquinasa, con su retirada del mercado americano, presenta menor número de estudios al respecto. Los más importantes reflejados en la bibliografía consultada en este artículo reflejan43:
- –
Estreptoquinasa: 100.000 U/h sistémica o locorregional.
- –
Uroquinasa: 200.000 U/día y anticoagulación con heparina.
- –
tPA: 0,05mg/kg/h; 0,05mg/kg en 4h seguido de la misma perfusión cada 8h; 100mg el primer día y luego 50mg por día los siguientes.
Tiempo de infusión: se administró una media de 67,8h para la infusión sistémica y una media de 48 horas mediante catéter dirigido36.
Vía de administraciónSe pueden utilizar bajo dos técnicas: sistémica o locorregional y dirigida por catéter.
- –
Infusión sistémica o locorregional: la técnica locorregional consiste en infundir el agente fibrinolítico a través de venas del pie con una compresión fuerte en la raíz de miembro, que obligue al agente a ir a través del sistema venoso profundo44.
Diversos estudios han concluido en su utilidad frente al tratamiento anticoagulante con heparina con tasas de mantenimiento de la función valvular muy dispares (44-92%) según los diversos autores, pero siempre superiores al tratamiento con heparina45.
A pesar de estos favorables resultados, autores como Schweizer46 tan sólo la indicarían en uso selectivo como salvamiento de extremidad debido al 5% de complicaciones mayores observada en su serie de 250 pacientes y al incremento en el número de embolismos pulmonares registrados.
Kiil et al47 compararon flebografías de los dos grupos de pacientes no encontrando diferencias significativas entre los tratados con heparina frente a los que se sometieron a terapia fibrinolítica.
La incidencia de complicaciones se encuentra en la mayoría de las series entre el 18 y el 33%45,48,49, fundamentalmente debidas a sangrado en el sitio de punción. Meisner50 tiene un 8% de mortalidad bajo esta modalidad terapéutica.
En una revisión de estos estudios se obtiene 3,7 veces más de trombólisis frente a la terapia anticoagulante pero con 2,9 más de sangrados mayores51.
En una revisión realizada por Comerota39 se pone de manifiesto que en la trombosis proximal es menos efectiva la terapia lítica sistémica.
- –
Fibrinólisis dirigida por catéter: debido a estos resultados ambiguos, así como a la gran incidencia de complicaciones dependientes fundamentalmente del gran número de horas necesarias en el tratamiento sistémico, se postuló esta modalidad de tratamiento fibrinolítico.
Consiste en enclavar un catéter multiperforado en el trombo e infundir a lo largo de éste el agente fibrinolítico.
En modelos animales frente a trombectomía quirúrgica se obtuvieron menos trombo residual y mayores tasas de competencia valvular en el grupo tratado con fibrinólisis52.
La mayor parte de los estudios con esta técnica se realizan en el sector iliofemoral y señalan elevada tasa de lisis completa o parcial > 50%, con un bajo índice de complicaciones. La serie de Semba53 se encuentra en esta línea, con éxito en el 72% de los casos. Mewisen2, en un estudio multicéntrico, obtiene un 83% de éxito con esta modalidad.
Este último autor, así como se desprende de los trabajos de Bjarnason54, señala que se obtiene mejor respuesta en el sector ilíaco que en el femoral, con tasas de éxito de 64-78% el primero y de 47-51% para el segundo. Identifican como factores pronósticos negativos la antigüedad del trombo (mayor de 1 mes), su extensión y ser portador de alguna neoplasia.
El único estudio aleatorizado55 con esta técnica señala un 72% de éxito con un 11% de reflujo, comparado con un 12% de recanalización y un 42% de reflujo en el grupo sometido a terapia anticoagulante solo.
Múltiples estudios han señalado la bondad de esta técnica frente a lisis sistémica; no obstante, se trata siempre de series personales y no aleatorizadas43. De todos los estudios aleatorizados revisados, sólo 12 cuentan con criterios de inclusión, reflejando en ellos disminución del síndrome postrombótico, mejora de la calidad de vida, riesgo de hemorragia intracraneal del 0,2%56, y complicaciones por sangrado en punto de punción en un 11%. Sobre el aspecto de la mejora de la calidad de vida, Comerota57 enfatiza que en un seguimiento de 68 pacientes a 16 meses informa de mejor calidad de vida tanto subjetiva como objetivamente (menos síndrome postrombótico).
Debemos reseñar pues que todos los estudios menos uno son observacionales. La mayor de las series se desprende del Registro Nacional de Trombosis Venosas americano36, donde se recogen en 63 centros 287 pacientes, consiguiendo lisis mayor del 50% en el 83% de los casos, con un mantenimiento de la permeabilidad al año del 79%, en los que se consiguió el 100% de lisis, y de 52% en los que se registro lisis entre 50-99%.
El resto de los estudios, que suponen 802 pacientes, son pacientes heterogéneos, que mezclan miembros superiores e inferiores, y con seguimiento escaso.
Una nueva visión del enfoque es la administración mediante el catéter de Trellis, que excluye la zona trombótica e infunde en ella el agente, eliminando la posibilidad de migración proximal del trombo58.
Coste (mediante infusión locorregional): la media de coste por tratamiento para el tratamiento con uroquinasa es de 6.577 $ mientras que para el tPA es de 488 $; sin embargo, la eficacia para la uroquinasa fue del 71,1% de lisis completa frente al 65,6% de tPA. Complicaciones con uroquinasa: del 12,4% frente al 22,2% de tPA42.
ComplicacionesLas complicaciones se encuentran en el 0-13% para sangrados mayores y en el 0-25% para los menores. Se encuentran registradas 1 hemorragia intracraneal y 1 hematoma subdural. La tasa de embolismo pulmonar se centra en torno al 1% y un 0,4% de mortalidad, aunque sólo existe un caso en el registro venoso americano donde se puede relacionar con la administración del agente fibrinolítico36.
DiscusiónA pesar de que faltan estudios adecuados, la experiencia descrita en la literatura parece incidir en el beneficio de la fibrinólisis en la enfermedad tromboembólica venosa. La técnica con catéter dirigido también parece ser más efectiva, como lo manifestó el estudio TOLEDO, pero éste tuvo que ser interrumpido cuando la uroquinasa se retiró del mercado americano.
Los pacientes con pocas expectativas vitales (neoplasias...) tan sólo se beneficiarían en caso de amenaza para la extremidad, así como aquellos con trombosis venosas crónicas que serían subsidiarios de otro tipo de tratamiento endovascular.
Hay que reseñar también el pobre seguimiento para evaluar las complicaciones, que en cualquiera de los casos se nos comunican en un amplio intervalo de confianza, lo que nos pone de manifiesto un alto nivel de incertidumbre43.
La administración locorregional del fármaco supone un índice mayor de éxitos, menor consumo de fármaco trombolítico y menos horas de infusión, lo que redundaría en menor tasa de complicaciones36.
Como factores pronóstico de éxito se encontraría: afectación iliofemoral nativa de menos de 14 días de evolución, expectativa de vida mayor a 1 año, buen estatus funcional del paciente, según se recoge en las recomendaciones dadas por el American College of Chest Physicians59,60; en estas indicaciones recientemente Comerota ha reportado tras tratamiento fibrinolítico mejoras en la calidad de vida de los pacientes, en relación directa con el éxito del procedimiento61-63.
A pesar de todo lo expuesto, hay que reseñar que se necesitan más estudios aleatorizados para establecer las indicaciones y potenciales riesgos de esta técnica, agente a emplear, dosis y vía de administración64. Nuevos fármacos como monteplase (tercera generación de agentes trombolíticos) han reportado éxitos en tratamientos donde no resultó útil la uroquinasa65.
Otros protocolos de manejo emplean una combinación de trombólisis intratrombo, combinada con trombectomía percutánea (clase IIa, nivel de evidencia B).
La trombólisis no se recomienda de rutina en todos los casos de trombosis venosa profunda (clase III, nivel de evidencia B); la posibilidad del tratamiento trombolítico se considera de manera individual, sobre todo en casos de pacientes jóvenes, con bajo riesgo de sangrado con trombosis venosa profunda extensa, trombosis venosa profunda iliofemoral, isquemia venosa asociada (flegmasia cerúlea dolens) o aumento de la extensión de la trombosis después de la terapia convencional (clase IIa, nivel de evidencia B).
Angioplastia asistida por láserEn los años ochenta y noventa del siglo pasado, el láser demostró su eficacia en multitud de técnicas médicas; sin embargo, no disponíamos de equipos que permitiesen su aplicación endoluminal debido a las repercusiones físicas que tenía sobre los tejidos circundantes. En los últimos diez años, con la aparición del láser Excimer y la generalización de las técnicas endoluminales, el láser ha recuperado el camino perdido.
El láser Excimer emite, desde la punta de un catéter, ráfagas intensas de energía UV en pulsos de corta duración, con lo que se consigue una profundidad de penetración corta, unos 50 #mm. Los catéteres láser eliminan una capa de tejido de unos 10 #mm en cada pulso de energía. Además, las uniones moleculares se rompen directamente mediante un mecanismo fotoquímico sin aumento de temperatura en los tejidos de alrededor gracias al potencial lítico de la energía UV.
Sólo disponemos de registros de pacientes, por lo que la evidencia de la que disponemos es limitada.
Scheinert et al66 analizan los resultados de la AAL en el tratamiento de 411 obstrucciones crónicas de la AFS en 318 pacientes, con una longitud media de 19,4±6cm, más del 75% claudicantes. Obtiene una tasa de éxito técnico del 90,5% y al año una permeabilidad primaria del 20,1%, primaria asistida del 64,6% y secundaria del 75,1%.
Resultados similares se obtuvieron en el PELA (Peripheral Excimer Laser Angioplasty)67, estudio multicéntrico, prospectivo y aleatorizado, que comparó los resultados de la AAL frente ATP simple en el tratamiento de las oclusiones de la AFS (10cm) en 251 pacientes claudicantes. Se obtuvieron los resultados en 189 pacientes, sin diferencias entre ambos grupos, salvo la menor utilización de stents en el grupo de AAL (el 42 frente al 59%).
Steinkamp et al68 comparan los resultados del tratamiento de 215 obstrucciones de la arteria poplítea de una media de 10,4cm de longitud mediante AAL (n=127) y angioplastia simple (n=88). Con AAL, el éxito técnico fue del 82m7%, y a los 36 meses la permeabilidad primaria y secundaria del 21,7 y el 50,8% respectivamente, sin diferencias con los resultados obtenidos con la ATP simple.
El LACI (laser angioplasty for critical limb ischemia)69 es un estudio multicéntrico que incluyó 155 MMII con isquemia crítica de 145 pacientes no aptos para by-pass. Las lesiones se localizaban en AFS (42%), poplítea (16%) o arterias infrapoplíteas (42%). El éxito técnico fue del 96%, con una tasa de retratamientos del 15% y un 93% de salvamento de extremidad a los 6 meses.
Serino et al70 desarrollaron un registro prospectivo para lesiones que no podían ser recanalizadas y a las que aplicaban la AAL. Trataron 51 lesiones en 35 pacientes; el éxito clínico inmediato fue del 88% (flujo directo hasta el pie), necesitando en el 21% de las lesiones implantación de stent. La permeabilidad de las lesiones tratadas a los 12 y 24 meses fue de 96 y el 94% respectivamente, siendo la tasa de salvamento de extremidad del 100 y el 94%, respectivamente.
En un estudio retrospectivo reciente sobre factores que afectaban a los resultados de la angioplastia en troncos distales, Fernandez et al71 encontraron que la aplicación de angioplastia asistida con láser en troncos distales, así como el tratamiento a varios niveles, eran predictores de curación de la lesión.
Los datos actuales nos hablan de que la angioplastia asistida por láser puede mejorar el éxito técnico en lesiones complejas, así como de la permeabilidad a medio plazo. No obstante, no se puede recomendar su uso indiscriminado sobre la base de la evidencia actual, máxime, teniendo en cuenta el sobrecoste que implica para la técnica.
Podría recomendarse su utilización en casos de enfermedad arterial crítica en pacientes no aptos para by-pass, con fracaso de intentos previos de recanalización con técnicas endovasculares convencionales, pues permite convertir una lesión difusa y compleja en otra más fácilmente tratable mediante angioplastia simple al extraer material trombótico y ateromatoso72.
Endarterectomía remota percutáneaMientras la angioplastia asistida por láser disuelve las partículas de material ateromatoso en la sangre, la endarterectomía remota retira el material del organismo. Podemos dividir estos dispositivos en función de su mecanismo; por un lado, encontramos aquéllos que escinden la placa mediante un sistema rotacional, de forma homogénea en torno al eje de la luz, y por el otro aquellos direccionales en los que un cuchilla en la cara lateral del catéter realiza la escisión; este último dispositivo puede utilizarse en vasos de hasta 2mm de diámetro y es, en la actualidad, el más extendido, dato reflejado en que la mayor parte de la literatura reciente encontrada utiliza la endarterectomía direccional.
Como en la angioplastia asistida por láser, sólo disponemos de registros de pacientes, lo que nos da una evidencia muy limitada.
Zeller et al72,73 en 2004 presentaron sus resultados iniciales en el sector femoropoplíteo y distal. En el primero (n=52 pacientes) hablan, usando de forma aislada la endarterectomía remota percutánea, de un 96% de pacientes con estenosis residuales de<50% y el 76% con estenosis residuales < 30%, siendo necesaria una angioplastia adicional en el 76% de los casos. El 80% de estos pacientes a los 6 meses estaban libres de sintomatología. En el sector distal (n=52 pacientes) refieren un éxito técnico del 96%, requiriendo en el 29% de los casos una angioplastia adicional. La permeabilidad a los 3 y 6 meses fue del 98 y el 94%, respectivamente.
En 2006 presentaron sus resultados a largo plazo74 a nivel femoropoplíteo (n=84 pacientes), informando de un 86% de éxito técnico usando la endarterectomía de forma aislada y de un 100% asociándola a otra técnica. En lesiones de novo, la permeabilidad primaria a 12 y 18 meses fue del 84 y el 73%, y en la reestenosis del 54 y el 45%. En las lesiones primarias el target lesion revascularization (TLR) fue del 16% a los 12 meses y del 22% a los 18 meses; en reestenosis fue del 45 y el 53%, respectivamente.
El mismo grupo acaba de publicar75 una nueva serie en la que presentan un éxito técnico del 76% en lesiones femoropoplíteas (n=161 pacientes), utilizando de forma aislada la endarterectomía en un 28% de los casos. La permeabilidad primaria a los 12 meses es del 61%, con mejores resultados en las lesiones más benignas. Existía una tendencia estadística, sin alcanzar la significación a favor de las lesiones primarias.
Los resultados a largo plazo de las lesiones tratadas en el sector distal76 muestran una permeabilidad primaria y secundaria del 67 y el 91% al año y el 60 y el 80% a los 2 años.
Yancey et al77 analizaron sus resultados en pacientes con enfermedad arterial crítica y lesiones TASC C de sector femoropoplíteo asociadas a lesiones a otros niveles (n=16 pacientes). Consiguieron éxito clínico en 13 casos, siendo necesaria una amputación inicial en los otros 3 casos. A los 6 meses otros 2 pacientes habían sido amputados. A los 12 meses la permeabilidad del sector femoropoplíteo era del 22%.
El registro multicéntrico TALON78 (n=601 pacientes) refiere una supervivencia libre de TLR del 90 y el 80% a 6 y 12 meses, respectivamente, tratando lesiones tanto a nivel femoropoplíteo como distal. La longitud de la lesión y la cardiopatía isquémica fueron los principales predictores de TLR.
Los resultados iniciales de Keeling et al79 mostraron una permeabilidad primaria de 61,7% al año en un total de 60 pacientes, con 70 lesiones tratadas, de las cuales una tercera parte eran en pacientes claudicantes y el resto en pacientes con enfermedad arterial crítica. Seis pacientes requirieron ser reintervenidos, 4 de ellos durante la misma hospitalización.
Chung et al80 presenta un éxito técnico del 100% (n=19 pacientes), requiriendo en una cuarta parte de los procedimientos una angioplastia adicional. Sólo 2 procedimientos permanecían permeables a los 12 meses (10% de permeabilidad primaria), siendo la mayor parte de las lesiones reestenosis. Fue necesaria la amputación en 5 pacientes (74% salvamento de extremidad).
Sarac et al81 publicaron sus resultados a un año en un total de 73 pacientes (78% claudicación intermitente), presentando una permeabilidad primaria del 43% y una tasa de salvamento de extremidad del 75%, siendo los principales factores asociados con la pérdida de la extremidad la diabetes y la presencia de lesiones isquémicas.
McKinsey et al82 publicaron la serie más amplia de pacientes tratados con esta técnica; sus resultados muestran, en un total de 275 pacientes (63,3% enfermedad arterial crítica), una permeabilidad primaria a los 18 meses de 52,7%, con una tasa de salvamento de extremidad del 100% en claudicantes y del 92,4% en pacientes con enfermedad arterial crítica.
Biskup et al83, en una serie más pequeña (n=35 pacientes), muestran una permeabilidad primaria del 68% y un salvamento de extremidad del 74% al año, pero el dato más interesante que arroja el estudio es que la permeabilidad primaria es mucho peor en lesiones previamente tratadas.
Eroshkin et al84 muestran una permeabilidad primaria del 60 y el 80% a los 12 y 18 meses, y una tasa de salvamento de extremidad del 88% a los 18 meses en pacientes con enfermedad arterial crítica.
Indes et al85 compararon de forma ambispectiva la angioplastia subintimal con la endarterectomía remota. Con la endarterectomía remota obtuvieron un 100% de éxito técnico, de las lesiones oclusivas un 82% requirió una reintervención, mientras que sólo fue necesario en el 12,5% de las lesiones reestenóticas. Frente a los resultados en las lesiones oclusivas, la angioplastia subintimal presentaba datos mucho mejores de permeabilidad primaria, con un 83,6% de éxito técnico.
Por último, Regine et al86 presentan una pequeña serie con dieciocho pacientes con lesiones femoropoplíteas (TASC A-C) que muestra un éxito técnico del 100% y una permeabilidad primaria a los 12 meses del 79%.
A pesar de la baja calidad de los estudios, podemos concluir que la endarterectomía remota es una técnica segura, y con un éxito técnico elevado, pudiendo mejorar el resultado inicial del tratamiento revascularizador. Como en otras técnicas de revascularización, estadios y lesiones más benignas presentan mejores resultados de permeabilidad, así como lesiones primarias frente a reestenosis; esto no quiere decir que no pueda estar indicado en este tipo de lesiones, donde otras técnicas tampoco presentan buenos resultados. En el único estudio comparativo que hemos encontrado las lesiones oclusivas mostraban mejor permeabilidad primaria mediante angioplastia subintimal que mediante endarterectomía remota, aunque el éxito técnico era menor, por lo que podría ser de elección la angioplastia subintimal en estos casos.
Son necesarios estudios prospectivos y comparativos entre las distintas técnicas, sobre todo frente a la angioplastia y el stent, para poder analizar los resultados de la endarterectomía remota y poder establecer qué pacientes y qué lesiones se pueden beneficiar de esta técnica.
También son necesarios estudios de coste-efectividad para analizar la eficiencia de esta técnica que implica un sobrecoste del procedimiento frente a las técnicas convencionales.
Por último, debemos señalar la variabilidad de los resultados, en la que influyen no sólo la selección de los pacientes, sino también la experiencia del equipo que realiza la técnica, apreciándose mejores resultados en series más amplias.
Tratamiento endovascular en el sector femoropoplíteoEl gran desarrollo en el que nos encontramos inmersos en la tecnología endovascular tiene su mejor reflejo en el sector FP. Dado su carácter menos invasivo y con menores cifras de mortalidad y morbilidad, se nos ofrece, igual que en otros territorios, como una atractiva alternativa al tratamiento quirúrgico convencional.
Entre otras razones que no son el objeto de esta guía, tras la publicación del estudio BASIL87 en la que se observaron resultados a los 2 años equivalentes entre los pacientes tratados de forma endovascular y aquellos en los que se realizó cirugía convencional, esta terapéutica va ganando más adeptos. En el año 2007 se publicó el TASC II88, con una actualización de las guías de tratamiento basadas en una clasificación morfológica, en las que se recomienda el tratamiento endovascular de forma inicial en las lesiones tipo B y el quirúrgico en las tipo C, y además demostrando una tendencia basándose en la literatura que justifica el tratamiento endovascular en este sector.
El establecimiento de guías definitivas sobre el tratamiento en este sector es muy complejo por varios motivos. Uno es el anteriormente descrito de la aparición continua de nuevos dispositivos o bien de modificaciones realizadas en los ya existentes en la búsqueda continua de mejora en la permeabilidad. Por otra parte, está la ingente cantidad de artículos publicados, tratándose en la mayoría de los casos de registros o estudios de diseño criticable, por lo que se hace muy complicado el compararlos o extraer conclusiones. Muchos estudios incluyen a pacientes con distinto grado de severidad o bien pacientes con lesiones localizadas en distintos sectores89,90.
El sector FP presenta una serie de peculiaridades que influyen sobre los resultados del tratamiento endovascular. Además de las consabidas consideraciones anatómicas tratadas en el apartado precedente, debemos reseñar que ningún otro lecho vascular está sujeto a tanta variabilidad en las lesiones que presenta.
Dada la elevada mortalidad de los pacientes afectados de EAP, es primordial un adecuado control de los factores de riesgo, así como prescribir, de no estar ya tomándolo, fármacos antiagregantes y estatinas88. El procedimiento endovascular estimula la trombosis del vaso sobre el que hemos actuado, por lo que es crítico antiagregar al paciente también por este motivo, y es un tema de debate cuál es el protocolo más adecuado que se debe seguir sobre qué fármaco, a qué dosis y durante cuánto tiempo91. Por otra parte, se sabe que los resultados se ven afectados según las diferentes patologías asociadas. Así, la coexistencia de insuficiencia renal crónica o diabetes mellitus ha sido descrita por algunos como factores que empobrecen los resultados92, o una mayor permeabilidad en pacientes hipertensos93.
Finalmente, otros factores que afectan negativamente al resultado de estos procedimientos son la longitud, la frecuente calcificación, la lesión oclusiva y la salida o runoff93,94.
Recomendación. En el paciente con diagnóstico de EAP se deben de seguir las mismas recomendaciones en cuanto a modificación del hábito de vida, control de factores de riesgo vascular, prescripción de medicación antiagregante y estatina, independientemente del procedimiento que se vaya a llevar a cabo.
Aunque el tratamiento antiagregante sea fundamental en la prevención de la obstrucción del procedimiento, el protocolo a llevar a cabo aún no está definido.
Existen múltiples factores que se deben tener en mente, que afectan sobre la permeabilidad del procedimiento.
Angioplastia simpleEl tratamiento endovascular del sector FP comenzó con la angioplastia con balón; existen evidentemente muchos estudios con múltiples pacientes pero que por otra parte son de diseño muy heterogéneo89. Al haberse tratado del tratamiento inicial, es frente a sus resultados con que se comparan los distintos dispositivos y mejoras que se van introduciendo en el tratamiento endovascular.
Entre las distintas publicaciones, es de especial mención la realizada por Rocha-Singh et al95, en la que se evalúan los resultados de 3 ensayos esponsorizados por la industria y de otros 3 prospectivos publicados en la literatura. Los resultados muestran una permeabilidad primaria a los 12 meses del 33%, con una clara influencia de la longitud de la lesión sobre ésta.
Las lesiones a este nivel presentan habitualmente una calcificación en mayor o menor medida, que es lo que justifica el pobre resultado inicial con este dispositivo debido al recoil elástico o a la disección provocada habitualmente por la fractura de la placa. Otra justificación es la reestenosis por la hiperplasia intimal reactiva. Tratando de inhibirla, una alternativa prometedora serían los balones recubiertos o impregnados en fármacos96, pero que no evitan la necesidad de stent en caso de recoil, lesiones calcificadas o de restenosis residuales tras la angioplastia de lesiones complejas y largas97,98. Por otra parte, se trata de tecnología cara, con la posible necesidad de cubrir lesiones que requieran de más de un balón.
Recomendación. La angioplastia simple con balón puede estar indicada en las lesiones TASC A cortas, poco calcificadas y que no se localizan a nivel de canal de los aductores.
En la actualidad, se precisa de más estudios para establecer la indicación de los balones recubiertos de fármacos en este sector.
Angioplastia con stentEl stent soluciona el problema del recoil, de la disección y de la estenosis residual observada con la angioplastia simple, pero en las lesiones cortas no ofrecen beneficio frente a la misma99.
Los resultados a medio plazo con el Wallstent (que permitía tratar lesiones más largas) hicieron que su empleo en este sector (permeabilidad menor de la esperada y fracturas) fuese abandonado. Este procedimiento quedó estancado, salvo en la indicación para «rescate» de angioplastias con balón complicadas, hasta la aparición del stent autoexpandible de nitinol. Sus propiedades son una mayor fuerza radial, memoria que le permite recuperar la forma y una liberación más precisa al no presentar acortamiento.
En el estudio prospectivo y aleatorizado de Schillinger et al100, incluidos los pacientes tratados con stent de nitinol autoexpandible con pacientes sometidos a angioplastia y stent condicional (resultado subóptimo), se observa una tasa de reestenosis a los 2 años significativamente mejor para el grupo de stenting primario (el 45,7% frente al 69,2%).
Durante este estudio, se fueron desarrollando otros ensayos clínicos aleatorizados (SIROCCO, RESILIENT, ASTRON, ABSOLUTE) que, corroborando estos resultados, fueron poniendo de relieve varias cuestiones de interés.
Una de ella es la fractura. Al observarse en zonas de solapamiento y de especial estrés, se han diseñado dispositivos de nitinol de segunda generación «sin fracturas», tras modificar el mallado o estructura del esqueleto y celdas, estando asimismo disponibles los stents de mayor longitud.
El mayor problema que nos plantea el stenting es el tratamiento de la restenosis intra-stent debido a la hiperplasia intimal, por la alta tasa de recidiva tras la angioplastia simple. Recuperar un segmento arterial cubierto con stent largo y trombosado puede ser muy complicado, por lo que se aconseja actuar sobre estas estenosis intra-stent incluso en pacientes asintomáticos97.
En el momento actual, y basándonos en los estudios aleatorizados publicados, debemos considerar la cirugía revascularizadora convencional mediante injerto venoso como la opción más duradera en los pacientes con EAP con lesiones severas extensas de la AFS lesiones TASC D88,93,97. Algunos autores extienden esta recomendación la a aquellos casos en los que el runoff o salida tibial sea mala o exista una gran pérdida tisular, plateándose incluso la amputación directa en los pacientes con lesiones TASC D o con gran pérdida tisular de alto riesgo quirúrgico para la cirugía convencional93. En aquellos casos de pacientes con alto riesgo quirúrgico o ausencia de vena y lesiones TASC D, puede estar indicado el tratamiento endovascular.
Recomendación. El stent está indicado en aquellos casos con resultados subóptimos con la angioplastia simple.
En las lesiones cortas el stent no muestra superioridad frente a la angioplastia aislada.
El mayor problema a solucionar del stenting primario es la hiperplasia con la restenosis intra-stent.
La angioplastia con stent primario de nitinol de última generación puede estar indicada en lesiones TASC A calcificadas, lesiones TASC B y en muchas estenosis TASC C.
La angioplastia con stent primario de nitinol de última generación puede estar indicada en lesiones TASC D en caso de elevado riesgo quirúrgico o ausencia de vena.
Angioplastia con stent recubiertoComo ha quedado reflejado previamente, el problema que más preocupa en la angioplastia con stent es la reestenosis intra-stent debido a la respuesta de la pared arterial con la hiperplasia. El objetivo de este tipo de stent sería tratar de minimizar la misma al teóricamente impedir la proliferación de las células musculares lisas a través de las celdas.
Con las mejoras conseguidas por la industria con dispositivos de menor perfil y apoyándonos en los resultados de estudios recientes, el stent recubierto está experimentando una mayor atracción.
En uno de ellos se compararon los resultados de la angioplastia con balón frente al stent de nitinol recubierto de PTFE expandido101. En este estudio multicéntrico y aleatorizado, se observaron diferencias significativas al año a favor del stent recubierto en cuanto al éxito técnico inicial (95-66%; p<0,0001), permeabilidad primaria (65-40%; p=0,0003), y respecto a la mejoría en los síntomas (sobre todo en los pacientes incluidos con isquemia crítica; p=0,003).
En el estudio de Kedora et al102, que compara los resultados de este tipo de stent con el implante de una prótesis de PTFE en el sector supragenicular, no se observan diferencias significativas en la permeabilidad primaria (63-64%) o secundaria (74-76%) a los 24 meses. Está por determinar si la teórica mejora de la impregnación con heparina en este tipo de stent recubierto tiene su repercusión en la incidencia de trombosis.
Un hecho relacionado con este tipo de stent es la posible cobertura de colaterales importantes en el tercio inferior de la AFS o en la poplítea supragenicular, por lo que, en caso de trombosis, la situación clínica del paciente podría ser peor que en el momento de su indicación.
Recomendación. El empleo de stent recubierto puede estar indicado en lesiones TASC B oclusivas crónicas o en aquellas en las que no existan colaterales permeables en el sitio de implante.
El empleo de stent recubierto puede estar indicado en lesiones TASC C y D en pacientes de alto riesgo quirúrgico.
El empleo de stent recubierto puede estar indicado en las restenosis intra-stent.
Angioplastia con stent liberador de fármacosEn concepto de combinar el stent de nitinol con los efectos antiproliferativos de un fármaco es atractivo. Sin embargo, los ensayos clínicos iniciales además de tener un bajo poder estadístico no mostraron diferencias significativas entre el stent liberador de sirolimús y el stent no liberador, atribuyéndose ello, entre otros, a la forma de liberación del fármaco97.
El estudio ZILVER, que es aleatorizado y con suficiente poder estadístico, emplea una tecnología diferente en la liberación del fármaco no polimérica con stent cubiertos de paclitaxel y está mostrando resultados prometedores103. Otro estudio en marcha es el STRIDES (prospectivo, no aleatorizado), en el que se evalúan los resultados de un stent cubierto de emerolimús. De ambos estudios se espera que aporten información relevante en el futuro sobre el papel de este tipo de stents.
Recomendación. Se debe esperar a los resultados de los estudios en marcha para poder recomendar el empleo del stent liberador de fármacos.
Tratamiento endovascular en el sector infrapoplíteoEl pequeño calibre de los vasos tibiales (2-3mm) y la naturaleza difusa de la enfermedad hacen más complicado el tratamiento endovascular en este sector. Los datos que se pueden extraer basándonos en la literatura son limitados debido a que se incluye a pacientes con distinto grado de isquemia, o bien pacientes con afectación en distintos sectores. En muchas series la documentación sobre el seguimiento funcional y hemodinámico es muy pobre, sin que se pueda aclarar si la recidiva de la sintomatología se deba a reestenosis o bien a progresión enfermedad con aparición de lesiones a otro nivel104. Como en el sector FP, la permeabilidad está disminuida en aquellos casos en los que el paciente tiene diabetes o insuficiencia renal. Otros factores que se han relacionado son la edad avanzada y la proteína C reactiva anormalmente elevada105. Las recomendaciones sobre el tratamiento médico y sobre el protocolo que se debe seguir con el tratamiento antiagregante son las mismas que para el sector FP. En este nivel, dados sus peores resultados, existe la idea mayoritaria de la necesidad de un tratamiento antitrombótico más agresivo en el peri y postoperatorio.
El avance tecnológico experimentado en este sector, con aparición de nuevas guías, catéteres y balones largos especialmente diseñados para este nivel, ha permitido un tratamiento más agresivo en este territorio.
Este sector ha sido considerado históricamente candidato a cirugía de revascularización únicamente en pacientes con diagnóstico de isquemia crítica. Ello no ha sido obstáculo para que se haya incluido a pacientes claudicantes en diferentes ensayos sobre el tratamiento mediante angioplastia106,107. Por otra parte, los mencionados ensayos clínicos han mostrado buenos resultados inmediatos y a corto plazo, sobre todo en pacientes claudicantes y en lesiones estenóticas. Aunque los resultados a largo plazo sean decepcionantes, este tratamiento podría ser una opción en pacientes seleccionados, como podrían ser aquellos sujetos con diagnóstico de isquemia crítica y en situación desfavorable para realizar una revascularización con vena, o en caso de lesión ulcerosa pequeña.
Angioplastia con stentAntes de la aparición del stent de nitinol para este territorio, la opción ante la angioplastia con resultado subóptimo eran los stents coronarios balón expandibles.
Existe un estudio108 que muestra resultados prometedores a corto plazo en pacientes con isquemia crítica. Este estudio compara el stent liberador de sirolimús frente al stent normal, empleados ambos en caso de resultado subóptimo de la angioplastia. Por otra parte, está el estudio de Rand109, prospectivo y aleatorizado, que compara los resultados de la angioplastia simple y la angioplastia con stent cubierto de carbono, con una permeabilidad acumulada a 6 meses mayor de forma significativa a favor del stent. De nuevo, deberemos esperar a los resultados a largo plazo o a nuevos estudios para poder extraer conclusiones sobre su posible indicación y en qué circunstancias.
Por tanto, en ausencia de datos reales sobre la permeabilidad a largo plazo de los procedimientos endovasculares que nos sugieran otra cosa, a los pacientes con vena apta y de bajo riesgo quirúrgico se les debe ofrecer la cirugía de by-pass como primera opción104.
Recomendación. El tratamiento endovascular en el sector infrapoplíteo es una alternativa en lesiones focales aisladas y en pacientes seleccionados.
Todavía no disponemos de datos que demuestren que el stent mejore los resultados de la angioplastia simple a largo plazo.
Cirugía combinada convencional y endovascularIntroducciónNo es infrecuente que la patología isquémica de extremidades inferiores se manifieste con lesiones arteriales a varios niveles. La cirugía endovascular ofrece desde hace años nuevos recursos para el tratamiento de estos pacientes, habiendo proporcionado seguridad y buenos resultados a medio-largo plazo en casos seleccionados. Cada lesión tiene una mejor opción. Para unas es la cirugía convencional y para otras es la cirugía endovascular. En muchos casos coexisten dos o más lesiones en el mismo paciente, que requieren la realización de una técnica endovascular como coadyuvante a la cirugía convencional; o una cirugía convencional como apoyo a una técnica mínimamente invasiva. Los dos procedimientos pueden realizarse simultáneamente o bien, de forma secuencial, aunque en la actualidad con los quirófanos dotados de arcos de alta resolución la tendencia es a realizar el procedimiento combinado en un solo tiempo. En la elección de las diferentes técnicas debe tenerse en cuenta el resultado de cada una en cada sector, no debiendo comprometer la reparación de una determinada lesión, o un by-pass, con una técnica de resultados dudosos o poco demostrados. No obstante, existen casos en los que la situación clínica del paciente o la gran comorbilidad impide la realización de un tratamiento quirúrgico abierto, condicionando la elección de una técnica, a priori, de inferior resultado con el fin de disminuir el riesgo quirúrgico; en estos casos es donde el tratamiento híbrido, especialmente del sector aorto-ilíaco, ha encontrado sus principales indicaciones. De hecho, a pesar de la permeabilidad superior de la revascularización quirúrgica comparada con la angioplastia y el stent ilíaco, del año 1996 al 2000, los procedimientos endovasculares sobre el sector ilíaco han aumentado un 850% y la realización de by-passes aortobifemorales se han reducido un 15%110. Así pues, la optimización en la utilización de los recursos disponibles debe ser el objetivo final para el tratamiento de los pacientes con lesiones arteriales complejas a diferentes niveles.
Cirugía endovascular proximal y convencional distalLa cirugía combinada endovascular ilíaca y endarterectomía femoral o by-pass infrainguinal no es nueva. Brewster et al111 en 1989 obtuvieron un 76% de permeabilidad a los 5 años, realizando angioplastia ilíaca y reconstrucciones infrainguinales. Otro estudio más reciente112 trata lesiones iliacas TASC C combinadas con endarterectomía femoral, consiguiendo una mejoría clínica en un 97% de los pacientes, con una permeabilidad primaria ilíaca/femoral común del 84% al primer año. Sin embargo, estos autores no estratificaron sus resultados según el tipo de lesión. A pesar de estos resultados prometedores, hay artículos posteriores113, que no han encontrado beneficio en la permeabilidad del stent combinado con revascularización infrainguinal, cuando se comparan con el stent solo. Este trabajo tiene un seguimiento de 5 años, aunque con las limitaciones de un estudio observacional y con una muestra relativamente pequeña.
Una de las formas de abordar la enfermedad arteriosclerótica aortoilíaca es la realización de un tratamiento endovascular de un ilíaca y un by-pass femorofemoral cruzado. Cuando existen graves factores de riesgo, edad avanzada u otras circunstancias que no permiten un abordaje abdominal para tratar lesiones ilíacas TASC D (donde existe un acuerdo mayoritario114 en el que el mejor tratamiento es la cirugía abierta), se ha diseñado esta solución para estenosis u oclusiones cortas del lado donante combinadas con oclusiones contra laterales. En un estudio115 con lesiones TASC C y D de un lado y B contra laterales, obtuvieron una permeabilidad primaria del 100, el 79, el 62 y el 51% a 1, 2, 3 y 5 años, respectivamente. Estos resultados son, en general, inferiores a las permeabilidades de un by-pass aortobifemoral, pero superiores a la angioplastia sola o combinada con stent.
Otro trabajo116 ha comparado lesiones TASC B y C de la arteria donante. Las indicaciones fueron salvación de extremidad (22%), dolor en reposo (44%) y claudicación (34%), el seguimiento mediano de 34,1 meses, pero los resultados no fueron estratificados por indicaciones. Las complicaciones perioperatorias fueron del 7% para las iliacas TASC B y del 62% para las ilíacas TASC C (p=0,0007). El stent se necesitó en un 92% de las lesiones TASC C y en un 14% de las lesiones TASC B. El éxito inmediato se consiguió en un 100% de los casos TASC B y en un 62% para los TASC C (p=0,0028). La permeabilidad primaria para el caso de lesiones ilíacas TASC B fue del 96, el 85 y el 85% a 1,2 y 3 años, respectivamente, y del 46, el 46 y el 31% en el mismo intervalo para las lesiones TASC C (p<0,01). Los autores concluyen que la angioplastia/stent de la arteria donante ilíaca con lesiones TASC C no proporciona una adecuada permeabilidad para el by-pass femorofemoral, por lo que si existen otras opciones, éstas deben contemplarse.
En un trabajo de endarterectomía femoral con procedimientos combinados sobre ilíaca y femoral superficial, Kang117 realizó 65 procedimientos abiertos sobre la femoral común y profunda en 58 pacientes y se efectuaron 37 (57%) procedimientos endovasculares sobre la ilíaca y/o femoral superficial. Se trataron un total de 20 ilíacas con una distribución TASC II A 30%, B 35%, C 20% y D 15%) y 25 femorales superficiales (TASC II A 24%, B 60%, C 12% y D 4%), logrando una permeabilidad combinada de 93% al año y del 91% a los 5 años, con una tasa libre de reintervención en la extremidad de 82% al año y del 78% a los 5 años.
Existen menos trabajos sobre la angioplastia/stent en el sector ilíaco y la cirugía infrainguinal con by-pass, aunque es una técnica que se realiza de forma rutinaria desde hace años. Miyahara et al118 han publicado unos resultados de permeabilidad a largo plazo comparando la permeabilidad del by-pass infrainguinal, según estuviese realizado con cirugía combinada o no. En el grupo de PTA ilíaca y revascularización infrainguinal, los resultados de permeabilidad primaria fueron del 83,2, el 80 y el 71,2% a 1,3 y 5 años, y del 97,1, el 89,9 y el 80,5%, en el grupo de cirugía infrainguinal sin enfermedad ilíaca, no existiendo diferencias estadísticamente significativas. Otros trabajos han obtenido resultados similares, en pacientes homogéneos, como es el trabajo de Faries et al119, que compara los resultados de la cirugía infrainguinal y PTA ilíaca en pacientes con isquemia crítica, diabéticos y no diabéticos, y no encontraron diferencia entre los dos grupos.
En la cirugía femoropoplítea, existen circunstancias en las que se pueden plantear la necesidad de realizar una angioplastia/stent de la femoral superficial proximal a un by-pass femoropoplíteo, poplíteo-poplíteo o poplíteo-distal. Estos casos pueden venir determinados en ocasiones por necesidad (p. ej., vena insuficiente para un by-pass desde la femoral común) o por conveniencia (lesión TASC A en la femoral superficial). Los resultados de los by-pass «cortos» han sido bien determinados en la literatura120. En un trabajo de Schneider et al121, se presenta una serie de pacientes diabéticos con isquemia crítica con by-pass distal cuyo origen es la arteria poplítea. Se comparan los resultados de dos grupos: aquellos que necesitaron una angioplastia de la femoral superficial con aquellos que no tenían lesiones apreciables. Con la evidente dificultad de la falta de aleatorización, se obtuvo una permeabilidad primaria de 82% en el grupo de pacientes que no necesitó angioplastia, frente al 76% del grupo de cirugía combinada, sin existir diferencias significativas.
Cirugía endovascular para mejorar la permeabilidad y el runoffLa cirugía endovascular como coadyuvante de la cirugía convencional se utiliza principalmente para los fracasos hemodinámicas de los by-pass infrainguinales, bien sea del injerto en sí o de las arterias distales.
En un estudio de Lofberg et al122 en el que evaluaban el papel de la angioplastia distal a los by-pass infrainguinales (incluyendo la anastomosis distal del injerto). Se realizaron 57 procedimientos: 13 en la anastomosis distal, 32 distales (19 poplíteas y 13 infrapoplíteas) y 12 en ambas localizaciones. El éxito técnico obtenido fue del 91%, con una permeabilidad primaria y asistida a los 3 años del 32% y del 53%, respectivamente, y no se encontraron diferencias en la permeabilidad según el tipo de lesión o el nivel de la PTA. Concluyen que los resultados de la angioplastia son inferiores a la cirugía según la revisión de la literatura, pero que sin embargo puede ser una alternativa en casos seleccionados.
En un artículo de Dougherty et al123, en una amplia serie de casos con 125 pacientes tratados con cirugía combinada, presenta 52 con pacientes con revisión de by-pass, realizándose 13 procedimientos (angioplastia y/o stent) distal al by-pass (11 poplítea y 2 vasos tibiales), 19 proximales (sobre femoral superficial) y ambos en 4 casos. En 35 casos se trató el injerto solo y en 4 casos se combinó la angioplastia del injerto con algún procedimiento sobre la arteria proximal o distal. El éxito técnico (< 30% estenosis) se consiguió en un 88%. No se pudo analizar la permeabilidad con una tabla de vida, pero sea analizaron las causas de las obstrucciones. Se produjo la obstrucción del by-pass en 22 casos (42%) a los 7,5 meses y los autores sólo se pudieron identificar un fracaso del procedimiento endovascular en 3 casos.
El trabajo de Nguyen et al124 plantea los resultados sobre 188 revisiones de by-pass, en las que se realizaron 35 angioplastias con balón, encontrando una permeabilidad secundaria al primer año del 84% con este procedimiento, frente al 95,4% del mejor tratamiento quirúrgico; estas diferencias no son estadísticamente significativas. Concluyen que aunque existe unos buenos resultados con el balón de angioplastia, se necesita más tiempo de seguimiento para poderlo recomendar frente a la cirugía.
Carlson et al125 han comunicado 45 angioplastias con balón sobre by-pass venosos. Se obtuvo un buen resultado radiológico en un 91,7%. La permeabilidad asistida que obtuvieron fue del 87, el 83,2 y el 78,9% a los 6, 12 y 24 meses, respectivamente, aunque la mayoría de los procedimientos fueron angioplastia con balón, se incluyen 5 pacientes tratados de forma quirúrgica, después del procedimiento inicial endovascular.
El desarrollo de nuevos materiales puede proporcionar en un futuro resultados diferentes para el tratamiento de las estenosis en los by-pass venosos. Kasirajan y Schneider126 publicaron en 2004 los resultados inmediatos de la utilización del cutting baloon sobre 19 estenosis de by-pass venoso de < 2cm. Ningún paciente requirió cirugía abierta o implante de stent por aparición de «recoil», disección o resultado subóptimo. En un seguimiento de 11 meses, sólo un paciente ha presentado reestenosis y no hubo durante el periodo obstrucciones de by-pass.
Una de las limitaciones del tratamiento endovascular en el sector infrainguinal es la extensión de las lesiones; en la recanalización de segmentos largos, la angioplastia subintimal se utiliza de modo preferente. Tiene el problema del fracaso de la entrada en la luz verdadera, dificultad esta última que ha disminuido desde el desarrollo de catéteres específicos de reentrada, obteniendo resultados de éxito técnico del 79%, con una permeabilidad primaria del 70% al año y del 34% a los 3 años127. Esto es especialmente útil en aquellos pacientes con patología femoropoplítea o distal, sin posibilidad de realizar un by-pass venoso, en los que una reparación femoral o ilíaca no es suficiente para la cicatrización de lesiones tróficas.
ConclusionesEs innegable que las tendencias de futuro pasan por el aumento del número de procedimientos endovasculares dentro del ámbito de la cirugía vascular128,129. Sin embargo, los resultados de muchos procedimientos quirúrgicos no han sido igualados por el tratamiento endovascular. Por otra parte, los procedimientos percutáneos tienen, en general, una morbimortalidad inferior a los procedimientos quirúrgicos que, sumado a las ventajas «menor agresividad» y «repetibilidad», hacen que sean demandados y realizados en casos sin el suficiente nivel de evidencia. Por otra parte, la dificultad en el estudio estadístico de los procedimientos híbridos es obvia. Existe una gran variedad de tratamientos con diferentes materiales, por lo que la protocolización y los diseños de los estudios son muy diversos, y por ello no es sencillo reproducir los trabajos de los diferentes grupos y validar los resultados. La utilización juiciosa de ambos tratamientos puede proporcionar buenos resultados, pero sería deseable un mayor nivel de evidencia para recomendar algunos procedimientos combinados.
Tratamiento endovascular de los aneurismas de la arteria poplíteaIntroducciónLos aneurismas de arteria poplítea (AAP) son una entidad relativamente infrecuente, que afecta al 0,1% de la población general. Suponen el 70% de los aneurismas periféricos, siendo en más de la mitad de los casos bilaterales. Aunque hasta el 62% de los pacientes portadores de AAP tienen aneurisma aórtico (AA) solamente el 14% de los AA también presentan AAP.
Suelen ser asintomáticos, aunque entre el 20 y el 40% debutan con isquemia crónica de la pierna130. La rotura es infrecuente.
Los AAP sintomáticos o asintomáticos de diámetro superior a 2cm son candidatos a cirugía131.
La cirugía abierta se ha considerado el tratamiento de elección en pacientes de bajo riesgo y suele consistir en exclusión de AAP mediante ligadura distal y proximal seguida de revascularización con vena safena. La permeabilidad secundaria en pacientes sin isquemia aguda está entre el 64 y el 90% a los 5 años132. Estas tasas disminuyen en caso de isquemia crónica y cuando se utiliza material sustitutivo heterólogo. El tratamiento del AAP por isquemia aguda conlleva una tasa de amputación de hasta el 25%133.
Recientes trabajos refieren como el proceder quirúrgico clásico (ligadura y by-pass) no resuelve los aneurismas. Se refiere hasta un 38% de los casos con flujo persistente en el saco y hasta un 12% de rotura en esa misma serie134,135. Es el mismo mecanismo de la endofuga tipo II de la cirugía endovascular de AA.
La mortalidad operatoria no debe ser superior al 2%130, aunque hasta el 61% de los pacientes portadores de un AAP presentan enfermedad arteriosclerótica cardiovascular sintomática131.
DiagnósticoIndependientemente del tipo de tratamiento que se elija, el diagnóstico se basa en el alto índice de sospecha en pacientes con factores de riesgo cardiovascular y mayores de 50 años:
- –
Examen físico: masa hiperpulsátil en la fosa poplítea.
- –
Ecografía-Doppler: utilizada desde 1978130 permite la cuantificación del diámetro de la arteria y la posible presencia de trombo. Evalúa la vena safena como posible conducto sustitutivo.
- –
TC-RM: permiten evaluar diámetro y trombo de forma más invasiva. Evalúa la presencia de aneurismas sincrónicos de otras localizaciones.
- –
Arteriografía: estudia de forma adecuada la permeabilidad distal y aporta interesante información anatómica en la planificación del tratamiento endovascular.
Diversos autores refieren la dificultad de asegurar una adecuada zona de anclaje proximal y/o distal. La imagen arteriográfica, en algunos, casos no es capaz de distinguir arteria no dilatada de zona aneurismática y trombo concéntrico. Para asegurar los márgenes del AAP, se recomienda el uso de ecografía perioperatoria y marcaje sobre la piel de los márgenes136. Otra opción es la utilización de ecografía intraoperatoria137.
Tratamiento endovascularLa primera descripción publicada data de 1994138, se utilizó un stent de acero cubierto con vena safena.
Las ventajas del tratamiento endovascular se refieren a que es menos agresivo que la cirugía convencional, hecho que puede ser de gran importancia en pacientes de alto riesgo. No utiliza la vena safena.
En la literatura no hay indicaciones consensuadas para optar por tratamiento quirúrgico o endovascular. No obstante algunos autores coinciden en que se puede indica cirugía endovascular en los siguientes casos130,132,136:
- –
Edad superior a los 50 años.
- –
Buen runoff (> 8 en el score de la Join Council of thee Society for vascular Surgery and the International Society for cardiovascular Surgery).
- –
Ausencia de compresión nerviosa o venosa.
- –
Ausencia de contraindicación para seguir tratamiento anticoagulante, antiagregante o fibrinolítico.
- –
Cuello de anclaje superior e inferior de un centímetro como mínimo.
- –
Diámetros de los vasos que admitan los dispositivos comerciales.
Se pueden considerar contraindicaciones, además de los ítems contrarios a las indicaciones referidas anteriormente:
- –
Alergia al contraste yodado. Aunque ya se ha publicado una serie implantada sin radiología ni contraste137.
- –
Estilo de vida. Determinadas sociedades tienden a realizar flexiones prolongas y forzadas de las rodillas, árabe y oriental (hasta 160°)139.
- –
Diámetros de las zonas de anclaje superior a los 14mm (no hay endoprótesis superiores a los 12mm).
Se han publicado casos tratados con varios tipos de stent recubiertos (tabla 1).
Tipos y medidas de endoprótesis utilizadas
| Tipo | Empresa | Esqueleto | Cobertura | Diámetro | Longitud | Fr |
| Cragg-Endopro-System/Passager/Corvita | Boston | Nitinol | Dacron | |||
| Wallgraf | Boston | Nitinol | Dacron | 6, 12, 14 | 20, 30, 50, 70 | 9-10 |
| Fluency | Bard | Nitinol | PTFE | 6, 7, 8, 9, 10 | 40, 60, 80 | 8-9 |
| Hemobahn- Viabahn | Gore | Nitinol | PTFE | 6, 7, 8 | 5, 10, 15 | 9 |
Algunos de los dispositivos empleados hace unos años ya no están disponibles en el mercado, han cambiado de nombre e incluso de diseño. Cragg-Endopro-System-1® pertenecía a una empresa que, al ser absorbida por Boston Stientific, cambió de nombre a Passager®. Algo similar ocurrió con Corvita®. Boston comercializa en España el Wallgraft, basado en el Wallstent®. Sin embargo, en EE. UU. la Fod and Drug Administration sólo autoriza el Wallgraft para uso bronquial. Esa misma situación ocurre con el stent recubierto Fluency®.
Gore comercializó hace unos años el dispositivo Hemobahn® en muchos calibres y longitudes. Se sustituyó por el Viabahn® que aportó numerosas mejoras técnicas pero ha disminuido la gama de calibres.
Los avances de la industria son constantes y la práctica diaria debería basarse en la utilización de dispositivos contrastados.
Los requerimientos técnicos ideales serian como mínimo. Metal poco fracturable con los movimientos de la rodilla y, a su vez, flexible. Ausencia de posibilidad de plicatura.
Métodos de seguimientoEl seguimiento de los pacientes sometidos a reparación endovascular de AAP no es distinto del seguimiento de los pacientes sometidos a cirugía de by-pass. Hasta un tercio de los AAP sometidos a reparación, tanto quirúrgica como endovascular, precisan en los dos primeros años una intervención secundaria140.
Se ha referido como la disminución de más del 20% en el ITB entre la posición basal y en flexión de 120° de la rodilla es signo de kinking y fallo de la endoprótesis132.
Algunos autores recomiendan la realización de TC para evaluar el tamaño del AAP y la presencia de endofugas tipo 2 a partir de colaterales132,136,141. Este tipo de exploración también se recomienda para los pacientes sometidos a cirugía de ligadura proximal y distal, y revascularización135,141.
De forma específica, en estos pacientes se recomienda la realización de radiología simple de rodilla en posición basal y de flexión en 120° para evaluar la plicatura e integridad del esqueleto metálico de la endoprótesis142.
En cuanto a la ecografía, si se detecta estenosis intraendoprótesis superior al 50%, se recomienda una arteriografía143. En una serie de sólo 14 pacientes intervenidos sin el uso de radiología y contraste (solamente eco-Doppler) se detectó que un flujo intraprótesis menor de 100ml/s era un predictor de trombosis precoz144,145.
Comentarios de algunas de las series más representativas publicadasActualmente, los resultados de los procedimientos endovasculares sobre aneurismas poplíteos parecen tener una permeabilidad inferior a los obtenidos mediante tratamiento quirúrgico abierto. Dos series referidas a tratamiento quirúrgico de más de 100 pacientes en total muestran permeabilidad asistida al año del 78 y el 80%146,147. Dos series amplias como son las de la AURC148 y la de St. Lukas149 muestran permeabilidad segundarias del 87% (3 años) y el 96%(4,5 años), respectivamente. En general, la tasa de trombosis de endoprótesis es superior a la de by-pass, sin embargo la permeabilidad asistida es superior para el tratamiento endovascular, permitiendo múltiples procedimiento de rescate de la endoprótesis antes de plantear cirugía. Este proceder puede llegar a suponer hasta el 14% de los casos a los 3 años150.
Un aspecto interesante relacionado con la permeabilidad es el de la fractura del dispositivo. Esta se ha encontrado hasta en el 17% de los casos147, presentándose en las zonas de solapamiento y sin afectar a la permeabilidad. Se ha identificado como factor de riesgo de trombosis el no estar bajo antiagregación con clopidogrel137 y para la fractura del dispositivo, la edad menor de 60 años147.
Sólo una serie ha referido la presencia de endofugas en el seguimiento precoz, llegando hasta el 11% de los casos148.
De los estudios actuales, no se puede deducir qué técnica ofrece mejores resultados en cuanto a permeabilidad, tasa de trombosis del procedimiento y salvamento de la extremidad.
CorolarioEl tratamiento endovascular del AAP sigue todavía en fase de investigación. Considerando todos los casos publicados, no hay más de 500 pacientes tratados136. Se han empleado al menos 7 dispositivos distintos, aunque en los últimos 5 años prácticamente sólo se reportan los dispositivos de GORE.
Los resultados referidos no son homologables entre los distintos estudios. Aun no se dispone de la endoprótesis ideal.
La decisión de ofrecer tratamiento endovascular a un paciente portador de AAP dependerá de su estado general, expectativa de vida, anatomía y disponibilidad de vena130. Considerando que el equipo quirúrgico pueda ofrecer resultados aceptables con ambas técnicas.
Faltan estudios prospectivos, aleatorizados y con grupos realmente comparables para poder extraer conclusiones de que tipo de tratamiento es el más adecuado de forma general y si algún subgrupo específico se pude beneficiar de un tratamiento u otro.
Tratamiento médico intra y postoperatorioFármacos antitrombóticosEl uso de antiagregantes plaquetarios y agentes antitrombóticos en pacientes con EAP tiene como objetivo principal la prevención de eventos cardiovasculares y accidentes cerebrovasculares, así como evitar las estenosis u obstrucciones de los diferentes procedimientos utilizados para la revascularización de los MMII. Por tanto, la administración de estos fármacos en pacientes sometidos a tratamiento endovascular de las extremidades debe estar orientada en ambos aspectos.
Gran parte de la evidencia que respalda el empleo de tratamiento antiagregante plaquetario y adyuvante perioperatoria en el tratamiento de la EAP, se basa en una extrapolación a partir de lo objetivado en estudios de patología coronaria.
El ácido acetilsalicílico (AAS) es un antiagregante plaquetario bien conocido, utilizado en la prevención secundaria. Numerosas publicaciones han concluido que pacientes con enfermedad cardiovascular consiguen una reducción del 25% de nuevos eventos cardiovasculares con su uso (sobre todo en pacientes con enfermedad coronaria o cerebrovascular). Un metaanálisis indica que dosis bajas de AAS (75-160mg) tienen efecto protector y producen menos efectos secundarios en relación con la hemorragia digestiva que dosis más elevadas. Estos hallazgos preconizan el uso actual de dosis bajas de AAS en pacientes con patología cardiovascular. En contraste con otro metaanálisis, más reciente, que combina datos de EAP de ensayos en los que se utilizaron, además de AAS, clopidogrel, ticlopidina, dipiridamol y picotamida, se objetivó una reducción estadísticamente significativa del 23% de presentar eventos isquémicos en todos los subgrupos de pacientes con EAP. El uso del tratamiento antiagregante plaquetario está de sobra justificado en el tratamiento global de la EAP, aunque sólo se ha demostrado eficacia de AAS cuando coexiste EAP y enfermedad cardiovascular151.
Por esto, se recomienda que los pacientes con EAP, como los tratados mediante cirugía endovascular de MMII, sean tratados con antiagregantes plaquetarios, para reducir el riesgo de infarto agudo de miocardio, accidentes cerebrovasculares y muerte de origen cardiovascular.
Según el último consenso TASC (TASC II), el tratamiento antiagregante plaquetario, que debe ya estar pautado previamente en todo paciente con enfermedad arterial obstructiva de extremidades inferiores, debe iniciarse antes de la intervención de revascularización de los MMII y debe continuarse posteriormente como farmacoterapia adyuvante después de ésta, tanto si se trata de cirugía convencional como de tratamiento endovascular (nivel de evidencia A)152. A menos que exista alguna contraindicación para el uso de antiagregación, ésta debe mantenerse de forma indefinida (nivel de evidencia A)152.
En todo paciente que va a ser intervenido de una reconstrucción arterial infrainguinal está recomendada la administración preoperatoria de 75-100mg de AAS. Igualmente, en pacientes que van a ser intervenidos de endarterectomía carotídea se recomienda administrar 75-100mg de AAS de forma preoperatoria para prevenir eventos neuroisquémicos peroperatorios (ambas con nivel de evidencia 1A)153. Teniendo en cuenta ambas premisas, sería recomendable la administración de AAS a dosis similares de forma preoperatoria ante el tratamiento endovascular de arterias de los MMII.
La combinación de AAS y clopidogrel se relaciona con una disminución del riesgo relativo del 20% de presentar complicaciones cardiovasculares en pacientes con síndrome coronario agudo154. En un estudio reciente donde se compara clopidogrel en asociación con AAS frente a AAS solo, en una población de alto riesgo de pacientes con enfermedad cardiovascular establecida (incluida EAP) y pacientes sin enfermedad cardiovascular pero con múltiples factores de riesgo, no se observó beneficio de la asociación de ambos fármacos en comparación con AAS, en cuanto a la evolución clínica de infarto agudo de miocardio, ictus y muerte por causas vasculares155. Por esta razón, no existe justificación para el uso combinado de AAS y clopidogrel en pacientes con EAP.
La información en relación con la utilidad de los anticoagulantes orales para reducir las complicaciones cardiovasculares se deriva de estudios en pacientes con cardiopatía isquémica. No existe evidencia que sustente la recomendación para el uso de anticoagulantes orales solos o en combinación con AAS como método para reducir los eventos cardiovasculares adversos en pacientes con EAP y en su utilización debe tenerse en cuenta el mayor riesgo de sangrado. En pacientes con EAP que requieren la administración de anticoagulantes orales por otro motivo, como puede ser fibrilación auricular, el riesgo/beneficio del uso de antiagregantes, anticoagulantes o la combinación de ambos, debe evaluarse individualmente.
El abciximab, un inhibidor de los receptores GPIIB/IIA que debe administrarse por vía intravenosa, mejora la permeabilidad de forma significativa respecto al placebo en el tratamiento endovascular de lesiones femoropoplíteas largas al mes y a los 6 meses. El abciximab podría ser útil en pacientes con lesiones largas y complicadas, pero no existe una evidencia que lo recomiende.
En un estudio se compara la permeabilidad de procedimientos endovasculares complicados con largas disecciones postangioplastia en MMII, administrando durante 6 meses AAS asociada a heparinas de bajo peso molecular (HBPM: nadroparina cálcica) o heparina no fraccionada durante 7 días. No hay diferencias en el sector ilíaco pero sí en el sector femoropoplíteo, donde las diferencias alcanzan la significación estadística a favor de la HBPM.
En las revisiones existentes sobre el tema, se concluye que existen pocas evidencias respecto a la efectividad del tratamiento antiagregante en la prevención de estenosis u obstrucciones de las técnicas endovasculares en MMII y las que hay tienen poco poder estadístico. Apuntan que la AAS a dosis entre 75 y 300mg administrada antes del tratamiento endovascular de MMII parece ser lo más efectivo y seguro en la prevención de estenosis/obstrucciones, y las dosis más altas no aportan mejores resultados. Estos resultados avalan el hecho del efecto que la activación y la agregación plaquetaria tienen en la reobstrucción de arterias ateromatosas tratadas mediante un balón de angioplastia y el papel que desempeñan los antiagregantes. No existen ensayos clínicos que utilicen clopidogrel asociados a AAS en la prevención de estas complicaciones, asociación que se ha demostrado efectiva en la angioplastia/stent coronarios. Sin embargo, es razonable considerar esta combinación al menos en lesiones de alto riesgo o en el tratamiento endovascular de las arterias distales.
La peculiaridad de este caso es que sabemos que la antiagregación es efectiva en la prevención de eventos cardiovasculares en todos los pacientes con EAP, con mayor poder estadístico que en pacientes con patología en otras localizaciones. Sabemos la efectividad de la doble antiagregación en angioplastia/stent coronario, demostrada y con alto poder estadístico. A nivel carotídeo, la Sociedad Española de Neurología recomienda la doble antiagregación (AAS 80-325mg y clopidogrel 300mg a dosis de carga antes de la implantación de un stent carotídeo, manteniendo posteriormente, como tratamiento adyuvante, AAS 100mg/24h y clopidogrel 75mg/24h) durante un año y posteriormente uno de los 2 fármacos indefinidamente, lo que coincide con lo administrado en el ensayo clínico ICSS que compara stent carotídeo y endarterectomía.
En MMII, los estudios en que nos basamos datan de hace más de 10 años y no existen estudios con doble antiagregación. Únicamente se ha demostrado que, funcionalmente en estudios de investigación, la doble asociación inhibe la función plaquetaria de forma significativamente mayor que solamente con AAS.
Se recomienda un tratamiento médico tras la angioplastia y la implantación de stents para prevenir los fallos tempranos de trombosis en el lugar de la intervención. El tratamiento estándar es la heparinización durante la intervención para aumentar el tiempo de tromboplastina activado a 200-250s. Después de la angioplastia y/o la implantación de stents en las arterias femoropoplíteas, se recomienda el empleo de medicación antiagregante plaquetaria durante toda la vida para fomentar la permeabilidad (AAS o clopidogrel). También se recomienda un tratamiento antiagregante plaquetario durante toda la vida para prevenir los episodios cardiovasculares152.
Uso de estatinas en el preoperatorioExisten múltiples estudios que han demostrado los efectos beneficiosos del uso de estatinas en prevención primaria y secundaria en patología cardiovascular. El beneficio de las estatinas en la enfermedad cardiovascular no se explica únicamente por la disminución de las cifras de colesterol, sino también por sus efectos pleiotrópicos.
Los procedimientos percutáneos cardiológicos pueden producir daño miocárdico, que se refleja en la elevación de la enzima creatincinasa-MB y la isoenzima troponina I, empeorando el pronóstico en el seguimiento de los procedimientos cardiológicos a largo plazo. Estudios observacionales en los que se han usado estatinas de forma preprocedimiento sugieren una reducción de la incidencia de infarto de miocardio tras dichos procedimientos y previenen del daño miocárdico156.
Se realizó un metaanálisis de estudios aleatorizados, seleccionando 21 estudios de 270, que incluían a 4.805 pacientes. Dicha selección se basaba en aquellos estudios que utilizaban estatinas de forma preoperatoria en procedimientos cardiológicos invasivos, considerando como tal intervenciones coronarias percutáneas y by-pass aorto-coronario. El uso preoperatorio de estatinas reducía de forma significativa el riesgo de infarto de miocardio tras el procedimiento (riesgo relativo 0,97; p<0,0001). Este beneficio se objetivó en procedimientos cardiológicos invasivos pero no en la cirugía aorto-coronaria, aunque sí reducía el riesgo de presentar fibrilación auricular en el postoperatorio de cirugía aorto-coronaria. No se halló significación estadística para muerte por cualquier causa. El uso rutinario de estatinas previo a procedimientos invasivos cardiológicos reduce de forma significativa el riesgo de infarto de miocardio posprocedimiento157, por lo que debería considerarse y quizá extrapolarse a la actividad endovascular de patología arterial de MMII, sobre todo en pacientes de riesgo alto.
Recomendaciones- –
Los pacientes que presentan EAP, tanto si presentan clínica isquémica coronaria o cerebrovascular, como ausencia de ellas, deben recibir tratamiento antiagregante plaquetario, puesto que su indicación está centrada en reducir el riesgo de morbimortalidad cardiovascular (nivel de evidencia 1A)152,153.
- –
El AAS es un tratamiento eficaz en pacientes con EAP que presentan asociados signos clínicos de otras patologías cardiovasculares (enfermedad coronaria o carotídea) (nivel de evidencia A)152.
- –
En ausencia de clínica coronaria o isquemia cerebrovascular, podría administrarse como terapia antiagregante AAS (75-100mg/día) frente a clopidogrel (75mg/día) (nivel de evidencia 2B)153.
- –
En caso de intolerancia a AAS, se recomienda el uso de clopidogrel (75mg/día) como alternativa segura y eficaz, frente a ticlopidina (nivel de evidencia 1B)152,153.
- –
En pacientes con EAP no está indicado el uso de anticoagulación para prevenir eventos cardiovasculares o muerte de origen vascular (nivel de evidencia 1A)153.
- –
Puede ser recomendable el uso de 75-100mg de AAS de forma preoperatoria ante el tratamiento endovascular de arterias de los MMII (nivel de evidencia C).
- –
Puede valorarse la asociación preoperatoria de estatinas en el tratamiento endovascular de los MMII, como tratamiento preventivo de IAM postoperatorio en pacientes de alto riesgo (nivel de evidencia C).
- –
Pacientes sometidos a angioplastia simple o angioplastia y stent a nivel de MMII, se recomienda la administración de AAS adyuvante (75-100mg/día) de por vida (nivel de evidencia 1C)153.
- –
Se puede recomendar la doble antiagregación con AAS y сlopidogrel en pacientes sometidos a colocación de stents libres, recubiertos o stents liberadores de drogas (dosis de carga preimplantación de stent: AAS 80-325mg y сlopidogrel 75-300mg). Manteniendo como tratamiento adyuvante AAS 80-325mg y сlopidogrel 75mg al día durante un año en pacientes sometidos a angioplastia y stent en MMII, continuando posteriormente con 1 solo fármaco (nivel de evidencia C).
- –
En pacientes tratados de forma endovascular a nivel de MMII, no está recomendado el uso de anticoagulación con heparina o anticoagulación oral (nivel de evidencia 1A)153.
Las técnicas endovasculares para el tratamiento de la patología arterial de MMII suponen la introducción de materiales (guías, catéteres, introductores…) dentro de éstas, a partir de abordajes percutáneo o arterial directo mediante una incisión cutánea mínima, condicionando una posible puerta de entrada para microorganismos (generalmente, saprofitos de la piel), con la consiguiente diseminación sistémica a través sistema arterial, implantación y proliferación en diferentes órganos o en las prótesis introducidas. Sin embargo, en teoría, las posibilidades de contaminación son menores que en la cirugía abierta porque, generalmente, la herida, el tiempo quirúrgico y el contacto de cirujanos y materiales con los tejidos internos son mucho menores.
La infección del stent es una complicación grave, aunque rara, en la cirugía endovascular, más frecuente que la infección arterial de una zona de angioplastia (puesto que la implantación de un stent supone colocar un material extraño en la zona intraarterial y produce mayor reacción inflamatoria). La infección del stent produce una arteritis con formación de seudoaneurisma.
Se consideran factores predisponentes de infección la punción reiterada en un mismo lugar en un corto intervalo o el mantenimiento de un introductor durante muchas horas.
En estos procedimientos se produce una bacteriemia en más de un 30% de los casos, que es transitoria y producida por microorganismos saprofitos de la piel (S. epidermidis, Streptococcus, Corynebacterium). En los estudios se ha demostrado que esta bacteriemia no se produce en los grupos a los que se les administró antibiótico antes del procedimiento.
Para algunos autores, la colocación de material endoluminal (stent) supone una indicación de profilaxis antibiótica158.
Recomendaciones. Dado el bajo riesgo de infección condicionada por los procedimientos endovasculares en MMII, a pesar de la bacteriemia que se produce, hace que actualmente la profilaxis antibiótica sea raramente utilizada.
Debemos considerar el uso de profilaxis antibiótica en aquellos casos de riesgo alto, como la reintervención en menos de 7 días, la necesidad de mantener introductores varias horas o procedimientos de larga duración (nivel de evidencia C).
La profilaxis antibiótica de referencia a usar en estos casos es cefazolina 2g/iv (nivel de evidencia C)159.
Anestesia en cirugía endovascular de miembros inferioresUna de las principales ventajas teóricas de la cirugía endovascular de MMII, sobre todo en pacientes de riesgo quirúrgico alto, es que puede practicarse bajo anestesia local. Sin embargo, puede que, en determinadas circunstancias, sea necesaria la asociación de algún otro tipo de anestesia o sedación.
En la actualidad, no existen evidencias sobre qué tipo de anestesia debe utilizarse en estos procedimientos, aunque si existen datos sobre las técnicas anestésicas utilizadas. En general, la práctica habitual es la utilización de anestesia local con mayor o menor grado de sedación, y se prefiere contar con el apoyo de un anestesista.
Más del 90% de los procedimientos en la zona de los MMII (arteriografía, angioplastia, stent) se realizan bajo anestesia local y sedación suave, para mantener alerta al paciente. En un alto porcentaje de pacientes se administra premedicación ansiolítica.
Recomendaciones. Los procedimientos endovasculares de MMII deben realizarse bajo anestesia local, asociando sedación suave, en caso necesario (nivel de evidencia C).
Es recomendable aplicar premedicación ansiolítica y contar con la colaboración del anestesista (nivel de evidencia C).