El aneurisma de aorta abdominal supone una importante causa de mortalidad en nuestra sociedad. Sin embargo, poco conocemos sobre su etiopatogenia. El importante papel de las metaloproteasas y alteraciones genéticas han centrado la mayor parte de los esfuerzos investigadores hasta hoy, pero poco se ha estudiado sobre el origen de esta enfermedad. Para llegar al conocimiento completo de esta, hay que avanzar con nuevas tecnologías que nos muestren el problema desde diferentes prismas. En este sentido, la proteómica como estudio de las proteínas expresadas por el tejido patológico o la epigenética como estudio de la influencia de los factores ambientales sobre los propios genes son técnicas que no han proliferado aún en esta patología, y que sin duda nos van a ayudar a profundizar en ella. Mediante esta revisión se repasan estas nuevas herramientas que invitan a la aventura de la investigación en esta y otras patologías de nuestro ámbito.
Abdominal aortic aneurysm is a major cause of death in our society. However, little is known about its pathogenesis. The important role of metalloproteinases and genetic disorders has been the focus of most research efforts to date, but little has been studied on the origin of this disease. To get the complete knowledge of this, we must move forward with new technologies that show us the problem from different perspectives. In this regard, proteomics as the study of proteins expressed by the diseased tissue, or epigenetics as the study of the influence of environmental factors on the genes themselves, are techniques that are still not widely used in this condition, and would definitely help in increasing our knowledge of it. These new tools that invite adventure of research into this and other diseases in our area are reviewed.
Los aneurismas de aorta abdominal (AAA) constituyen un problema de salud pública, con una prevalencia del 9% en hombres y del 1% en mujeres de edad superior a los 65 años1,2. Los principales factores de riesgo para su desarrollo son edad avanzada, ser varón, tabaquismo, hipertensión, hipercolesterolemia, obesidad, aterosclerosis e historia familiar3.
Poco a poco son más las evidencias que apuntan hacia la existencia de factores ambientales y genéticos implicados en el desarrollo de los AAA3,4.
Por ello, mejorar los conocimientos sobre los mecanismos implicados en la aparición de los AAA resulta, sin duda alguna, de gran ayuda para intentar identificar pacientes con riesgo de sufrir AAA.
Aneurisma abdominal y susceptibilidad genéticaEl mejor conocimiento del genoma humano está facilitando el conocimiento de los genes que median en el desarrollo de los AAA. Se estima que el 19% de los familiares de primer grado de enfermos afectados de AAA presentan una predisposición genética a desarrollar la enfermedad4.
Se han descrito alteraciones genéticas asociadas a muchos otros genes candidatos a estar implicados en la génesis de los AAA. Probablemente los más estudiados son los relacionados con procesos inflamatorios, como el gen de la interleuquina (IL)-10, IL-15, factor de necrosis tumoral-alfa (TNFα) y factor de crecimiento beta (TGFβ), mediadores de la respuesta inmune como el antígeno leucocitario humano (HLA-DR), proteasas tisulares como la metaloproteasa (MMP)-9, MMP3, inhibidores de las MMP (TIMP)-1 y TIMP-2, y aquellos que codifican para diferentes componentes del sistema renina-angiotensina como la enzima convertidora de angiotensina i (ECA) y el receptor tipo 1 de angiotensina ii, entre otros5.
Un hallazgo repetido en la literatura científica es que existen ciertos polimorfismos (alteraciones en la secuencia de un gen que ocurre en más del 1% de la población) que se asocian al desarrollo de AAA. Diversos estudios han descrito la asociación del polimorfismo del gen que codifica IL-10 (IL-10 -1082A), con el desarrollo de AAA6,7. Otros estudios han demostrado una mayor incidencia del alelo HLA-DR B1*0401 en pacientes con AAA. Por el contrario, el alelo HLA-DR B1*01 se presenta como un factor protector ante el desarrollo de AAA, siendo la asociación entre ambos alelos similar a la observada en enfermedades autoinmunes8,9.
Sin embargo, los resultados que se han obtenido hasta el momento son, en muchas ocasiones, inconsistentes y dispares, no mostrando evidencias claras de asociación con la enfermedad. Esto puede deberse al reducido tamaño muestral, diversidad en las poblaciones analizadas y tipo de técnicas empleadas en los estudios. Por ello, en los últimos años han ido surgiendo estudios genéticos a gran escala denominados «estudios de asociación integral del genoma» (genome-wide association [GWA]), para intentar identificar en grandes grupos poblacionales genes candidatos de asociación con el desarrollo de AAA.
Los GWA se están centrando fundamentalmente en el análisis de regiones intergénicas de determinados cromosomas. Hasta ahora se han centrado en los cromosomas 3, 4, 6, 11 y 19 en busca de posibles asociaciones con la aparición de aneurismas10.
El primero de estos estudios genéticos a gran escala fue el realizado por Elmore et al., en el que identificaron una posible asociación de un haplotipo en la región 3p12.3 del cromosoma 3 con el desarrollo de AAA11. Sin embargo, el impacto tanto de este estudio como del de los realizados con los cromosomas 4, 6, 11 y 19ha sido limitado debido al reducido número de pacientes analizados en cada uno de ellos. Ha sido recientemente cuando se ha confirmado la asociación de una variación genética en la región 9p21 del cromosoma 9 con la aparición y desarrollo de AAA12,13. Es por ello, junto con la del gen de la fibrilina, la segunda variante encontrada hasta la fecha con consistencia de asociación genética con el desarrollo de AAA. Esta misma variante también se ha asociado con riesgo de enfermedad aterosclerótica, independientemente de los factores tradicionales14. Se trata de una nueva alteración o polimorfismo en los genes CDKN2A, DKN2B y ARF que codifican proteínas con un papel fundamental en procesos como proliferación celular, envejecimiento celular y apoptosis. Sin embargo, el mecanismo por el que las variantes en esta región del cromosoma 9 aumentan el riesgo de enfermedad cardiovascular o de AAA sigue siendo desconocido.
En resumen, ninguno de los estudios realizados hasta el momento ha logrado explicar por completo la génesis de esta enfermedad, lo que hace pensar en la naturaleza multigénica de esta patología, con genes pendientes de estudiar, así como de otros factores o procesos implicados en el desarrollo y progresión de la enfermedad
EpigenéticaLa función del gen puede estar alterada por algo más que cambios en la secuencia nucleotídica. La epigenética, concepto acuñado en 1940 por Conrad Waddington, es la ciencia encargada de analizar el efecto del ambiente sobre los genes15.
El concepto de epigenética hoy en día describe las interacciones que se producen en los organismos entre los genes y el ambiente, y que se traducen en una mayor o menor expresión de un gen y en las proteínas derivadas de él. En este sentido, los factores de riesgo medioambientales son considerados promotores de diferentes tipos de patologías, estimulando una variedad de alteraciones o cambios a nivel epigenético16,17.
Es fundamental tener bien claro que los procesos epigenéticos son naturales y esenciales para muchas de las funciones del organismo, pero que si ocurren de manera inapropiada pueden provocar o inducir importantes efectos adversos. Es bien conocido que los genes se expresan o no dependiendo de diferentes factores, como la forma de la cromatina o condiciones bioquímicas, como la metilación del ADN o de las histonas, y es precisamente la epigenética quien se encarga de estudiar estos factores.
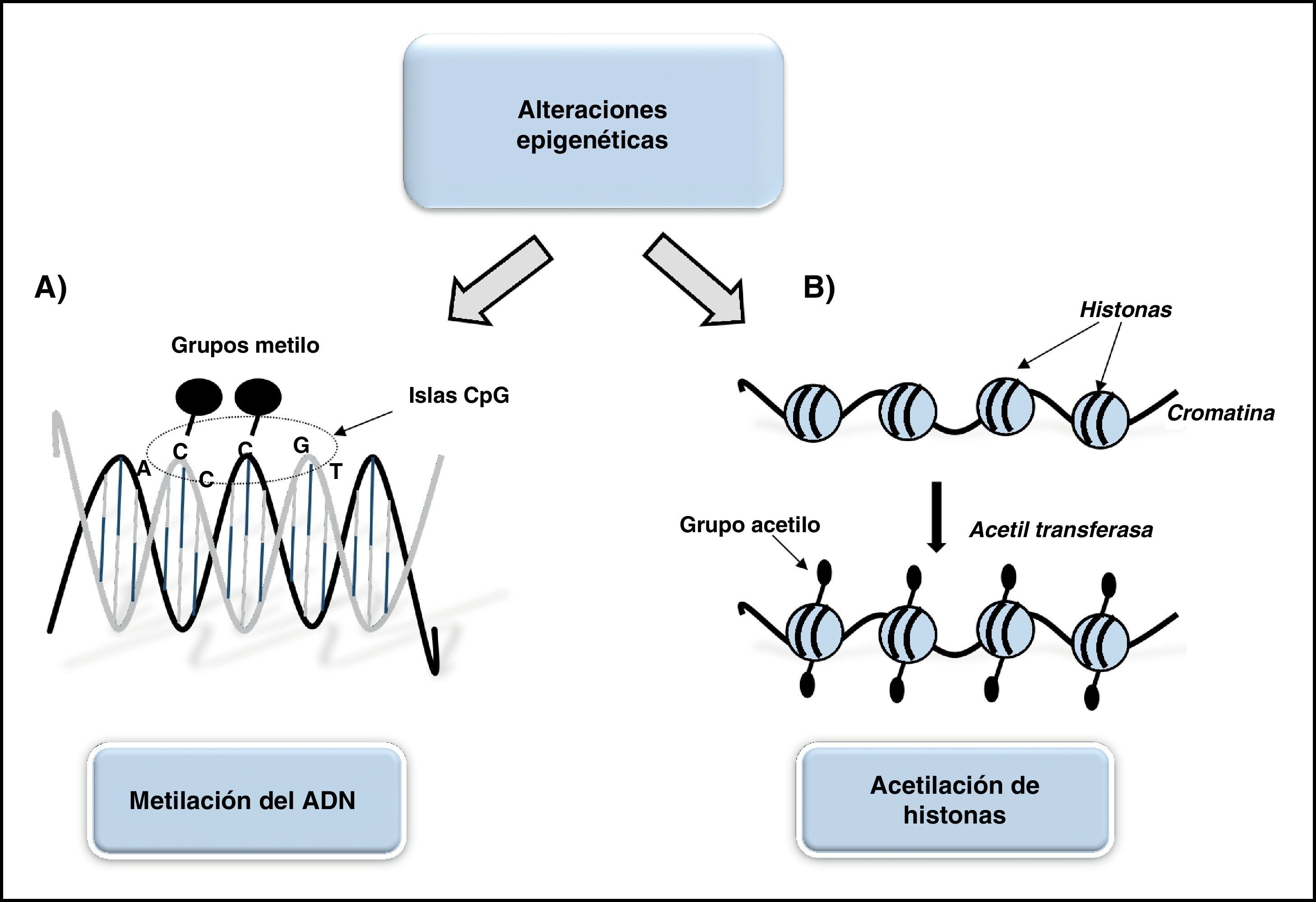
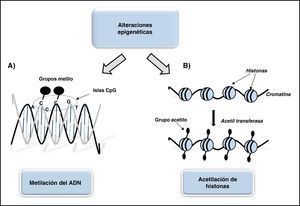
Tipos de modificaciones epigenéticasSe conocen distintos tipos de procesos epigenéticos que suponen modificaciones químicas en proteínas asociadas al ADN o a los nucleótidos componentes del ADN, entre los que destacan la metilación, acetilación, fosforilación y ubiquitinación de proteínas asociadas, siendo el más conocido la metilación del ADN (fig. 1).
Esquema representativo de las alteraciones epigenéticas más comunes asociadas el desarrollo de aneurismas. A. Metilación del ADN: adquisición de un grupo metilo (-CH3) en los lugares de la secuencia de ADN donde se disponen consecutivamente varias bases de citosina previa y contiguamente a una guanina (islas CpG) que funcionan como mecanismo de control de la expresión génica. B. Acetilación de histonas: proceso epigenético habitual que modifica la cromatina (complejo de ADN e histonas) por grupos acetilo que alteran la estructura de la cromatina influenciando la expresión génica.
Esta modificación consiste en la adquisición de un grupo metilo en los lugares de la secuencia de ADN donde se disponen consecutivamente varias bases de citosina previa y contiguamente a una guanina (pares CpG). Estas regiones se concentran fundamentalmente en la región promotora de los genes, y se llaman islas CpG. Estas funcionan como mecanismo de control de la expresión génica. El ambiente tiene una incidencia directa en la metilación CpG. Así, la dieta pobre en colina, metionina, vitamina B12 y ácido fólico reduce la capacidad del donador universal de metilos, S-adenosil-L-metionina, produciéndose metilaciones anómalas18. Existen diferentes proteínas involucradas en la metilación del ADN; entre ellas destacan las ADN metiltransferasas, las proteínas de unión metil-CpG y las ADN demetilasas. En concreto, las ADN metiltransferasas catalizan la transferencia de grupos metilo desde la S-adenosil-L-metionina a grupos CpG no metilados19.
Otro proceso epigenético habitual es la modificación de la cromatina (complejo de ADN e histonas) por grupos acetilo, enzimas y algunas formas de ARN como los microARN y pequeños ARN de interferencia, que alteran la estructura de la cromatina influenciando la expresión génica. Tanto la metilación del ADN como la modificación de la cromatina son procesos reversibles, por lo que la epigenética se presenta como una herramienta potencial para el estudio de las patologías.
Epigenética y aneurismas de aorta abdominalA pesar de la importancia que pueden tener los hallazgos epigenéticos en el estudio de las enfermedades vasculares, la investigación en esta área sigue siendo mínima comparada con otras áreas.
Estudios recientes ponen de manifiesto la asociación de genes específicos que promueven la hiper o hipometilación del ADN en la aterosclerosis19. De forma similar, la acetilación de histonas parece estar implicada en el desarrollo de las enfermedades cardiovasculares. De hecho, alteraciones del ADN por metilación o acetilación de las histonas ocurren durante procesos inflamatorios, proliferación celular y remodelación vascular, pudiendo ejercer un papel importante en la patogenia de los AAA20.
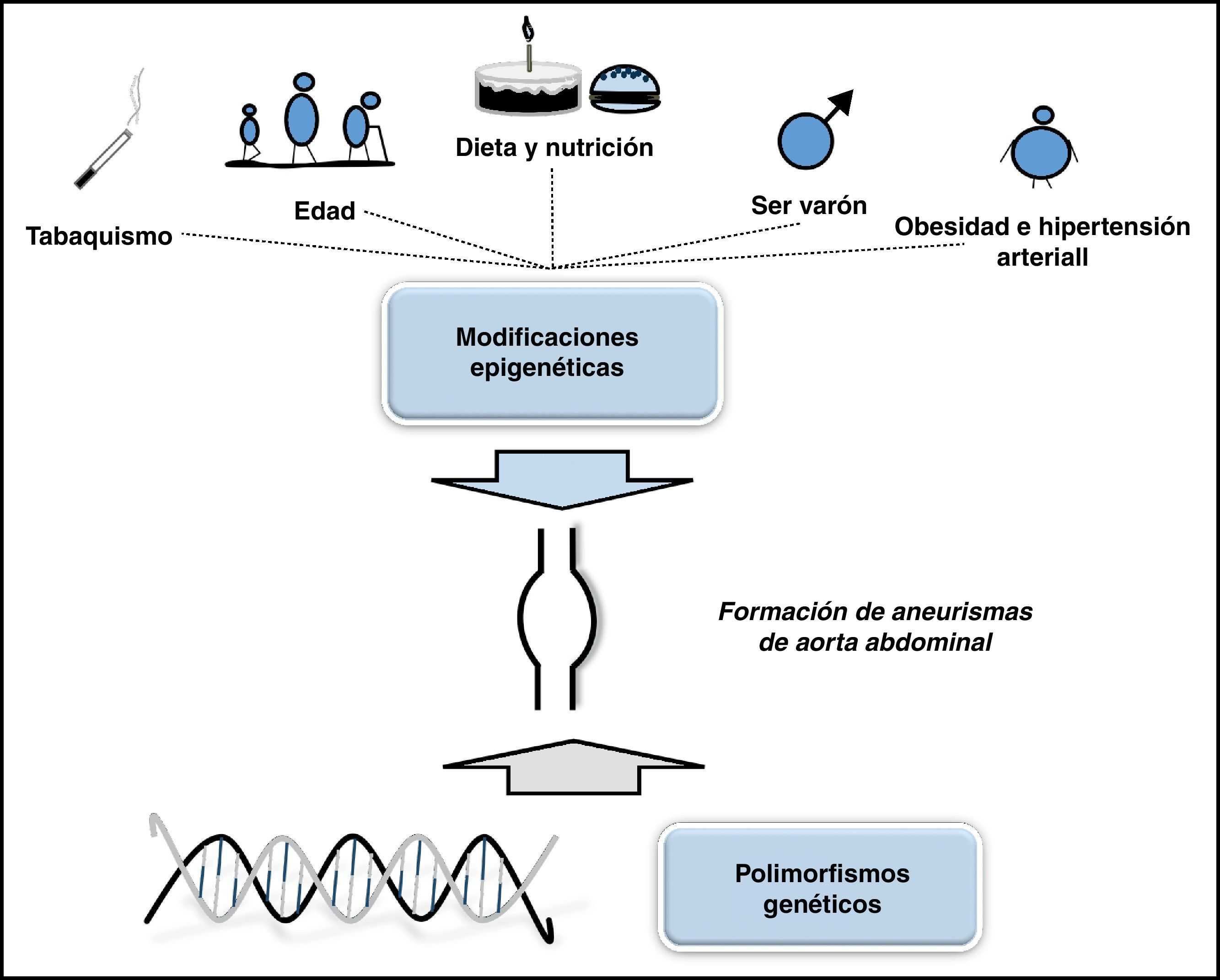
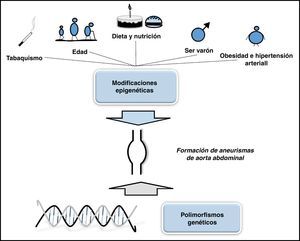
Factores de riesgo importantes para el desarrollo del AAA como el tabaco, la edad, el género masculino y la hipertensión se han vinculado con efectos epigenéticos, y por lo tanto, podrían actuar promoviendo la genésis de los AAA (fig. 2). Dado que determinadas alteraciones epigenéticas son reversibles, la profundización en el estudio de este campo podría identificar objetivos terapéuticos y el desarrollo de nuevos tratamientos del AAA.
Dos de los factores que influyen sobre los procesos epigenéticos son el tabaquismo y la HTA21. Teniendo en cuenta que ambos factores tienen una gran prevalencia en los pacientes que sufren AAA, y que pueden prevenirse, los resultados epigenéticos que se obtengan pueden ayudar en el tratamiento de estos pacientes. Otro factor que tiene influencia epigenética y que puede tener relevancia en el desarrollo de los AAA es la edad. La implicación epigenética de esta en el desarrollo de los AAA no ha sido estudiada. Se ha propuesto que alteraciones epigenéticas relacionadas con la edad predisponen a algunas células a desarrollar aterosclerosis, particularmente en lugares con estrés mecánico22.
Proteómica de los aneurismas de aorta abdominalNo existe ninguna duda sobre la necesidad avanzar y profundizar mucho más en el estudio de la génesis de los AAA. Para poder comprender esta patología es fundamental no centrar los esfuerzos únicamente en el estudio de los genes. Como hemos visto, el estudio de otros factores que pueden afectar a la expresión génica puede aportar información clave sobre el desarrollo y evolución de los aneurismas. Sin embargo, son pocos los estudios que han ido más allá y se han focalizado en las proteínas, que son el resultado de la expresión de los genes y que pueden aportan información fuera del alcance de los estudios genéticos. En las últimas décadas se ha ido desarrollando la proteómica, cuyo objetivo final es lograr comprender la función desempeñada en el organismo por las proteínas, así como su implicación en el desarrollo y evolución de patologías.
La proteómica consiste en el estudio y caracterización del conjunto de proteínas expresadas en un genoma. Estas son las encargadas de llevar a cabo las distintas funciones del organismo. En este sentido las proteínas, a diferencia de los genes, presentan una mayor complejidad y variabilidad. El genoma es relativamente constante, llegándose a considerar como un elemento estático de las células, mientras que el proteoma se caracteriza por ser dinámico, cambiante según las condiciones del medio ambiente como situaciones de estrés o acción de fármacos. Además, las proteínas una vez sintetizadas se encuentran sujetas a múltiples modificaciones postransduccionales como fosforilación, dando lugar a las isoformas de una proteína, que pueden desempeñar funciones diferentes.
La proteómica se encarga de identificar a gran escala patrones proteicos de enfermedad y de su aplicación a los pacientes para determinar la susceptibilidad de estos a desarrollar una determinada enfermedad23,24. También es una herramienta útil en el estudio de los mecanismos moleculares implicados en la patogenia de las enfermedades y para la identificación de dianas terapéuticas para el diseño de fármacos. Mediante esta tecnología, además de poder identificar y analizar múltiples proteínas de forma simultánea, podemos identificar distintas isoformas de una proteína, algo que hasta ahora era totalmente imposible.
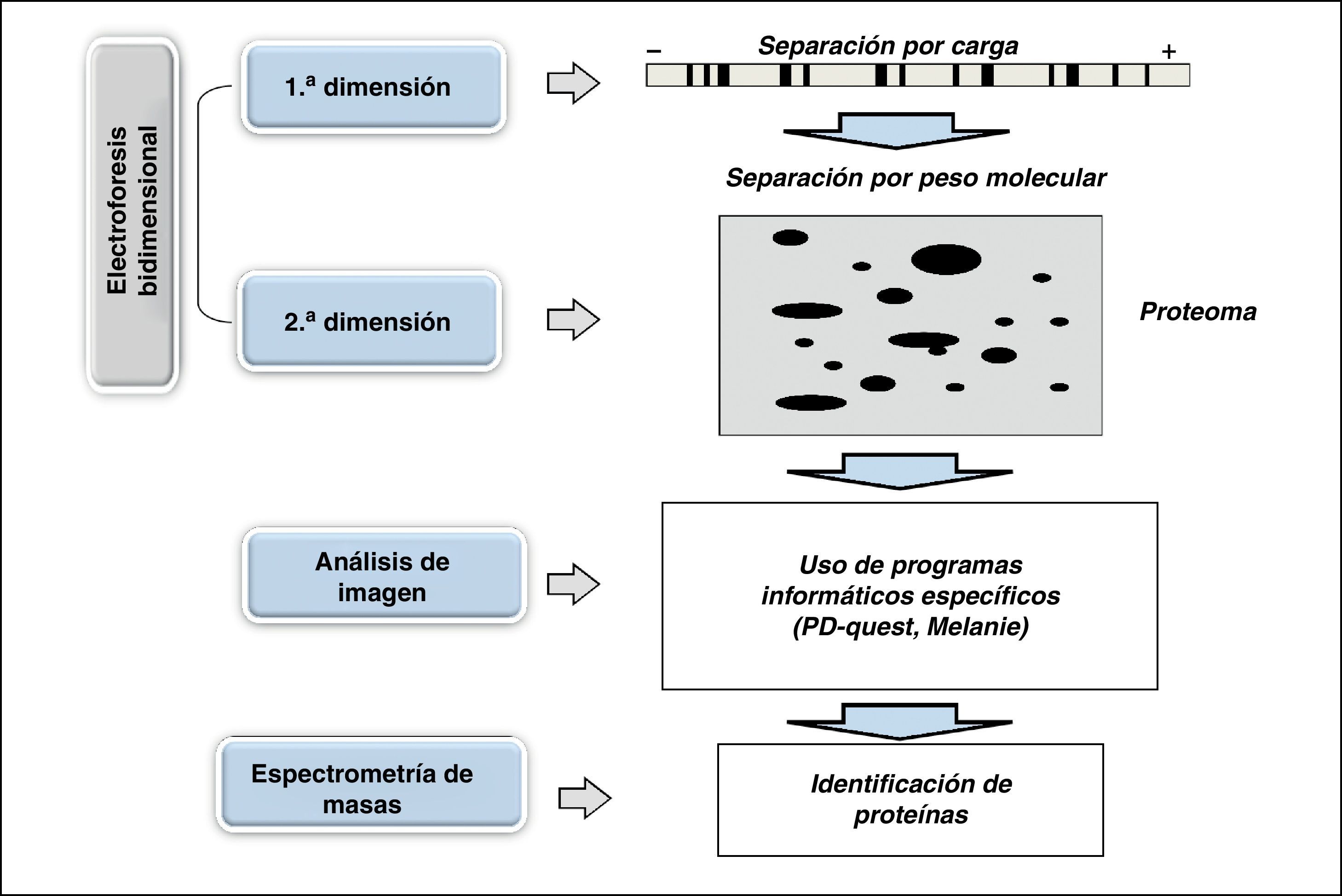
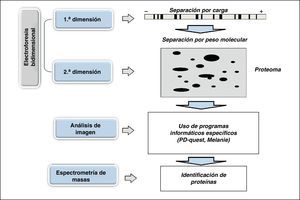
Para el estudio proteómico es necesario integrar diversas metodologías como electroforesis bidimensional, análisis de imagen, espectrometría de masas y bioinformática (fig. 3). La electroforesis bidimensional es la base fundamental para poder obtener los mapas bidimensionales o proteomas. Esta técnica permite separar las proteínas en dos dimensiones: la primera por punto isoeléctrico y la segunda por peso molecular, obteniendo así un mapa de puntos (proteoma), que representa el mapa de expresión de las diferentes proteínas en una muestra y que serviría como documento de identidad de la célula, tejido o muestra que se esté analizando. Una vez obtenidos los proteomas cada proteína puede ser identificada mediante la espectrometría de masas, y mediante programas informáticos especializados realizar un análisis completo, estableciendo la comparación entre diversos mapas de forma simultánea.
Esquema representativo de los diferentes pasos necesarios para desarrollar un estudio proteómico: electroforesis bidimensional (1.a y 2.a dimensión), obtención del mapa de expresión proteico (proteoma), análisis de imagen mediante programas informáticos especializados e identificación de proteínas mediante espectrometría de masas.
El resultado de los estudios proteómicos pone de manifiesto tanto la existencia de una expresión diferencial de proteínas en las diferentes situaciones como la de rutas metabólicas hasta ahora desconocidas, que están implicadas en la patogenia de la enfermedad25,26.
Son pocos los estudios en los que se ha aplicado esta tecnología para el análisis de los aneurismas de aorta abdominal. Un estudio reciente llevado a cabo por Urbonavicius et al. ha demostrado mediante análisis proteómico de la pared aneurismática una clara correlación de la expresión de proteínas implicadas en las vías de señalización celular, como la anexina A4, y de proteínas de la matriz extracelular como vitronectina y la cadena beta de fibrinógeno con el grado de expansión de los aneurismas de aorta abdominal27.
Basándonos en el conocimiento actual sobre la génesis de los AAA, una buena diana de estudio sería el análisis proteómico de las proteínas estructurales que forman el tejido conectivo, proteínas implicadas en la proliferación celular y metabolismo celular, envejecimiento y apoptosis, ya que es en genes que codifican precisamente este tipo de proteínas donde se han observado mayores alteraciones a nivel genético y epigenético.
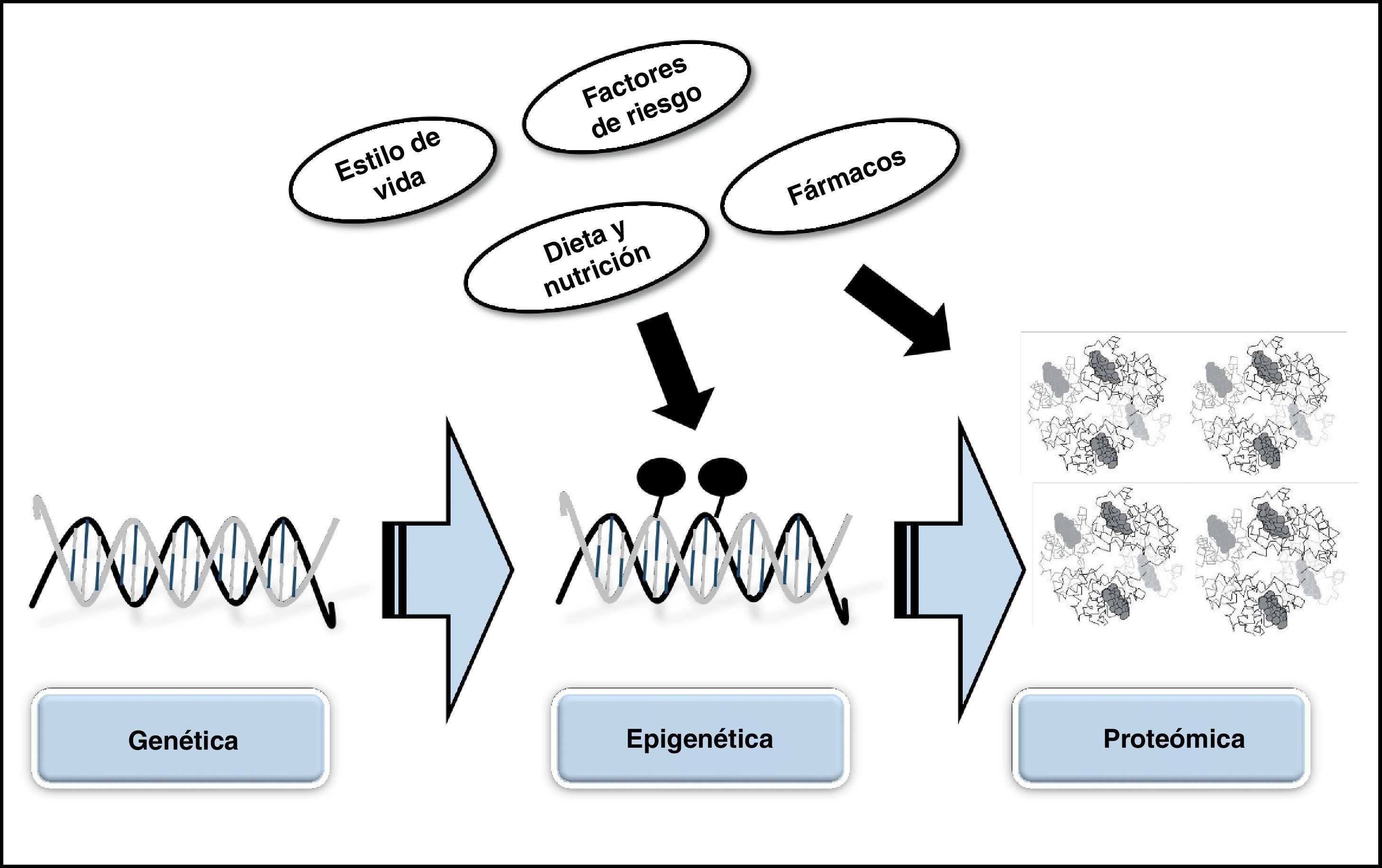
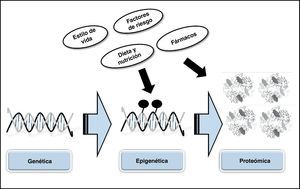
ConclusionesLa conclusión más importante que podemos extraer del conocimiento actual sobre la génesis de los AAA es que la realización de análisis combinados, tanto a nivel genético y epigenético como proteómico, pueden ser «claves» a la hora de ayudar a avanzar en el conocimiento de estas patologías (fig. 4). Además, el mejor conocimiento de los mecanismos genéticos, epigenéticos y de las proteínas involucradas en la génesis y desarrollo de los AAA puede favorecer el conocimiento de nuevas dianas terapéuticas, así como el desarrollo de nuevos fármacos.
En el año 2003 comenzó el Proyecto Epigenoma Humano, de iniciativa público/privada, cuyo objetivo final es obtener un mapa de las modificaciones bioquímicas que sufre el ADN que muestre y que ayude a comprender cómo estas modificaciones actúan sobre nuestro genoma induciendo cambios epigenéticos. Este proyecto va a brindar la posibilidad de identificar los factores ambientales que afectan a nuestro genoma y descifrar la manera en que puede modular nuestro genoma e inducir el desarrollo de determinadas patologías. Se hace necesario ahondar en el estudio genético/epigenetico/proteómico de los AAA para en un futuro abordar de forma más directa el diagnóstico y tratamiento de esta patología.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de la correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.