La reparación endovascular de aorta torácica (TEVAR) es una modalidad mínimamente invasiva y generalmente excelente de tratar aneurismas torácicos, disecciones o roturas aórticas postraumáticas. La fístula aortoesofágica (FAE) es una causa altamente letal de sangrado masivo y constituye una complicación catastrófica tras una TEVAR. La incidencia de FAE tras TEVAR ha sido situada entre el 5 y el 10,53%. En este artículo aportamos 3 casos de de FAE tras TEVAR y nuestra experiencia en el tratamiento de las mismas. Se incluye además una revisión de la literatura disponible. Estos hallazgos enfatizan la importancia de la infección mediastínica, el tratamiento quirúrgico del esófago y el reemplazamiento de la aorta. El tratamiento debe ser quirúrgico, puesto que las estrategias conservadoras han demostrado un desenlace casi invariablemente fatal. Futuros desarrollos en el diseño de las endoprótesis y los materiales, así como el evitar un sobredimensionamiento excesivo, pueden reducir la aparición de esta desastrosa complicación.
Thoracic endovascular aortic repair (TEVAR) is a minimally invasive, and generally excellent, technique to treat thoracic aortic aneurysms, dissections, or traumatic aortic transections. Aortoesophageal fistula (AEF) is a highly lethal cause of massive bleeding and a catastrophic complication after TEVAR. The incidence of AEF after TEVAR has been reported as between 5% and 10.53%. We present 3 cases of AEF after TEVAR, and our experience with management and outcome of these patients. A review of the recent literature has been included. These findings emphasize the importance of mediastinal infection, esophageal surgical management, and aorta replacement. Management should be surgical, since the outcome under conservative management seems almost invariably fatal. Future developments in endoprosthesis design and material, and avoidance of oversizing will hopefully reduce the occurrence of this disastrous complication.
La reparación endovascular de la aorta torácica (TEVAR) se asocia a posibles complicaciones derivadas de la técnica, como son la migración de la endoprótesis, la pérdida de la integridad de la misma como fracturas u oclusiones, así como endofugas.
La incidencia de FAE tras TEVAR ha sido situada entre el 51 y el 10,53% 2; además, dada su rareza y gravedad, la mayoría de los pacientes fallecen antes de realizar el diagnóstico. La tríada clínica clásica consiste en dolor centrotorácico o disfagia, seguido de sangrado digestivo alto, y posteriormente exanguinación o hemorragia tras un periodo asintomático variable3.
Presentamos 3 casos de FAE tras TEVAR acontecidas en nuestro servicio, incluyendo una revisión de la literatura médica y un esquema terapéutico según la evidencia publicada hasta la actualidad.
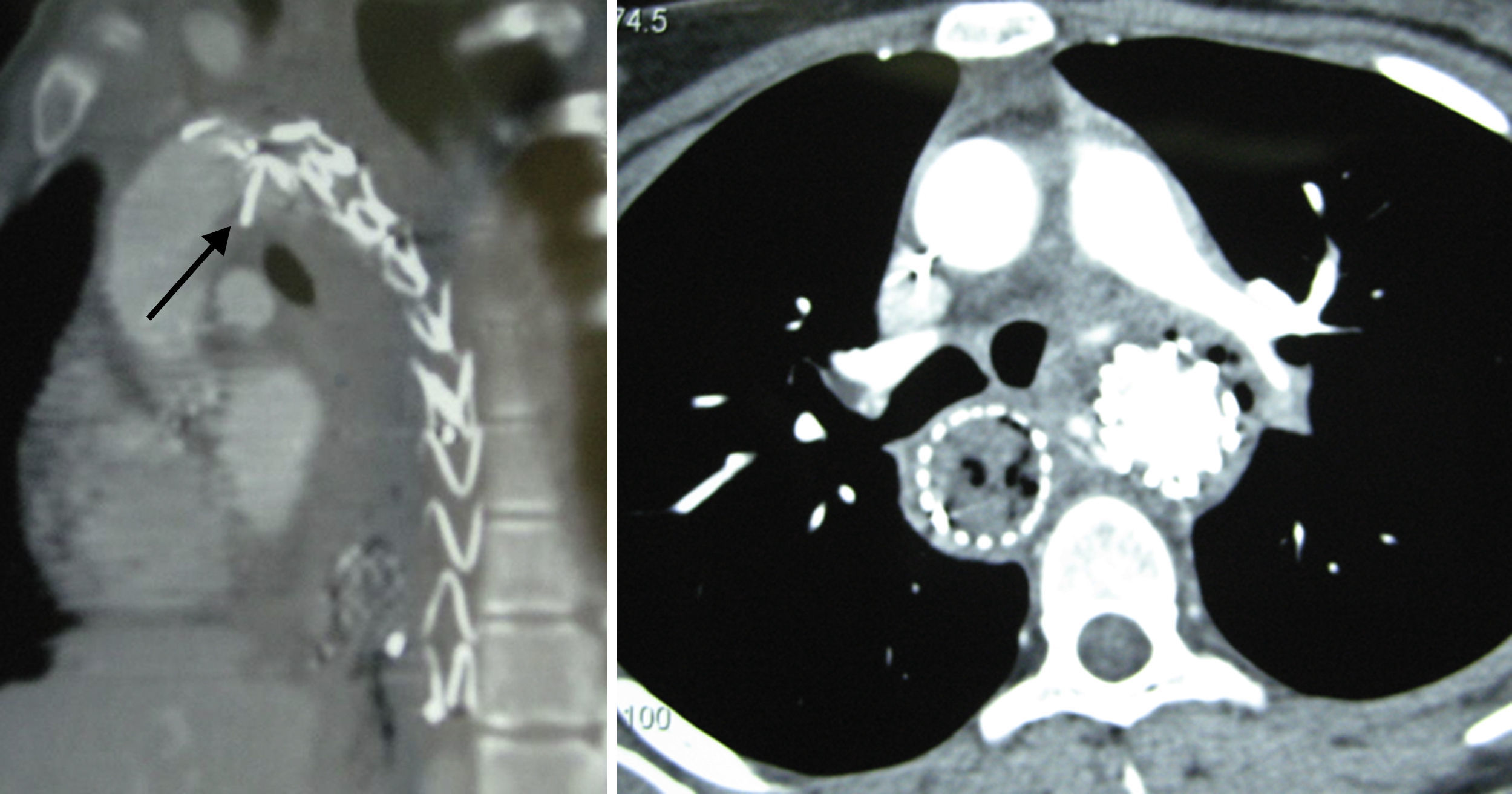
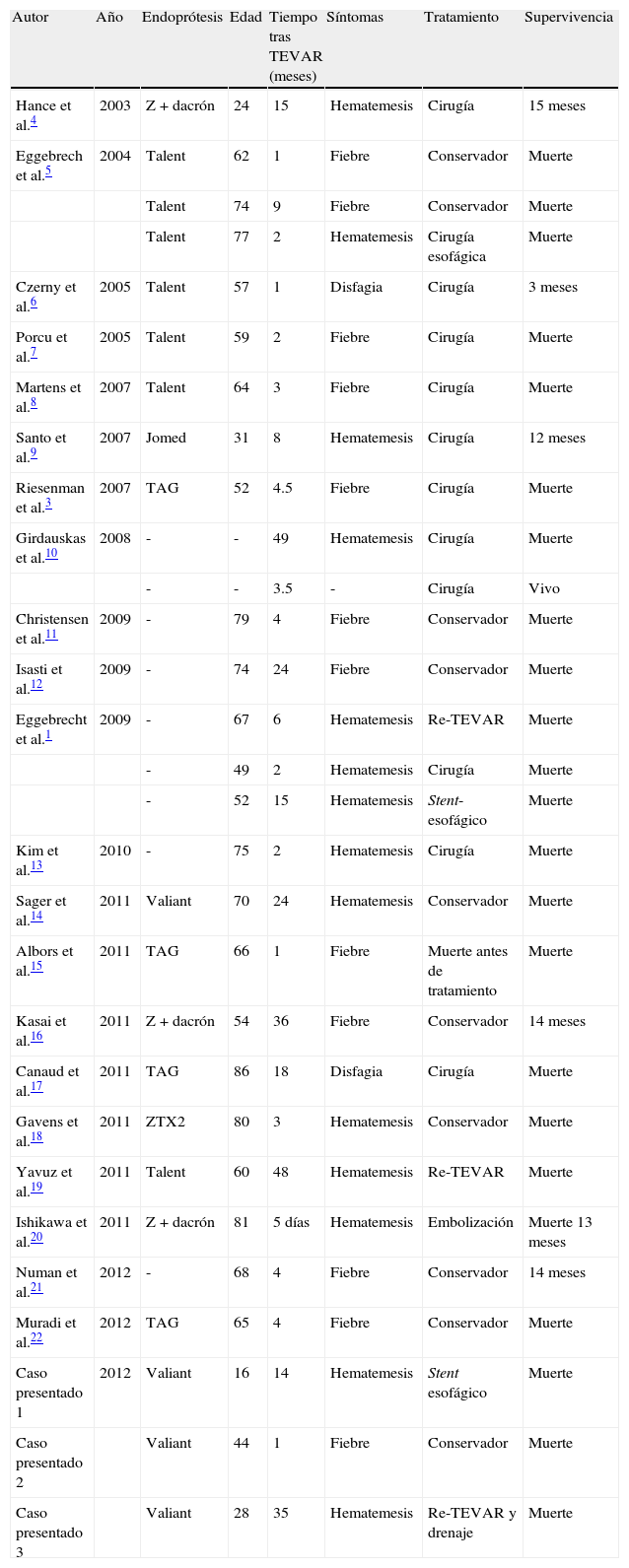
Casos clínicosCaso 1Paciente de 15 años intervenida de seudoaneurisma postraumático de aorta torácica tras accidente automovilístico, mediante la implantación de una endoprótesis Valiant de 24×24×150mm (Medtronic World Medical, Sunrise, FI, EE. UU.). Tras 14 meses de la intervención presentó severa hematemesis con notables signos de shock hipovolémico. El estudio mediante angio-TC (fig. 1) demostraba una endofuga tipo ia y una colección con burbujas de aire alrededor de la endoprótesis de aorta torácica descendente. La esofagogastroscopia mostró una úlcera mucosa a 23cm de la arcada dentaria, con sangre fresca y coágulos, durante el mismo procedimiento se colocó un stent esofágico (10mm longitud, Ultraflex, Boston Scientific Microinvasive, Natick, Mass., EE. UU.). Posteriormente se procedió al tratamiento endovascular aórtico mediante el despliegue de una nueva endoprótesis Valiant de 24×24×150mm (Medtronic World Medical, Sunrise, FI, EE. UU.), cubriendo el origen de la arteria subclavia izquierda. En la arteriografía de control se observó la obliteración de la endofuga. En el postoperatorio se instauró nutrición parenteral y tratamiento antibiótico intravenoso de amplio espectro con imipenem y vancomicina. La paciente permaneció hemodinámicamente estable hasta el sexto día postoperatorio en el que comenzó nuevamente con la hematemesis e hipotensión. Se procedió a tratamiento quirúrgico a través de toracotomía izquierda, observando en el campo quirúrgico una importante reacción inflamatoria periaórtica y una colección purulenta alrededor del tercio medio esofágico. El defecto esofágico se suturó de manera primaria y se cubrió con un pedículo de pleura. A nivel de la aorta se explantaron las 2 endoprótesis, sustituyendo la aorta descendente por una prótesis de Dacron impregnada en rifampicina. La paciente falleció por shock séptico al día siguiente de la cirugía.
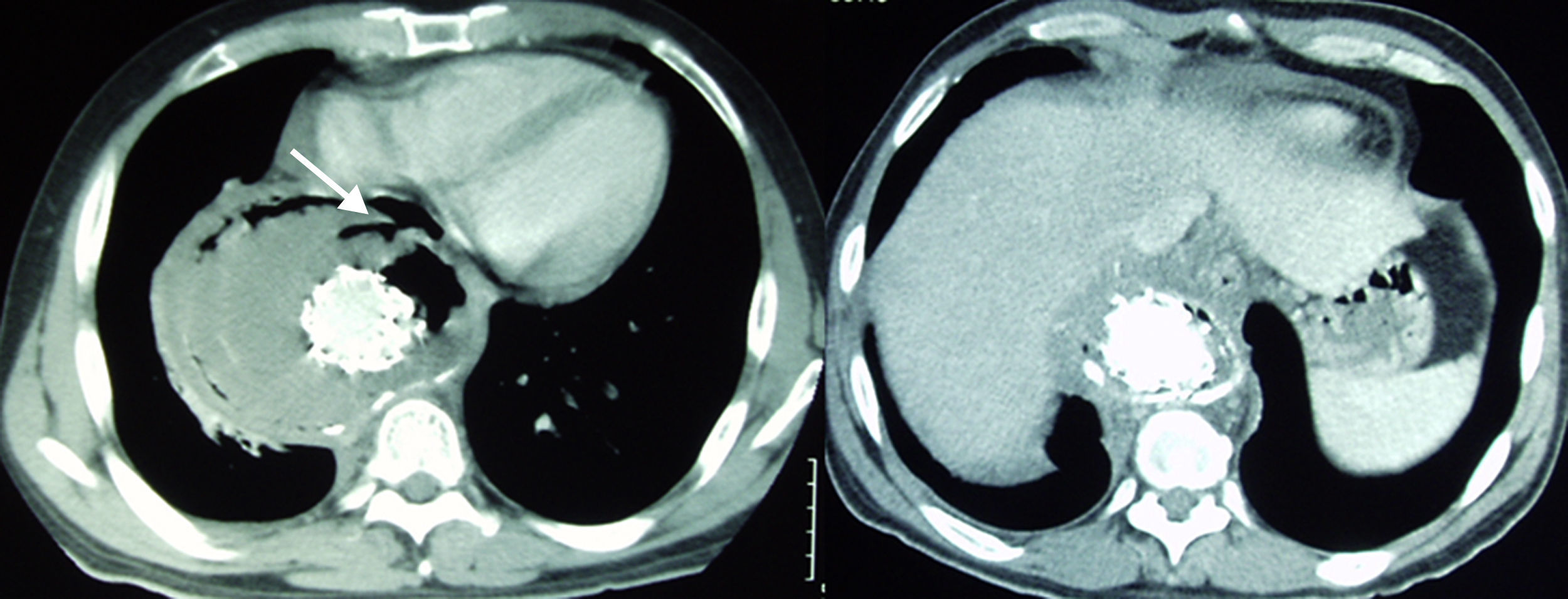
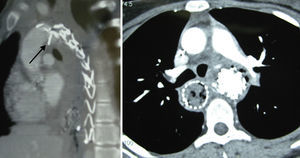
Caso 2Paciente de 44 años tratado mediante una endoprótesis torácica Valiant de 38×38×150mm, 38×34×150mm y 34×30×150mm (Medtronic World Medical, Sunrise, FI, EE. UU.), por aneurisma de aorta torácica descendente roto de 12,5cm de diámetro máximo. Al mes de la intervención reingresa por síndrome febril. En la angio-TC se observan burbujas de gas a nivel de mediastino y saco aneurismático trombosado con sospecha de fístula aortoesofágica (fig. 2). En la gastroscopia digestiva presentaba imágenes compatibles con candidiasis esofágica y a 35cm de la arcada dentaria un orificio fistuloso que alcanzaba los 7mm de diámetro, confirmando la sospecha diagnóstica de fístula esofágica. El paciente murió por sepsis tras 21 días de ingreso durante el cual fue tratado mediante tratamiento antibiótico de amplio espectro intravenoso y nutrición parenteral.
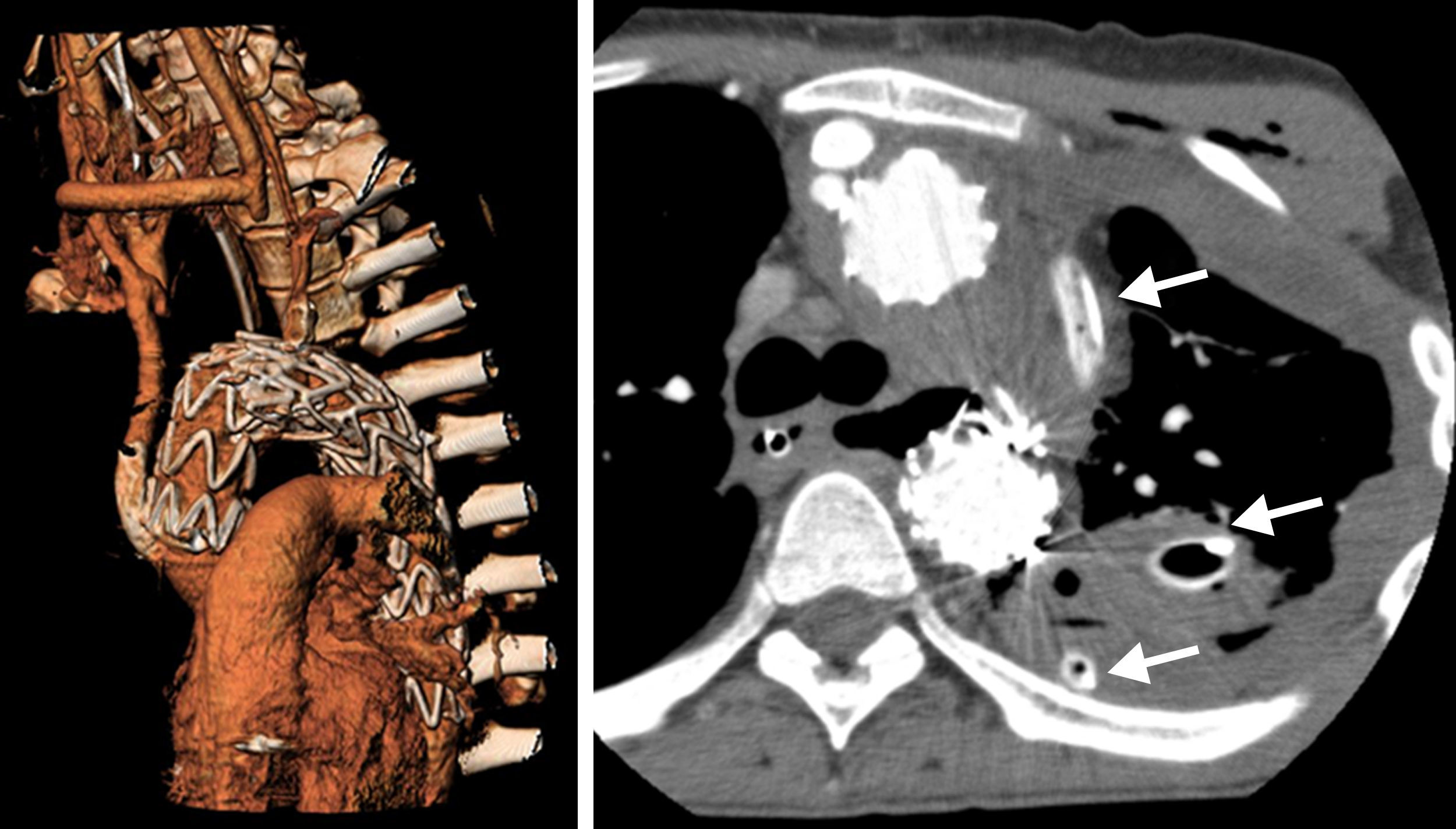
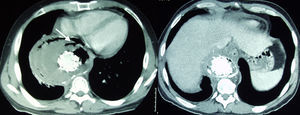
Caso 3Paciente de 25 años intervenido de seudoaneurisma postraumático de aorta torácica tras accidente automovilístico, mediante la implantación de una endoprótesis Valiant de 30×30×150mm (Medtronic World Medical, Sunrise, FI, EE. UU.), con exclusión de subclavia izquierda mediante colocación de Amplatzer (AGA Medical Corporation, Golden Valley, MN, EE. UU.) en el origen de la misma. Presentó un AIT embolígeno del hemisferio izquierdo procedente de la luz de un seudoaneurisma de carótida interna izquierda, tratado mediante embolización con coils soportados con stent. Transcurridos 35 meses de la implantación de la endoprótesis torácica el paciente ingresa por episodio de importante hematemesis. En el estudio mediante angio-TC se observa un seudoaneurisma de cayado aórtico a nivel de stent libre proximal previo de la endoprótesis. Se procedió a la implantación de una nueva endoprótesis en el arco aórtico previa realización de un bypass carótido-carotídeo con Dacron. En la angio-TC de control se observó la persistencia de una endofuga tipo i, procediendo al tratamiento quirúrgico mediante esternotomía media y bypass desde aorta ascendente a tronco braquiocefálico y nueva colocación de endoprótesis torácica, con zona de anclaje proximal en aorta ascendente (fig. 3). El estudio mediante esofagoscopia demostró fístula aortoesofágica a 30cm de la arcada dental. En la nueva angio-TC transcurridas 72 h se observaron signos de mediastinitis, procediendo al drenaje de la misma mediante toracotomía izquierda y cervicotomía. El paciente murió por shock séptico el día 12 postoperatorio.
Izquierda: angio-TC en reconstrucción 3D, endoprótesis aórtica con zona de anclaje proximal en la aorta ascendente, bypass desde aorta ascendente a tronco braquiocefálico y bypass carótido-carotídeo, Amplatzer en origen de subclavia izquierda. Derecha: derrame pleural y mediastinitis con drenaje pleural y mediastínico (flechas).
Las FAE tras TEVAR publicadas en la literature médica, junto con las 3 presentadas en este artículo, ascienden a 29 casos (tabla 1), con una incidencia en nuestro centro de 1,7% (3 casos/176 TEVAR). La edad media de los casos publicados fue 59,7 (16-86, mediana 64 años) años. Las endoprótesis implicadas en esta enfermedad fueron Talent (24,1%), Valiant (13,8%), TAG (13,8%), stent de gianturco y Dacron (10,3%), Zenith TX2 (3,4%) y Jomed (3,4%). El tiempo medio de aparición tras la TEVAR ascendió a 11,7 meses (5 días-49 meses, mediana 4 meses). Los 3 síntomas relacionados con esta enfermedad han sido hematemesis (48,3%), fiebre (41,4%) y disfagia (6,9%).
Aspectos demográficos, endoprótesis implantada, manifestaciones clínicas, tratamiento y evolución de los 29 casos publicados en la literatura médica
| Autor | Año | Endoprótesis | Edad | Tiempo tras TEVAR (meses) | Síntomas | Tratamiento | Supervivencia |
| Hance et al.4 | 2003 | Z + dacrón | 24 | 15 | Hematemesis | Cirugía | 15 meses |
| Eggebrech et al.5 | 2004 | Talent | 62 | 1 | Fiebre | Conservador | Muerte |
| Talent | 74 | 9 | Fiebre | Conservador | Muerte | ||
| Talent | 77 | 2 | Hematemesis | Cirugía esofágica | Muerte | ||
| Czerny et al.6 | 2005 | Talent | 57 | 1 | Disfagia | Cirugía | 3 meses |
| Porcu et al.7 | 2005 | Talent | 59 | 2 | Fiebre | Cirugía | Muerte |
| Martens et al.8 | 2007 | Talent | 64 | 3 | Fiebre | Cirugía | Muerte |
| Santo et al.9 | 2007 | Jomed | 31 | 8 | Hematemesis | Cirugía | 12 meses |
| Riesenman et al.3 | 2007 | TAG | 52 | 4.5 | Fiebre | Cirugía | Muerte |
| Girdauskas et al.10 | 2008 | - | - | 49 | Hematemesis | Cirugía | Muerte |
| - | - | 3.5 | - | Cirugía | Vivo | ||
| Christensen et al.11 | 2009 | - | 79 | 4 | Fiebre | Conservador | Muerte |
| Isasti et al.12 | 2009 | - | 74 | 24 | Fiebre | Conservador | Muerte |
| Eggebrecht et al.1 | 2009 | - | 67 | 6 | Hematemesis | Re-TEVAR | Muerte |
| - | 49 | 2 | Hematemesis | Cirugía | Muerte | ||
| - | 52 | 15 | Hematemesis | Stent-esofágico | Muerte | ||
| Kim et al.13 | 2010 | - | 75 | 2 | Hematemesis | Cirugía | Muerte |
| Sager et al.14 | 2011 | Valiant | 70 | 24 | Hematemesis | Conservador | Muerte |
| Albors et al.15 | 2011 | TAG | 66 | 1 | Fiebre | Muerte antes de tratamiento | Muerte |
| Kasai et al.16 | 2011 | Z + dacrón | 54 | 36 | Fiebre | Conservador | 14 meses |
| Canaud et al.17 | 2011 | TAG | 86 | 18 | Disfagia | Cirugía | Muerte |
| Gavens et al.18 | 2011 | ZTX2 | 80 | 3 | Hematemesis | Conservador | Muerte |
| Yavuz et al.19 | 2011 | Talent | 60 | 48 | Hematemesis | Re-TEVAR | Muerte |
| Ishikawa et al.20 | 2011 | Z + dacrón | 81 | 5 días | Hematemesis | Embolización | Muerte 13 meses |
| Numan et al.21 | 2012 | - | 68 | 4 | Fiebre | Conservador | 14 meses |
| Muradi et al.22 | 2012 | TAG | 65 | 4 | Fiebre | Conservador | Muerte |
| Caso presentado 1 | 2012 | Valiant | 16 | 14 | Hematemesis | Stent esofágico | Muerte |
| Caso presentado 2 | Valiant | 44 | 1 | Fiebre | Conservador | Muerte | |
| Caso presentado 3 | Valiant | 28 | 35 | Hematemesis | Re-TEVAR y drenaje | Muerte |
El mecanismo etiológico de este tipo de FAE se ha relacionado con la erosión progresiva a través de la pared aórtica y esofágica de los stents libres, principalmente proximales, de las endoprótesis implantadas. El punto de fijación proximal de muchas endoprótesis situadas a nivel de aorta torácica descendente se encuentra en el ligamento arterioso, zona de angulación entre la porción distal del arco aórtico y la aorta descendente6,7. Esta zona de anclaje angulada y la rigidez de la endoprótesis constituyen una combinación peligrosa, llegando a perforar la pared aórtica, habitualmente en el cruce con el esófago4. Además, en casos de TEVAR por rotura traumática de aorta torácica descendente, los sujetos suelen ser jóvenes con aortas de pequeño calibre, por lo que se añade un sobredimensionamiento de la endoprótesis por encima del 20%, por la discordancia con las medidas de las endoprótesis disponibles. La perforación de la pared del tubo digestivo añade un mecanismo secundario de infección que agrava el trayecto fistuloso9. Otros mecanismos etiopatogénicos descritos han sido la presencia de un seudoaneurisma, la existencia de una endofuga que rellene el saco aneurismático residual, o incluso la necrosis isquémica de la pared esofágica por la cobertura por parte de la endoprótesis de ramas arteriales esofágicas directas desde la aorta descendente8. En los 3 pacientes presentados, la primera endoprótesis contaba con un primer stent libre (proximal FreeFlo Straight) y el sobredimensionamiento en el área de anclaje proximal fue del 36, 18 y 27%, respectivamente. Las lecciones aprendidas de estos mecanismos propuestos y los 3 casos publicados incluyen el evitar un sobredimensionamiento agresivo y el empleo de endoprótesis con primer stent libre en pacientes jóvenes o con morfología de arco aórtico y aorta descendente en ángulo agudo.
El diagnóstico de FAE se realiza habitualmente por esofagoscopia. Los resultados de la aortografía, el esofagograma con bario o la TC son variables1,8. Aunque dichos exámenes pueden no identificar la fístula, confirman lesiones esofágicas o aórticas, asociadas habitualmente con la presencia de FAE, como es el caso de burbujas de gas en mediastino o el engrosamiento de tejidos periesofágicos8. Los microorganismos implicados han sido S. aureus, E. coli, P. melaninogenica, P. acnes, S. angionosus, bacilos anerobicos y Candida3,6–8.
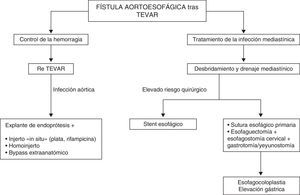
El implante de una nueva endoprótesis constituye una estrategia efectiva y rápida de control de la hemorragia masiva asociada con la FAE23. Esta técnica provee un control temporal del sangrado y permite posponer el tratamiento quirúrgico abierto para el momento en que el paciente se encuentre en una situación hemodinámica estable. Sin embargo, la nueva implantación de una endoprótesis precisa una nueva zona de anclaje aórtica más proximal, motivando que la zona de clampaje durante la cirugía abierta involucre a la subclavia izquierda o a la carótida izquierda, incrementando su morbilidad.
Los stents esofágicos metálicos autoexpandibles o plásticos han sido empleados como tratamiento paliativo de fugas anastomóticas tras cirugía esofágica, roturas espontáneas esofágicas, síndromes de Boerhaave, ingestión de cuerpos extraños o tras procedimientos iatrogénicos que provoquen la erosión de la pared del esófago24. Los pacientes con FAE, además del control de la hemorragia, precisan el tratamiento de la mediastinitis concomitante que se produce1,4. El stent esofágico solo puede considerarse como un tratamiento «puente» previamente a un tratamiento quirúrgico abierto definitivo en pacientes con infecciones mediastínicas leves con ausencia de colecciones purulentas o en pacientes con un elevado riesgo quirúrgico. No obstante, el desbridamiento y el drenaje del mediastino debe realizarse en todos los casos.
En los 29 casos publicados en la literatura médica, la mortalidad ascendió al 79,3%. De los 6 pacientes vivos, a 4 se les había practicado cirugía y a 2 tratamiento conservador. Hance et al. en 20034 publicaron el primer caso de éxito, durante el cual explantaron la endoprótesis previa, sustituyeron la aorta descendente por un injerto de dacrón y repararon de manera primaria el defecto esofágico. Emplearon además la pared aórtica residual y un pedículo de pleura para proteger dichas suturas. Cerny et al.6 intervinieron exclusivamente la porción digestiva, tratando al paciente con esofagectomía, esofagostomía cervical y gastrostomía de alimentación, y posteriormente, transcurridos 3 meses, realizaron una coloplastia retroesternal. Santo et al.9 realizaron un bypass protésico de aorta ascendente a descendente, explantando y excluyendo la porción de arco aórtico y aorta descendente desde el origen de arteria subclavia izquierda, tratando la parte digestiva exclusivamente con una gastrostomía de descompresión y una enterostomía de alimentación. Girdauskas et al.10 extirparon la endoprótesis previa, reemplazando la aorta descendente por un injerto de dacrón, además de resecar el segmento de esófago perforado, restaurando la continuidad esofágica 7 días después mediante una elevación gástrica.
El primer paciente publicado tratado de manera conservadora (alimentación parenteral, antibióticos e inhibidores de la bomba de protones) se encontraba vivo tras un seguimiento de 14 meses. La opción terapéutica tomada en este caso se justificaba al tratarse de un sujeto con un carcinoma hepatocelular en tratamiento con quimioterapia. Ishikawa et al., en 201020, trataron a un paciente que había desarrollado una FAE tras TEVAR por aneurisma de aorta torácica descendente mediante embolización del saco aneurismático residual y stent esofágico. No obstante, el paciente precisó la implantación de un stent bronquial por compresión del saco aneurismático creciente durante el seguimiento, falleciendo por una neumonía a los 13 meses de la embolización.
Los procedimientos quirúrgicos abiertos descritos abarcan el desbridamiento de los tejidos desvitalizados, la resección o sutura del segmento esofágico afectado y el reemplazamiento del segmento aórtico enfermo25. Tras el explante de la endoprótesis existente, diferentes reconstrucciones vasculares pueden realizarse: prótesis in situ, bypass extraanatómicos u homoinjertos criopreservados26,27. La corrección del defecto esofágico mediante esofagectomía y esofagostomía cervical asociada y gastro o yeyunostomía elimina el riesgo de dehiscencia de una reparación esofágica primaria y una nueva contaminación del mediastino y la prótesis empleada para la sustitución aórtica. En un segundo procedimiento puede realizarse una esofagocoloplastia o una elevación gástrica para conseguir la restauración del tubo digestivo28. En pacientes de alto riesgo con complicaciones infecciosas como empiema pleural o abscesos mediastínicos pueden tratarse con punción percutánea guiada con ultrasonidos y drenaje sin ningún otro procedimiento invasivo esofágico29.
En nuestros casos 2 puntos necesitan enfatizarse. La decisión inicial de diferir la cirugía abierta esofágica fue motivada por la inestabilidad hemodinámica de los pacientes. Además, se planeó una estrategia por etapas, inicialmente con una reparación endovascular emergente de aorta torácica que permitiera la estabilización del paciente y la recuperación de la mediastinitis mediante tratamiento antibiótico, y posteriormente la esofagectomía (o reparación esofágica primaria) y la reparación aórtica definitiva. Sin embargo, en ninguno de los casos presentados se consiguió el control de la infección mediastínica solamente con tratamiento antibiótico intravenoso (ni con la implantación de un stent esofágico, como en el caso número 2). Se consideran obligados el desbridamento y el drenaje mediastínico quirúrgico abierto, una vez controlada la hemorragia aórtica.
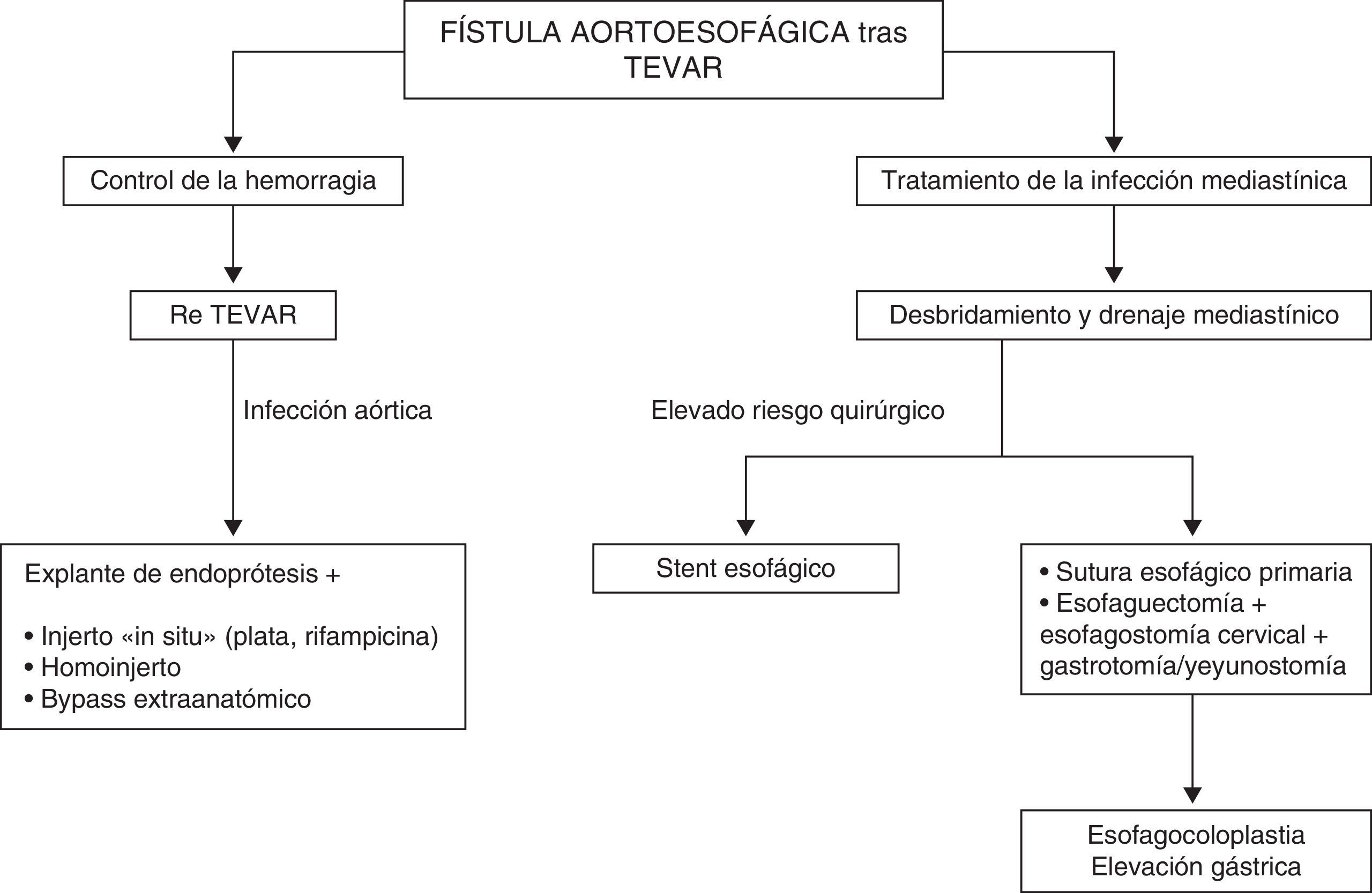
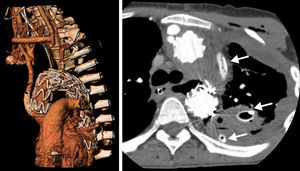
ConclusionesEl control de la hemorragia y el proceso infeccioso mediastínico son los principios esenciales del tratamiento de las FAE tras TEVAR. La implantación de una nueva endoprótesis es una opción terapéutica alternativa en el control del sangrado. El desbridamiento, el drenaje mediastínico y la reparación esofágica directa o la esofagectomía minimizan el riesgo de complicaciones infecciosas y sepsis. Los pacientes con comorbilidades prohibitivas para la reparación abierta esofágica pueden ser candidatos para la colocación de un stent esofágico como tratamiento temporal en casos de infección local mínima (fig. 4). Según la bibliografía existente, la sustitución aórtica abierta tras el control de la infección mediastínica continúa siendo necesaria en los pacientes que sobreviven.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.