Varón de 82 años, hipertenso, con insuficiencia renal crónica moderada, con marcapasos por síncopes de repetición, cardiopatía isquémica con implantación de 2 stents e intervenido de cáncer de colon y cáncer renal.
En el año 2000 fue intervenido de aneurisma de aorta abdominal infrarrenal de 70mm, con riesgo anestésico III según la Sociedad Americana de Anestesiología; se decidió en aquel momento un manejo endovascular dadas las características del paciente. A la exploración física presentaba pulsos conservados a todos los niveles, con índice tobillo brazo de 1 y un latido aórtico expansivo asociado. Se interpuso una endoprótesis bifurcada Excluder® Gore® con fijación infrarrenal con extensión a ambas arterias ilíacas comunes.
El paciente fue seguido durante 4 años en consultas externas mediante ecodoppler abdominal cada 6 meses y angio-TC anual, sin evidencia de endofugas. Posteriormente se produjo una pérdida de seguimiento de 4 años, periodo en el cual fue tratado de un cáncer renal. En las ulteriores revisiones encontramos en el control por angio-TC una imagen de endofuga, catalogada como de tipo ii, sin crecimiento del saco (tamaño aneurismático 69mm). Tras 2 años de seguimiento se siguió detectando la presencia de endofuga, esta vez con crecimiento del saco aneurismático, con tamaño de 80mm. Dada la comorbilidad del paciente y el crecimiento del saco, se decidió actitud intervencionista poco invasiva mediante inyección de trombina (3,5cc) ecoguiada por punción directa del saco por vía translumbar. Control ecográfico posterior sin evidencia de fuga.
En la revisión ambulatoria al mes se detectó mediante ecodoppler la persistencia de la endofuga y, a su vez, el paciente refirió una claudicación invalidante, a menos de 20 m en el miembro inferior derecho. A la exploración presentaba ausencia de pulsos y un índice tobillo brazo de 0,4. Se decidió ingreso inmediato para realización de aortoarteriografía. En la prueba de imagen se evidenció una estenosis crítica de la rama protésica derecha, así como la presencia de un relleno del saco aneurismático que parecía proceder de una arteria lumbar izquierda conectada con la arteria hipogástrica izquierda. Se realizó tratamiento mediante bypass de derivación femorofemoral en sentido izquierda-derecha, más interposición de oclusor de nitinol en ilíaca primitiva derecha de tipo Amplatzer ®Vascular Plug 10×7mm (St. Jude Medical). Durante el mismo ingreso se realizó una segunda embolización con trombina ecoguiada por punción intrasaco, de nuevo con control posterior óptimo. El paciente fue dado de alta con recuperación de pulsos en miembro inferior derecho.
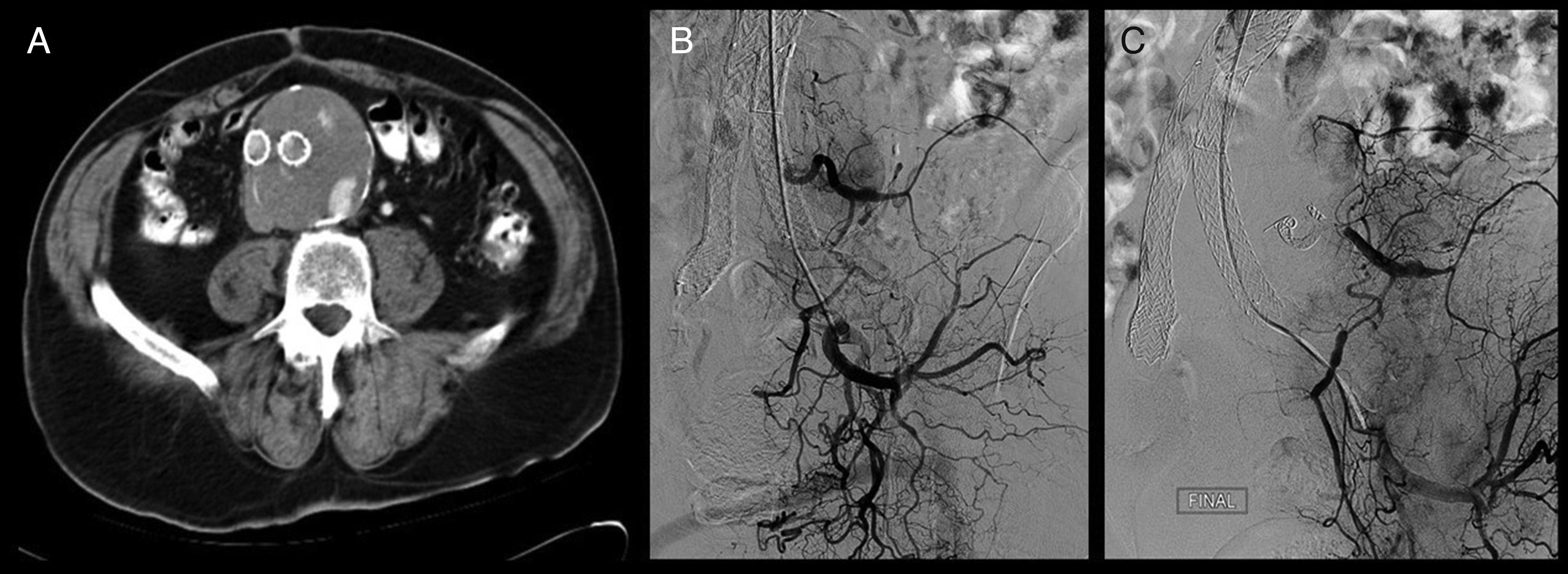
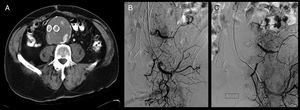
En la revisión al mes con angio-TC en consulta presentó recurrencia de endofuga, con nuevo crecimiento del saco, de 83mm. Se decidió ingreso para tratamiento endovascular. Por vía humeral izquierda mediante la técnica de punción de Seldinger, se realizó aortoarteriografía con identificación de la endofuga a través de rama lumbar izquierda procedente de arteria hipogástrica izquierda, con posterior embolización selectiva de la rama lumbar mediante varios coils de 3×4mm (IMWCE-35-4-3) del tipo MReyeCook® y onyx® a través de la arteria hipogástrica, utilizando un microcatéter. El control angiográfico posterior fue óptimo. El paciente fue dado de alta sin complicaciones, con ecodoppler de control que muestra ausencia de flujo en saco aneurismático (fig. 1).
A) Angio-TC que muestra endofuga de contraste dentro del saco aneurismático. B) Aortoarteriografía que pone de manifiesto endofuga a través de arteria lumbar izquierda, rama que conecta con arteria hipogástrica inferior izquierda. C) Sellado selectivo de la endofuga mediante embolización con coils y onyx de rama lumbar izquierda, que llega a ella a través de la arteria hipogástrica izquierda.
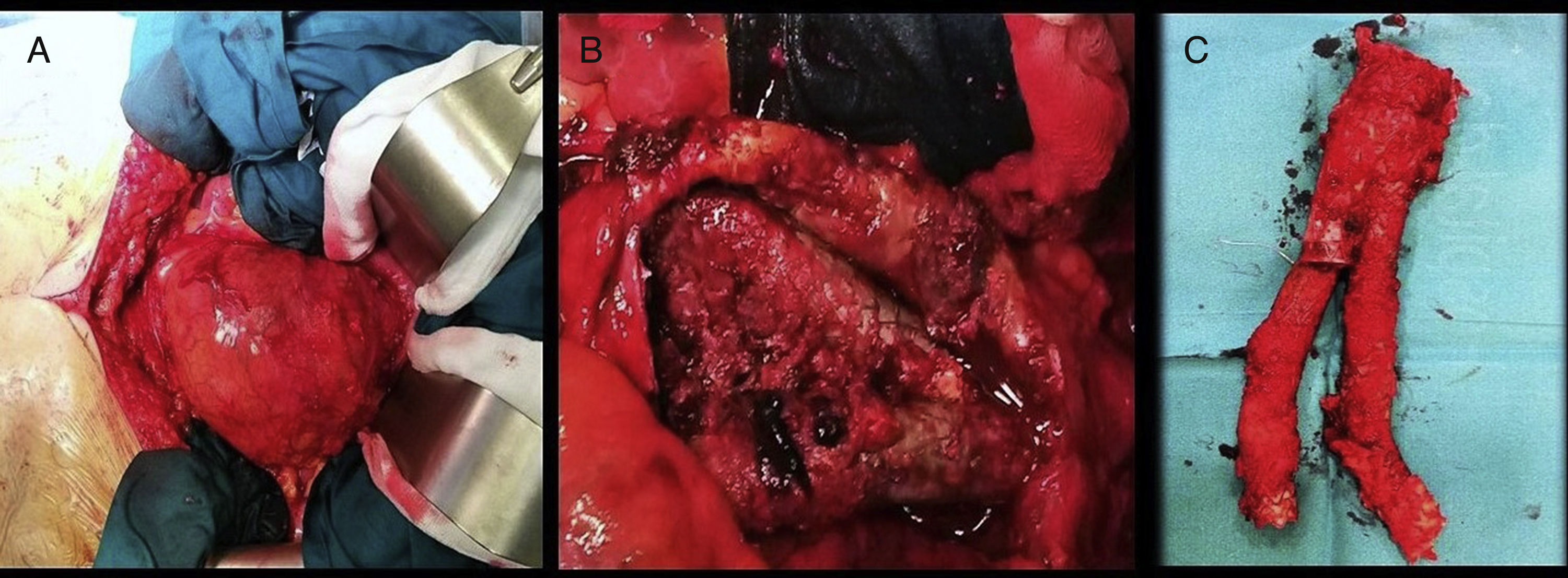
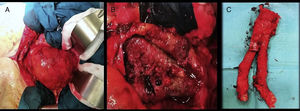
En el control ambulatorio al mes con angio-TC de control se objetivaba persistencia de endofuga, de origen incierto, con crecimiento masivo del saco aneurismático, con tamaño de 93mm (previo 83mm). Se decidió ingreso para cirugía abierta. Mediante laparotomía media, por vía transperitoneal, se realizó disección del aneurisma y cuello aneurismático infra- y suprarrenal, con extracción de las ramas distales de la endoprótesis; se introducen ambas en una jeringa de 20 cc con cono proximal cortado y se va metiendo lentamente el cuerpo en la jeringa mientras se va colapsando la endoprótesis. El cirujano ayudante realizó despinzamiento sincronizado en el momento de extracción total de la región proximal de la endoprótesis en el cuello aórtico, zona de ganchos, con pinzamiento rápido una vez extraída. Posteriormente se realizó bypass aortofemoral izquierdo. Dicha intervención se realizó previa valoración anestésica con un riesgo ASA IV (Asociación Americana de Anestesiología) (fig. 2).
El paciente fue dado de alta a los 5días sin complicaciones. Se realizó seguimiento ambulatorio mediante ecodoppler al mes, 6meses y actualmente de forma anual.
La reparación endovascular de la aorta abdominal infrarrenal, introducida en 1991, presenta unas tasas de reintervención por complicación en torno al 30%. Gran parte de ellas se solventan de forma endovascular, pero pueden presentarse casos complejos, estimados en torno a un 5%, en los que se requiera un abordaje quirúrgico. Las indicaciones de reconversión a cirugía abierta son infección de prótesis, trombosis de rama, migración de prótesis y endofuga persistente con crecimiento del saco1-4.
Las estrategias de gestión de endofugas van desde observación hasta terapias agresivas: inyección de trombina, ligadura de ramas, dispositivos endovasculares o cirugía abierta, según el crecimiento de saco aneurismático y la complejidad de la fuga5.
El explante quirúrgico implica el fracaso de todas las anteriores, con una elevada morbimortalidad. Lynch et al., en su estudio publicado en 2015, concluyen que las endofugas son la causa más frecuente de explante quirúrgico6. Así mismo, Brinster et al. concluyen, en su estudio publicado en 2001, que el explante endoprotésico debe llevarse a cabo cuando ha habido un fallo del tratamiento endovascular previo para solucionar una endofuga de tipo II, siempre que esté produciendo crecimiento del saco aneurismático.
Esta técnica conlleva una alta morbimortalidad, por lo que debe realizarse por un equipo con adecuada experiencia en cirugía aórtica abierta2,7.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Trabajo presentado en el 32 Congreso de la Sociedad Andaluza de Angiología y Cirugía Vascular (24-26 de noviembre de 2016, Málaga).