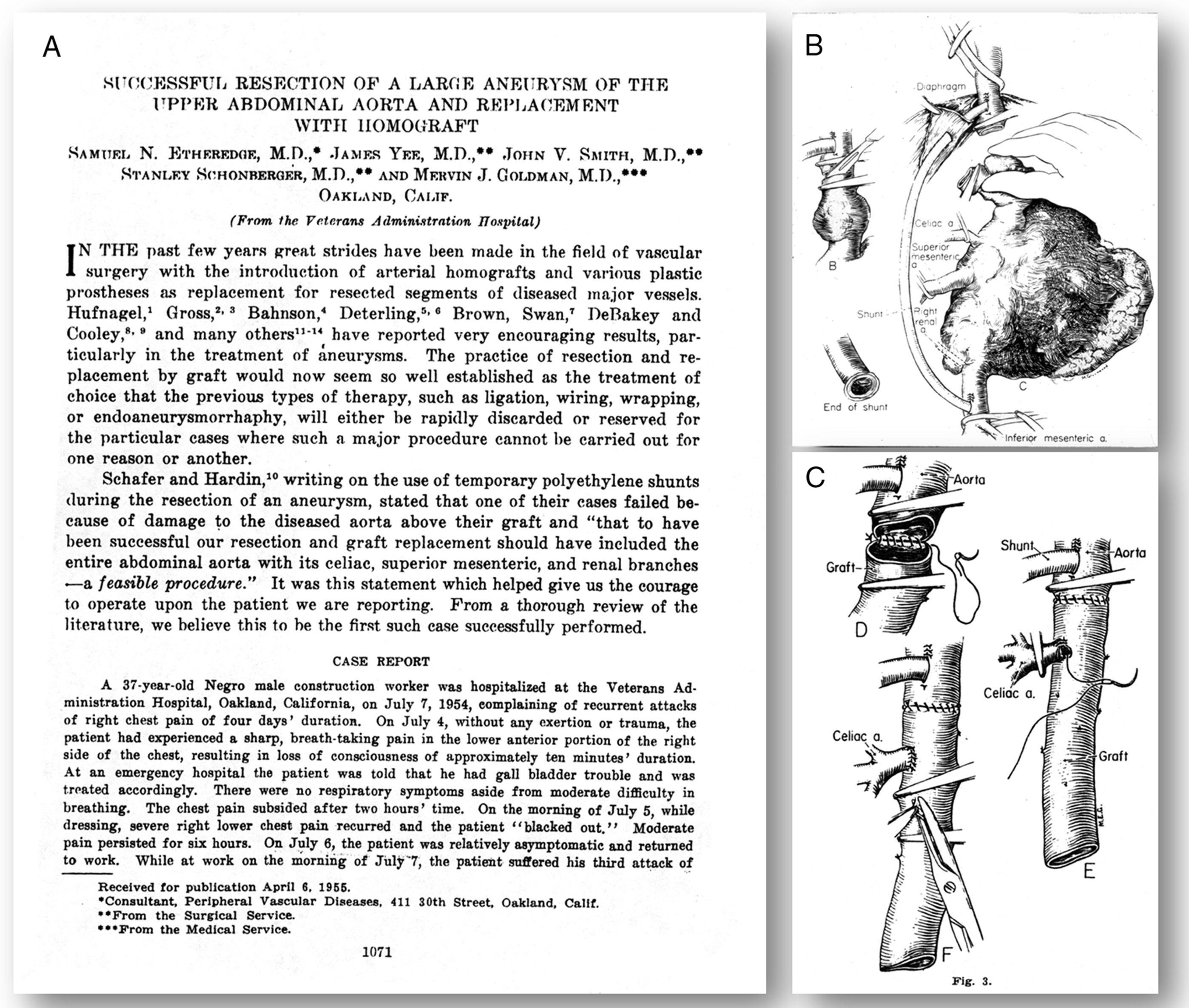
El tratamiento del aneurisma aórtico toracoabdominal (AATA) representa un reto continuado para los cirujanos vasculares. La primera descripción de reparación quirúrgica exitosa es atribuible a Samuel Etheredge et al.1, del Hospital de Veteranos de Oakland (California, EE. UU.), quienes practicaron, en julio de 1954, la sustitución de un AATA con un homoinjerto y con la ayuda de una derivación temporal aorto-aórtica (fig. 1). En 1955, Charles Rob, en Londres publicó varios casos de reparación de AATA mediante la técnica de clamp and sew2. En 1956, Michael E. DeBakey presentó en la reunión anual de la American Surgical Association una serie de 4 casos de AATA reparados quirúrgicamente3.
Artículo original de Etheredge et al.1. A) Primera página.B y C) Gráficos de los detalles técnicos de su primer caso.
Estos primeros hitos históricos fueron seguidos de forma especialmente brillante por el llamado «grupo de Houston», creado en torno a Michael E. DeBakey en los años 70. A DeBakey se le unieron en Houston nombres como Stanley Crawford, a quien, entre otras cosas, le debemos la primera clasificación anatómica de los AATA4,5, Hazim Safi, Joseph Coselli, Denton Cooley o Lars Svensson. Gracias a sus revolucionarias aportaciones técnicas-quirúrgicas y adyuvantes para la protección medular y visceral (drenaje de líquido cefalorraquídeo, hipotermia profunda, perfusión renal fría, bypass cardiopulmonar, anastomosis intraaórtica, anastomosis en isla de los troncos viscerales…), hoy es posible tratar quirúrgicamente los AATA con resultados aceptables, siendo los del «grupo de Houston» los de referencia mundial. Sin duda que otros nombres, no vinculados directamente con el «grupo de Houston», pueden añadirse a la lista de cirujanos innovadores que han contribuido o están contribuyendo en la evolución de la cirugía de los AATA. Pero la auténtica referencia histórica en el tratamiento quirúrgico de los AATA se concentra meritoriamente en Houston6.
Del mismo modo, otro hito revolucionario en la historia ha sido la incorporación más reciente del tratamiento endovascular de los AATA. En este punto, después de la obligada mención de Juan Carlos Parodi7 y de Nikolai Volodos8 por sus contribuciones pioneras en el tratamiento endovascular de los aneurismas de aorta, nuestra mirada debe dirigirse hacia San Francisco, donde Tim Chuter reparó el primer caso publicado de AATA con una endoprótesis con ramas9, y hacia Cleveland, donde Roy Greenberg aglutinó la mayor experiencia clínica, todavía hoy no superada10. Pero la juventud del tratamiento endovascular sin duda permitirá escribir nuevas páginas de la historia del tratamiento de los AATA. Mientras tanto, algunas controversias siguen siendo objeto de polémica y debate, a la espera de la solución con ayuda de las evidencias. ¿Cuáles son estos puntos de controversia relevantes que a nuestro juicio precisan de un consenso preferente? En las próximas líneas son discutidos con la intención final de ofrecer una perspectiva de futuro en cada uno de ellos.
Acerca de las indicacionesEs una obviedad que cualquier AATA sintomático, independientemente de su tamaño, debe ser reparado. No existe tanto acuerdo en el momento de fijar la indicación con relación al tamaño transversal del AATA. Es decir, si debemos dar una cifra a partir de la cual sentar la indicación, esta se sitúa en torno a los 6cm. Pero otros parámetros antropométricos o genéticos deben ser tenidos en consideración. Por ejemplo, el tamaño aórtico debe ajustarse por superficie corporal y por género. También debe tener diferente consideración la coincidencia con enfermedades congénitas, como el síndrome de Marfan, que aconsejan reducir el dintel a 5,5cm. También es criterio de indicación quirúrgica la documentación de un crecimiento rápido ≥ 1cm/año11.
Independientemente de los citados criterios para indicar una reparación quirúrgica, en cualquier caso, el ofrecimiento terapéutico debe ser mejor que la propia historia natural de la enfermedad. Así, si el riesgo de rotura de un AATA de 6cm es de 7% anual, la terapia ofrecida debe tener un riesgo de mortalidad inferior. Pocos, muy pocos centros podrían garantizar una mortalidad de la cirugía del AATA inferior al 7%12. Solo los citados centros de Houston, y alguno más, podrían justificar la indicación quirúrgica. Cuando el tamaño del AATA alcanza los 7cm, el 43% desarrollan una disección o rotura al año13. Obtener cifras de mortalidad inferiores al 40% ya es más viable, incluso fuera de Houston.
Probablemente, en un futuro no muy lejano, otras informaciones de carácter funcional obtenidas desde el análisis computacional de las imágenes, ya disponibles técnicamente, aportarán nuevos parámetros que cambiaran los criterios de indicación. El cálculo del riesgo de rotura se podrá obtener a partir del cálculo de estrés sobre la pared. Solo los estudios sobre la historia natural de los aneurismas vinculada a estas nuevas variables validarán su utilidad.
Acerca de los métodos de protección medular y visceralExiste suficiente evidencia para recomendar el uso de drenaje de líquido cefalorraquídeo como medida de protección medular a través de los resultados de estudios aleatorizados14 y metaanálisis15,16, especialmente en la reparación quirúrgica convencional de AATA tipo I y II. Sin embargo, todavía no existen suficientes evidencias para su aplicación indiscutible en las reparaciones endovasculares. Aunque desde las guías clínicas se recomienda que debe ser considerada su práctica para los casos de mayor riesgo de paraplejía (AATA tipo I y II, oclusiones de arterias subclavias o de hipogástricas)17.
Del mismo modo, la monitorización de potenciales evocados motores no es generalmente aceptada, ni siquiera en aquellos centros con gran experiencia y volumen en ambos métodos terapéuticos.
Otros métodos de protección visceral y medular como el bypass izquierdo o el bypass cardiopulmonar parcial, la hipotermia profunda con parada circulatoria, o la hipotermia permisiva a 32°C, o la perfusión con sangre o cristaloides en tronco celíaco y mesentérica superior, la perfusión con cristaloides a 4°C en las renales o en las intercostales, el pinzamiento secuencial o el reimplante de las intercostales bajas deben ser valorados caso a caso, dependiendo de la extensión de la aorta a tratar y de los hábitos en cada centro18. Precisamente, al hablar de los hábitos en cada centro queremos hacer énfasis en señalar que, sin volumen de casos necesario, no es posible hablar de hábitos, sino más bien de anécdotas. Es importante escoger y planificar los diferentes procedimientos coadyuvantes, pero no menos importante es que todos los profesionales relacionados con el pre-, per- y postoperatorio estén familiarizados con el fundamento racional de los mismos. Ello sin duda redundará en los mejores resultados.
Si bien las precauciones en cirugía endovascular se centran en otros cuidados perioperatorios como el mantenimiento de la colateralidad (arteria subclavia izquierda y las hipogástricas, fundamentalmente), del nivel de hemoglobina o de las tensiones sistémicas, de nuevo en la práctica habitual, mayor volumen de casos hace más comprensible y protocolizable el manejo de estos pacientes para todos aquellos profesionales que de forma directa o indirecta interactúan en algún momento del procedimiento y del proceso clínico.
Tanto con una como con otra modalidad terapéutica es aconsejable que varios profesionales del centro (más allá de los cirujanos vasculares, radiólogos, anestesiólogos e intensivistas) y los respectivos profesionales técnicos y diplomados en enfermería (neumólogos, cardiólogos, infectólogos y neurólogos) estén al corriente de los protocolos de manejo de estos pacientes, pues sus acciones son importantes en cada uno de los puntos del proceso y pueden contribuir en la prevención y solución de las posibles complicaciones. De lo contrario, cuando la experiencia que se acredita es puntual o esporádica, y no se implica al resto de profesionales desde el principio, se producen situaciones indeseadas, estresantes y poco efectivas, al tener que explicar la complejidad fisiopatológica de estos pacientes a otros colegas cada vez que se trata un caso de AATA. Y ello se agrava, precisamente, cuando hay que resolver complicaciones agudas en un entorno de desconocimiento que conduce a la improvisación, y esta, al fracaso. En otras palabras, el tratamiento de los AATA en centros con mayor volumen y con un entorno multidisciplinar entrenado garantizará una mejor calidad en los procedimientos diagnósticos, terapéuticos y de monitorización, que conducirán a los mejores resultados19,20.
Qué método terapéuticoSon 3 los posibles abordajes para la reparación de los AATA: la cirugía abierta convencional, la cirugía híbrida y la cirugía endovascular.
La cirugía abierta constituye una intervención aórtica mayor asociada a complicaciones graves miocárdicas, respiratorias y renales que son las causas más frecuentes de mortalidad. La paraplejía es la morbilidad más temida. En líneas generales los centros con gran experiencia, los del «grupo de Houston», ofrecen tasas de mortalidad entre el 5 y el 15%21–23. Las complicaciones respiratorias llegan hasta el 60%. Las complicaciones neurológicas (ictus y paraplejía) y las nefrológicas alcanzan el 18 y el 15%, respectivamente. Fuera de estos centros de excelencia24, las cifras de mortalidad y morbilidad casi se duplican. Una vez más, el volumen es un factor decisivo en los resultados. Así demuestra una revisión reciente, con mortalidades del 27 y del 15% para los hospitales de bajo y alto volumen, respectivamente20.
Las técnicas híbridas, o de debranching, se desarrollaron como consecuencia del retraso del tratamiento totalmente endovascular para los AATA y con la intención de reducir las cifras de mortalidad y morbilidad de la cirugía convencional en pacientes de riesgo. Estos procedimientos suelen ser aplicados en 2 tiempos quirúrgicos. Sin embargo, los que abogan por un solo tiempo, aunque parecen acumular mayores cifras de mortalidad y morbilidad nefrológica, argumentan que hay posibilidad de rotura del aneurisma o rechazo de una nueva intervención en la espera del segundo tiempo25. Las experiencias reportadas son muy dispares y con series muy reducidas. Las 2 teóricas ventajas de este método frente a la cirugía convencional se centran en la no necesidad de toracotomía ni de pinzamiento aórtico. Si nos fijamos en una revisión sistemática publicada en 2012, la mortalidad media a los 30 días se cifra en torno al 14%, las complicaciones cardiológicas, respiratorias y neurológicas alcanzan 4,6, 7,8 y 7%, respectivamente. Sin embargo, algunas experiencias más locales han sido menos afortunadas, en términos de mortalidad, entre las que incluimos la nuestra propia con una mortalidad del 44% en una serie de 9 pacientes26. Tampoco ha sido muy prometedora la experiencia multicéntrica francesa que con una serie de 76 pacientes recogió un 34% de mortalidad, 18% de paraplejía, 17% de isquemia mesentérica y un 8% de necesidad de hemodiálisis crónica27.
Muy probablemente los criterios de selección expliquen las diferencias obtenidas. En nuestra serie, incluimos solo a pacientes no candidatos a cirugía abierta toracoabdominal, entendiendo, equivocadamente, que la técnica híbrida era poco agresiva. Probablemente los pacientes que soportan una técnica híbrida, sobre todo los AATA tipo III-V, puedan también soportar un tratamiento quirúrgico convencional. Obviamente, la solución vendría de la mano de estudios aleatorizados. En el momento actual, la técnica híbrida estaría más reservada para aquellos casos que no sean favorables para el tratamiento convencional o endovascular puros.
Pero en el horizonte podemos ser más exigentes para poder reducir las cifras de morbimortalidad y ello pueda ser posible con la evolución de las técnicas endovasculares. Los resultados positivos con las endoprótesis fenestradas para los aneurismas yuxtarrenales, llevaron a idear la posibilidad de crear endoprótesis con ramas o fenestradas, o combinación de ambas, para el tratamiento de los aneurismas que comprometían la zona visceral de la aorta, especialmente para pacientes no candidatos a cirugía abierta (fig. 2). Existen limitaciones anatómicas que se están superando con el desarrollo tecnológico de las propias endoprótesis y de las técnicas de imagen y navegación. Otras limitaciones se relacionan con la necesidad de esperar un tiempo prolongado para la fabricación de las endoprótesis a medida, pero que se está resolviendo en parte con la disponibilidad de alguna endoprótesis toracoabdominal estándar, lo que también contribuye a reducir el coste final del procedimiento. Finalmente, la técnica de implante es altamente exigente desde el punto de vista de la pericia endovascular, la necesidad de materiales accesorios y la exposición a tiempos prolongados de irradiación. De nuevo, el volumen permite minimizar estos inconvenientes a base de acumular experiencia y practicar la técnica de forma continuada.
Las experiencias clínicas publicadas aportan cifras de mortalidad entre 5,2 y 9,7%, que son inferiores al 3% en el caso de los AATA tipo iv28–31. Estos datos son especialmente reseñables si consideramos que los pacientes tratados con esta técnica son mayoritariamente rechazados para cirugía abierta. Sin embargo las cifras de isquemia medular no se reducen significativamente cuando se comparan con las obtenidas con cirugía abierta en los grandes centros (4,3 vs. 7,5% para tratamiento endovascular y cirugía abierta, respectivamente; p=0,08)29. La durabilidad de la técnica es más que aceptable cuando se analizan las grandes series10,28–31.
Existen otras modalidades endovasculares. Las técnicas de «sándwich» necesitan mayores series con seguimiento suficiente para poder ser incluidas en el arsenal endovascular de modo definitivo. En último lugar, y aún más lejano de la evidencia, se encuentra el polémico uso de stents moduladores de flujo o «multicapa». Por el momento, no añadiremos más comentarios al respecto de estas 2 modalidades a la espera de información más sustancial.
Quién y dóndeYa hemos glosado en diferentes puntos de este manuscrito la relevancia de realizar cualquiera de las técnicas aquí mencionadas para el tratamiento de los AATA en centros de alto volumen y experiencia para asegurar los mejores resultados al menor coste19,20.
Ahora es el momento de que las autoridades sanitarias definan y se atrevan a aplicar sus definiciones al territorio. Este es sin duda el más controvertido de los temas relacionados con la terapia de los AATA, no desde la lógica o el conocimiento científico sino desde el punto de vista político. En algunas comunidades como la mía propia, desde septiembre de 2014, se está implementando la instrucción de la Generalitat de Catalunya que ordena la actividad de alta y muy alta complejidad con la creación de centros de referencia. Si bien todavía es pronto para saber los resultados, esperamos no traicionar la lógica y hacer buenas las previsiones. Esta decisión política no ha estado libre de polémica. Pero se ha aceptado de mejor grado al crear redes de colaboración interhospitalarias y permitir la movilización de profesionales. Evidentemente, se seguirá la calidad del funcionamiento y se analizarán los resultados clínicos y económicos para permitir ajustar su implementación.
Como ya hemos repetido, la centralización de estas técnicas de reparación de los AATA aporta beneficios clínicos. Más allá de este rendimiento positivo para los pacientes, existen otros beneficios no menores que afectan a otros aspectos éticos, asistenciales, docentes y de investigación. Por ejemplo, en los centros donde se puedan ofrecer todas las técnicas de reparación no cabe el sesgo de conducir a todos los pacientes hacia una única modalidad terapéutica ocultando otras posibilidades. Es decir, se puede personalizar la decisión clínica atendiendo a las características clínicas y anatómicas del paciente, al conocimiento de la evidencia clínica y a las preferencias del paciente, sin limitarla por carencias estructurales o técnicas del propio centro32. Además, no hay duda de que la centralización aporta una mayor experiencia en la prevención, detección y tratamiento de las complicaciones, con los mejores resultados al menor coste. Precisamente, el coste hace necesaria la inclusión de una microgestión (administrador) en los equipos clínicos multidisciplinarios que ya hemos definido más arriba. Finalmente, el alto volumen y la experiencia hacen más fácil y comprensible la docencia y entrenamiento de nuevos equipos y la activación de líneas de investigación clínica y básica relacionadas con los AATA, todavía necesitados de mejoras terapéuticas.
Perspectiva futuraUna vez revisada la literatura disponible, está claro que la cirugía abierta de los AATA deja margen a la mejora en términos de morbimortalidad asociadas. Solo los centros con gran volumen consiguen cifras razonables, lo que permite que sea aplicada en pacientes con riesgo quirúrgico aceptable. Sin duda, las técnicas menos invasivas deben mejorar los resultados presentes. La aplicación de endoprótesis fenestradas o ramificadas se está demostrando competitiva en este sentido. No obstante, solo deben ser aplicadas en centros experimentados con alto volumen. La centralización es la clave de valor para hacer frente a esta compleja enfermedad y conseguir así los mejores resultados con el menor coste.