El empleo de escalas clínicas, ecocardiografía, angiografía torácica computarizada, biomarcadores y electrocardiograma permite clasificar la embolia pulmonar aguda en masiva, submasiva y de bajo riesgo con el objetivo de poder administrar al paciente el tratamiento adecuado. En ausencia de contraindicaciones deben tratarse inicialmente con heparinas de bajo peso molecular, fondaparinux o heparinas no fraccionadas. La trombólisis es el tratamiento de elección en la embolia pulmonar masiva al tener un riesgo aceptable de complicaciones hemorrágicas. La trombectomía percutánea y la embolectomía quirúrgica son tratamientos efectivos en la embolia masiva o submasiva con disfunción ventricular derecha. A los pacientes que presenten episodios embólicos recurrentes, a pesar de recibir una anticoagulación adecuada, se les debe colocar un filtro en la vena cava inferior. Debe realizarse un ecocardiograma con suero salino agitado previamente a su administración intravenosa para descartar o confirmar un foramen oval persistente y, por tanto, una embolia paradójica.
The use of clinical scales, echocardiography, computed tomography scans, biomarkers and electrocardiography, allows the classification of the acute pulmonary embolism to be classified into, massive, submassive, and low-risk in order to provide patients with a more appropriate treatment. In the absence of contraindications they should be initially treated with low molecular weight heparins, fondaparinux, or unfractionated heparins. Thrombolysis is the treatment of choice for massive pulmonary embolism with an acceptable risk of haemorrhagic complications. Percutaneous thrombectomy and surgical embolectomy are effective treatments in massive or submassive pulmonary embolism with right ventricular dysfunction. An inferior vena cava filter must be installed in patients who have recurrent episodes despite receiving suitable anticoagulation. An echocardiogram with saline serum infusion (that must be mixed prior to the intravenous administration), rules out or confirms the presence of a patent foramen ovale and therefore, a paradoxical embolism.
Los términos masiva, submasiva y no masiva se han utilizado desde los años setenta para caracterizar y clasificar la embolia pulmonar (EP). El concepto de masiva se ha asociado erróneamente a grave, cuando en realidad hace referencia al tamaño y grado de oclusión vascular, medido por el índice de Miller1, que se corresponde con una afectación superior al 50% del territorio vascular pulmonar. Esta definición, basada solo en parámetros angiográficos, no tiene en cuenta las comorbilidades que presentan los pacientes, por lo que no permite establecer una correlación adecuada con el pronóstico de la enfermedad, ni decidir la actitud terapéutica más conveniente en cada caso. Por ejemplo, una EP submasiva puede asociarse con un alto riesgo de complicaciones en pacientes con distintas comorbilidades, tales como una enfermedad pulmonar obstructiva crónica o un fallo cardíaco congestivo2.
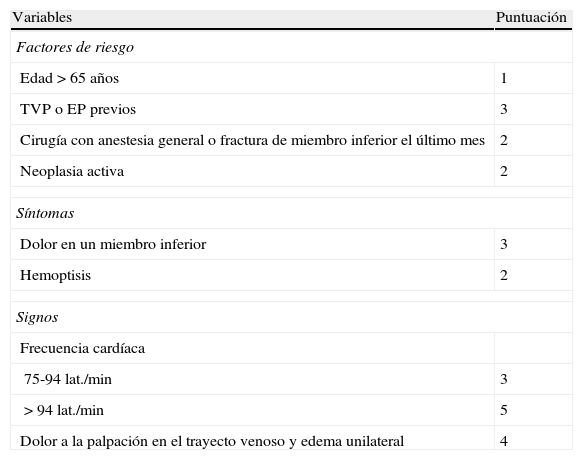
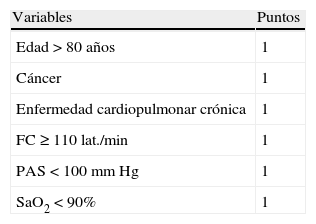
Datos actuales demuestran que en la EP aguda la hipotensión y la parada circulatoria se asocian con un incremento de la mortalidad a corto plazo. Así, en una cohorte de 2.392 pacientes, a los 90 días de seguimiento la tasa de mortalidad entre los que inicialmente presentaban o no una presión arterial sistólica (PAS) inferior a 90mmHg fue del 54,2 y del 14,7%, respectivamente3. En otro trabajo realizado con 1.001 pacientes la tasa de mortalidad hospitalaria fue del 8,1% para los hemodinámicamente estables, del 25% para los que cursaron con shock cardiogénico y del 65% para los que necesitaron reanimación cardiopulmonar4. También la escala de Ginebra revisada5 (tabla 1) y el PESI simplificado6 −índice de severidad de la embolia pulmonar (tabla 2)− identifican la hipotensión (PAS < 100mm Hg) como un factor significativo de mal pronóstico.
Escala de Ginebra revisada para el diagnóstico de la embolia pulmonar
| Variables | Puntuación |
| Factores de riesgo | |
| Edad > 65 años | 1 |
| TVP o EP previos | 3 |
| Cirugía con anestesia general o fractura de miembro inferior el último mes | 2 |
| Neoplasia activa | 2 |
| Síntomas | |
| Dolor en un miembro inferior | 3 |
| Hemoptisis | 2 |
| Signos | |
| Frecuencia cardíaca | |
| 75-94 lat./min | 3 |
| > 94 lat./min | 5 |
| Dolor a la palpación en el trayecto venoso y edema unilateral | 4 |
EP: embolia pulmonar; TVP: trombosis venosa profunda.
Probabilidad clínica:
Baja: 0-3 puntos.
Media: 4-10 puntos.
Alta: ≥ 11 puntos.
Tomada de Le Gal et al.5
Índice de severidad de la embolia pulmonar simplificada
| Variables | Puntos |
| Edad > 80 años | 1 |
| Cáncer | 1 |
| Enfermedad cardiopulmonar crónica | 1 |
| FC ≥ 110 lat./min | 1 |
| PAS < 100mm Hg | 1 |
| SaO2 < 90% | 1 |
FC: frecuencia cardíaca; PAS: presión arterial sistólica; SaO2: saturación de oxígeno.
Estratificación del riesgo:
0 puntos: bajo riesgo.
≥ 1 punto: alto riesgo.
Tomada de Jimenez et al.6
Estudios que incluyen el empleo de escalas clínicas, ecocardiografía, angiografía torácica computarizada (angio-TC), biomarcadores y ECG permiten clasificar la EP aguda en masiva, submasiva y de bajo riesgo con el objetivo de poder administrar al paciente el tratamiento adecuado2,7.
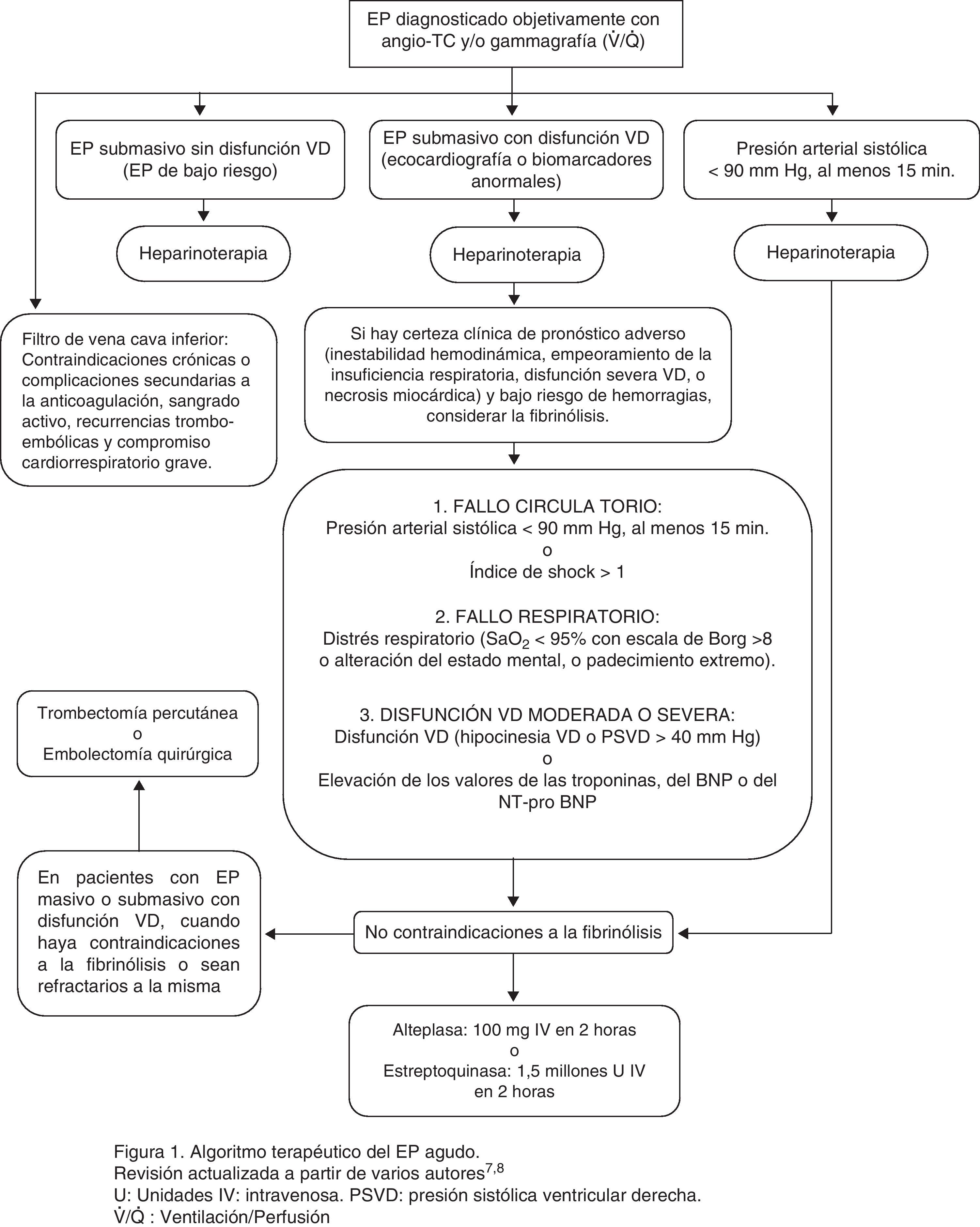
Embolia pulmonar masivaLa EP con hipotensión mantenida (PAS < 90mm Hg) al menos 15min, o que necesite soporte inotrópico no debido a otras causas diferentes de EP como arritmias, hipovolemia, sepsis, disfunción ventricular izquierda (VI) o bradicardia persistente (< 40 lat./min con signos o síntomas de shock).
Embolia pulmonar submasivaLa EP sin hipotensión (PAS > 90mm Hg), con disfunción ventricular derecha (VD) o necrosis miocárdica2.
La disfunción VD significa la presencia de al menos uno de estos parámetros:
- -
Dilatación VD (diámetro VD/diámetro VI > 0,9) o disfunción sistólica ecocardiográfica.
- -
Dilatación VD (diámetro VD/diámetro VI > 0,9) mediante angio-TC.
- -
Elevación del N-terminal pro-BNP (NT-BNP) (> 500 pg/ml).
- -
Cambios electrocardiográficos (bloqueo completo o incompleto de la rama derecha del haz de Hiss de nueva aparición), elevación o depresión anteroseptal del ST o inversión anteroseptal de la onda T.
La necrosis miocárdica se define por uno de los siguientes parámetros:
- -
Troponina I elevada (> 0,4 ng/ml).
- -
Troponina T elevada (> 0,1 ng/ml).
Una EP con ausencia de marcadores clínicos de pronóstico adverso que definen a la masiva o submasiva. Siempre deben incorporarse las escalas clínicas en la valoración de todo tipo de EP aguda, lo que incluye la escala revisada de Ginebra5 y el PESI simplificado6, ya que pueden predecir un mal pronóstico independientemente de los biomarcadores o de las técnicas de imagen.
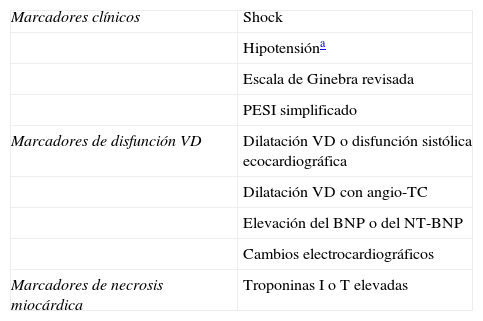
En la tabla 3 se resume la estratificación del riesgo de los pacientes en función de una serie de parámetros clínicos, ecocardiográficos, radiológicos, electrocardiográficos y biológicos.
Estratificación del riesgo en los pacientes con embolia pulmonar aguda
| Marcadores clínicos | Shock |
| Hipotensióna | |
| Escala de Ginebra revisada | |
| PESI simplificado | |
| Marcadores de disfunción VD | Dilatación VD o disfunción sistólica ecocardiográfica |
| Dilatación VD con angio-TC | |
| Elevación del BNP o del NT-BNP | |
| Cambios electrocardiográficos | |
| Marcadores de necrosis miocárdica | Troponinas I o T elevadas |
NT-BNP: N-Terminal pro-Brain Natriuretic Peptide.
Elaboración propia.
En ausencia de contraindicaciones los pacientes objetivamente diagnosticados deben tratarse inicialmente con heparinas de bajo peso molecular (HBPM), fondaparinux o con heparinas no fraccionadas (HNF). Así mismo, los que durante su proceso diagnóstico tengan una probabilidad media o alta de presentarlo deben anticoagularse hasta confirmarlo o descartarlo7,8.
Heparinas de bajo peso molecular comparadas con heparinas no fraccionadas intravenosasDistintos estudios9,10 indican que las HBPM se asocian con una disminución de la mortalidad, de las hemorragias mayores y de las tromboembolias recurrentes cuando se las compara con las HNF intravenosas.
Tienen la ventaja de su fácil administración que favorece el tratamiento ambulatorio, y el inconveniente de su bioacumulación cuando existe un fallo renal, lo que se refleja en los niveles supraterapéuticos de anti-Xa y en el incremento del riesgo hemorrágico. Por este motivo se recomiendan las HNF en enfermos con un CrCL < 30ml/min y en aquellos subsidiarios de trombólisis.
Fondaparinux comparado con heparinas de bajo peso molecularLos resultados del ensayo Matisse11 indican que el fondaparinux presenta unas tasas de mortalidad, de hemorragias mayores y de tromboembolias recurrentes similares a las alcanzadas por las HBPM, aunque la mediocre calidad de los datos obtenidos por las imprecisiones del trabajo no permiten tener una certeza clara sobre su eficacia en el tratamiento de la EP. Se ha sugerido a través de evidencias indirectas en pacientes con TVP que el fondaparinux es igual de efectivo que las HBPM, aunque no se ha demostrado hasta el momento12.
Fondaparinux comparado con heparinas no fraccionadas intravenosasAl igual que en el caso anterior tampoco existe evidencia directa de que el fondaparinux sea igual de efectivo que las HNF en el tratamiento del EP12.
Una ventaja potencial de este fármaco es que raramente se asocia a trombocitopenia inducida por heparina. Su inconveniente es que no debe administrarse a pacientes con CrCl < 30ml/min13.
Prevención secundaria o tratamiento a largo plazo de la embolia pulmonarCualquiera de estos fármacos debe simultanearse con la administración de antivitaminas K (AVK), durante un mínimo de 5 días y hasta que la relación internacional normalizada (INR) sea igual o superior a 2, por lo menos durante 24h, momento en el que se suspende la medicación parenteral14.
Decidir la duración del tratamiento debe basarse en los factores de riesgo, en la presencia de tromboembolias recurrentes, en la tolerancia a la anticoagulación, en el riesgo de sangrado y en las preferencias del paciente15,16.
En este sentido pueden definirse 3 grupos:
- a)
En general, después de 3 meses, la anticoagulación puede suprimirse con seguridad en la mayor parte de los pacientes con un primer episodio de EP asociada a factores de riesgo reversibles como la cirugía reciente o traumatismos17.
- b)
Las EP recurrentes o idiopáticas deberían anticoagularse indefinidamente con reevaluaciones periódicas del balance riesgo/beneficio18.
- c)
En la mayoría de casos de cáncer que desarrollan una EP se recomienda la administración inicial de HBPM al menos entre 3 y 6 meses, o mientras dure su tratamiento19.
- d)
De los nuevos anticoagulantes orales actualmente disponibles, el único autorizado en España en la prevención secundaria de la ETEV (EP y TVP) es el rivaroxabán. En el estudio Einstein-EXT que lo compara con placebo después de un período inicial de 6 a 12 meses en el que los enfermos eran tratados con AVK, los resultados obtenidos no señalan que los pacientes con EP sintomática tengan tasas diferentes de recurrencias tromboembólicas o de hemorragias según sean tratados con rivaroxabán o AVK20.
Está indicada en los siguientes casos:
- –
Cuando exista un fallo circulatorio con un episodio de hipotensión o un índice de shock persistente (número de latidos cardíacos por min/PAS en mm Hg) > 121.
- –
En la insuficiencia respiratoria con hipoxemia, definida como una SaO2 < 95% respirando aire ambiente y criterios clínicos de dificultad respiratoria21,22 que puede cuantificarse mediante la escala de Borg23 que calcula su severidad del 0 al 10 (0: ausencia de disnea, y 10: sensación de ahogamiento o de muerte); menos del 10% de los pacientes con EP aguda presentan una puntuación superior a 8 en el momento del diagnóstico.
- –
En el trastorno moderado o severo del VD confirmado ecocardiográficamente con presencia de hipocinesia VD, desplazamiento del septo interventricular y/o su abombamiento o una PSVD > 40mm Hg. La elevación de la troponina y del BNP (marcador de disfunción VD) evidencian también la alteración VD.
Se recomienda la perfusión continua de alteplasa o estreptocinasa durante 2 h, más segura y eficaz que las pautas de 12 a 24h. Debe administrarse por vía venosa periférica y no a través de un catéter central ya que aumenta el riesgo de sangrado en el punto de inserción7,8.
Si no se dispone de técnicas de imagen que confirmen el diagnóstico o el resultado de las mismas es dudoso, solo debe iniciarse la trombólisis en pacientes con hipotensión sostenida (PAS < 90mm Hg al menos 15min o que requiera soporte inotrópico no debido a otras causas diferentes de la EP), con alta probabilidad clínica de presentarlo o con disfunción VD comprobada ecocardiográficamente24.
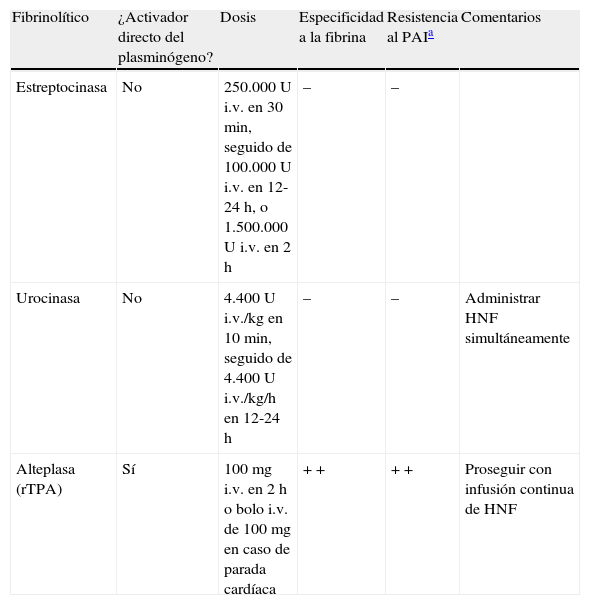
Farmacología de los trombolíticosLos trombolíticos convierten el plasminógeno circulante en plasmina, que a su vez escinde la fibrina polimerizada en distintos puntos y libera los productos de degradación del fibrinógeno, lo que incluye fragmentos de dímero D25. En la tabla 4 se expone el perfil farmacológico y las dosis recomendadas de los fibrinolíticos más utilizados en el tratamiento de la EP aguda.
Terapia trombolítica en la embolia pulmonar aguda
| Fibrinolítico | ¿Activador directo del plasminógeno? | Dosis | Especificidad a la fibrina | Resistencia al PAIa | Comentarios |
| Estreptocinasa | No | 250.000 U i.v. en 30min, seguido de 100.000 U i.v. en 12-24 h, o 1.500.000 U i.v. en 2 h | – | – | |
| Urocinasa | No | 4.400 U i.v./kg en 10min, seguido de 4.400 U i.v./kg/h en 12-24 h | – | – | Administrar HNF simultáneamente |
| Alteplasa (rTPA) | Sí | 100mg i.v. en 2 h o bolo i.v. de 100mg en caso de parada cardíaca | + + | + + | Proseguir con infusión continua de HNF |
i.v.: intravenosa; rTPA: activador tisular del plasminógeno recombinante; U: unidades.
Tomada de Bell et al.25
Los beneficios incluyen una resolución más rápida de los síntomas (disnea, dolor torácico y sufrimiento psicológico), estabilización de la función cardiorrespiratoria sin necesidad de ventilación mecánica o soporte vasopresor, reducción del daño VD, mejoría de la tolerancia al ejercicio, prevención de la recurrencia tromboembólica y aumento de la supervivencia.
Los riesgos potenciales abarcan desde las hemorragias menores y mayores, incluidas las intracerebrales (2,1% en los pacientes tratados con alteplasa), hasta las fatales. Además no parece reducir la extensión de la trombosis residual. Todo esto conlleva un aumento de las estancias hospitalarias y el empleo de cantidades ingentes de hemoderivados7,8. Diversos estudios26–28 confirman que a las 24h los pacientes tratados con heparina no mejoran sustancialmente el flujo sanguíneo pulmonar, mientras que los que reciben fibrinolíticos experimentan una reducción de sus defectos de perfusión entre un 30 y un 35%. Sin embargo, a los 7 días el incremento del flujo sanguíneo es similar en ambos grupos (reducción de sus defectos de perfusión ≈ 65 a 70%).
Investigaciones clínicas29,30 realizadas en pacientes con EP masivas muestran una reducción significativa de las recurrencias tromboembólicas o de las muertes desde un 19% con heparina a un 9,4% con fibrinolíticos (odds ratio 0,45, IC 95% 0,22-0,90). Otro trabajo revela que a los 6 meses de seguimiento el 27% de los tratados con heparina presentaban un incremento de la presión sistólica VD (PSVD) comprobada ecocardiográficamente. De estos, el 46% tenían disnea de reposo y una clase funcional iii/iv de la NYHA. Por el contrario, ninguno de los pacientes tratados con fibrinolíticos experimentó un incremento de la PSVD, lo que indica que la trombólisis puede disminuir la incidencia de la hipertensión pulmonar tromboembólica crónica31.
En la tabla 5 se recogen las contraindicaciones absolutas y relativas para el tratamiento trombolítico.
Contraindicaciones para el tratamiento trombolítico en la embolia pulmonar aguda
| Contraindicaciones absolutas |
| Antecedentes de hemorragia intracraneal |
| Enfermedades cerebrovasculares estructurales conocidas (malformaciones arteriovenosas) |
| Neoplasias intracraneales |
| Infarto isquémico cerebral en los 3 meses anteriores |
| Sospecha de disección aórtica |
| Sangrado activo o diátesis hemorrágica |
| Cirugía cerebral reciente o del canal medular |
| Traumatismo reciente cerrado de cabeza o de cara, con evidencia radiográfica de fractura ósea o lesión cerebral |
| Contraindicaciones relativas |
| Edad superior a 75 años |
| Paciente anticoagulado |
| Embarazo |
| Punciones vasculares no compresibles |
| Resucitación cardiopulmonar traumática o prolongada más de 10 min |
| Sangrado interno reciente (dentro de las 2-4 semanas precedentes) |
| Historia de hipertensión arterial crónica severa mal controlada |
| Hipertensión arterial severa no controlada en el momento de la presentación de la EP |
| (presión sistólica > 180mm Hg o presión diastólica > 110mm Hg) |
| Demencia |
| Infarto isquémico cerebral de más de 3 meses de evolución |
| Cirugía mayor en las 3 semanas anteriores |
| Pericarditis o derrame pericárdico |
| Retinopatía diabética |
| Sexo femenino |
| Raza negra |
| Peso < 60 kg |
Las técnicas mediante catéter percutáneo para recanalizar las oclusiones del tronco pulmonar o de las arterias pulmonares principales pueden salvar la vida a pacientes seleccionados con EP masiva o submasiva32. Se utilizan cuando la trombólisis y la trombectomía quirúrgica están contraindicadas o esta última no puede realizarse. La combinación de trombólisis farmacológica e intervenciones mecánicas son habitualmente utilizadas, a menos que el riesgo de sangrado sea elevado.
Sus objetivos incluyen una rápida reducción de la presión arterial pulmonar, de la sobrecarga VD, de la resistencia vascular pulmonar (RVP) y del incremento de la perfusión sistémica7,8.
Hay 3 tipos de intervenciones percutáneas para eliminar los trombos pulmonares y disminuir la carga trombótica: la trombectomía por aspiración, por fragmentación del trombo y la reolítica. Esta última se realiza con un catéter que utiliza un chorro salino a gran velocidad que fracciona los coágulos mediante un efecto Venturi33.
Una revisión de cohortes de 348 pacientes con EP masiva demostró una mejoría clínica según se tratasen con trombectomía percutánea (81%) o combinada con infusión local de trombolíticos (95%)34. Un estudio retrospectivo de 51 pacientes con EP masiva o submasiva que recibieron trombectomía reolítica reveló una mejoría clínica en el 92% de los casos35.
Estas técnicas deben realizarse por equipos médicos que tengan no solo la habilidad suficiente para efectuarlas sino también los conocimientos adecuados para manejar eficazmente situaciones clínicas graves, ya sea un shock cardiogénico, trastornos de la coagulación, distintos tipos de arritmias o un taponamiento cardíaco.
En general, la trombectomía mecánica se limita a las ramas arteriales pulmonares principales y lobares. Este procedimiento debe prolongarse hasta estabilizarlos hemodinámicamente, independientemente del resultado angiográfico. En muchos casos el aumento del flujo sanguíneo pulmonar solo se acompaña de una modesta mejoría angiográfica36.
La hemorragia pulmonar y la perforación auricular o VD y el taponamiento cardíaco consiguiente representan una complicación rara, aunque grave. La perforación o la disección de una rama de la arteria pulmonar pueden causar una hemorragia pulmonar y la muerte. Este riesgo de perforación se incrementa cuando se manipulan vasos inferiores a 6mm de diámetro37.
Embolectomía quirúrgicaLa embolectomía quirúrgica de urgencia con bypass cardiopulmonar ha resurgido como un tratamiento efectivo en la EP masiva o submasiva con disfunción VD, cuando la fibrinólisis está contraindicada o los pacientes son resistentes a la misma38.
También está indicada en enfermos que requieren la escisión quirúrgica de un trombo auricular derecho o que presentan una embolia paradójica. Su resultado es óptimo si se practica antes de que aparezca un shock cardiogénico39.
Ningún estudio clínico aleatorio o prospectivo observacional ha evaluado este tratamiento en pacientes con EP aguda. Una investigación retrospectiva realizada en 47 pacientes tratados con embolectomía quirúrgica muestra una tasa de supervivencia del 96% a los 4 años de seguimiento40. Este procedimiento tiene la ventaja de poder realizarse con normotermia y sin clampaje aórtico o paro cardíaco, y el inconveniente de que la extracción se limita únicamente a los trombos visibles.
Filtros de vena cava inferiorAunque los filtros de VCI no son un tratamiento de la EP están indicados si hay contraindicaciones o complicaciones secundarias a la anticoagulación, sangrado activo, recurrencias tromboembólicas a pesar de mantener un INR adecuado, y en casos de compromiso cardiorrespiratorio grave41. También un estudio realizado en 2.392 pacientes con EP agudo e hipotensión muestra que la inserción de un filtro de VCI junto con el tratamiento trombolítico disminuye la mortalidad y la EP precoz recurrente, por lo que podría estar indicada en este grupo de pacientes42.
Un gran estudio clínico comparativo y aleatorio muestra que a los 2 y 8 años de seguimiento los filtros de VCI incrementan el riesgo de TVP recurrentes, reducen el peligro de EP, no aumentan el del SPT y no alteran la mortalidad ni la frecuencia combinada de TVP y EP43.
Otro estudio observacional realizado en pacientes con TVP, tratados o no con filtro de VCI, indica que los primeros tenían una mayor incidencia de EP previas, hemorragias mayores recientes, cánceres e infartos. Como en el caso anterior el filtro de VCI reduce significativamente los episodios anuales de EP, pero se asocia con una alta tasa de rehospitalización por TVP en los que inicialmente la habían presentado44.
Una extensa revisión retrospectiva de series de casos de inserciones de filtros de VCI (6.500 pacientes en 89 publicaciones) sugiere que en el 10% de los casos provocan trombosis venosas en el punto de inserción45.
En el caso de que se decida implantar un filtro permanente de VCI debe continuarse o reasumirse la anticoagulación una vez que las contraindicaciones a la misma o el riesgo de sangrado activo hayan desaparecido.
En pacientes con contraindicaciones temporales a la anticoagulación se puede implantar un filtro de VCI recuperable7,8,41. También puede tener indicaciones potenciales como profilaxis en los pacientes con politraumatismos graves, que han recibido cirugía ortopédica mayor de alto riesgo o bariátrica y en la trombólisis iliocava46. Para prevenir posibles efectos adversos deben reexaminarse periódicamente y retirarse cuando las indicaciones iniciales o las contraindicaciones a la anticoagulación hayan desaparecido. Previamente a su extracción se efectúa un eco-Doppler para descartar la existencia de un trombo, ya sea en el propio filtro o por debajo de él.
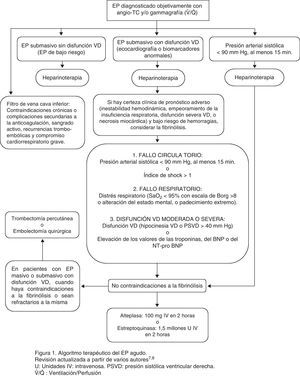
En la figura 1 se expone el algoritmo terapéutico de la EP aguda.
Algoritmo terapéutico de la EP aguda. Revisión actualizada a partir de varios autores7,8. IV: intravenosa; PSVD: presión sistólica ventricular derecha; U: unidades; V˙/Q˙: ventilación/perfusión.
Es una complicación devastadora que incrementa la morbimortalidad relacionada con la EP47. La existencia de un foramen oval persistente (FOP) en pacientes con esta afección incrementa el riesgo de muerte (riesgo relativo 2,4), de infarto isquémico (riesgo relativo 5,9) y de embolia arterial periférica (riesgo relativo > 15)48. Su presencia no solo se asocia con un aumento del riesgo de infartos silentes cerebrales del 33% comparado con el 2% de los que no lo presentan, sino también con la probabilidad de presentar una embolia paradójica e hipoxemia49.
La realización de ecocardiografías transtorácicas de rutina con suero salino agitado previamente a su administración intravenosa en pacientes con EP masiva o submasiva aumenta la detección de una embolia paradójica amenazante (trombo atrapado dentro del FOP). Por esto, en los enfermos con shunt intracardíaco debería considerarse la posibilidad de emplear opciones terapéuticas agresivas que incluyen la embolectomía quirúrgica (particularmente si existe un trombo intracardíaco) y una terapia antitrombótica apropiada7.
Aunque no se conoce con exactitud cuál es el tratamiento adecuado, la trombectomía quirúrgica puede disminuir la tasa de infartos, mientras que la trombólisis puede asociarse con una mortalidad más elevada comparada con la cirugía o la heparinoterapia50.
Actualmente quedan por resolverse una serie de interrogantes:
- -
¿Cómo detectar un FOP o una fístula arteriovenosa pulmonar en la EP masiva o submasiva?
- -
¿La presencia de un FOP debería cambiar el tratamiento de la EP?
- -
¿Cuándo ocluir un FOP en pacientes con embolia paradójica y EP?
- -
¿Cómo el tamaño y la morfología del shunt intracardíaco influyen en la aparición de reacciones adversas?
- -
¿En qué momento debe implantarse un filtro de VCI y ocluir el FOP en los pacientes con embolia paradójica y EP?
- •
En ausencia de contraindicaciones los pacientes diagnosticados objetivamente de EP, y los que durante su proceso diagnóstico tengan una probabilidad media o alta de presentarla, deben anticoagularse inicialmente con HBPM, HNF o fondaparinux.
- •
La fibrinólisis es una elección razonable en la EP masiva al tener un riesgo aceptable de complicaciones hemorrágicas. Puede considerarse en EP submasivas con evidencia clínica de mal pronóstico (inestabilidad hemodinámica, empeoramiento de su insuficiencia respiratoria, disfunción VD severa o necrosis miocárdica) y bajo riesgo de complicaciones hemorrágicas.
- •
Tanto la trombectomía percutánea como la embolectomía quirúrgica son tratamientos efectivos en la EP masiva o submasiva con disfunción VD cuando haya contraindicaciones a la fibrinólisis o sean resistentes a la misma2,22.
- •
En los enfermos que a pesar de recibir una anticoagulación adecuada presenten episodios recurrentes de EP, y en aquellos con contraindicaciones o complicaciones secundarias a la anticoagulación o afectación cardiorrespiratoria severa, se les debe implantar un filtro de VCI. Una vez resueltas estas complicaciones debe reanudarse la anticoagulación.
- •
En la EP masiva o submasiva se aconseja la realización de un ecocardiograma con suero salino agitado previamente a su administración intravenosa para descartar o confirmar un FOP.
- •
La embolectomía quirúrgica es una opción terapéutica razonable en la embolia paradójica amenazante.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesNo existe ningún conflicto de intereses por parte de ninguno de los autores.