La neuropatía diabética (ND) es la complicación sintomática más frecuente en pacientes con diabetes mellitus (DM) y la principal causa de lesiones y de amputación. El objetivo de este trabajo es revisar el diagnóstico y tratamiento de esta patología, así como las posibles medidas preventivas.
Esta patología afecta fibras sensitivas, motoras y autonómicas del sistema nervioso periférico de forma distal en extremidades inferiores. El diagnóstico es clínico, no siendo necesarias, de forma rutinaria, pruebas complementarias. En la exploración física se debe realizar siempre el test de Semmes-Weinstein, acompañado de al menos una de las siguientes exploraciones: sensibilidad algésica, vibratoria o temperatura.
Los antidepresivos tricíclicos y antiepilépticos siguen siendo los fármacos de elección como primera línea de tratamiento, pudiendo ser utilizados en monoterapia o asociados si fuera necesario.
Hasta el 50% de las amputaciones en pacientes con polineuropatía diabética sensitivomotora crónica se pueden evitar mediante el diagnóstico precoz de esta patología. En los últimos años se han probado diferentes intervenciones y fármacos para modificar el curso natural de esta patología, pero a día de hoy, el control estricto de la glucemia es la única intervención que puede prevenir el desarrollo de la ND en pacientes con DM tipo 1 o retrasarla en pacientes con DM tipo 2.
Diabetic neuropathy (ND) is a common complication in diabetic patients, and is associated with high risk of ulcers and amputation of the foot or the limb.
The aim of this article is to provide an overview of the diagnosis and all treatment regimens for peripheral diabetic neuropathy.
Early recognition and appropriate management of peripheral neuropathy in patients with DM is important. Assessment should include Semmes-Weinstein testing, and at least one of the following tests: Pin-prick, temperature, or vibration sensitivity.
Antidepressants and anticonvulsants are first line drugs in its treatment.
Early diagnosis can prevent up to 50% of all amputations in diabetic patients with ND. Intensive glucose control can prevent the development of neuropathy in patients with type 1 diabetes, and slow down the progression in patients with type 2 diabetes.
La diabetes mellitus (DM) afecta a más de 382 millones de personas en todo el mundo y la Organización Mundial de la Salud (OMS) estima que en 2030 será la primera causa de mortalidad1.
La neuropatía diabética (ND) es la complicación sintomática más frecuente en pacientes con DM2. Está presente en más del 10% de los pacientes al diagnóstico y en hasta el 50% tras 10 años de evolución de la enfermedad3. Es el principal factor de riesgo para el desarrollo de úlceras y, por tanto, de amputaciones, ya que más del 75% de las amputaciones de miembros inferiores están precedidas por la aparición de lesiones4.
Esta patología es una de las principales causas de dolor neuropático en la población, lo que produce un gran impacto en la calidad de vida de estos pacientes5, con una alta tasa de depresión asociada, de baja laboral y por tanto con un alto coste asociado6.
ObjetivoPor la alta prevalencia de esta patología en nuestra práctica clínica diaria y las graves consecuencias del diagnóstico tardío, el objetivo de este trabajo es revisar el diagnóstico y tratamiento de la ND, así como las posibles intervenciones preventivas en este campo.
DesarrolloDefinición y patogeniaLa ND se define como el conjunto de síntomas o signos de disfunción del sistema nervioso periférico una vez excluidas otras causas7. Aunque estos pacientes pueden desarrollar neuropatías no diabéticas, ND agudas o de predominio distal, más del 75% de los cuadros son debidos a polineuropatía distal simétrica o sensitivomotora crónica (PDS)7.
En la PDS se afectan 2 tipos de fibras. Por un lado, las fibras gruesas —afectación más frecuente, aunque de forma subclínica—, que son las encargadas de trasmitir la sensibilidad vibratoria, propioceptiva, así como los reflejos osteotendinosos3. Y por otro lado, las fibras finas, sin mielina, que son las que transmiten el dolor superficial, la sensibilidad a la temperatura y la autonómica3,8. Así pues, en esta patología se afectan fibras sensitivas, motoras y autonómicas del sistema nervioso periférico9. La afectación de fibras sensitivas produce alteración de la sensibilidad térmica, algésica, vibratoria y propioceptiva, que suele pasar desapercibida por la pérdida del reflejo doloroso, siendo en muchas ocasiones la úlcera el primer síntoma de la enfermedad. Las fibras motoras son las encargadas de mantener la posición correcta de las articulaciones y la distribución de las presiones. Su alteración produce atrofia muscular, deformidades óseas y alteraciones de la marcha con riesgo añadido de caídas, especialmente en pacientes ancianos. Estos cambios se traducen en aumento de presión en las cabezas de los metatarsianos y en la región plantar, que aumenta el riesgo de desarrollar úlceras. Finalmente, la lesión de las fibras autonómicas altera la regulación del flujo sanguíneo y disminuye la sudoración, lo que provoca sequedad en la piel, con tendencia al desarrollo de fisuras y, por tanto, de lesiones9.
La hiperglucemia presenta un papel fundamental en la fisiopatología de la PDS, ya que produce un aumento de productos finales de glucosilación avanzada que afectan al colágeno tisular, favorecen la aparición de lesiones microvasculares y se comportan como proinflamatorios incrementado la permeabilidad vascular. Además, la metabolización del exceso de glucosa la convierte parcialmente en sorbitol, que aumenta el estrés oxidativo, especialmente en nervios periféricos y en retina, donde produce un aumento de la osmolaridad celular y una peroxidación de los lípidos de la membrana celular de los nervios periféricos que conduce a isquemia e hipoxia de los mismos10.
ClínicaCaracterísticamente, la PDS afecta inicialmente a las extremidades inferiores en la parte más distal, es decir, los pies, y progresa proximalmente. En más del 80% de los casos esta patología es asintomática9.
Los síntomas sensitivos se clasifican tradicionalmente en «positivos» y «negativos». Los síntomas «positivos» (parestesias, disestesias, hiperalgesia, alodinia y dolor urente) son aquellos que no se asocian a mayor riesgo de desarrollar lesiones, y los «negativos» (hipoestesia, hipoalgesia y anestesia) son los que sí aumentan el riesgo de presentar úlceras11.
Los síntomas motores, menos frecuentes, suelen aparecer en estadios más avanzados de la enfermedad11.
Habitualmente el inicio es bilateral y simétrico, con déficit sensitivo «en calcetín» y alteración de la sensación vibratoria, temperatura y tacto fino2. Es muy característico el empeoramiento nocturno del dolor2. Los reflejos aquíleos suelen estar abolidos al diagnóstico11.
Cuando el cuadro avanza desaparecen los reflejos rotulianos, se altera la propiocepción e incluso se pueden afectar antebrazos y manos con una distribución «en guante»12.
DiagnósticoHistoria clínicaEl diagnóstico de esta patología es fundamentalmente clínico. No es preciso realizar estudios electrofisiológicos cuando la historia clínica y los hallazgos físicos son consistentes con el diagnóstico13. No hay que olvidar que es un diagnóstico de exclusión, por lo que es imprescindible descartar otras causas de neuropatía en estos pacientes11,14 (tabla 1).
Diagnóstico diferencial de las neuropatías periféricas
| Diagnóstico de las diferencias en neuropatías periféricas |
|---|
| N. tóxica y/o por fármacos (isoniazida, hidralazina, vincristina) |
| N. metabólica, alcohólica |
| Déficit de vitamina B12 |
| N. vasculítica |
| N. asociada al VIH |
| Hipotiroidismo |
| N. hereditarias |
| Enfermedad de Fabry |
| Paraneoplásica |
N.: neuropatía; VIH: virus de la inmunodeficiencia humana.
El primer paso debe ser realizar una historia clínica completa, en la que debemos interrogar al paciente sobre sus antecedentes personales, hábitos tóxicos, especialmente de tabaquismo, años de evolución de la DM, grado de control glucémico alcanzado, presencia de otras complicaciones micro y macrovasculares, y sobre las características y factores desencadenantes del dolor9.
En la valoración del dolor hay 2 pasos fundamentales: cuantificar el grado y el tipo de dolor. Para valorar la severidad del dolor, en este contexto, puede utilizarse la escala visual analógica (EVA)15. En caso de que haya dudas de si el origen del cuadro doloroso del paciente es o no neuropático, es útil la utilización de la escala DN-4. Esta escala es rápida y sencilla, está validada al castellano y tiene una alta sensibilidad y especificidad en el diagnóstico del dolor neuropático. Consta de 10 ítems a los que el paciente debe contestar sí o no (sensación de quemazón, de alfileres, frío-doloroso, descargas eléctricas, hormigueo, entumecimiento, picazón, hipoestesia al tacto o a los pinchazos o roce doloroso). Tres o más respuestas positivas se consideran diagnóstico de dolor de origen neuropático16.
Exploración físicaA parte de la exploración física general se debe realizar una exploración neurológica completa de las extremidades. En esta exploración neurológica se debe valorar la sensibilidad algésica, táctil, vibratoria, térmica, sensibilidad a la presión y los reflejos osteotendinosos. Para ellos se utilizan fundamentalmente 3 instrumentos: el monofilamento de 10g o de Semmes-Weinstein, un diapasón de 128herzios (Hz) y un martillo de reflejos17.
- -
Sensibilidad algésica: se realiza mediante un pinchazo en el primer dedo del pie con un objeto romo, que no produzca lesiones en la piel. El paciente debe diferenciar la sensación dolorosa del pinchazo y la de la presión.
- -
Sensibilidad táctil: con un algodón, el paciente debe notar el roce sobre la piel.
- -
Sensibilidad vibratoria: se realiza con el diapasón de 128Hz18. Se hace vibrar el diapasón y se coloca sobre una protuberancia ósea, normalmente en la cabeza del primer metatarsiano. El paciente debe notar tanto el inicio de la vibración, como el cese de esta. Si el examinador es aún capaz de notar la vibración cuando el paciente ha dejado de hacerlo, la prueba será patológica. Esta prueba presenta una sensibilidad del 62%19 y una especificidad muy elevada, cercana al 98%20, en el diagnóstico de esta patología.
- -
Sensibilidad térmica: habitualmente se utiliza el mango del martillo de reflejos o del diapasón. El sujeto debe percibir la sensación de frialdad del metal9.
- -
Sensibilidad a la presión: para este examen es indispensable el monofilamento de 10g o de Semmes-Weinstein9. Se valoran 4 puntos en cada pie, que tradicionalmente son la falange distal del primer dedo y la cabeza de los metatarsianos primero, tercero y quinto. Se realiza aplicando presión hasta que el monofilamento se curva. En el caso de que el paciente presente hiperqueratosis en estos puntos, se deben evitar, por lo que la prueba se realizará alrededor de estos. Se aplica 3 veces en cada punto y el sujeto debe acertar, al menos, 2 de cada 3 pruebas. Este es un test rápido y sencillo con una elevada sensibilidad (95%) y especificidad (82%) en el diagnóstico de la neuropatía21.
- -
Reflejos osteotendinosos: la exploración de los reflejos aquíleos es altamente sensible, pero presenta una especificidad baja19, probablemente debido a que se ha demostrado que, con la edad, aumenta la prevalencia de sujetos sanos con reflejos aquíleos abolidos22.
Este año se han publicado las nuevas guías de la Sociedad Americana de Diabetes (ADA)23, que recomiendan realizar siempre el test del monofilamento de 10g acompañado de al menos una de las siguientes exploraciones: vibración, temperatura o sensibilidad algésica. Hay que tener en cuenta que estas exploraciones no solo evidencian la presencia de disfunción del sistema nervioso periférico, sino que sirven como predictores de futuras complicaciones23. Para evitar la aparición de lesiones, las nuevas guías de la ADA recomiendan realizar este cribado para descartar ND al diagnóstico en pacientes con DM tipo 2, a los 5 años del diagnóstico en pacientes con DM tipo 1, y después de forma anual.
TratamientoSolo el 20% de los pacientes con ND presentarán cuadros dolorosos, pero estos son de difícil control2. En casos moderados se pueden utilizar analgésicos débiles, pero no se recomiendan antiinflamatorios no esteroideos (AINE) por el alto riesgo de nefrotoxicidad2.
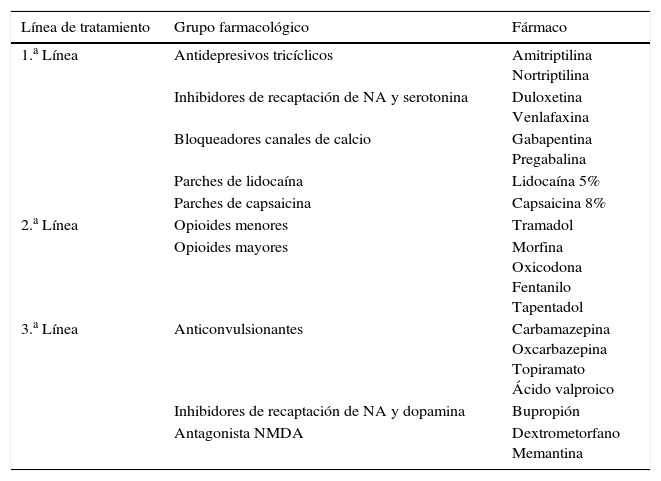
En el manejo de la ND dolorosa hay 3 líneas de tratamiento2,24,25 (tabla 2).
Líneas de tratamiento de la neuropatía diabética
| Línea de tratamiento | Grupo farmacológico | Fármaco |
|---|---|---|
| 1.a Línea | Antidepresivos tricíclicos | Amitriptilina Nortriptilina |
| Inhibidores de recaptación de NA y serotonina | Duloxetina Venlafaxina | |
| Bloqueadores canales de calcio | Gabapentina Pregabalina | |
| Parches de lidocaína | Lidocaína 5% | |
| Parches de capsaicina | Capsaicina 8% | |
| 2.a Línea | Opioides menores | Tramadol |
| Opioides mayores | Morfina Oxicodona Fentanilo Tapentadol | |
| 3.a Línea | Anticonvulsionantes | Carbamazepina Oxcarbazepina Topiramato Ácido valproico |
| Inhibidores de recaptación de NA y dopamina | Bupropión | |
| Antagonista NMDA | Dextrometorfano Memantina |
NA: noradrenalina; NMDA: N-metil-aspartato.
En primera línea se recomienda iniciar en monoterapia un antidepresivo tricíclico (ATDt) o inhibidor selectivo de la recaptación de noradrenalina y serotonina o un fármaco antiepiléptico (bloqueadores de los canales de calcio). En principio no hay evidencia para recomendar uno sobre el resto25, pero hay que tener en cuenta que los ATDt presentan muchos efectos secundarios en pacientes ancianos, como mareo, taquicardia, hipotensión ortostática y retención urinaria2. En trabajos recientes sobre la tolerabilidad y eficacia de estos fármacos, la pregabalina resultó el fármaco más eficaz, la amitriptilina el menos seguro y la gabapentina el que mejor balance eficacia-seguridad presentaba26.
Se puede asociar un fármaco tópico de primera línea, ya sea lidocaína o capsaicina en parches24. Los parches de lidocaína al 5% son efectivos en el tratamiento de la alodinia. Se debe cubrir la zona a tratar, que previamente se ha debido marcar. El tratamiento se aplica durante no más de 12h y respetando un intervalo de otras 12h antes de poder volver a colocar otro parche. La eficacia se evalúa tras 2-4 semanas del inicio, y si tras este periodo no ha resultado efectivo, se debe suspender el tratamiento27.
Recientemente el nuevo consenso de tratamiento del dolor no oncológico ha introducido los parches de capsaicina al 8% como alternativa de tratamiento de primera línea24. Estos parches deben ser aplicados en la zona dolorosa, con la piel limpia, seca e íntegra, durante 30min. Tras retirarlo se debe aplicar gel limpiador para retirar los restos de fármaco de la piel. Frecuentemente produce molestias en la zona de aplicación, por lo que se puede utilizar un anestésico tópico o un analgésico oral antes de colocarlo28. Se puede repetir el tratamiento tras 90 días si el dolor persiste o reaparece.
Si el tratamiento es mal tolerado se recomienda cambiar de grupo farmacológico, es decir, cambiar el fármaco antiepiléptico elegido por un antidepresivo o al revés. Si, por el contrario, la tolerancia ha sido buena pero no se ha logrado el objetivo analgésico deseado, se puede optar por combinar ambos fármacos6.
En los casos en los que aún no se ha alcanzado el control óptimo del dolor, la siguiente opción sería utilizar un fármaco de segunda línea. Se recomienda comenzar con un opioide débil, es decir tramadol29, generalmente asociado a paracetamol. Si fuera necesario se podrían sustituir estos por un opioide mayor. En los casos en que el paciente aún presente mal control del dolor, se recomienda derivar a la Unidad de Dolor6.
PrevenciónUna vez que el paciente presenta ND esta es irreversible30, por lo que son fundamentales las medidas para evitar esta situación, es decir, las actuaciones preventivas para evitar el desarrollo de esta patología23,31.
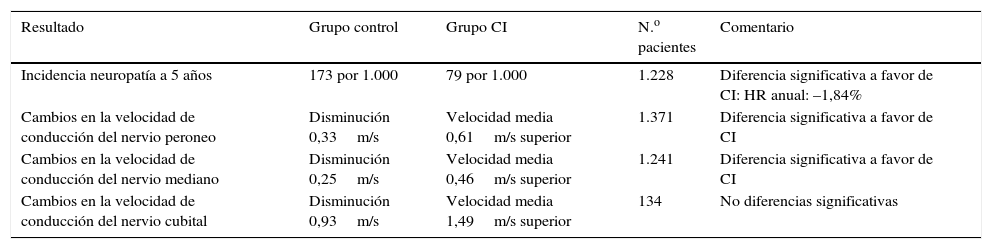
El control estricto de la glucemia es el único tratamiento efectivo en el control de la ND. En pacientes con DM tipo1 está demostrado que el control estricto de la glucemia puede prevenir el desarrollo de la ND23,32, sin embargo, en DM tipo 2 esta evidencia no es tan fuerte. En estos pacientes retrasa el inicio y la clínica de la ND, pero no se ha demostrado que el control intensivo de la glucemia evite el desarrollo de esta patología23,31,33. En el estudio Diabetes Control and Complications Trial (DCCT) se aleatorizaron 1.441 pacientes con DM tipo 1 en 2 grupos: control normal o control intensivo de las glucemias. En este último grupo, tras 5 años de seguimiento se objetivó una reducción del 65% de la prevalencia de ND34. Más recientemente, se ha realizado un análisis de los factores de riesgo para el desarrollo de neuropatía en 1.172 pacientes con DM tipo1 del estudio European Diabetes Prospective Complications Study (EURODIAB). Estos pacientes fueron seguidos durante una media de 7,3 años (DE 0,6). La incidencia acumulada de neuropatía se relacionó con el control glucémico y con la duración de la DM32. En 2012 se publicaron los resultados de una revisión Cochrane35 en la que se incluyeron 17 estudios aleatorizados, tanto en pacientes con DM tipo 1 como tipo 2. Según los resultados de este trabajo, el control estricto de la glucemia previene el desarrollo de neuropatía y reduce las alteraciones en la conducción nerviosa y la sensibilidad vibratoria en pacientes con DM tipo 1 (tabla 3). En sujetos con DM tipo 2, estos resultados no fueron significativos (p=0,06).
Control normal de la glucemia vs. control intensivo
| Resultado | Grupo control | Grupo CI | N.o pacientes | Comentario |
|---|---|---|---|---|
| Incidencia neuropatía a 5 años | 173 por 1.000 | 79 por 1.000 | 1.228 | Diferencia significativa a favor de CI: HR anual: –1,84% |
| Cambios en la velocidad de conducción del nervio peroneo | Disminución 0,33m/s | Velocidad media 0,61m/s superior | 1.371 | Diferencia significativa a favor de CI |
| Cambios en la velocidad de conducción del nervio mediano | Disminución 0,25m/s | Velocidad media 0,46m/s superior | 1.241 | Diferencia significativa a favor de CI |
| Cambios en la velocidad de conducción del nervio cubital | Disminución 0,93m/s | Velocidad media 1,49m/s superior | 134 | No diferencias significativas |
CI: control intensivo; HR: hazard ratio; m/s: metros por segundo.
A pesar de que el control glucémico estricto es la única medida bien establecida para el control de esta patología, estudios recientes señalan que tras ajustar los datos al nivel de control glucémico y al tiempo de evolución de la enfermedad, los niveles elevados de lipoproteínas de baja densidad (LDL)32, de triglicéridos31,32 y del índice de masa corporal31,32, la hipertensión31 y el tabaquismo31 eran factores que se asociaban a una mayor incidencia de neuropatía en esta población.
Una vez que el paciente ha desarrollado ND es fundamental evitar la aparición de lesiones y, por lo tanto, de las amputaciones asociadas. Hasta el 50% de las amputaciones de estos pacientes se pueden evitar mediante un diagnóstico precoz y un adecuado tratamiento36. Se debe instruir al paciente en el autocuidado de los pies e insistir en la inspección diaria de los mismos, para sustituir la pérdida del reflejo doloroso por la inspección diaria de los pies y del calzado, buscando lesiones que puedan haber pasado desapercibidas9.
Nuevas intervenciones para prevención y tratamiento de la neuropatía diabéticaEn los últimos años se han realizado ensayos con diferentes fármacos para valorar si alguna intervención puede alterar el curso natural de esta patología. Se ha observado que los pacientes con ND presentaban niveles inferiores de vitamina D que pacientes sin ND37 y que presentaban mayor prevalencia de parestesias (odds ratio [OR] 2,12; IC [intervalo de confianza] 95%: 1,17-3,85) tras haber ajustado los datos al control glucémico y a la duración de la DM38. A pesar de estos datos, ningún ensayo ha podido demostrar que el tratamiento con vitamina D no tenga ningún efecto clínico37. Resultados similares se han descrito con la presencia de hiperuricemia en estos pacientes39. Los niveles elevados de ácido úrico son un factor independiente que se asocia de forma significativamente estadística a la presencia de ND en pacientes con DM tipo 239 (riesgo relativo [RR] 1,95; IC 95%: 1,23-3,11; p=0,005)40, sin haber demostrado que el tratamiento de esta patología no produzca ningún beneficio clínico en estos pacientes.
Debido a la relación establecida de la vitamina B12 con las neuropatías periféricas, se han publicado varios trabajos intentando determinar la posible asociación entre la ND y la vitamina B12. A pesar de que la vitamina B12 es un fármaco seguro, y que cuando se detectan niveles disminuidos de la misma está indicado el tratamiento sustitutivo de la misma41, no hay evidencia de que no tenga ningún papel en la prevención o el tratamiento de la ND42.
Desde hace más de 10 años se está investigando el papel del ácido alfa lipoico (ALA) o tióctico en la prevención de la ND y en el control de los síntomas de las ND. Este fármaco es un potente antioxidante, producido de forma endógena y coenzima del ciclo de Krebs. En modelos animales ha demostrado reducir y prevenir las complicaciones micro y macrovasculares de la DM43. Hasta el momento solo está aprobado su uso para el tratamiento de la ND en Alemania y está cubierto por su sistema sanitario44.
En una revisión sistemática del año 2012 en el que se incluyeron 4 ensayos clínicos contra placebo con 653 pacientes, el ALA vía oral (v.o.) o intravenoso (i.v.) mejoró de forma significativa el control del dolor en estos pacientes. En este trabajo el dolor se cuantificó mediante la escala TSS que valoraba el dolor, las parestesias y la sensación de quemazón, con una mejoría tras 3 semana de tratamiento (IC 95%: –3,12, –1,14, p=0,00001)43. Este año se ha publicado otra revisión sistemática en la que se obtienen los mismos resultados: ALA 600mg v.o. (IC 95%: –2,89, –1,01) o i.v. (IC 95%: –4,25, –0,39) parece reducir los síntomas respecto al placebo45. En 2015 se realizó un metaanálisis en el que se analizaron datos de 18 ensayos clínicos con 1.410 pacientes. En este trabajo la asociación de ALA, prostaglandina E1 (PGE1) y metilcobalamina se asoció a una mejor velocidad de conducción motora de los nervios mediano y peroneo, y sensitiva en el nervio mediano, de forma significativa respecto al uso de PGE1 y metilcobalamina sin ALA46. A pesar de estos datos, que parecen prometedores, la baja calidad científica de estos trabajos, en muchos de los cuales no se detalla el modo de aleatorización, ni si eran o no por intención de tratar, hace que no dispongamos de evidencia científica de calidad para recomendarlo en la práctica clínica.
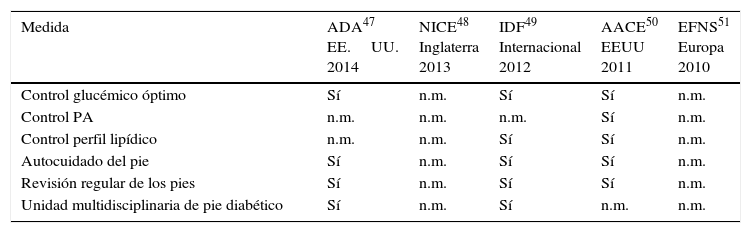
El manejo de la ND no siempre es sencillo, sobre todo teniendo en cuenta que muchas de las guías de práctica clínica en ocasiones presentan recomendaciones diferentes. En la tabla 4 se resumen las diferentes indicaciones según las últimas publicaciones de las principales guías.
Recomendaciones de las principales guías de práctica clínica
| Medida | ADA47 EE.UU. 2014 | NICE48 Inglaterra 2013 | IDF49 Internacional 2012 | AACE50 EEUU 2011 | EFNS51 Europa 2010 |
|---|---|---|---|---|---|
| Control glucémico óptimo | Sí | n.m. | Sí | Sí | n.m. |
| Control PA | n.m. | n.m. | n.m. | Sí | n.m. |
| Control perfil lipídico | n.m. | n.m. | Sí | Sí | n.m. |
| Autocuidado del pie | Sí | n.m. | Sí | Sí | n.m. |
| Revisión regular de los pies | Sí | n.m. | Sí | Sí | n.m. |
| Unidad multidisciplinaria de pie diabético | Sí | n.m. | Sí | n.m. | n.m. |
AACE: American Association of Clinical Endocrinologist; ADA: American Diabetes Association; EFNS: European Federation for Health and Clinical Excellence; EE.UU.: Estados Unidos; IFD: International Diabetes Federation; n.m.: no mencionado; PA: Presión arterial; NICE: National Institute for Health and Clinical Excellence.
La ND es una patología muy prevalente en los pacientes con DM y es una de las causas más frecuentes de lesiones y, por tanto, amputaciones en estos pacientes. Se debe realizar cribado en todos los sujetos con DM tipo 2 en el momento del diagnóstico y en DM tipo 1 a los 5 años del mismo.
El control glucémico estricto ha demostrado evitar el desarrollo de esta patología en pacientes con DM tipo 1 y retrasarla en DM tipo 2. El autocuidado del pie debe sustituir la pérdida del reflejo doloroso en estos pacientes.
En la actualidad se están investigando nuevos fármacos e intervenciones que ayuden a disminuir la prevalencia de ND en esta población, pero el control glucémico sigue siendo la única medida efectiva.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo está basado en la ponencia realizada el día 22 de abril de 2016 en la Mesa de la Sección de Medicina Vascular «Neuropatía diabética, ¿qué hacer antes de que sea demasiado tarde?», de la IX Reunión Nacional de la Sección de Pie Diabético, celebrada los días 21 y 22 de abril en Madrid.