Puntos clave
- •
El recién nacido pretérmino (RNP) debe ser vacunado de acuerdo con su edad cronológica, independientemente de su edad gestacional y su peso.
- •
Salvo en situaciones excepcionales de inestabilidad clínica, no se debe retrasar la edad de vacunación de la indicada en el calendario vacunal.
- •
Aunque existe un aumento de eventos adversos tras la vacunación, estos suelen ser leves y se atribuyen a la prematuridad y no a las vacunas.
- •
Los RNP presentan, en general, una buena respuesta a las vacunas con toxoide y vacunas inactivadas, pero respuestas variables y en ocasiones subóptimas a las vacunas polisacáridas conjugadas.
- •
Si bien la inmunogenicidad a las vacunas puede verse disminuida con respecto a los recién nacidos a término, sigue siendo adecuada y suficiente como para generar protección.
- •
Es necesario promover los programas de vacunación desde las unidades neonatales, realizando posteriormente un seguimiento estrecho para que todos los niños finalicen su calendario vacunal.
La supervivencia de los recién nacidos prematuros (RNP) es uno de los logros más importantes de la pediatría moderna gracias a los progresos en los cuidados pre y posnatales. La tasa de partos prematuros ha aumentado en las 2 últimas décadas en los países desarrollados (España: 7,4% de total de nacimientos)1.
Una de las causas más importantes de morbimortalidad son las infecciones, siendo algunas de ellas prevenibles mediante la administración de vacunas. Debido a que muchos de estos niños cumplen los 2 meses de edad estando hospitalizados, se considera fundamental la puesta en marcha de su programa de vacunaciones, indicándose su inicio en la propia unidad neonatal. Sin embargo, la evidencia científica es escasa y los estudios realizados en recién nacidos son limitados y presentan fallos metodológicos, errores y sesgos, por lo que en muchas ocasiones el uso de las vacunas y la respuesta a las mismas se fundamenta en extrapolaciones de adultos o niños mayores2.
Lectura rápida
El recién nacido prematuro (RNP) posee un sistema inmunitario inmaduro que le hace más susceptible a las infecciones y a que las respuestas a la vacunación sean menores a las esperadas.
La respuesta a las vacunas en los RNP es similar en términos de inmunogenicidad, seguridad y duración a largo plazo a la que se produce en recién nacidos a término (RNT).
La vacuna frente a la tos ferina de célula completa se asoció a una mayor reactogenicidad, por lo que ya no se utiliza. La respuesta frente a algunos componentes de las vacunas acelulares es similar a los RNT, mientras que frente a otros está algo disminuida, lo que mejora tras una dosis de recuerdo.
En general, la inmunogenicidad de los RNP frente a los toxoides diftérico y tetánico, la vacuna inactivada frente a la poliomielitis y la vacuna conjugada frente a meningococo C es satisfactoria y similar a los niños a término.
Se ha demostrado una menor producción de anticuerpos frente a Haemophilus influenzae tipo b en RNP, sin embargo, esta respuesta parece mejorar con el esquema de administración a los 2, 4 y 6 meses.
Los RNP de peso < 2.000g deberán recibir la vacuna frente a hepatitis B al mes de vida o antes del alta hospitalaria. Los > 2.000g seguirán el esquema de vacunación de los RNT. En caso de madre con HBsAg positivo o desconocido, deben recibir la vacuna junto con la inmunoglobulina específica antihepatitis B en las 12 primeras horas de vida, independientemente de su peso y edad gestacional. Posteriormente, recibirán 3 dosis más (4 dosis en total).
Las vacunas conjugadas frente a neumococo 7 y 10-valente, son seguras e inmunógenas en los RNP, aunque con menor efectividad para algunos de los serotipos. En la actualidad, no existen datos de inmunogenicidad en RNP para la vacuna 13-valente.
Los niños prematuros, especialmente los que presenten o hayan presentado enfermedad grave, respiratoria, cardíaca o neurológica, deben vacunarse contra la gripe una vez que cumplan los 6 meses, al llegar el otoño. La vacunación se repetirá anualmente.
No se debe administrar la vacuna contra el rotavirus ni la vacuna oral contra la poliomielitis mientras los niños se encuentren hospitalizados, puesto que se eliminan en las heces y existe riesgo de transmisión a otros pacientes.
Las vacunas de la triple vírica y la varicela, al administrarse habitualmente después del año de vida, cuando la respuesta inmunitaria del niño prematuro ya es prácticamente normal, no suponen un problema importante.
Las vacunas combinadas, y en concreto las vacunas hexavalentes, han demostrado ser seguras y eficaces, por lo que deben ser utilizadas para inmunizar a los RNP, pudiéndose administrar junto a las vacunas conjugadas frente a meningococo C o neumococo.
Además de la vacunación, se considera fundamental la protección indirecta de los lactantes mediante la vacunación a familiares y cuidadores («estrategia del nido») en afecciones como la gripe y la tos ferina.
A pesar de los avances en medicina perinatal, el manejo de los RNP aún sigue siendo un desafío, en especial el de los nacidos con < 28 semanas de gestación y < 1.000g de peso2. Uno de los factores que aumentan la morbimortalidad son las infecciones, tanto en su vertiente precoz o vertical como las tardías o de transmisión horizontal3.
Los niños prematuros se encuentran a menudo expuestos a procedimientos invasivos múltiples y a una ecología hospitalaria abundante en microorganismos agresivos y con frecuencia resistentes a antimicrobianos. Además, presentan un sistema inmunitario incompetente con respecto al de recién nacido a término (RNT), lo que conlleva una mayor susceptibilidad para las infecciones y un mayor riesgo de evolución grave4.
Todo recién nacido presenta inmadurez en el desarrollo tanto de su inmunidad innata como de la adquirida, así como de la integridad de las barreras cutáneo-mucosas5, siendo esta inmadurez mayor en el RNP que en los RNT6. A las 8 semanas de edad, los RNP tienen recuentos absolutos de linfocitos, células T, células B, linfocitos T colaboradores y una relación CD4/CD8 inferiores a los RNT7. Diversos estudios demuestran que la actividad de las células dendríticas y los monocitos de los RNP es menos eficaz a la hora de reconocer y procesar antígenos que la de los RNT6, y esta a su vez es menos eficaz que la de los lactantes de más edad. Además, la limitada gama de células T y los defectos funcionales y estructurales de las células B acentúan esta disfunción inmunitaria5,6.
Estos defectos de la inmunidad no son debidos a inmunodeficiencias propiamente dichas, sino a un estado de inmadurez del sistema inmunitario que se debe resolver de forma progresiva y variable a lo largo del tiempo (generalmente, los 2 primeros años de vida)4,7,8. La vacunación representa una de las mejores armas para superar estos defectos en los RNP, aunque debido a la disfunción del sistema inmunitario la respuesta a algunas vacunas puede ser subóptima5. No obstante, existen datos muy interesantes acerca de cómo la exposición prematura a los antígenos puede acelerar el desarrollo de receptores antigénicos de las células B. Esto significa que los RNP podrían alcanzar una gama de anticuerpos más amplia en el momento en que alcancen su edad «a término» en comparación con los RNT9, lo que proporciona un argumento teórico contra el retraso de la inmunización en RNP7.
Inmunogenicidad y protección a largo plazoEn general, las vacunas que se administran vía parenteral provocan una respuesta inmunitaria sistémica, mientras que las vacunas vivas atenuadas producen una respuesta inmunitaria inducida en las mucosas4. La mayoría de las vacunas generan una respuesta humoral mediante la producción de inmunoglobulinas (inicialmente IgM, que luego hacen un cambio de isotipo a IgG y aumentan su afinidad) y formación de células memoria. Todo este proceso está alterado en los RNP, lo que parece reducir la protección a corto y largo plazo tras la vacunación. También existen antígenos vacunales (como algunos componentes de la vacuna frente a tos ferina de célula completa) que generan una respuesta T independiente tipo I (Ti-I), en la que las células B proliferan de forma policlonal con producción de IgM, sin cambio de isotipo ni formación de células memoria, lo que ocurre de forma más importante en los RNP. Por último, algunas vacunas (p. ej., las que contienen virus vivos atenuados como la triple vírica o la varicela) actúan tanto sobre la inmunidad humoral como sobre la celular, que también está afectada. Sin embargo, estas vacunas suelen administrarse después del año de vida, cuando la respuesta inmunitaria del RNP es prácticamente normal, por lo que no suponen un problema importante6.
Los datos indican que los RNP presentan, en general, una buena respuesta a las vacunas con toxoide y vacunas inactivadas, pero respuestas variables y en ocasiones subóptimas a las vacunas polisacáridas conjugadas4,7. Esto último es debido a que las vacunas polisacáridas son dependientes de una respuesta inmunitaria T-independiente tipo II (Ti-II), en la que los antígenos Ti-II solo pueden activar a células B maduras, las cuales no existen hasta los 2–5 años de edad5. Existen ensayos clínicos con vacunas polisacáridas que demuestran que el uso de un calendario vacunal de múltiples dosis con adyuvantes y preparaciones conjugadas (con antígenos Ti-II) es generalmente eficaz en la protección de los lactantes prematuros5.
Además de las alteraciones en la inmunidad adaptativa, existen otros factores que pueden alterar aún más la respuesta a las vacunas, como son las infecciones, un estado nutricional deficiente o el tratamiento prolongado con corticoides para la displasia broncopulmonar10. Asimismo, los RNP presentan niveles más bajos de inmunoglobulinas (Ig) maternas que los RNT, ya que el paso de estas a través de la placenta se produce de forma más importante a partir de la semana 32 de gestación. Se ha demostrado que los anticuerpos maternos inhiben todas las respuestas vacunales, aunque los datos son a menudo contradictorios. Algunos de los mecanismos inhibitorios propuestos son neutralización de anticuerpos, defectos de fagocitosis de antígenos, formación de complejos de anticuerpos y enmascaramiento de epítopos por las Ig maternas, impidiendo la unión y activación de las células B del lactante5,7. Por todo ello, algunos autores indican que tener niveles más bajos de Ig maternas puede suponer una ventaja inmunológica en los RNP7.
A pesar de todo lo comentado anteriormente, la respuesta a los antígenos vacunales suele ser similar en intensidad y perdurabilidad a la de RNT de la misma edad cronológica. Varios trabajos demostraron que, si bien la inmunogenicidad a las vacunas puede verse disminuida, sigue siendo adecuada y suficiente como para generar protección11–14.
SeguridadLas reacciones adversas a las vacunas, tanto locales como sistémicas, son similares en los RNT y RNP, incluso con una menor reactogenicidad de estos últimos. Sin embargo, existe cierto miedo, por parte de algunos pediatras, a la administración de las primeras vacunas a niños prematuros a los 2 meses de edad cronológica. Este recelo tiene su origen en la publicación de algunos artículos que comunicaban eventos adversos graves (apneas, desaturaciones y bradicardias) en las primeras 24h tras la administración de las vacunas DTP y Hib, que conllevaban la necesidad de reanimación e incluso en algún caso intubación y ventilación mecánica de forma transitoria15. Estos eventos se relacionaron con el componente de tos ferina de célula completa y eran más frecuentes en pacientes de menor edad gestacional, que recibieron ventilación mecánica durante más tiempo y con diagnóstico de enfermedad pulmonar crónica16. No obstante, estudios más recientes realizados con la vacuna de tos ferina acelular demuestran que, aunque existe un aumento de eventos adversos en los niños de menor edad gestacional con respecto a los RNT, estos son leves, no suelen precisar modificaciones terapéuticas y se atribuyen a la prematuridad y no a las vacunas13. Un ensayo clínico aleatorizado y multicéntrico no encontró diferencias significativas en la aparición de apneas y bradicardias entre los RNP vacunados y no vacunados con DTPa a los 2 meses de vida17. Todo ello apoya la recomendación de vacunar a los RNP según su edad cronológica, si bien en los pacientes más prematuros o que hayan estado más inestables se recomienda la vacunación durante su hospitalización y estando monitorizados6.
Difteria, tétanos y tos ferinaLos RNP presentan un elevado riesgo de infección por Bordetella pertussis, con mayor morbimortalidad que los RNT, por lo que es muy importante que tengan una protección adecuada.
Las vacunas frente a la tos ferina pueden ser tanto de célula completa como acelulares, estas últimas con un número variable de componentes de Bordetella pertussis (los más frecuentes son toxina pertúsica, hemaglutinina filamentosa y pertactina). La respuesta a la vacuna de célula completa se consideró adecuada, aunque se le atribuyó un aumento de reactogenicidad, por lo que actualmente se utilizan las vacunas acelulares2. Estas vacunas estimulan tanto la inmunidad humoral como la celular. En cuanto a la producción de anticuerpos, la respuesta frente a hemaglutinina filamentosa y pertactina es similar a los RNT, mientras que frente a toxina pertúsica está algo disminuida en el RNP18. Sin embargo, tras una dosis de recuerdo a partir del año de vida, alcanzan niveles similares a los de los RNT, independientemente de su edad gestacional. También son capaces de producir interferón gamma e interleucinas 5 y 13, lo que refleja una adecuada respuesta inmunitaria celular frente a las primeras dosis de esta vacuna19.
Los toxoides tetánico y diftérico son antígenos Td que generan la producción de anticuerpos neutralizantes. Más del 98% de los RNP presentan una respuesta adecuada con producción de títulos de anticuerpos ≥ 0,1U/ml, sin diferencias significativas con respecto a los RNT20,21.
PoliomielitisLa vacuna contra la poliomielitis es una vacuna Td de virus enteros inactivados, que producen anticuerpos neutralizantes contra los poliovirus 1, 2 y 3. Se consideran protectores títulos de anticuerpos de 1:4 o 1:8. Varios estudios han demostrado que los RNP presentan una adecuada respuesta humoral, con generación de títulos protectores de anticuerpos tras 3 dosis de vacuna22,23. La respuesta celular de los niños prematuros se considera adecuada, con generación de células T memoria de forma similar a los RNT, aunque con algo menor linfoproliferación específica. En conjunto, la inmunogenicidad de la vacuna inactivada parece satisfactoria y similar a los RNT24. La vacuna oral no debe administrarse a niños ingresados en el hospital por el riesgo de transmisión a otros pacientes2.
Haemophilus influenzae tipo bLas vacunas conjugadas contra Haemophilus influenzae tipo b contienen polisacáridos capsulares de esta bacteria junto con transportadores proteicos (toxoide tetánico o diftérico, proteína CRM197 de Corynebacterium diphteriae, etc.). Los resultados en RNP han sido variables dependiendo del esquema de vacunación, el transportador proteico utilizado y la edad gestacional. En varios estudios se demuestra una menor producción de anticuerpos en RNP, alcanzando títulos protectores solo un pequeño porcentaje de pacientes25. Esta respuesta parece mejorar con la pauta de 2, 4 y 6 meses (en vez de 2, 3 y 4) y con el uso de la proteína CRM como transportador21. La efectividad también podría verse influida por la administración conjunta con las vacunas DTPa (competición antigénica con los antígenos de Bordetella pertussis)26 y poliovirus inactivado27. Los niños < 28 semanas de edad gestacional pueden quedar mal protegidos tras la primovacunación, por lo que podría ser necesaria una dosis entre la primovacunación y la dosis de recuerdo administrada a los 18 meses de vida2.
Hepatitis BLas vacunas frente a la hepatitis B que se utilizan en la actualidad son vacunas recombinadas, que contienen partículas de antígeno de superficie (HBsAg) purificado mediante técnicas de ADN recombinante. Diferentes estudios de inmunogenicidad indican que los RNP, en general, responden peor a esta vacuna que los RNT; sin embargo, esta respuesta mejora cuando son vacunados a partir de los 30 días de vida6. Recientemente, se ha demostrado que casi todos los RNP alcanzan títulos protectores de anticuerpos (anti-HBs > 10mU/ml) tras las 3 dosis recomendadas, independientemente de la edad gestacional y el peso al nacimiento28. No existe unanimidad en el esquema de vacunación de la hepatitis B, siendo válidas varias pautas siempre que se administren 3 dosis y la última no se administre antes de los 6 meses. Recomendaciones en niños prematuros (modificado de http://www.cdc.gov/hepatitis/HBV/PDFs/correctedtable4.pdf):
- 1.
Prematuros hijos de madre con HBsAg negativo:
- –
Peso < 2.000g: recibirán la primera dosis de vacuna al mes de vida o al alta hospitalaria, completando la pauta a los 2 y 6 meses.
- –
Peso > 2. 000g: seguirán la pauta de los RNT (válidas las opciones de 0–1–6 meses, 0–2–6 meses y 2–4–6 meses).
- –
- 2.
Prematuros hijos de madre con HBsAg positivo o desconocido:
- –
Deben recibir la vacuna junto con la inmunoglobulina específica antihepatitis B en las 12 primeras horas de vida, independientemente de su peso y edad gestacional. Posteriormente, recibirán 3 dosis más (4 dosis en total) con la pauta de 1–2–6 o la de 2–4–6 meses.
- –
Se trata de una vacuna conjugada compuesta por oligosacárido de meningococo C junto con toxoide tetánico o proteína CRM197 de Corynebacterium diphteriae como transportador. Las vacunas meningocócicas frente al serogrupo C se pueden administrar simultáneamente con otras vacunas. Al ser una vacuna conjugada, induce una respuesta dependiente del timo y la formación de memoria inmunológica.
En los estudios realizados, no existen diferencias clínicamente significativas en la respuesta a esta vacuna entre los RNP y RNT, independientemente de la edad gestacional y el tipo de vacuna. En un estudio sobre inmunogenicidad, se observó que tanto los lactantes prematuros (< 32 semanas de gestación) como los que nacieron a término que recibieron la vacuna conjugada con la proteína CRM 197 con un esquema de 3 dosis presentaban niveles de anticuerpos protectores (> 98%), siendo las diferencias no significativas. Aunque ambos grupos desarrollaban memoria inmunológica, las respuestas tendieron a ser menores en los RNP25.
Los estudios de efectividad de esta vacuna demostraron que la protección disminuía hacia los 6 meses, sobre todo en los RNP, lo que mejoraba tras una dosis de recuerdo29. Por ello, parece que la pauta más eficaz es la que se ajusta al calendario vacunal habitual, con administración de 2 dosis en los primeros 6 meses de vida y una dosis de recuerdo entre los 12 y 15 meses2.
NeumococoEn los RNP la incidencia de enfermedad neumocócica invasiva (ENI) es mucho mayor que en los RNT. Para su prevención, existen 2 tipos de vacunas antineumocócicas: las que contienen polisacáridos «puros» (VNP23), sin coadyuvante, poco inmunógenas por debajo de 2 años y que no producen memoria inmunológica (independientes del timo), y las conjugadas (VCN7, VCN10 y VCN13), que se componen de polisacáridos capsulares que se unen a proteínas transportadoras que producen una respuesta inmunitaria mayor e inducen memoria inmunológica (dependientes del timo).
El estudio Kaiser de EE. UU. demostró eficacia, inmunogenicidad y seguridad con la vacuna conjugada frente a neumococo heptavalente (VCN7) en niños prematuros y bajo peso2. Diversos estudios han demostrado una respuesta vacunal similar a la de RNT para la mayoría de antígenos, excepto para el 6B, 23F, 4 y 9V5,30. La vacuna VCN10 también ha demostrado ser bien tolerada e inmunogénica en RNP cuando se administra con una primovacunación de 3 dosis seguida de una dosis de refuerzo31. En la actualidad, no existen datos de inmunogenicidad en RNP para VCN13.
En los RNP, al igual que en el resto de los niños, se recomienda la vacunación antineumocócica con vacunas conjugadas para la prevención de la ENI2. Se debe administrar con un esquema vacunal similar al de los RNT10. La pauta de 3 dosis separadas 2 meses cada una parece más eficaz que la de 2, 3 y 4 meses, por persistir los niveles de anticuerpos protectores por más tiempo2.
Con respecto a la vacuna VNP23, la condición de prematuridad no es criterio determinante para administrarla, sino que debe asociarse algún otro factor de riesgo, como inmunodepresión o enfermedades subyacentes32.
Bacilo de Calmette-GuérinLa vacuna con bacilo de Calmette y Guérin no se aplica de forma sistemática en España desde hace más de 25 años. En zonas de alta incidencia de tuberculosis aún se considera una de las estrategias preventivas de esta enfermedad, en especial de las formas más graves en los primeros años de vida10. Tradicionalmente, esta vacuna ha estado contraindicada en los recién nacidos que no alcanzaban los 3.000g de peso porque se pensaba que la respuesta inmunitaria sería escasa o inexistente. Sin embargo, los datos sobre respuesta vacunal en RNP son contradictorios33–36. A efectos prácticos y a la vista de la escasa evidencia científica, se ha establecido que los RNP ≥ 32 semanas de edad gestacional pueden ser vacunados al nacimiento, mientras que en los < 32 semanas la vacunación no debe demorarse si el riesgo de exposición a la infección tuberculosa es alto; si el riesgo es pequeño o no existe, la vacunación se debe diferir a los 3–6 meses2,10.
GripeLa vacuna antigripal ha mostrado tasas de seroprotección elevadas, con un buen perfil de seguridad y tolerabilidad, incluso en niños muy prematuros2,37.
Los RNP presentan un riesgo incrementado de infección grave por el virus influenza38, sobre todo aquellos que presentan enfermedad pulmonar crónica u otras complicaciones asociadas a la prematuridad2. Diversos organismos internacionales recomiendan la vacunación de gripe de forma anual a todos los prematuros ≥ 6 meses que hayan tenido o tengan enfermedad pulmonar crónica, cardiológica, neurológica o nutricional10. Se debe administrar la vacuna antigripal inactivada trivalente del año en curso al inicio de la temporada de gripe. La primovacunación se realiza con 2 dosis de 0,25ml separadas por un intervalo de un mes la primera vez que se vacunen, mientras que en años sucesivos solo será necesaria una dosis anual2,7,39.
Debido a la falta de datos sobre seguridad e inmunogenicidad de la vacuna contra la gripe en RNT y en RNP menores de 6 meses, no se recomienda la vacunación en este grupo. Hasta entonces, los niños deben ser protegidos de forma indirecta vacunando a los convivientes, contactos y cuidadores («estrategia del nido»)7,10.
La vacuna de virus vivos adaptada al frío (no comercializada en Europa), de administración intranasal, está contraindicada en niños hasta que no se conozcan mejor datos sobre su inmunogenicidad y seguridad10.
RotavirusLa vacuna contra el rotavirus es una vacuna inactivada que se administra vía oral y que ha demostrado ser eficaz y segura en ensayos clínicos, aunque el número de RNP incluidos en estos estudios es pequeño2,38. En un ensayo clínico realizado en casi 1.000 niños se observó buena inmunogenicidad y seguridad con la vacuna en RNP entre las 27 y 36 semanas de gestación40. Aunque los datos aún son limitados en este grupo, se considera que los beneficios de la administración superan los posibles riesgos2,38 y se recomienda que los RNP que tengan al menos 6 semanas de edad y se encuentren clínicamente estables reciban la vacuna contra el rotavirus tras ser dados de alta del hospital, siguiendo las mismas pautas que en los RNT41,42. Los RNP que permanezcan ingresados no deben recibirla porque el rotavirus vacunal se elimina en las heces y existe riesgo de diseminación en la unidad neonatal2,38.
Vacunas combinadasEl uso de vacunas combinadas en el RNP es un consenso general, ya que aporta numerosas ventajas (disminución del número de pinchazos, optimización del programa de vacunación…), además de reducir la complejidad técnica para administrar numerosas inyecciones debida a la reducida superficie corporal y la menor masa muscular de los niños prematuros2,10.
La serie primaria de vacunación consiste en la aplicación de 3 dosis administradas durante los 6 primeros meses de vida (en general 2, 4 y 6 meses), con un intervalo de 2 meses entre dosis. Para asegurar una respuesta inmunitaria a largo plazo se debe administrar una dosis de recuerdo en el segundo año de vida, preferiblemente entre los 12–14 meses de edad2.
Existen pocos estudios realizados con vacunas combinadas en esta población, destacando el trabajo de Omeñaca y García-Sicilia13 en nuestro país, que demostraron que la vacuna combinada hexavalente (DTPa-VPI-Hib-HB) presenta una adecuada inmunogenicidad, eficacia y seguridad en RNP, muy similar a la del RNT. La respuesta vacunal fue muy buena, con tasas de seroprotección > 92% para todos los antígenos excepto para PRP (Hib) y hepatitis B. No se registraron más efectos secundarios que los esperables de la administración por separado de las vacunas ni acontecimientos desfavorables graves13,20. Posteriormente, se demostró que esta protección se mantenía a largo plazo tras dosis de recuerdo a los 18–24 meses y a los 4 años20,43.
La vacuna hexavalente se puede administrar en el mismo acto vacunal con la vacuna MenC o con la VNC7 (VCN10 o VCN13) porque, por el momento, no hay estudios que avalen la administración simultánea de los 3 preparados vacunales2.
Otras vacunas: triple víricaVacuna de virus atenuados de sarampión, rubéola y parotiditis. Los RNP vacunados con triple vírica a la edad de 15 meses presentan respuestas de anticuerpos similares a la de los RNT44. Cuando se administra a RNT antes de los 9 meses, las tasas de seroconversión son limitadas45; esto mismo se ha visto en RNP o lactantes en los que han desparecido los anticuerpos maternos, lo que indica que la respuesta depende fundamentalmente de la inmadurez inmunológica7.
Aunque hasta ahora no se han publicado estudios que evalúen la respuesta de la administración temprana de la triple vírica a RNP, esta podría recomendarse en RNP entre 6–9 meses con riesgo de exposición al sarampión7. Posteriormente, se deben aplicar 2 dosis después de los 12 meses para considerar completa la primovacunación2.
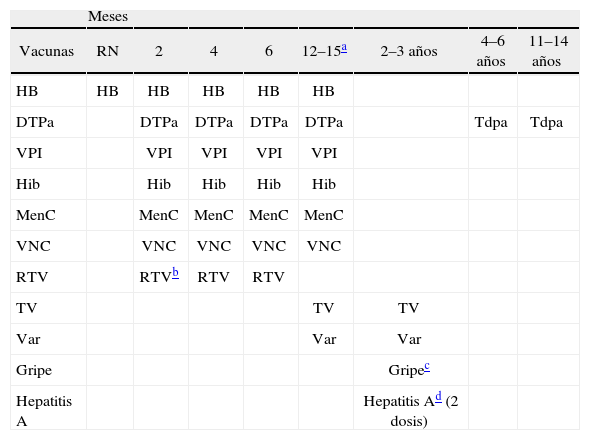
Consideraciones generales. Calendario vacunal en los recién nacidos pretérminoEs muy importante que se administren las vacunas del calendario según la edad cronológica del niño (independientemente su edad gestacional y de su peso al nacimiento), siempre que se encuentren clínicamente estables (en fase de crecimiento sostenido, sin necesidad de ventilación mecánica o tratamientos para infecciones graves o esteroideos, sin alteraciones metabólicas, renales, cardiovasculares o respiratorias significativas), incluso aunque no hayan sido dados de alta de la unidad neonatal2 (tabla 1). De hecho, iniciar la vacunación en el hospital podría mejorar la cobertura vacunal a largo plazo46.
Calendario de vacunación en recién nacidos pretérmino (edad cronológica).
| Meses | ||||||||
| Vacunas | RN | 2 | 4 | 6 | 12–15a | 2–3 años | 4–6 años | 11–14 años |
| HB | HB | HB | HB | HB | HB | |||
| DTPa | DTPa | DTPa | DTPa | DTPa | Tdpa | Tdpa | ||
| VPI | VPI | VPI | VPI | VPI | ||||
| Hib | Hib | Hib | Hib | Hib | ||||
| MenC | MenC | MenC | MenC | MenC | ||||
| VNC | VNC | VNC | VNC | VNC | ||||
| RTV | RTVb | RTV | RTV | |||||
| TV | TV | TV | ||||||
| Var | Var | Var | ||||||
| Gripe | Gripec | |||||||
| Hepatitis A | Hepatitis Ad (2 dosis) |
Destacado en color:vacuna hexavalente.
Es prioritario evitar retrasos en la vacunación del RNP para conseguir precozmente niveles de anticuerpos protectores suficientes y mantenidos en los primeros meses de vida que los protejan de las enfermedades inmunoprevenibles3. Además de la protección directa mediante la inmunización, se deben considerar otras estrategias de protección indirecta, como la vacunación de las madres durante el embarazo o el puerperio, del resto de convivientes del recién nacido («estrategia del nido»)2 y del personal sanitario al cuidado de estos pacientes.
Los autores declaran no tener ningún conflicto de intereses.