Puntos clave
- •
Los catarros son procesos infecciosos autolimitados producidos por un gran número de virus. No se conoce tratamiento eficaz contra los virus ni contra los mecanismos de invasión viral en los catarros.
- •
La terapéutica del catarro ha ¡do enfocada a su sintomatología, siendo la tos el síntoma más combatido pese a ser un mecanismo de defensa.
- •
Los efectos secundarios de los antitusígenos pueden ser graves, sobre todo en lactantes, y el uso abusivo de antitusígenos se han convertido en droga recreacional en niños y adolescentes.
- •
Los antitusígenos disponibles carecen de un balance riesgo/beneficio claramente justificado frente a placebo u otros productos no farmacológicos como la miel.
- •
Los antibióticos ni los preparados «naturales» no han demostrado ser de utilidad en el tratamiento del catarro ni de sus complicaciones en los niños.
- •
La educación sanitaria y las medidas de vigilancia y cuidados son actualmente la mejor recomendación que se puede dar a las familias en el tratamiento del catarro.
El catarro común o resfriado es una infección aguda, autolimitada, de la vía respiratoria superior que se acompaña de grados variables de fiebre, tos, estornudos, rinorrea, cefalea, malestar, dolor de garganta e inapetencia. Está causado por más de 200 virus, siendo el rinovirus, con más de 100 serotipos, el agente infeccioso responsable de la mitad de estos procesos. Es, sin duda alguna, una de las causas más frecuentes de consulta en Pediatría.
La terapéutica del catarro se ha orientado de manera preferente al tratamiento de sus síntomas y no de su causa. Los resultados clínicos obtenidos con la mayoría de los fármacos empleados han sido poco alentadores porque los tratamientos propuestos no han superado con claridad el balance riesgo/beneficio que cabría esperarse. Como dijo Osler hace más de un siglo, hoy en día podríamos decir también que la mejor manera de tratar el catarro es con desprecio.
Virus catarrales. Tratamiento antivíricoEn el hemisferio Norte, el catarro ocurre preferentemente en meses fríos. El rinovirus es el agente causal predominante en septiembre; en octubre y noviembre son más frecuentes las infecciones por virus parainfluenza; en los meses invernales los virus patógenos más habituales son virus respiratorio sincitial, coronavirus e influenza. En primavera se cierra el ciclo con un nuevo brote de rinovirus1.
El rinovirus afecta preferentemente a las células del epitelio de la rinofaringe y libera su ARN de forma intracelular. Este mecanismo de penetración viral y la apoptosis consiguiente de células epiteliales están regulados por el interferón, que minimiza la replicación viral. El tratamiento de la infección por rinovirus con interferón intranasal ha producido resultados desalentadores porque no ha sido capaz de revertir la cascada inflamatoria que produce la infección y la administración tópica de interferón ocasiona una sintomatología similar a la del proceso catarral. Por todo ello, no parece que esté justificado su empleo2.
AntitusígenosLa tos en un proceso catarral es, sin discusión alguna, un mecanismo de defensa para eliminar secreciones de la vía respiratoria. No obstante, el uso de antitusígenos y otros medicamentos anticatarrales es muy frecuente en nuestro medio. Según un estudio3 publicado recientemente sobre prescripción de medicamentos anticatarrales en Pediatría en el ámbito de la Comunidad Autónoma de Castilla y León, las tasas de prescripción, referidas a 100 personas/año, fueron de 20,7 para antitusígenos, 7,0 para simpaticomiméticos y 23,4 para mucolíticos, con tasas más altas en niños menores de 4 años.
En el siglo xviii se utilizó la quinina como medicamento antitusígeno y, posteriormente, la heroína y la morfina (comercializada hasta hace 100 años como tratamiento de la tos en niños y adultos). En 1827 se obtuvo la codeína, que más tarde se convertiría en el medicamento de referencia contra la tos, pero la importante dependencia farmacológica que causa su empleo creó la necesidad de sintetizar un fármaco antitusígeno sin estas limitaciones. Así, a mediados del siglo pasado, se obtuvo una molécula, el dextrometorfano, que pretendía tener las propiedades antitusígenas de la codeína pero no su dependencia. Sin duda, el dextrometorfano es el medicamento antitusígeno más utilizado en la población pediátrica4 en el mundo. Otro medicamento antitusígeno de amplio uso en España, según se desprende del trabajo de Cano et al., es la cloperastina3.
Lectura rápida
Los catarros son una de las infecciones más prevalentes en la edad pediátrica. Están ocasionadas por virus, siendo el rinovirus el más predominante.
No hay tratamiento antivírico ni actuación terapéutica sobre los mecanismos de invasión del virus (interferón) con evidencias suficientes para que se justifique cualquier tratamiento en este sentido.
La tos es uno de los síntomas más relevantes y constituye uno de los mayores motivos de demanda de medicación por parte de las familias.
Los antitusígenos que actualmente están en el mercado tienen más de 50 años de existencia y no está demostrado que su eficacia terapéutica justifique sus riesgos, especialmente en niños pequeños.
Los mucolíticos, los expectorantes, los antihistamínicos y otros preparados farmacológicos tampoco han demostrado eficacia terapéutica en Pediatría.
Antitusígenos, mucolíticos, expectorantes y antihistamínicos, solos o en combinación, poseen riesgos potenciales de intoxicación y algunos de adicción.
La venta libre de antitusígenos y otros preparados anticatarrales suponen un riesgo innecesario de iatrogenia, especialmente en lactantes.
Son varios los países que han establecido una reglamentación para limitar la venta de preparados antitusígenos y anticatarrales en niños.
Los productos basados en plantas y otros productos naturales, así como la homeopatía, no han demostrado ser eficaces y no se recomienda en niños para el tratamiento del catarro.
No hay suficientes estudios que avalen los vahos como parte del tratamiento de los catarros. Sí es necesaria una buena hidratación y eliminar las secreciones nasales con suero fisiológico o soluciones salinas isotónicas.
No están justificados los antibióticos como medida de prevención de complicaciones bacterianas.
Los analgésicos-antitérmicos deben utilizarse únicamente para tratamiento del dolor y malestar y no de la fiebre. Tampoco está justificado el uso de corticoides tópicos.
La codeína es uno de los antitusígenos más usados, sola o en combinación con otros medicamentos anticatarrales. Su vida media en plasma es de 2–4h y un 10% se metaboliza en morfina. Los lactantes presentan mayor susceptibilidad a la intoxicación por codeína por inmadurez del sistema de glucuronidación hepático. Además, se ha observado que existen diferentes genotipos de metabolización de la codeína en morfina pudiendo dar lugar a resultados fatales en los metabolizadores rápidos del citocromo P4502D6 (CYP2D6)5,6. Las reacciones adversas de la codeína consisten en náuseas, vómitos, estreñimiento, palpitaciones y mareos. En casos de intoxicación, la codeína puede ocasionar parada respiratoria.
La eficacia de la codeína como antitusígeno viene siendo cuestionada desde hace años7,8. Ya en 1997 la Academia Academia Americana de Pediatría se pronunció en el sentido de que la codeína se podría considerar como un medicamento contraindicado y peligroso en muchos procesos respiratorios, incluido el catarro de vías altas9. En 2010 la agencia británica del medicamento, MHRA, sobre la base de la ausencia de pruebas concluyentes que apoyaran la eficacia de la codeína como antitusígeno en niños, su toxicidad y el riesgo de abuso y dependencia en adolescentes, indicó la supresión de la comercialización de todos los jarabes que contienen codeína para menores de 18 años10.
DextrometorfanoEl dextrometorfano está relacionado estruc-turalmente con la codeína pero carece de efecto analgésico. Su efecto antitusígeno es más prolongado que el de la codeína y dura unas 6h. A dosis habituales, su toxicidad es baja pero a dosis altas puede tener un efecto disociativo similar a la ketamina y por este motivo se ha convertido en un fármaco de uso recreacional frecuente en niños y adolescentes en Estados Unidos11 y en otros países. Su eficacia antitusígena y el beneficio subjetivo de mejora del sueño de los niños y de las familias de niños tosedores no parecen que sean superiores a la miel o al placebo12,13.
CloperastinaLa cloperastina es un antitusígeno de prescripción frecuente entre los pediatras españoles3 pese a que apenas se han publicado estudios de su eficacia en sus más de 50 años de vida. La cloperastina tiene un efecto dual, depresor del centro de la tos y antihistamínico14. Debido a la precariedad de estudios sobre este fármaco, no pueden extraerse conclusiones sobre su eficacia.
Otros antitusígenosLa levodropropizina es un antitusígeno no opiáceo que parece actuar sobre receptores del tracto respiratorio pero que posee pocos estudios clínicos en niños, la mayoría de ellos realizados en el mismo entorno geográfico15 con manifiesto conflicto de intereses.
La noscapina es un antitusígeno opiáceo también conocido desde hace muchos años. Carece de estudios que evalúen su eficacia y seguridad en niños.
Eficacia, seguridad y regulación de los antitusígenos y anticatarralesPese a que se lleva más de medio siglo utilizando estos medicamentos como tratamiento de la tos, no se ha conseguido demostrar su eficacia. Son numerosas las publicaciones que demuestran que la mejoría es explicada por el curso natural de las infecciones respiratorias y por la sensación subjetiva de mejoría que refieren los padres, explicada muchas veces por el efecto placebo16,17. Este efecto placebo, desencadenado también por sustancias azucaradas18, puede estar relacionado con la generación de neurotransmisores centrales, como los opioides endógenos.
Hace una década ya se advirtió de la ineficacia de los medicamentos de venta libre (OTC), incluidos los antitusígenos, en el tratamiento de la tos en el contexto de las infecciones respiratoria de vías altas19. Posteriormente, han sido otros estudios en los que la comparación de los efectos antitusígenos del dextrometorfano frente a la miel concluyeran que no existen razones favorables a la administración de este antitusígeno.
En una reciente Revisión Cochrane20 se comparó la eficacia de los medicamentos antitusígenos OTC con el placebo en el contexto de infecciones respiratorias de vías altas en ámbito ambulatorio para adultos y niños. Se incluyeron 26 ensayos clínicos aleatorizados, (18 en adultos y 8 en niños), con una muestra de 616 niños. En lo referente a estudios pediátricos, 2 estudios de antitusígenos aislados y otro de antitusígenos asociados a broncodilatadores no encontraron mejores resultados comparados con el placebo. Un ensayo clínico que valoraba 2 jarabes antitusígenos mostraba una «respuesta satisfactoria» en el 46 y el 56% de los niños comparando con el 21% en los niños que recibieron placebo. Los autores de la revisión concluyen que no existe evidencia ni a favor ni en contra de los medicamentos OTC en la tos aguda y que estos resultados deben ser valorados con cautela debido a las características de los estudios y a la calidad de ellos, sin olvidar conflictos de intereses. Esta revisión concluyó que eran necesarios nuevos estudios y de mayor calidad metodológica para establecer criterios fiables sobre la indicación de estos antitusígenos OTC.
Tampoco se ha visto que el uso de antitusígenos OTC cause mejoría en niños y adultos con neumonía21, aunque sí se recomienda expresamente no emplear codeína ni antihistamínicos debido a sus efectos deletéreos.
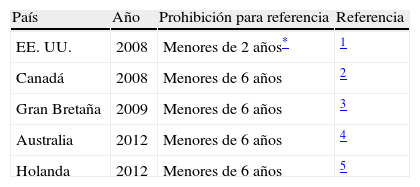
Además de la ineficacia de los antitusígenos y anticatarrales, se sabe que estos productos no están exentos de riesgo y en ocasiones con consecuencia fatales22,23. Por tanto, la necesidad de regulación de estos productos parecía necesaria24 por la falta de eficacia, por los riesgos potenciales para la salud y por la ausencia de estudios farmacológicos en niños. Las dosis pediátricas de estos fármacos se habían estimado en función de las dosis de adultos. En 2007, la Food and Drug Administration (FDA) había comunicado 123 fallecimientos en menores de 6 años en las últimas décadas como consecuencia del empleo de medicamentos antitusígenos y anticatarrales25. La FDA, en 2008, prohibió el uso de estos productos para menores de 2 años26. Posteriormente, esta limitación se ha hecho extensiva a los menores de 4 años. Esta prohibición de venta de medicamentos anticatarrales y antitusígenos de libre disposición se ha extendido para los niños menores de 6 años en muchos países como Reino Unido, Canadá, Australia y Holanda, entre otros (tabla 1).
Regulación de venta de medicamentos anticatarrales y antitusígenos OTC en niños
| País | Año | Prohibición para referencia | Referencia |
| EE. UU. | 2008 | Menores de 2 años* | 1 |
| Canadá | 2008 | Menores de 6 años | 2 |
| Gran Bretaña | 2009 | Menores de 6 años | 3 |
| Australia | 2012 | Menores de 6 años | 4 |
| Holanda | 2012 | Menores de 6 años | 5 |
OTC: medicamentos de venta libre.
US Food and Drug Administration. Using over-the-counter cough and cold products in children. Silver Spring, MD; US Food and Drug Administration; 2008. Disponible en: www.fda.gov/ForConsumers/ConsumerUpdates/ucm048515.htm.
Health Canada. Cough and cold medicines for children. Ottawa, ONHealth Canada. 2008. Disponible en: www.hc-sc.gc.ca/ahcasc/media/advisoriesavis/_2008/2008_184info1-eng.php
Medicines and Healthcare products Regulatory Agency (MHRA).Disponible en: http://www.mhra.gov.uk/ Safetyinformation/Safetywarningsalertsandrecalls/Safetywarningsandmessagesformedicines/CON038908
La regulación sobre el uso de anticatarrales y antitusígenos en Estados Unidos ha tenido repercusiones en forma de una reducción sustancial del número de intoxicaciones y efectos adversos en niños27. Estos productos antitusígenos y anticatarrales OTC son frecuentemente objeto de errores en su administración a niños por parte de familiares y cuidadores que, asociados a la impresión de su inocuidad por su fácil accesibilidad y al uso consagrado por varias generaciones, además de la proclividad a la reiteración de su uso por la ineficacia en la erradicación de los síntomas, hacen que sean frecuentes las consultas a urgencias como consecuencia de efectos adversos e intoxicaciones, en ocasiones con consecuencias fatales.
Antitusígenos tópicos. Preparados terpénicosLos preparados terpénicos (alcanfor, cineol, citral, eucalipto, mentol, niaouli, pino, ter-pineol, terpina, tomillo, trementina) se usan desde hace más de un siglo como productos antitusígenos y anticatarrales. Recientemente, se ha publicado que preparados terpénicos tópicos disminuyen la tos y facilitan el sueño28. Estas conclusiones se han cuestionado por ser un estudio no cegado, con errores metodológicos y con manifiesto conflicto de intereses. Estos productos se emplean en ocasiones en localizaciones caprichosas, como las plantas de los pies y en otros en la cara y pecho de los niños, ocasionando problemas de irritación local en muchos niños. Además, hay que considerar el riesgo potencial de estos productos, entre ellos la provocación de convulsiones y otros problemas neurológicos, no solo por vía tópica sino también por otras vías de administración29.
En España, durante muchos años se han utilizado preparados terpénicos por vía rectal para el tratamiento de la tos. Según la Agencia Europea del Medicamento, los supositorios que contienen derivados terpénicos no deberían usarse en niños menores de 30 meses o en niños con antecedentes de epilepsia o convulsión febril30, tal y como lo ha recogido la Agencia Española del Medicamento.
Mucolíticos y expectorantesLos mucolíticos son medicamentos que supuestamente rompen el moco, haciendo que las secreciones sean más fluidas y, por tanto, más fácilmente eliminables por la tos. En Europa es la n-acetilcisteína el mucolítico más empleado por su eficacia in vitro para romper puentes disulfuro y fluidificar el moco. Esta eficacia no está suficientemente probada31. Por el contrario, se ha observado en lactantes un efecto paradójico con riesgo de broncorrea, broncoespasmo, prolongación de la tos y disfunción respiratoria32, que ha ocasionado que Francia e Italia no autoricen su uso en niños menores de 2 años.
Los expectorantes se prescriben con el propósito de transformar una tos seca en una tos productiva. Su mecanismo de acción es mediante estimulación indirecta del nervio vagal y de las glándulas bronquiales productoras de moco. Estos productos, como la guaifenesina, la ipecacuana y el cloruro amónico, pueden causar náuseas y vómitos. La guaifenesina es el expectorante más empleado en Estados Unidos, pero carece de estudios clínicos controlados que avalen su eficacia en niños.
AntihistamínicosSe suelen añadir a preparados anticatarrales como antitusígenos y como anticongestivos nasales, en ocasiones también asociado a analgésicos. Según una Revisión Cochrane, la eficacia de estos preparados no está establecida para niños pequeños y pueden ser de alguna utilidad en niños mayores y adultos33. Cuando los antihistamínicos se usaron como monoterapia no se encontró mejoría ni en niños ni en adultos, observándose menor rinorrea por sus propiedades anticolinérgicas, pero mayor somnolencia34. Entre los efectos adversos de los anticolinérgicos se encuentran: sedación, excitabilidad paradójica, depresión respiratoria y alucinaciones. No están recomendados en menores de 6 años y es de dudosa indicación en menores de 12 años.
Productos naturales. Miel y fitoterapiaSon innumerables los remedios para los catarros obtenidos de plantas y otros productos naturales mediatizados por la situación geográfica y la cultura, pero muchos de ellos sin eficacia demostrada y no exentos de riesgos.
MielLa miel ha sido uno de los productos más usados desde antiguo para el tratamiento de la tos. Se sabe que los productos dulces disminuyen la sensación de molestia de la tos y contribuyen al efecto placebo. Además, se le atribuye efectos antioxidantes y posible acción antimicrobiana mediante liberación de citocinas. La eficacia de la miel como antitusígeno en niños ha sido avalada frente al no tratamiento o al placebo12,35,36.
La miel es muy bien tolerada y tiene un excelente perfil de seguridad siempre que esté pasteurizada y se administre a niños mayores de un año para evitar el riesgo de botulismo37.
AjoEl ajo, supuestamente con efectos antimicrobianos y antivirales, no ha demostrado ser eficaz en los procesos catarrales38.
EquináceaA la Echinacea purpurea se le atribuyen propiedades de estimulación del sistema inmunitario y por este mecanismo se supone que disminuye la intensidad y la duración de los procesos catarrales. Aunque se ha comunicado una posible eficacia en adultos39,40, no se han comunicado estos resultados en niños. Por el contrario, en un estudio pediátrico no se encontró ninguna diferencia en cuanto a la duración e intensidad del catarro en comparación con el placebo 41. Una revisión sistemática estableció que no había evidencias de que el tratamiento con Echinacea purpurea fuera útil en los procesos catarrales y, además, recomendó que se evitara en los alérgicos a gramíneas y en aquellas personas que estuvieran en tratamiento con corticoides42.
Otros productos fitoterápicos como el ginseng no han demostrado eficacia alguna en la evolución de los síntomas catarrales.
Otros preparadosProbióticosNo hay estudios sobre la eficacia de los probióticos en el tratamiento del catarro. Se ha comunicado la eficacia de estos productos en la reducción de los síntomas catarrales cuando se establece un consumo previo durante 6 meses43. No existen razones para indicar estos preparados con este propósito.
CincDesde hace 30 años se viene utilizando el cinc en el tratamiento del catarro, sin saber exactamente cuál es su mecanismo de acción. Se piensa que el cinc pudiera inhibir la adhesión de los rinovirus al epitelio y de esta manera limitar su replicación.
Un metanálisis reciente44 establece acortamiento de los síntomas del catarro en población adulta, especialmente con formulaciones orales de acetato de cinc, pero sin que este beneficio se pueda establecer para población infantil. En términos similares lo hace una Revisión Cochrane, siempre que el tratamiento se inicie en las primeras 24h de inicio del catarro y en población sana, aunque reconoce la dificultad de establecer recomendaciones sobre las formulaciones de cinc y la duración del tratamiento45.
Hidratación. Aire húmedoEl consumo de líquidos se considera un pilar en el tratamiento del catarro en niños. Se entiende que una buena hidratación facilitará el ablandamiento de las secreciones respiratorias y la eliminación de las mismas mediante la tos y el estornudo.
Con frecuencia se recurre a los vahos, tanto con agua fría o caliente, para que el contacto de las secreciones con el vapor de agua facilite su fluidificación. Una Revisión Cochrane no encontró argumentos para hacer esta recomendación46. Sin duda, uno de los mayores inconvenientes que tiene este procedimiento es el riesgo de quemaduras por contacto del niño con agua caliente. Está totalmente desaconsejado exponer al niño a la proximidad con agua caliente.
Los lavados nasales y la aspiración de mocos de las fosas nasales con sistemas apropiados de succión facilitan la permeabilidad de la vía aérea nasal y la ventilación de la misma. El uso frecuente de dispositivos de instilación y aspiración pueden producir inflamación local y ocasionar un efecto inconveniente.
No hay estudios que demuestren que preparados con agua marina posean beneficios sobre preparaciones de suero fisiológico o agua con sal al 0,9% para instilación nasal.
HomeopatíaLa homeopatía se basa en 2 principios acien-tíficos como son el principio de similitud, lo igual cura lo igual, y el de dilución infinitesimal, cuanto más se diluye un soluto (hasta que virtualmente desaparece de la solución) más potencia curativa tiene. En una revisión de la Sociedad Canadiense de Pediatría47 sobre homeopatía de 2005 se hace referencia a una publicación de 1994 donde no se encontró beneficio alguno de la homeopatía en el catarro de vías altas.
Siguiendo el principio de similitud homeopático y considerando que el contacto del jugo de la cebolla con la vía respiratoria alta remeda los síntomas catarrales, todavía es frecuente la colocación de una cebolla en la proximidad del niño con catarro como remedio casero para el tratamiento de la tos nocturna. Esta práctica tan extendida no ha demostrado ninguna eficacia pero tampoco se conocen riesgos.
Analgesia. Antitermia. AntiinflamaciónEl dolor y la fiebre pueden acompañar al cuadro catarral. La fiebre es un mecanismo del sistema inmunitario para combatir más adecuadamente las infecciones, incluidas las víricas. Existen motivos para pensar que la fiebre en sí misma puede reducir el tiempo de evolución de procesos virales. Por este motivo, y siguiendo la Guía de Práctica Clínica NICE48, no habría que utilizar antitérmicos-analgésicos como tratamiento sintomático de la fiebre. Solo se recurriría al paracetamol o al ibuprofeno como analgésicos ante el dolor o malestar. El uso alternante de estos preparados está desaconsejado porque no mejora sustancialmente la analgesia y existe un riesgo mayor de intoxicación por estos fármacos.
El uso de medios físicos para bajar la temperatura como friegas con alcohol o baños en agua tibia o fría también se desaconseja porque no ocasionan más que un descenso breve de la temperatura y una pérdida de calor que exigirá más gasto energético para que el niño alcance el punto de equilibrio térmico que le exige su centro termorregulador hipotalámico.
En algunos casos se ha empleado tratamiento antiinflamatorio local mediante el empleo de corticoides tópicos pero son escasos los trabajos publicados como para establecer que esta modalidad de tratamiento tenga suficiente evidencia que la justifique49.
Consideraciones finalesLa falta de evidencia para el tratamiento etiológico de los catarros con fármacos antivirales o con productos moduladores de la respuesta inmunitaria (interferón tópico), asociada a la limitada o escasa eficacia de los fármacos antitusígenos para inhibir un mecanismo natural de defensa del aparato respiratorio y a los riesgos potenciales asociados que conllevan su uso, y la no probada eficacia de antihistamínicos, expectorantes y mucolíticos en niños y sus riesgos potenciales, sobre todo en lactantes, hacen que el tratamiento de los catarros en niños se vea, hoy por hoy, privado de tratamiento farmacológico eficaz. Tampoco está justificado el empleo de antibióticos como medida preventiva de sobreinfecciones bacterianas.
Las bases del tratamiento del catarro en Pediatría se basan en mantener una buen estado de hidratación mediante la ingesta de líquidos (preferentemente, zumos de frutas y otros productos con hidratos de carbono para aportar vitamina C y calorías), lavados nasales con suero fisiológico y aspiración de secreciones nasales. Aunque los vahos no han demostrado ser de utilidad comprobada y atendiendo a las recomendaciones de la mayoría de los artículos y guías de tratamiento del catarro, parece conveniente emplearlos siempre que se tenga la seguridad de evitar totalmente riesgos de escaldadura.
La miel ha demostrado ser un producto que no quita la tos pero produce una sensación subjetiva de mejoría que facilita el sueño de los niños acatarrados y sus familias. Otros productos promocionados como «naturales» (ajo, equinácea, ginseng, remedios herbales, cinc u homeopatía) no están justificados en el tratamiento del catarro.
Probablemente, el tratamiento más eficaz del catarro infantil es la educación sanitaria para familias y cuidadores, empoderándolos con información que ayude al manejo de estos tan frecuentes procesos respiratorios, sabiendo reconocer cuales son los signos y síntomas que indican gravedad del proceso respiratorio y, por consiguiente, la necesidad de acudir a un pediatra50.
En el siglo xxi podemos decir que sigue en pie el aforismo de Osler sobre el tratamiento con desprecio de los catarros pero con un adecuado soporte de educación sanitaria y evitando la iatrogenia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.