Puntos clave
Alrededor de un 1% de los recién nacidos presentan hemorragias, si bien sólo la mitad de éstas son de importancia clínica. Su frecuencia es más elevada en las unidades de cuidados intensivos neonatales donde pueden alcanzar prevalencias del 10-20% ya que, como veremos, este tipo de enfermedad es más frecuente en pacientes enfermos o recién nacidos prematuros. El mecanismo hemostásico del neonato es diferente al del niño mayor y al del adulto. Por ello es necesario tener un conocimiento general de éste y del manejo específico de los trastornos hemorrágicos en el recién nacido que nos permita un adecuado diagnóstico y tratamiento en estos pacientes1.
Hemostasia en el recién nacidoLa hemostasia es un sistema dinámico dependiente de la edad. Los factores de la coagulación no son capaces de atravesar la barrera placentaria y se sintetizan fundamentalmente durante las primeras fases del período fetal1. Hacia la semana 20 de gestación, la gran mayoría de los factores de coagulación del feto son ya similares en cantidad y características a los del recién nacido a término2.
Al nacimiento la concentración de factores de la coagulación dependientes de la vitamina K (factores II, VII, IX, X), factores de contacto (XI, XII), proteínas C y S, y plasminógeno alcanzan el 50% de los valores normales en edad adulta. Estos valores son aún más reducidos en el recién nacido pretérmino3,4. Los factores V, VIII, XIII y el fibrinógeno presentan, sin embargo, valores similares a los del adulto. Por otro lado, los valores de factor inhibidor del plasminógeno y del factor activador tisular del plasminógeno están incrementados, lo que explica la menor actividad del plasminógeno en los recién nacidos5. Las plaquetas están presentes en un número similar al adulto aunque son menos reactivas a los altos valores de factor de Von Willebrand (FVW) presentes. Todos estos factores alcanzarán valores similares a los del adulto hacia el sexto mes de vida6. Un primer punto importante cuando se valora a un recién nacido con un trastorno hemorrágico es, por lo tanto, tener en todo momento en cuenta esta diferencia cuantitativa y cualitativa de varios componentes de la coagulación con respecto a los valores de adultos. Existen distintas tablas publicadas sobre valores de referencia de los diferentes componentes de la coagulación en función de la edad gestacional y los días de vida del recién nacido1,2,5.
A pesar de estas sorprendentes diferencias hoy sabemos que la coagulación es igual e incluso en algunas situaciones más rápida en el recién nacido que la que se desarrolla en adultos7, todo ello consecuencia de un sistema finamente equilibrado. Los fenómenos hemorrágicos son así poco frecuentes en el recién nacido a término sano8. Hay, sin embargo, una serie de factores perinatales y neonatales inmediatos que van a poder romper este delicado equilibrio, que aumentan el riesgo de aparición de trastornos hemorrágicos en los pacientes.
Lectura rápida
La hemostasia es un sistema dinámico dependiente de la edad con unas peculiaridades tanto cuantitativas como cualitativas en el período neonatal respecto al niño mayor y al adulto. A pesar de ello la coagulación del recién nacido sano es sumamente eficaz y los trastornos hemorrágicos y trombóticos son poco frecuentes.
La trombocitopenia es la causa más frecuente de sangrado en el neonato, sin embargo su etiología y tratamiento se desarrollan en otro artículo de este mismo número (p. 55-63). A continuación se describen brevemente otras causas de sangrado en el recién nacido (tabla 1) que se dividen en hereditarias y adquiridas.
Causas de hemorragia neonatal
| Hereditarias |
|---|
| Recesivas ligadas al cromosoma X |
| Hemofilia A: déficit de factor VIII |
| Hemofilia B: déficit de factor IX |
| Autosómicas dominantes |
| Enfermedad de Von Willebrand tipos 1 y 2 |
| Desfibrinogenemia |
| Autosómicas recesivas |
| Déficit de factores V, VII, X, XII y XIII |
| Déficit de factores I y II |
| Déficit de factor XI |
| Enfermedad de von Willebrand tipo 3 |
| Trombastenia de Glanzmann, otras trombopenias hereditarias* |
| Adquiridas |
|---|
| Déficit de vitamina K |
| Coagulación intravascular diseminada |
| Hepatopatías |
| Problemas vasculares |
| Traumatismo obstétrico |
| ECMO |
| Déficit de α2-antiplasmina |
| Trombopenias adquiridas inmunes/no inmunes* |
| Trastornos cualitativos de plaquetas* |
Véase el artículo de Corniero-Alonso y Pertierra-Cortada en este mismo número (p. 55-63).
ECMO: oxigenación por membrana extracorpórea.
Representan la etiología más frecuente de sangrado en el recién nacido. Se suelen relacionar con el consumo de factores de coagulación o plaquetas en el contexto de sepsis o coagulación intravascular diseminada (CID). A continuación se detallan algunas de estas causas.
Déficit de vitamina K3Con este nombre se conocen las hemorragias que ocurren en el recién nacido como consecuencia del déficit de vitamina K. La mencionada vitamina está presente en las plantas como la filoquinona y también es producida por las bacterias intestinales como la menaquinona9,10. El déficit de vitamina K puede presentarse hasta los 6 meses de vida, de ahí que la anterior nomenclatura de “enfermedad hemorrágica del recién nacido” haya caído en desuso11. Como señalábamos anteriormente los factores dependientes de la vitamina K y las proteínas C y S se encuentran disminuidos en este período de la infancia, y además son funcionalmente inactivos en ausencia de ésta. En función de la edad de presentación, esta entidad se clasifica en precoz (≤ 24h de vida), clásica (≥ 24h-7 días de vida) y tardía (> 2 semanas de vida)12. La forma precoz se debe al consumo por parte de la madre durante el embarazo de fármacos que interfieren en el metabolismo y depósito de la vitamina K, como los antiepilépticos (fenobarbital o difenilhidantoína), anticoagulantes (warfarina o dicumarol), tuberculostáticos (isoniacida o rifampicina) o salicilatos. La forma clásica tiene una incidencia de entre el 0,25-1,7% de los recién nacidos que no han recibido profilaxis con vitamina K, y está asociada a la lactancia materna exclusiva y malabsorción por retraso en la colonización bacteriana intestinal. Se manifiesta como sangrado gastrointestinal, hemorragia intracraneal o hematomas. La presentación tardía tiene una incidencia de 4 a 10 por 100.000 recién nacidos vivos y está asociada a la ausencia de profilaxis correcta con vitamina K unida a malabsorción intestinal producida por procesos como diarrea o cuadros de colestasis. Su manifestación principal suele ser la hemorragia intracraneal.
En cuanto a las pruebas diagnósticas, debemos sospechar esa entidad cuando en la analítica inicial se encuentre un tiempo de protrombina (TP) y tromboplastina alargado con un fibrinógeno y cifras de plaquetas normales. El diagnóstico de certeza lo obtenemos con la detección disminuida de los factores dependientes de la vitamina K. Ante la sospecha diagnóstica se debe administrar 1mg de vitamina K por vía parenteral sin esperar la confirmación diagnóstica6. Es eficaz entre las 2 y 4h siguientes a su administración y tiene una duración de 24h. En el pretérmino, o si existe hemorragia activa, puede se necesario el uso concomitante de plasma fresco congelado a 15ml/kg por vía intravenosa.
La profilaxis de esta entidad sigue siendo controvertida en cuanto a dosis y método óptimo de administración. Hoy en día no hay ninguna duda de que todos los recién nacidos necesitan vitamina K. La aplicación de 1mg de vitamina K por vía intramuscular al nacimiento previene tanto la forma clásica como tardía de la enfermedad. Según la American Academy of Pediatrics debemos ajustar esta dosis a 0,3mg en < 1.000g y a 0,5mg en recién nacidos prematuros entre 1.000 y 1.500 g13. La administración oral de 1mg de vitamina K al nacimiento previene también frente a la forma clásica del déficit aunque no frente a la forma tardía. De ahí que en niños con lactancia materna exclusiva esta dosis oral deba continuarse mediante la suministración semanal de 1mg hasta las 12 semanas de vida o administrando 2mg las semanas 1 y 4 de vida10. La revisión Cochrane del año 2000 sobre la profilaxis con vitamina K concluye que tanto la administración oral como la intramuscular de vitamina K mejora los parámetros de coagulación. Sin embargo, ninguno de los dos regímenes se ha investigado en ensayos clínicos aleatorizados para evaluar su eficacia en la prevención del déficit tardío de vitamina K. Serían necesarios ensayos de este tipo comparando la administración intramuscular con dosis repetidas orales para dilucidar la mejor estrategia preventiva a seguir14.
Lectura rápida
Las causas adquiridas son la etiología más frecuente de los trastornos hemorrágicos en el recién nacido, entre las que destaca la infección. Entre las causas hereditarias, la hemofilia es el trastorno que más frecuentemente se manifiesta como hemorragia en el período neonatal.
El déficit de vitamina K era una causa frecuente de hemorragia hasta la universalización de la profilaxis neonatal. Hoy sabemos que la administración de vitamina K al nacimiento previene tanto la forma clásica como la tardía de la enfermedad, aunque existe controversia sobre la vía de administración más adecuada (una dosis única intramuscular o varias dosis repetidas por vía oral).
La CID es un proceso fisiopatológico adquirido en el que coexisten la activación y la desregulación de los sistemas de coagulación y fibrinolítico. Es una situación grave que provoca la formación de trombina con depósitos de fibrina, consumo de factores de coagulación y plaquetas, todo ello asociado a un fallo multiorgánico.
Las manifestaciones clínicas son extremadamente variables, y debe ser sospechada en pacientes enfermos con o sin clínica hemorrágica que presentan entre los datos de laboratorio plaquetopenia, alargamiento de los tiempos de protrombina y tromboplastina, déficit de fibrinógeno y aumento del dímero D además de fragmentación eritrocitaria en el frotis de sangre periférica. Inicialmente, sin embargo, la coagulación puede estar mínimamente alterada.
Respecto al manejo, es fundamental el tratamiento del desencadenante de la CID tratando la hipoxia, sepsis o acidosis y proporcionando un soporte hemodinámico. A pesar de que no existe evidencia de que la transfusión de hemoderivados mejore la CID el manejo agudo del recién nacido en esta situación intenta facilitar una adecuada hemostasia para limitar el sangrado. De esta forma se transfundirán plaquetas y plasma fresco congelado con el objetivo de mantener la cifra de plaquetas > 50.000/μl, el TP > 50% y el fibrinógeno > 1g/l. El uso de proteína C ha demostrado su beneficio en la CID secundaria a sepsis en adultos, mientras que en la práctica clínica habitual no se recomienda en neonatos debido al aumento de hemorragia intracraneal observado en varios estudios15–17. Otra posibilidad sería inhibir la activación de la coagulación mediante la infusión de heparina (dosis de 5-10 U/kg/h): sin embargo, los ensayos clínicos evaluando este aspecto han sido poco concluyentes y el riesgo de sangrado podría estar incrementado7.
Enfermedad hepáticaUna hepatopatía puede manifestarse como un trastorno hemorrágico, ya que muchos de los factores de la coagulación se sintetizan aquí. Este es el caso del fallo hepático en el contexto de shock, o en situaciones como el hídrops faetalis, y, especialmente, enfermedades infecciosas (hepatitis virales incluyendo citomegalovirus y enterovirus, sífilis, etc.). Las características hematológicas de la hemorragia por enfermedad hepática son similares a las de la CID, con la única diferencia de que aquí muy raramente encontraremos trombocitopenia. El manejo es similar al de la CID.
Oxigenación por membrana extracorpóreaEn esta situación, el consumo por mecanismo traumático de plaquetas y factores de coagulación en el circuito, unido a la necesidad de anticoagulación terapéutica hará que exista un mayor riesgo de hemorragia18,19.
Causas hereditariasHemofiliaLas hemofilias A y B son el trastorno hereditario de la coagulación que más frecuentemente se manifiestan en el período neonatal. La hemofilia A o clásica se debe a un déficit del factor VIII, y afecta a 1/10.000 varones nacidos vivos. La hemofilia B o enfermedad de Christmas es debida a un déficit de factor IX y tiene una incidencia mucho menor, de 1/50.000 varones nacidos vivos. Ambas alteraciones tienen una transmisión recesiva ligada al cromosoma X. Se calcula que un tercio de los afectados no tienen historia familiar de hemofilia, por lo que parece existir gran incidencia elevada de mutaciones de novo, aunque mosaicismos en padres o abuelos podrían explicar esta situación20,21. Entre el 15 y el 33% de los pacientes con hemofilia sufren sangrados durante el primer mes de vida22,23.
La sospecha diagnóstica se debe tener en varones con clínica y/o antecedentes familiares y un tiempo parcial de tromboplastina alargado. Para el diagnóstico definitivo se deben cuantificar el factor VIII en la hemofilia A y el factor IX en la B. Es importante tener en cuenta que el factor VIII en un neonato sano puede alcanzar valores mucho más elevados que los de un adulto. Sin embargo, el factor IX en un recién nacido sano presenta unos valores muy bajos que impiden el diagnóstico de una hemofilia B hasta los 3-6 meses de vida. Estas peculiaridades del recién nacido retrasarán en muchas ocasiones el diagnóstico de hemofilia24.
El tratamiento se debe iniciar previa extracción de una muestra para estudio. La administración de plasma fresco congelado (aunque no presenta factor VIII) a dosis de 15-20ml/kg/12h es la primera opción terapéutica, mientras que si el diagnóstico de hemofilia está confirmado, la administración de factor VIII o IX es el tratamiento de elección25.
Enfermedad de Von WillebrandEs el trastorno hereditario de la coagulación más frecuente en la población general (el 1% de la población presenta disminución del FvW)26 Su herencia es fundamentalmente autosómica dominante, afectando a nivel cuantitativo o cualitativo la producción del factor. Se clasifica en 3 tipos:
- —
Tipo 1: es el más frecuente. Es un trastorno cuantitativo que no se diagnostica hasta pasado el período neonatal debido a los altos valores fisiológicos de FvW en el recién nacido secundario a los estrógenos maternos.
- —
Tipo 2: similar al tipo 1, pero puede asociar trombocitopenia.
- —
Tipo 3: es la forma más grave y, afortunadamente, la más rara. Su herencia es autosómica recesiva. Existe una ausencia prácticamente total del FvW, y este tipo de EvW se manifiesta con sangrados importantes desde el nacimiento.
Respecto a las pruebas de laboratorio sólo en el tipo 3 se encuentra una alteración aislada del tiempo parcial de tromboplastina (como ocurre en la hemofilia). El manejo de la tipo 3 requiere la administración inmediata de factor VIII que contiene multímeros de FvW25.
Otros trastornos de la coagulaciónEste grupo comprende una serie de déficit autosómicos recesivos que afectan a diversos factores de la coagulación. Todos ellos pueden manifestarse en los primeros días de vida. Los más frecuentes son las deficiencias en el fibrinógeno y en los factores VII, X y XIII27. Aunque la presentación clínica más típica son las hemorragias leves del muñón umbilical y tejidos blandos, es relativamente frecuente la aparición de sangrados intracraneales. Todos estos trastornos, salvo el déficit de factor XIII, se manifestarán en las pruebas de coagulación básicas.
El manejo de estas entidades se debe realizar con concentrados de factores específicos. Dada la gravedad del déficit del factor XIII, en estos pacientes se debe hacer una profilaxis periódica con factor XIII para evitar posibles sangrados intracraneales28.
Lectura rápida
Ante un recién nacido con hemorragia y con buen estado general, las causas más frecuentes son la deficiencia de vitamina K, déficit aislados de factores de la coagulación, trombocitopenia de causa inmune o inducida por fármacos y traumatismos. En un recién nacido con afectación del estado general las causas más habituales de hemorragia son la coagulación intravascular diseminada (CID), la infección, la presencia de hepatopatía o el consumo mecánico de las plaquetas.
El diagnóstico y manejo adecuados del recién nacido con hemorragia dependen del reconocimiento precoz por parte del clínico de un sangrado anormal junto con el inicio de las investigaciones apropiadas. Esto unido al inicio de medidas de soporte general facilitará una evolución favorable.
AnamnesisLa historia clínica debe incluir los datos siguientes13,29,31:
- —
Antecedentes familiares de hemorragias o trombosis. Consanguinidad: antecedentes de otro hijo con trastornos hemorrágicos. En partos gemelares, situación del gemelo y valorar diferencias por el sexo.
- —
Medicamentos maternos: especial atención a fármacos anticonvulsivantes y anticoagulantes.
- —
Datos sobre embarazo: antecedentes de trombopenia materna, preeclampsia, sífilis, rubéola en el primer trimestre. Edad gestacional.
- —
Sexo del recién nacido.
- —
Problemas obstétricos y distocias.
- —
Administración o no de vitamina K en el período perinatal, dosis y vía.
- —
Período neonatal inmediato: enfermedad, fármacos, procedimientos realizados en el recién nacido.
- —
Tipo y lugar del sangrado.
- —
Momento del sangrado (horas o días de vida).
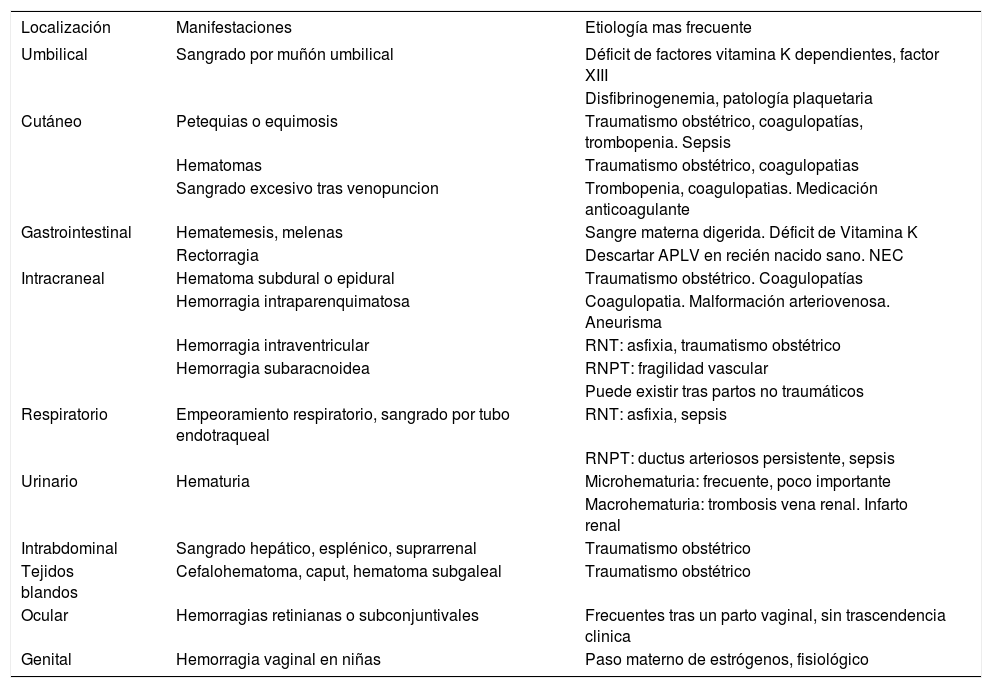
Para un diagnóstico y tratamiento correctos del recién nacido con hemorragia un punto clave será determinar si éste tiene apariencia de sano o de enfermo. Se debe realizar una exploración física detallada buscando otras localizaciones de sangrado como la presencia de petequias, equimosis, hemorragias mucosas, hemorragia del muñón umbilical y/o de lugares de punción, hematomas cutáneos y subcutáneos, cefalohematomas, hemangiomas (Kassabach-Merritt), hepatoesplenomegalia, ictericia, hallazgos retinianos anómalos (tabla 2).
Manifestaciones clínicas de la hemorragia en el recién nacido según su localización
| Localización | Manifestaciones | Etiología mas frecuente |
|---|---|---|
| Umbilical | Sangrado por muñón umbilical | Déficit de factores vitamina K dependientes, factor XIII |
| Disfibrinogenemia, patología plaquetaria | ||
| Cutáneo | Petequias o equimosis | Traumatismo obstétrico, coagulopatías, trombopenia. Sepsis |
| Hematomas | Traumatismo obstétrico, coagulopatias | |
| Sangrado excesivo tras venopuncion | Trombopenia, coagulopatias. Medicación anticoagulante | |
| Gastrointestinal | Hematemesis, melenas | Sangre materna digerida. Déficit de Vitamina K |
| Rectorragia | Descartar APLV en recién nacido sano. NEC | |
| Intracraneal | Hematoma subdural o epidural | Traumatismo obstétrico. Coagulopatías |
| Hemorragia intraparenquimatosa | Coagulopatia. Malformación arteriovenosa. Aneurisma | |
| Hemorragia intraventricular | RNT: asfixia, traumatismo obstétrico | |
| Hemorragia subaracnoidea | RNPT: fragilidad vascular | |
| Puede existir tras partos no traumáticos | ||
| Respiratorio | Empeoramiento respiratorio, sangrado por tubo endotraqueal | RNT: asfixia, sepsis |
| RNPT: ductus arteriosos persistente, sepsis | ||
| Urinario | Hematuria | Microhematuria: frecuente, poco importante |
| Macrohematuria: trombosis vena renal. Infarto renal | ||
| Intrabdominal | Sangrado hepático, esplénico, suprarrenal | Traumatismo obstétrico |
| Tejidos blandos | Cefalohematoma, caput, hematoma subgaleal | Traumatismo obstétrico |
| Ocular | Hemorragias retinianas o subconjuntivales | Frecuentes tras un parto vaginal, sin trascendencia clinica |
| Genital | Hemorragia vaginal en niñas | Paso materno de estrógenos, fisiológico |
APLV: alergia a proteínas de leche de vaca; RNT: recién nacido a término; RNPT: recién nacido pretérmino.
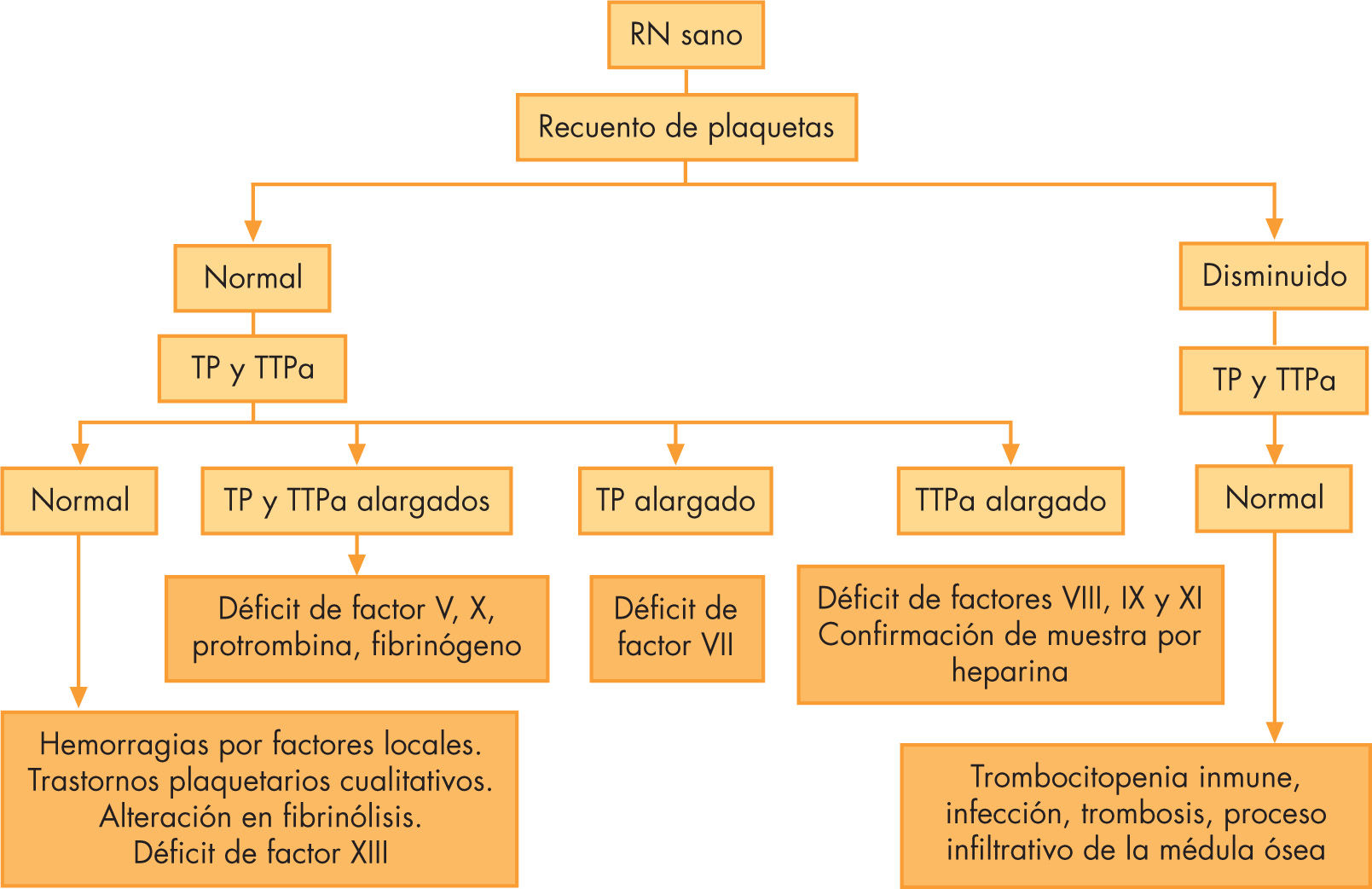
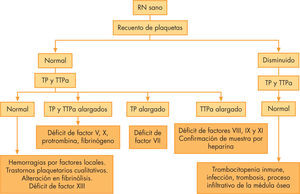
En un recién nacido sano con buen estado general las causas más frecuentes de hemorragia serán la deficiencia de vitamina K, déficit aislados de factores de la coagulación, traumatismos o trombocitopenia de causa inmune o inducida por fármacos.
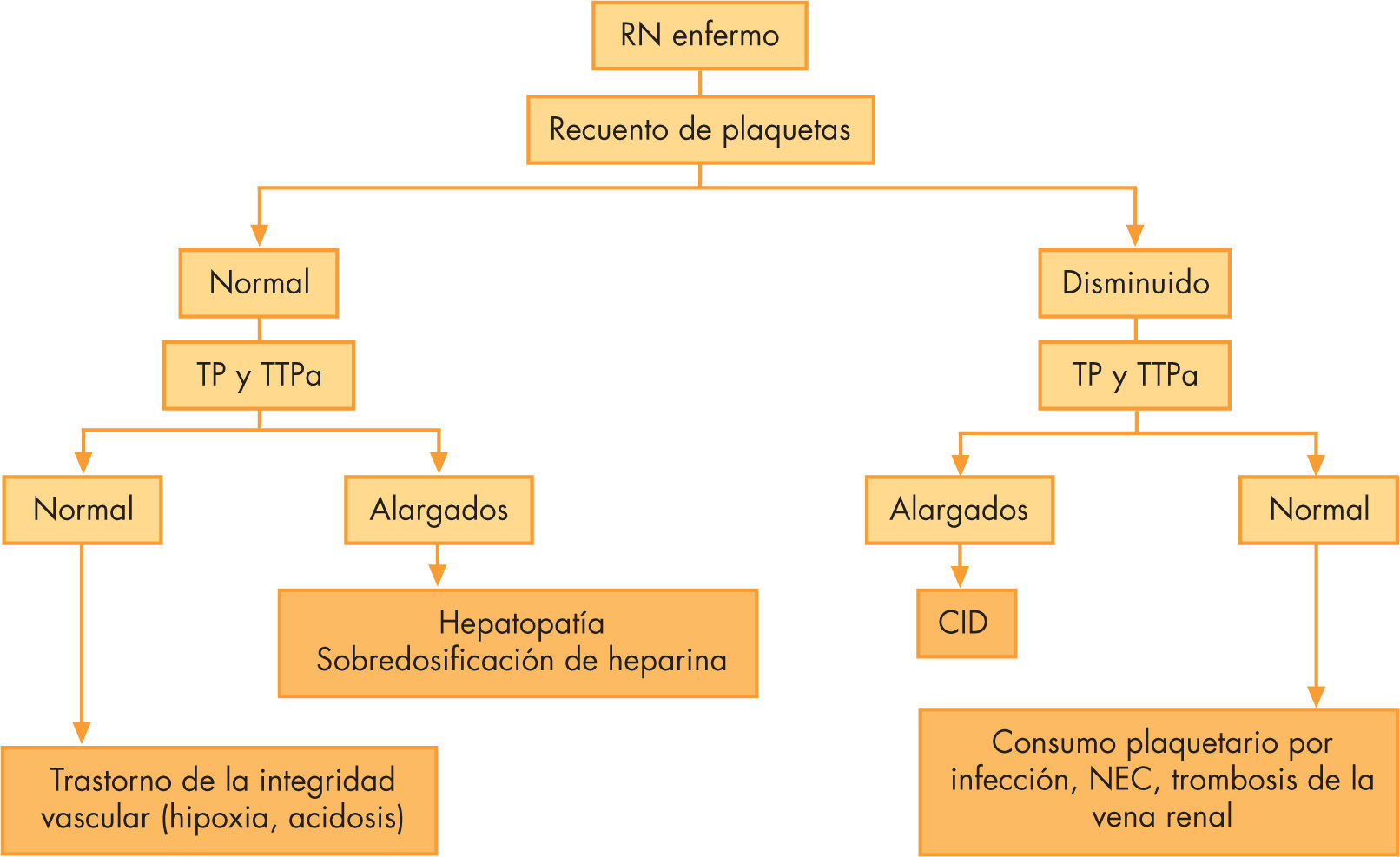
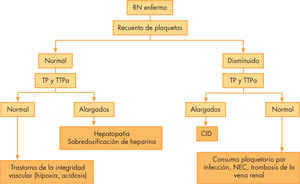
En el caso de un recién nacido enfermo, con mal estado general, las posibilidades diagnósticas más probables son la CID, infección o hepatopatía. En recién nacidos con un sangrado intracraneal, especialmente en presencia de cifras de plaquetas normales, siempre debemos considerar la posibilidad de un trastorno congénito de la coagulación. El sangrado de articulaciones (hemartros) frecuente en niños y adultos con defectos congénitos de factores de la coagulación, raramente ocurre en neonatos1.
Lectura rápida
Diagnóstico
La anamnesis debe incluir los antecedentes familiares de hemorragias o trombosis, consanguinidad, medicamentos maternos y del recién nacido, así como datos sobre embarazo, problemas obstétricos y en el parto. Sobre el período neonatal inmediato debemos recoger datos sobre la administración o no de vitamina K incluyendo dosis y vía de administración, enfermedades, fármacos, anomalías o prematuridad
Tras una historia clínica básica y una primera división entre recién nacido sano y enfermo, se pondrán en marcha unas pruebas básicas de laboratorio. Los resultados siempre se deben considerar en el contexto de la edad del paciente y debemos recordar recoger una muestra para el diagnóstico antes de la transfusión de cualquier hemoderivado. También es importante que la recogida de la muestra sea precisa, de cantidad suficiente y evitando contaminantes como la heparina, empleada muchas veces en las infusiones por catéteres centrales y que puede alterar nuestros resultados.
- —
La prueba de Apt se utiliza para descartar el origen materno de la sangre. Se debe realizar en un recién nacido con buen estado general y una hemorragia exclusivamente gastrointestinal. Puede utilizarse un sacaleches o aspirar el estómago antes y después de una toma para confirmar la presencia de sangre en la leche. Técnica. Mezclar una parte de la muestra de heces o aspirado gástrico con 5 partes de agua; centrifugar y separar el sobrenadante rosa pálido (hemolizado); añadir 1ml de hidróxido sódico al 1% a 4ml del hemolizado. Resultado: Se observa si hay cambio de color al cabo de 2 minutos. El color rosado de la hemoglobina A cambia a amarillo pardo (sangre materna) y el color rosado de la hemoglobina F resiste a la desnaturalización, y no se modifica (sangre fetal)13,29,30.
Lectura rápida
Además se analizará el tipo y la localización del sangrado y su momento de aparición. En la exploración física analizaremos la repercusión general de este sangrado además de buscar de manera sistemática otros focos de hemorragia.
Los historia clínica junto con la exploración física y una analítica básica (hemograma completo con extensión sanguínea, recuento plaquetario y estudio de coagulación) nos dará el diagnóstico en la mayoría de los casos. Siempre debemos analizar los resultados en función de la edad del paciente y, en función de éstos y de su evolución, se decidirá si se continúa con exploraciones más específicas.
- —
Hemograma completo con extensión sanguínea, recuento de plaquetas y frotis sanguíneo, además de la fórmula sanguínea en el frotis de sangre periférica veremos el tamaño y la morfología de las plaquetas (descartar agregados plaquetares o seudotrombocitopenias por presencia de anticoagulantes) y posible presencia de hematíes fragmentados.
- —
Tiempo de sangría o de Ivy: no se recomienda en recién nacidos.
- —
Platelet Function Analyser (PFA)31: mide in vitro el tiempo que tardan las plaquetas en una muestra de sangre total citratada en formar un tapón que ocluya la apertura de una membrana recubierta de colágeno/adrenalina y de colágeno/adenosindifosfato (ADP). Está alargado en trombocitopenias y trombopatías hereditarias o adquiridas. Sustituye al tiempo de hemorragia.
- —
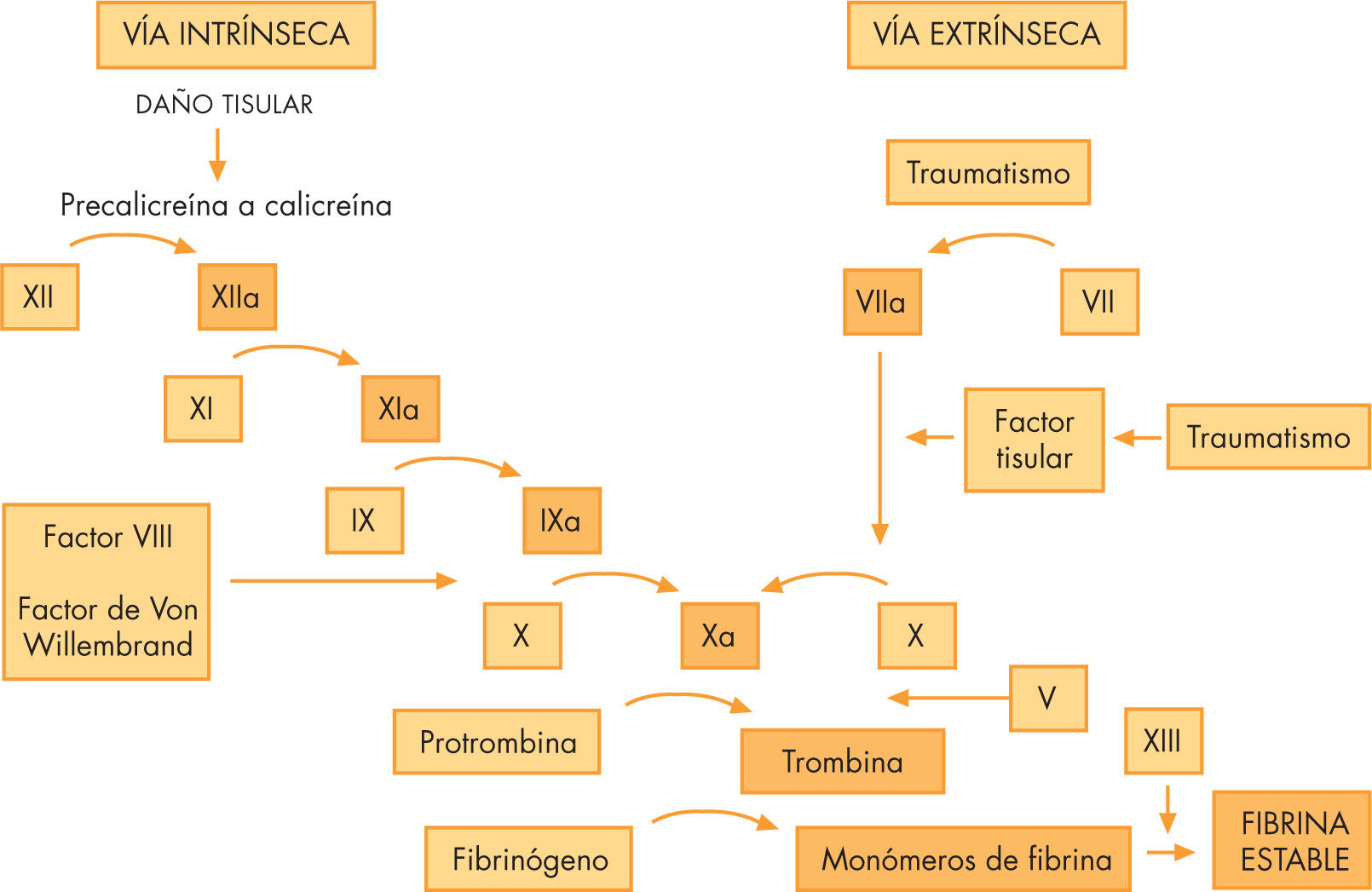
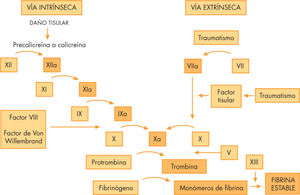
El TP o Quick: explora la vía extrínseca (fig. 1). Las causas más frecuentes de su alargamiento son los déficit hereditarios o adquiridos de los factores dependientes de vitamina K, factor V y fibrinógeno. Su resultado se puede dar en porcentaje (normal: 80-100%) o en ratio de protrombina (TP muestra/TP plasma normal).
- —
Tiempo de tromboplastina parcial activado (TTPa) o tiempo de cefalina-kaolín: estudia la vía intrínseca. Alargado en el déficit de cualquier factor excepto el VII. Sensible a la contaminación con heparina y se utiliza para el control del tratamiento con heparina sódica.
- —
Tiempo de trombina (TT): refleja la actividad del fibrinógeno.
- —
Fibrinógeno: disminuido en hepatopatías y situaciones de consumo. Interesa su cantidad y su alteración funcional (disfibrinogenemia).
- —
Dímero-D: los dímeros D se forman a partir de la acción de la plasmina en el coágulo de fibrina, lo que genera derivados cruzados de fibrina que contienen dímeros D. La concentración normal es < 0,5mg/ ml. Se encuentran aumentados en la CID, la trombosis venosa profunda y la embolia pulmonar. Han demostrado mayor sensibilidad que los productos de degradación de la fibrina (PDF).
- —
Estudio específico de factores de la coagulación en sangre periférica: valores de vitamina K, detección de formas descarboxiladas de factores dependientes de vitamina K, medición del factor VIII y IX, FvW, fibrinógeno, factores VII, X y XIII1.
En función de los resultados obtenidos tendremos una primera aproximación diagnóstica, que se resume en las figuras 2 y 331.
Lectura rápida
El tratamiento inicial siempre será la estabilización, en la que puede ser necesario el empleo de hemoderivados. El diagnóstico etiológico posterior nos permitirá la instauración de tratamientos específicos. Si la situación del paciente lo permite es importante realizar las pruebas de laboratorio antes de la transfusión de cualquier hemoderivado para permitir una correcta interpretación de los mismos.
Para el tratamiento correcto de una hemorragia anormal en el recién nacido es primordial reconocer esta situación y hacer una evaluación rápida de la gravedad. La administración de hemoderivados puede ser necesaria, pero siempre hay que tener en cuenta que ésta también puede comportar un riesgo para el paciente32,33 y debe siempre realizarse según las pautas de transfusión específicas de cada centro. Nuestra primera actuación debe encaminarse a la estabilización del paciente, prestando especial atención a la situación de posible shock concomitante y aplicando medidas de soporte hemodinámico y respiratorio. Una vez realizado este punto y, puestas en marcha las investigaciones pertinentes, procederemos al tratamiento etiológico específico de cada entidad descrito anteriormente.
Algunos de los tratamientos generales ante una clínica de hemorragia se detallan a continuación:
Vitamina K- —
Indicaciones: hemorragia en un neonato que no ha recibido vitamina K profiláctica. Todo paciente con prolongación del TTPa y TP en el que sospechemos un déficit de vitamina K.
- —
Efectos secundarios: su asociación con tumores sólidos y leucemia descrita en 1990 en un estudio epidemiológico ha quedado posteriormente descartada34.
- —
Dosis terapéutica: 1mg por vía intramuscular o intravenosa lenta.
- —
Indicaciones: corrección de coagulopatías debidas a deficiencias de factores.
- —
Efectos secundarios: reacciones transfusionales. Lesión pulmonar aguda asociada a transfusión (compromiso respiratorio debido a reacciones de incompatibilidad de anticuerpos del donante contra antígenos HLA del receptor). Hipocalcemia.
- —
Dosis: 15ml/kg/12h por vía intravenosa.
- —
Indicaciones: hemorragia activa y trombocitopenia < 50.000/μl.
- —
Dosis: 15ml/kg/12 por vía intravenosa.
- —
Indicaciones: shock hipovolémico (transfusión inmediata). Si el hematocrito es inferior a 35% en el contexto de sepsis, enterocolitis necrosante o ductus sintomático; en función de necesidades de oxígeno o ventilación mecánica (véase artículo de anemia en este mismo número, p. 73-80).
- —
Efectos secundarios: sobrecarga de volumen, hemólisis (por incompatibilidad de grupo ABO), hiperpotasemia, enfermedad injerto contra huésped, infecciones (virus y bacterias) y daño pulmonar agudo por atrapamiento de leucocitos en la circulación pulmonar35.
- —
Dosis: habitualmente 15ml/kg por vía intravenosa. En niños lábiles o shock grave se deben considerar cantidades mayores o repetir la transfusión con un intervalo de 12h.
- —
Indicaciones: deficiencia conocida de un factor de la coagulación (VIII, IX, XIII). En el caso de una EvW tipo 3 se debe administrar un derivado del plasma con factor VIII y FvW29,36.
A la Dra. T. Toll, Servicio de Hematología, Hospital Sant Joan de Déu, Barcelona.