La tos ferina continúa siendo un problema de salud pública mundial. Causa 17 millones de casos y 180.000 fallecimientos anuales, sobre todo en niños de países en vías de desarrollo, aunque las campañas de vacunación están disminuyendo esas cifras1. En países desarrollados, la vacunación sistemática durante los primeros años de vida redujo drásticamente la incidencia. Sin embargo, en los últimos años, se ha observado una resurgimiento de la enfermedad en estos países, con un desplazamiento a ciertos grupos de edad, como adolescentes y adultos jóvenes2. Estos últimos son la fuente de contagio habitual del otro grupo más afectado, los lactantes pequeños, los más vulnerables para presentar formas graves y necesidad de hospitalización3,4.
Las posibles causas de este fenómeno son la pérdida de la inmunidad posvacunal a los 6–8 años de la última dosis y la disminución del refuerzo natural, debido a la alta cobertura vacunal. Esto da lugar a una bolsa de población formada por adolescentes y adultos jóvenes susceptibles4.
La frecuente atipicidad de la clínica en adolescentes y adultos, unida a las dificultades para la confirmación microbiológica, contribuyen al infradiagnóstico y la propagación de la infección en la comunidad. Un mejor reconocimiento clínico y la aparición de nuevas pruebas diagnósticas, como la reacción en cadena de la polimerasa, podrían mejorar el diagnóstico y, con ello el control, de la enfermedad.
Tratamiento de la tos ferinaEl uso temprano de macrólidos en los casos índice puede reducir la contagiosidad, con un efecto parcial, y a veces incluso escaso, en la intensidad y la duración de la sintomatología5,6, y resulta nulo si se inicia a partir del día 14–21 del inicio de la tos5.
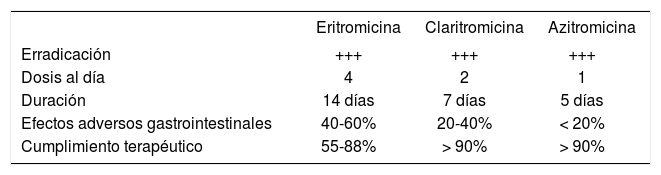
Fármacos de primera elección: macrólidosHay consenso universal en usar macrólidos5,7–9. En las tablas 1 y 2 se puede observar los principales macrólidos empleados para la tos ferina. Clásicamente, la eritromicina ha sido y es la primera opción, fundamentalmente por su bajo coste. La aparición de macrólidos igual de eficaces y erradicadores de Bordetella pertussis en nasofaringe6,10,11, pero con mayor cumplimiento terapéutico6, debido al mejor perfil de tolerabilidad gastrointestinal y de dosificación-duración (menos dosis diarias y menor duración en días), hace que en las guías y las revisiones actuales se dé la opción para elegir entre eritromicina o las más costosas, claritromicina o azitromicina5,6,12 (tablas 1 y 2).
Dosis de los principales macrólidos empleados en el tratamiento y la quimioprofilaxis de la tos ferina
| Eritromicina (14 días) | Claritromicina (7 días) | Azitromicina (5 días) | |
|---|---|---|---|
| < 1 mes | No recomendable: asociación a EHP | No recomendable: no datos | Datos limitados. 5–10mg/kg/24h |
| 1-6 meses | 40-50mg/kg/día cada 6h | 15mg/kg/día cada 12h | 10mg/kg/24h |
| 6 meses-14 años | 40-50mg/kg/día cada 6h (máx. 2g/día) | 15mg/kg/día cada 12h (máx. 1g/día) | 1.er día: 10mg/kg (máx. 500mg/día) 2.°-5.° días: 5mg/kg/día (máx. 250mg/día) |
| Adultos | 500mg/6h | 500mg/12h | 1.er día: 500mg 2.°-5.° días: 250mg/día |
EHP: estenosis hipertrófica de píloro.
En menores de 1 mes, la eritromicina se ha relacionado con la aparición de estenosis hipertrófica de píloro (EHP), sobre todo cuando se emplea en los primeros 15 días de vida13. El riesgo calculado es del 1-5%. Dada la escasa experiencia existente con claritromicina o azitromicina, no se conoce su posible efecto en la EHP7. Sólo hay algunos datos con azitromicina, y los Centers for Diseases Control and Prevention (CDC) estadounidenses lo han considerado el macrólido de elección en menores de 1 mes5. No obstante, la dosis de azitromicina recomendada parece excesiva y no está validada ni por el laboratorio farmacéutico (que no incluye a los menores de 3 meses en las indicaciones del producto por falta de estudios) ni por investigaciones fiables independientes, lo cual pone en entredicho su empleo.
A partir del mes de vida, como se puede ver en la tabla 1, se puede emplear cualquiera de los 3 macrólidos, y aunque los datos sobre claritromicina y azitromicina son más limitados que con eritromicina en lactantes de 1–6 meses, los estudios existentes, aun con escaso número de pacientes, indican los mismos resultados que con eritromicina5,6. También en este caso, la indicación y posología indicadas de azitromicina y claritromicina no se han aprobado, y de hecho la ficha técnica de ambos antibióticos desaconseja su empleo en menores de 6 meses por falta de estudios suficientes.
Cuando se emplea etilsuccinato de eritromicina, la duración debe ser de 14 días5. No obstante, se ha observado la misma eficacia con 7 días de estolato de eritromicina12. La duración de la claritromicina es de 7 días y de la azitromicina, de 5 días.
Fármacos de segunda elección: trimetoprimsulfametoxazolEstá indicado si hay alergia o intolerancia a los macrólidos. No está indicado por sospecha de resistencia a los macrólidos, ya que es excepcional (< 1% en Estados Unidos). La dosis recomendada es de 8mg/kg/día, cada 12h (máximo 160mg/12h), durante 7–14 días5,12. Está contraindicado en menores de 1–2 meses.
Tratamiento adyuvanteDada la intensa y molesta sintomatología de la tos ferina, es fundamental un buen abordaje terapéutico. Este incluye una gran diversidad de fármacos, con mayor o menor efectividad: antitusígenos (codeína), corticoides sistémicos o inhalados, broncodilatadores inhalados, oxigenoterapia-ventilación mecánica, tratamiento antibiótico empírico en sobreinfecciones bacterianas. En lactantes pequeños con pausas de apnea secundarias a la tos ferina, estaría justificado emplear estimulantes del centro respiratorio, como salbutamol oral o cafeína.
PrevenciónLa prevención se basa en el diagnóstico y el tratamiento temprano de los casos (ya comentado en el apartado anterior), la quimioprofilaxis postexposición de los contactos del caso índice y la vacunación.
La erradicación de B. pertussis de la nasofaringe de los pacientes infectados, sintomáticos y asintomáticos, es vital para la disminución de la circulación de esta bacteria en la comunidad. se ha observado cómo, en individuos sintomáticos, la erradicación espontánea no sucede hasta pasadas al menos 3–4 semanas del inicio de la tos en la mayoría de casos, y llega a ser incluso superior a 6 semanas en lactantes no vacunados5.
Sin embargo, la medida más efectiva para el control de esta enfermedad es la existencia y el mantenimiento de una tasa alta de cobertura vacunal en niños, adolescentes y adultos, y además evitar la exposición de los lactantes y otros individuos de alto riesgo de adquirir tos ferina.
Quimioprofilaxis postexposiciónSe centra en la administración temprana de macrólidos a los contactos de los casos índice5. Esta indicación debe llevar mayor énfasis, y se recomienda un seguimiento atento de la adherencia terapéutica en: a) menores de 12 meses8 y sus convivientes; b) mujeres en el tercer trimestre del embarazo, e c) individuos con enfermedad de base susceptibles de presentar tos ferina grave5. No está indicado en compañeros de clase en colegios o institutos, dado el retraso habitual en el diagnóstico del caso índice y las obvias dificultades de implantación de una quimioprofilaxis correcta7.
En todos los consensos y revisiones amplias5,7,12, la recomendación es emplear los mismos fármacos, dosis y duración que las comentadas para el tratamiento de los casos (apartado 1 y tablas 1 y 2). Al igual que antes, por comodidad posológica y menor índice de efectos adversos, el empleo de claritromicina o azitromicina pueden ser opciones igual o incluso más válidas que la clásica eritromicina, lo que facilita el cumplimiento terapéutico5,6,10–12.
Se aconseja que el inicio de la quimioprofilaxis sea lo más temprano posible, es decir, en cuanto se confirme el caso índice, siendo más efectiva cuanto antes se inicie. La efectividad de ésta probablemente sea muy baja si se inicia más allá de los 12 días de la exposición a la tos paroxística del caso índice, y nula, y por tanto no recomendable, si han pasado ya más de 21 días5. Esto, junto a la dificultad habitual para el diagnóstico clínico y microbiológico del caso índice, invita al pesimismo. Además, no hay una evidencia clara del beneficio de la quimioprofilaxis de la tos ferina para la prevención del cuadro clínico12, aunque sí como control de la circulación de la Bordetella6. La única excepción a esta recomendación se dará en neonatos, donde la tos ferina es potencialmente tan grave que no se tendrá en cuenta el tiempo que haya pasado desde la exposición5.
VacunaciónLas dificultades ya comentadas para la identificación de los casos de tos ferina, los problemas inherentes al tratamiento y la quimioprofilaxis correctos, así como su dudosa eficacia, y la corta inmunidad provocada por la infección natural, hacen que la mejor medida preventiva para el control de la tos ferina sea la inmunización activa.
La estrategia vacunal actual en España se centra en la administración, de manera generalizada desde el año 2004, de la vacuna antipertussis acelular, incluida en los preparados pentavalentes (vacuna frente a difteria-tétanos-tos ferina acelular [DTPa]-vacuna inactivada frente a la poliomielitis [VPI]-Haemophilus influenzae tipo b [Hib]) o trivalentes (DTPa), con un esquema de primovacunación a los 2, 4 y 6 meses de vida, con refuerzos a los 15–18 meses y 4–6 años. La presentación hexavalente (DTPa-VPI-Hib-virus de la hepatitis B[VHB]) está comercializada, pero no se incluye por ahora en los calendarios sistemáticos de las comunidades autónomas, aunque podría incluirse próximamente, como ya ha ocurrido en otros países europeos.
En nuestro medio, a pesar de las elevadas coberturas registradas, esta estrategia se presenta como insuficiente para el control adecuado de la enfermedad, ya que la pérdida de la inmunidad vacunal a los 6–10 años de la última dosis a los 4-6 años de edad, provoca la aparición de casos en adolescentes y adultos, con la consecuente potencial transmisión a otros individuos no inmunes de riesgo, fundamentalmente los lactantes menores de 4–6 meses.
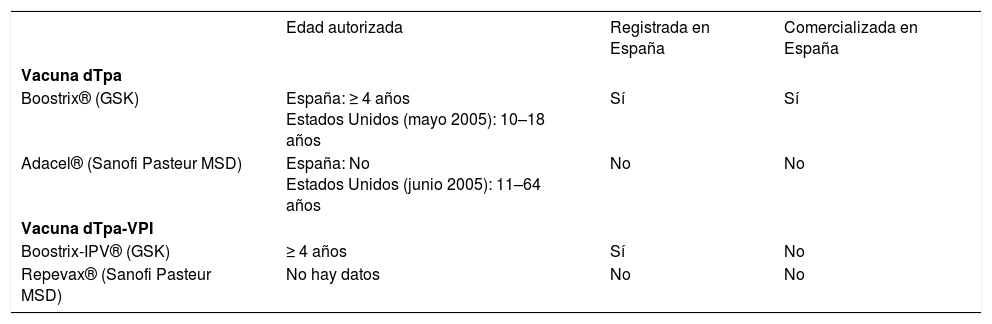
La creación y comercialización en los últimos años de una vacuna antipertussis tipo adulto, con una baja carga antigénica de difteria, pertussis y tétanos, conocida como dTpa, ha supuesto un avance prometedor. su administración debe ser por vía intramuscular en dosis única, y se recomienda un refuerzo cada 10 años. En la tabla 3 se pueden apreciar las diferencias antigénicas de la vacuna DTPa o “tipo infantil” y la dTpa o “tipo adulto” comercializadas en España, y en la tabla 4 se exponen las características de los preparados vacunales de dTpa y la menos conocida dTpa-VPI.
Diferencias de los preparados vacunales DTPa o “tipo infantil” y la dTpa o “tipo adulto” comercializadas en España
| DTPa (p. ej., Infanrix®, GSK) | dTpa (Boostrix®, GSK) | |
|---|---|---|
| Difteria | ≥ 30 U | ≥ 2 U |
| Tétanos | ≥ 40 U | ≥ 20 U |
| Pertusis | ||
| Toxina pertúsica | 25μg | 8μg |
| Toxina filamentosa | 25μg | 8μg |
| Pertactina | 8μg | 2,5μg |
dTpa: difteria-tétanos-tos ferina acelular dosis adulto; DTPa: difteria-tétanos-tos ferina acelular dosis infantil; GSK: GlaxoSmithKline.
Vacunas antipertussis “tipo adulto” existentes
| Edad autorizada | Registrada en España | Comercializada en España | |
|---|---|---|---|
| Vacuna dTpa | |||
| Boostrix® (GSK) | España: ≥ 4 años Estados Unidos (mayo 2005): 10–18 años | Sí | Sí |
| Adacel® (Sanofi Pasteur MSD) | España: No Estados Unidos (junio 2005): 11–64 años | No | No |
| Vacuna dTpa-VPI | |||
| Boostrix-IPV® (GSK) | ≥ 4 años | Sí | No |
| Repevax® (Sanofi Pasteur MSD) | No hay datos | No | No |
dTpa: difteria-tétanos-tos ferina acelular dosis adulto; GSK: GlaxoSmithKline; VPI: vacuna inactivada frente a la poliomielitis.
Las estrategias potenciales para el control de la enfermedad en nuestro medio se exponen a continuación:
- -
Vacunación de adolescentes. En España, sólo Ceuta decidió incluir la vacuna dTpa en calendario oficial hace varios años. Recientemente, desde principios del 2006, Estados Unidos inició la vacunación sistemática en este grupo de edad14, tras la recomendación del CDC de Atlanta15. Este organismo propone la vacunación a los 11–18 años, preferiblemente a los 11–12 años, debiéndose esperar 5 años de la última dosis de tétanos o al menos 2 años si se trata de una persona de riesgo (o sus convivientes) de presentar un cuadro grave. Dos estudios de coste-efectividad avalan su inclusión en este período de la vida16,17. El Comité Asesor de Vacunas de la Asociación Española de Pediatría también recomienda la inclusión de esta vacuna en época adolescente (a los 13-16 años) en su calendario vacunal18. En la tabla 5 se especifica de forma actualizada (junio 2007) los países que han adoptado esta política vacunal.
Tabla 5.Inclusión de la vacuna difteria-tétanos-tos ferina acelular dosis adulto (dTpa) en la edad adolescente en calendarios sistemáticos internacionales (actualizado a fecha de junio 2007)
País Edad de administración de dTpa en adolescentes Canadá 6.a dosis: 14–16 años Estados Unidos 6.a dosis: 11–12 años Alemania 5.a dosis: 9–17 años Australia 5.a dosis: 15–17 años Austria 5.a dosis: 13–16 años Finlandia 5.a dosis: 14–15 años Francia 5.a dosis: 11–13 años Italia 5.a dosis: 14–15 años Luxemburgo 6.a dosis: 12–15 años Malta 6.a dosis: 16 años Suecia 5.a dosis: 14–16 años - -
Vacunación universal de adultos. Actualmente, esta vacuna está incluida sólo en algunos calendarios oficiales de vacunación de adultos, como el último de los CDC19. Recientemente, el Comité de Vacunas de la sociedad Española de Medicina Preventiva, salud Pública e Higiene ha incluido la vacuna dTpa en su calendario oficial en adultos hasta los 64 años20.
- -
Vacunación selectiva de adolescentes y adultos: “estrategia del nido”. En caso de imposibilidad económica y/o logística para la vacunación universal de adolescentes y adultos, la estrategia más razonable es vacunar a los convivientes de los lactantes pequeños, lo que se denomina “estrategia del nido”21.
- -
Vacunación selectiva de adolescentes y adultos: junto a la vacunación antitetánica. Recientemente se ha aprobado, para la vacuna dTpa, la indicación en el tratamiento de heridas potencialmente tetanígenas en personas que hayan recibido un esquema de vacunación antitetánica.
- -
Empleo de vacunas menos reactógenas. Aunque la vacuna dTpa tiene un perfil de reactogenicidad tolerable, la creación de vacunas más depuradas, o incluso sin el antígeno tetánico, ayudarían a la vacunación en adultos22.