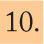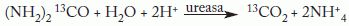El test de la urea marcada con carbono 13 (TAU-13C) es un test muy sensible y específico en niños mayores de 6 años. La experiencia en niños menores de esa edad, especialmente en menores de 2 años, es relativamente limitada y debe ampliarse.
El descubrimiento de la bacteria Helicobacter pylori ha supuesto uno de los hitos más importantes en la historia de la gastroenterología. Su presencia en el hombre y los animales se conoce desde hace más de 100 años, pero fueron 2 investigadores, Warren y Marshall1, los que la describieron por primera vez en mucosa gástrica asociada con gastritis crónica activa a principios de la década de los años ochenta.
La infección por H. pylori induce siempre la aparición de gastritis, además es causa de dispepsia no ulcerosa, úlcera péptica, linfoma tipo MALT (del inglés mucosa-associated lymphoid tissue) y cáncer gástrico. Aunque no se ha demostrado en niños una asociación definitiva entre gastritis por H. pylori y dolor abdominal, en parte por la dificultad de realizar estudios extensos en este grupo poblacional2, debe investigarse esta infección cuando los síntomas indiquen enfermedad orgánica3. Esta monografía tiene como objetivo revisar el TAU-13C como herramienta diagnóstica y de seguimiento del tratamiento.
Puntos clave
H. pylori es un bacilo gramnegativo, microaerofílico, con morfología espiral en forma de sacacorchos, que se encuentra en la mucosa gástrica.
Bioquímicamente, su característica más importante es la producción de la enzima ureasa, más potente que la de otras bacterias, que desdobla la urea en amoníaco y anhídrido carbónico4.
PatologíaLa relación causal entre H. pylori y gastritis crónica superficial está bien establecida. Virtualmente todos los pacientes infectados con esta bacteria presentan una gastritis antral5. En el año 1994, la Agencia Internacional para la Investigación en Cáncer (IARC) de la Organización Mundial de la Salud incluyó a H. pylori como agente carcinógeno para el hombre (categoría 1), a partir de evidencias epidemiológicas que lo asocian con cáncer gástrico6. Algunos estudios indican que puede haber una asociación entre la infección por H. pylori y la anemia ferropénica y púrpura trombocitopénica idiopática7,8.
Aunque la mayoría de las infecciones por H. pylori son asintomáticas, durante la infancia también hay asociación con gastritis y úlcera duodenal9. En un estudio multicéntrico, retrospectivo, realizado en Japón, se demostró que había relación entre H. pylori y la úlcera gástrica en niños10. Sólo hay algunos casos descritos de linfoma tipo MALT del estómago en la infancia11, y ninguno de adenocarcinoma. Sin embargo, la asociación entre dolor abdominal persistente y H. pylori no se ha demostrado12.
Estudio de la infección por Helicobacter pylori en niñosIndicacionesSe recomienda realizar cribado en niños como parte de su evaluación sólo cuando los síntomas indiquen enfermedad orgánica3, y deben recibir tratamiento en caso de haber infección13. La anemia ferropénica refractaria es una indicación de cribado de H. pylori, después de haber descartado otras causas, como la enfermedad celíaca y la enfermedad inflamatoria intestinal. No está justificado el estudio en caso de dolor abdominal recurrente13.
Métodos diagnósticosPara diagnosticar la infección por H. pylori, pueden emplearse métodos invasivos (requieren endoscopia digestiva) y no invasivos (tablas 1 y 2).
Indicaciones de métodos diagnósticos14
| Método | Indicación |
|---|---|
| Invasivos | |
| Test de ureasa | Prueba de primera elección en pacientes que requieren endoscopia |
| Tinciones histológicas | En caso de negatividad de la ureasa |
| Cultivo | Investigación y resistencia al tratamiento |
| No invasivos | |
| TAU-13C | Prueba de elección en pacientes que no precisan endoscopia y seguimiento de la erradicación de Helicobacter pylori |
| Serología | Estudios epidemiológicos |
| Antígeno en heces | Segunda opción en caso de no poder realizar el TAU-13C |
TAU-13C: test de la urea marcada con 13C.
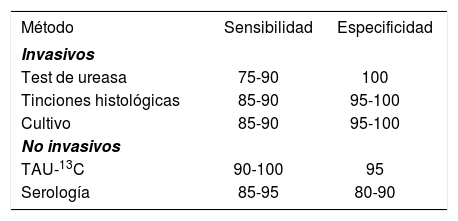
Sensibilidad y especificidad de los métodos diagnósticos19,20
| Método | Sensibilidad | Especificidad |
|---|---|---|
| Invasivos | ||
| Test de ureasa | 75-90 | 100 |
| Tinciones histológicas | 85-90 | 95-100 |
| Cultivo | 85-90 | 95-100 |
| No invasivos | ||
| TAU-13C | 90-100 | 95 |
| Serología | 85-95 | 80-90 |
TAU-13C: test de la urea marcada con 13C.
La endoscopia con biopsia es el método diagnóstico preferido en niños con síntomas digestivos indicativos de enfermedad orgánica3. La toma de biopsia permite realizar la prueba rápida de la ureasa (prueba de primera elección en pacientes que requieren endoscopia), el estudio histológico, la identificación del bacilo mediante tinciones microbiológicas y la realización de cultivo y antibiograma (en casos de resistencia y con fines de investigación)4,14.
Métodos no invasivosDentro de este grupo cabe destacar la serología, el TAU-13C y la detección del antígeno en heces. Los principales problemas de la serología radican en que no diferencia entre individuos con infección activa y personas sanas previamente expuestas, y además hay una prolongada latencia entre la desaparición de H. pylori y el descenso de los títulos de anticuerpos; sin embargo, es muy útil para estudios epidemiológicos, y los resultados no se ven afectados por el tratamiento reciente con antibióticos e inhibidores de la bomba de protones (IBP)4,15. Se han descrito métodos de serología "rápida" que utilizan sangre capilar, pero presentan una exactitud diagnóstica deficiente y no se recomienda su uso generalizado16. La detección del antígeno en heces permite establecer el diagnóstico inicial y el seguimiento de la eficacia del tratamiento. Ofrece la ventaja de obtener la muestra de forma fácil, estar al alcance de cualquier laboratorio y no precisar la colaboración del paciente, lo que lo hace especialmente útil en niños pequeños4; sin embargo, aunque parece ser un método prometedor, no todos los estudios muestran resultados igualmente concluyentes, y varían según la metodología utilizada, por lo que actualmente se recomiendan las técnicas que utilizan anticuerpos monoclonales14,17, y como segunda opción de diagnóstico en el caso de no poder realizar el test en aliento14.
Test de la urea marcada con carbono 13En 1987, se introdujo por primera vez el TAU-13C para el diagnóstico de H. pylori18. Actualmente, es un método que muestra una exactitud diagnóstica muy elevada, entre el 90 y el 100%19, con una sensibilidad entre el 90 y el 100% y una especificidad superior al 95%20.
FundamentoEs un método indirecto basado en la capacidad de la bacteria para producir ureasa. Si se administra urea marcada con carbono 13 (13C-urea) por vía oral y hay H. pylori en el estómago, esta enzima cataliza la hidrólisis de la 13C-urea y produce dióxido de carbono marcado (13Co2) y amonio.
El 13Co2 se absorbe y transporta a los pulmones, donde se excreta junto al Co2 fisiológico (constituido principalmente por 13CO2), y se detecta en el aire espirado. Si H. pylori no está presente, el desdoblamiento de la 13C-urea no tiene lugar y no se produce 13Co2. Por tanto, la información que proporciona la prueba es la presencia o ausencia de H. pylori. El objetivo es diferenciar con exactitud entre pacientes H. pylori positivos y negativos.
ProtocoloHay diversos protocolos, y la mayoría presenta una exactitud similar. En un protocolo típico, tras un ayuno nocturno, se administra una solución de ácido cítrico, se recoge una muestra basal de aire espirado, posteriormente se administra una cantidad fija de 13C-urea disuelta en agua, y a un intervalo fijo se recoge una segunda muestra. Al principio se utilizaban 250mg o más de 13C-urea, si bien 75 o 100mg dan resultados consistentes21. otros estudios han demostrado especificidad y sensibilidad excelentes, sin necesidad de administrar ácido cítrico, lo que permite acortar el intervalo de muestreo22. Las muestras se recogen insuflando aire en un tubo o una bolsa específicos, dependiendo del equipo empleado posteriormente para su análisis. La facilidad de la toma de muestras y la estabilidad del 13CO2 permiten que la toma lo realice personal no especializado, y así se pueda remitir al centro de análisis. No hay protocolos estandarizados para la realización del TAU-13C en niños. El principal problema se relaciona con la superficie corporal, ya que condiciona la excreción de CO2, variando en función de la edad23. En general, se admite que el test se muestra eficaz para el diagnóstico a dosis de 1,5-2mg de 13C-urea por kg de peso. A efectos prácticos, se recomienda utilizar 50mg de 13C-urea en niños que pesan menos de 30–35kg y de 100mg en aquellos con peso superior23–26.
Expresión de resultadosEl enriquecimiento de 13C se detecta al comparar la relación de los isótopos 13C/12C entre ambas muestras (antes y tras la administración de 13C-urea) y aumenta en caso de infección por H. pylori. El resultado se expresa en unidades delta por mil (‰) con respecto a un estándar internacional de referencia24.
Punto de corteLa elección del punto de corte para definir si el test es positivo o negativo varía entre 2 y 5‰, en función del protocolo utilizado19.
Equipos de mediciónEl primer equipo utilizado fue el espectrómetro de masas de relaciones isotópicas. Actualmente hay otros métodos, como la espectrometría de infrarrojos y la espectroscopia optogalvánica láser, que han demostrado ser comparativos, fiables, seguros y más baratos y, por tanto, alternativas válidas para la medición de dióxido de carbono en el aire espirado24,27,28.
Interferencias de medicamentosLa realización de la prueba durante un tratamiento con iBP, sales de bismuto o antibióticos (especialmente los empleados en el tratamiento erradicador) puede dar lugar a un resultado falso negativo, por lo que se indica su supresión 1 mes antes del análisis. En algunos casos, los bloqueadores de los receptores H2 también afectan al TAU-13C, por lo que se recomienda suspenderlos 7 días antes24.
IndicacionesEs una prueba simple, no invasiva y fácilmente aplicable a la práctica clínica. Se considera el test de elección para el diagnóstico de la infección por H. pylori cuando no se requiere realizar endoscopia, y en los casos en que el test rápido de la ureasa y el estudio histológico de la biopsia han resultado negativos14. Es la mejor opción para controlar la respuesta al tratamiento13, excepto en los casos en que estén indicadas endoscopias repetidas. El TAU-13C ha dado resultados excelentes en los estudios realizados en niños de 6 y más años. La experiencia en niños de 5 años o menores, especialmente por debajo de 2 años, es limitada y debe ampliarse y validarse antes de poder recomendarlo para este grupo de edad3,29.
Conclusión
El TAU-13C es una técnica inocua, segura y de fácil manejo, que emplea carbono no radiactivo, permite realizar la prueba repetidamente en la misma persona y no requiere instalaciones especiales para manipularlo, y se puede usar sin restricción en niños y embarazadas.
La investigación de infección por H. pylori en niños debe realizarse sólo cuando los síntomas indiquen enfermedad orgánica, después de descartar otras enfermedades, por lo que la endoscopia es el método diagnóstico más recomendable.
El TAU-13C se considera el test de elección para el diagnóstico de la infección cuando no se requiere realizar endoscopia, y en los casos en que se realiza, pero en los que el test rápido de la ureasa y el estudio histológico han resultado negativos.
El TAU-13C es la mejor opción para confirmar la erradicación de H. pylori, excepto en los casos en que se indiquen endoscopias repetidas, por lo que se recomienda que transcurra al menos 1 mes desde la finalización del tratamiento.
En niños mayores de 6 años, el test da resultados concordantes y excelentes, independientemente del protocolo utilizado. La experiencia en niños de 5 o menos años, especialmente en bebés, es relativamente limitada y debe ampliarse.