En reumatología se denomina «terapia biológica» a los fármacos generados mediante ingeniería genética (anticuerpos monoclonales, proteínas de fusión, etc.), cuyo objetivo son moléculas implicadas en el proceso inflamatorio1,2. Su diana terapéutica es absolutamente específica e incluye citocinas como el factor de necrosis tumoral alfa (TNF-α), interleuci-na-1 (IL-1) o IL-6, moléculas coestimuladoras necesarias para la activación de linfocitos T (B7) o receptores de superficie de linfocitos B (CD20).
Estos fármacos han revolucionado el tratamiento de la artritis idiopática juvenil (AIJ). Antes de su introducción a principios de los años 2000, un 30–40% de los pacientes con AIJ —un porcentaje mucho más elevado de pacientes con la forma sistémica— eran refractarios a las terapias existentes. Estos fármacos abrieron una nueva vía terapéu
Puntos clave
Las terapias biológicas no solo han ampliado el arsenal terapéutico de la artritis idiopática juvenil (AIJ), sino que representan una auténtica alternativa al tratamiento convencional de distintas formas clínicas de la enfermedad.
Los fármacos antifactor de necrosis tumoral (TNF) representan el grupo más numeroso de moléculas y con el que se tiene más experiencia.
La terapia anti-interleucina-1 (IL-1) y anti-IL-6 ha modificado el tratamiento de la forma sistémica de la enfermedad hasta el punto de que en breve constituirá el tratamiento inicial de elección.
Abatacept constituye una alternativa terapéutica eficaz para aquellos pacientes con AIJ refractarios tanto al tratamiento convencional, como a la terapia anti-TNF.
La limitada experiencia que se tiene con estos fármacos y sus efectos secundarios, tanto conocidos (infecciones, reacciones infusionales, etc.) como potenciales (efecto sobre el sistema inmunitario en desarrollo) hace imprescindible que sean utilizados por facultativos con experiencia en su indicación, utilización y monitorización.
tica para todos aquellos pacientes que no respondían o no toleraban el tratamiento con fármacos modificadores de la enfermedad (FAME) como metotrexato (MTX), leflunomida o sulfasalazina.
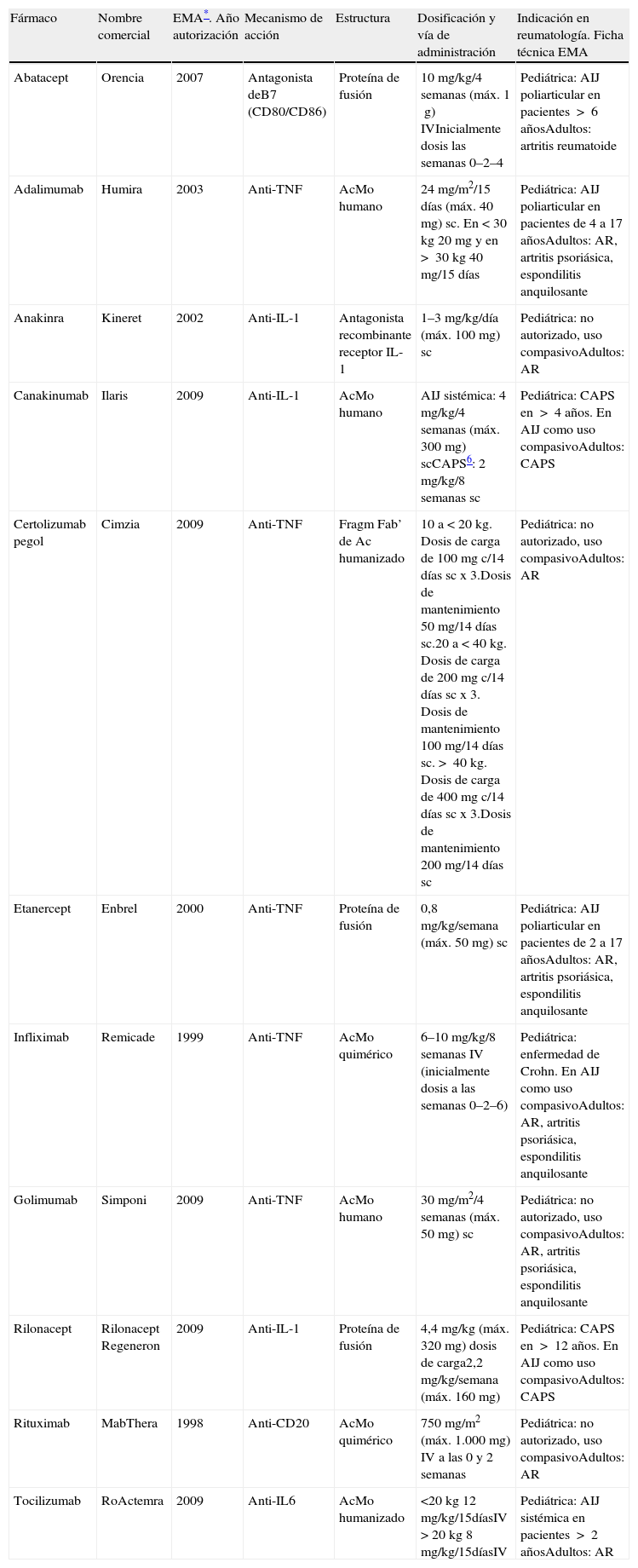
Antagonistas del factor de necrosis tumoral alfaEl TNF es una molécula proinflamatoria secretada por linfocitos, macrófagos, mastocitos, células endoteliales, etc. que induce la activación de otras células con la consiguiente liberación de citocinas y amplificación de la respuesta inflamatoria. Dada su implicación en la patogenia de las artritis inflamatorias, fue la primera diana terapéutica estudiada y, por tanto, el grupo terapéutico con mayor número de representantes. Dentro de este grupo hay 2 categorías: anticuerpos antirreceptor soluble del TNF (etanercept), que neutralizan la forma soluble pero no la fracción unida a la membrana, y anticuerpos anti-TNF (infliximab, adalimumab, golimumab y certolizumab pe-gol), que neutralizan todas las formas bioactivas del TNF. Todos son de prescripción hospitalaria y se administran vía parenteral (tabla 1).
Fármacos biológicos empleados en el tratamiento de la artritis idiopática juvenil.
| Fármaco | Nombre comercial | EMA*. Año autorización | Mecanismo de acción | Estructura | Dosificación y vía de administración | Indicación en reumatología. Ficha técnica EMA |
| Abatacept | Orencia | 2007 | Antagonista deB7 (CD80/CD86) | Proteína de fusión | 10mg/kg/4 semanas (máx. 1g) IVInicialmente dosis las semanas 0–2–4 | Pediátrica: AIJ poliarticular en pacientes > 6 añosAdultos: artritis reumatoide |
| Adalimumab | Humira | 2003 | Anti-TNF | AcMo humano | 24mg/m2/15 días (máx. 40mg) sc. En < 30kg 20mg y en > 30kg 40mg/15 días | Pediátrica: AIJ poliarticular en pacientes de 4 a 17 añosAdultos: AR, artritis psoriásica, espondilitis anquilosante |
| Anakinra | Kineret | 2002 | Anti-IL-1 | Antagonista recombinante receptor IL-1 | 1–3mg/kg/día (máx. 100mg) sc | Pediátrica: no autorizado, uso compasivoAdultos: AR |
| Canakinumab | Ilaris | 2009 | Anti-IL-1 | AcMo humano | AIJ sistémica: 4mg/kg/4 semanas (máx. 300mg) scCAPS6: 2mg/kg/8 semanas sc | Pediátrica: CAPS en > 4 años. En AIJ como uso compasivoAdultos: CAPS |
| Certolizumab pegol | Cimzia | 2009 | Anti-TNF | Fragm Fab’ de Ac humanizado | 10 a < 20kg. Dosis de carga de 100mg c/14 días sc x 3.Dosis de mantenimiento 50mg/14 días sc.20 a < 40kg. Dosis de carga de 200mg c/14 días sc x 3. Dosis de mantenimiento 100mg/14 días sc.> 40kg. Dosis de carga de 400mg c/14 días sc x 3.Dosis de mantenimiento 200mg/14 días sc | Pediátrica: no autorizado, uso compasivoAdultos: AR |
| Etanercept | Enbrel | 2000 | Anti-TNF | Proteína de fusión | 0,8mg/kg/semana (máx. 50mg) sc | Pediátrica: AIJ poliarticular en pacientes de 2 a 17 añosAdultos: AR, artritis psoriásica, espondilitis anquilosante |
| Infliximab | Remicade | 1999 | Anti-TNF | AcMo quimérico | 6–10mg/kg/8 semanas IV (inicialmente dosis a las semanas 0–2–6) | Pediátrica: enfermedad de Crohn. En AIJ como uso compasivoAdultos: AR, artritis psoriásica, espondilitis anquilosante |
| Golimumab | Simponi | 2009 | Anti-TNF | AcMo humano | 30mg/m2/4 semanas (máx. 50mg) sc | Pediátrica: no autorizado, uso compasivoAdultos: AR, artritis psoriásica, espondilitis anquilosante |
| Rilonacept | Rilonacept Regeneron | 2009 | Anti-IL-1 | Proteína de fusión | 4,4mg/kg (máx. 320mg) dosis de carga2,2mg/kg/semana (máx. 160mg) | Pediátrica: CAPS en > 12 años. En AIJ como uso compasivoAdultos: CAPS |
| Rituximab | MabThera | 1998 | Anti-CD20 | AcMo quimérico | 750mg/m2 (máx. 1.000mg) IV a las 0 y 2 semanas | Pediátrica: no autorizado, uso compasivoAdultos: AR |
| Tocilizumab | RoActemra | 2009 | Anti-IL6 | AcMo humanizado | <20kg 12mg/kg/15díasIV>20kg 8mg/kg/15díasIV | Pediátrica: AIJ sistémica en pacientes > 2 añosAdultos: AR |
AcMo: anticuerpo monoclonal; AR: artritis reumatoide; CAPS: síndromes periódicos asociados a criopirina; EMA: Agencia Europea del Medicamento; IV: vía intravenosa; sc: subcutáneo.
Etanercept3 (ETN), infliximab4 (IFX), adalimumab5 (ADA) y, en general todos los fármacos anti-TNF, comparten la misma indicación: el tratamiento de la AIJ de curso poliarticular refractaria al tratamiento con FAME. En la práctica diaria también se utilizan como uso compasivo para la uveítis asociada a AIJ refractaria al tratamiento habitual, para lo que se utiliza IFX o ADA, y para las artritis relacionadas con entesitis/espondiloartropatías y artritis psoriásica que cursan con afectación axial (columna y/o articulaciones sacroilíacas) donde representan el único tratamiento que ha demostrado ser eficaz a medio plazo.
No todos los anti-TNF están autorizados para uso pediátrico, como sucede con 2 moléculas muy prometedoras comercializadas recientemente, golimumab6, de administración mensual, y certolizumab pegol7. En la actualidad, se están realizando ensayos clínicos con ambas moléculas en niños > 2 años con AIJ de curso poliarticular en Europa (golimumab, EudraCT 2009-015019-42) y en EE. UU. (golimumab NCT01230827; certolizumab pegol NCT01550003).
EfectividadLa respuesta de la AIJ al tratamiento se valora mediante un índice de mejoría sintético constituido por 6 variables denominado índice ACR pediátrico8 (tabla 2). Para considerar que la enfermedad mejora se requiere un determinado nivel de mejoría (30–50–70–90%) en al menos 3 de las 6 variables, sin que empeore más de una de las 3 restantes en más de un 30%. Este índice permite valorar no solo el porcentaje de pacientes que mejora, sino también cuantificar dicha mejoría. La eficacia de ETN, IFX y ADA es similar, aunque la molécula sobre la que existe más experiencia y publicaciones es, con gran diferencia, ETN. Estos fármacos permiten alcanzar índices de mejoría ACRped50 y 70 a los 3 meses de tratamiento al 60–75% y al 35–50% de los pacientes, respectivamente. Estos porcentajes aumentan a los 6 meses de tratamiento, registrándose mejorías muy significativas —ACPped70- en el 55–70% de los enfermos. La única serie pediátrica española publicada hasta la fecha con ETN obtuvo resultados similares9. La respuesta al tratamiento, sin embargo, no es homogénea entre todas las formas clínicas de AIJ, siendo excelente en las artritis relacionadas con entesitis y mucho menos eficaz en las formas sistémicas10,11. Una vez confirmada la efectividad de la terapia anti-TNF en el tratamiento de la AIJ, se plantean 3 preguntas:
- 1.
¿Debe administrarse en monoterapia o asociada a MTX? El IFX debe administrarse siempre con MTX para disminuir la formación de anticuerpos anti-IFX, dado su origen quimérico (25% de la molécula de origen murino). En lo referente al ETN, un estudio abierto reveló que a los 12 meses de tratamiento la respuesta ACRped50 y 70 era un 11 y un 17% superior en quienes habían recibido ETN + MTX que en quienes solo recibieron ETN12. La combinación ADA + MTX también resultó un 20% superior a la administración de ADA en monoterapia a las 16 semanas5. La terapia combinada con MTX, sin embargo, parece aumentar la incidencia de infecciones.
- 2.
¿La falta de eficacia de un primer anti TNF implica que la enfermedad es refractaria a estas moléculas? No necesariamente. Los pacientes que no responden al ETN pueden responder a los monoclonales IFX o ADA. Asimismo, los pacientes que han respondido al IFX y que han presentado reacciones infusio- nales que han obligado a suspender el tratamiento se pueden beneficiar de otro anti-TNF.
- 3.
¿Cuándo se debe suspender el tratamiento? No hay una respuesta clara. El 69% de los pacientes a quienes se había suspendido el ETN tras permanecer en remisión durante al menos 6 meses recurrían, independientemente del tiempo de inactividad de la enfermedad o de si el tratamiento se había suspendido brusca o progresivamente, disminuyendo la dosis o aumentando el intervalo. La recaída se producía una media de 6 meses después de suspender el tratamiento y el 100% respondió a la reintroducción de ETN13.
Componentes del criterio de mejoría de la artritis juvenil de la Sociedad Americana de Reumatología (American College of Rheumatology) o ACR pediátrico8.
| Variables |
| Número de articulaciones activas (con artritis) |
| Número de articulaciones limitadas |
| Evaluación global de la actividad de la enfermedad valorada por el médicoa |
| Evaluación global de la actividad de la enfermedad valorada por el paciente o su familiaa |
| Capacidad funcional del pacienteb |
| Reactante de fase agudac |
Las evaluaciones globales se realizan utilizando una escala visual analógica de 10cm con los valores «0» (enfermedad sin actividad) y «10» (enfermedad muy activa) situados en los extremos de la misma.
La capacidad funcional se valora mediante la versión validada al español del cuestionario cHAQ (childhood Health Assessment Questionnaire), que valora distintas actividades cotidianas, como el aseo, la deambulación, la capacidad de prensión o de alimentarse sin asistencia. Las puntuaciones oscilan entre 0 (sin limitación) y 3 (severa limitación funcional).
Los anti-TNF se han mostrado como fármacos seguros, existiendo en la actualidad pacientes que han recibido ETN ininterrumpidamente durante 8 años. Los efectos adversos (EA) más frecuentes son las reacciones locales (tabla 3), las reacciones infusionales y las infecciones respiratorias de vías altas (IRVA), siendo poco frecuentes las infecciones graves (13/100 años-paciente)14. También se ha descrito la aparición de un primer episodio de uveítis o de enfermedad inflamatoria intestinal durante el tratamiento, sobre todo con ETN, el desarrollo de psoriasis y otros EA extraordinariamente infrecuentes (enfermedad desmielinizante) o de significado incierto (desarrollo de autoanticuerpos). No parece que la terapia anti-TNF aumente la tasa de neoplasias en pacientes con AIJ15.
Efectos adversos de la terapia biológica.
| Efecto adverso | Comentarios |
| Reacciones locales | Eritema, prurito o dolor en el punto de la inyección. Frecuentes con anakinra, ETN y ADA |
| Reacciones infusionales | Reacciones anafilácticas, angioedema, alteraciones de la PA, cefalea, náuseas, sensación de mareo, etc. Frecuentes con IFX y RTX |
| Infecciones leves | Principalmente infecciones de vías respiratorias altas, ocasionalmente infecciones urinarias. Frecuentes con todos |
| Infecciones graves | Precisan hospitalización (neumonías, pielonefritis) o ponen en riesgo la vida del paciente (meningitis, encefalitis). Descrito un aumento del riesgo de tuberculosis. Las infecciones oportunistas son excepcionales |
| Elevación de transaminasas (> 3 veces el límite superior) | Descrito con todos los biológicos, más frecuente con TCZ |
| Citopenias | Descritas con todos los biológicos. Incluye neutropenia (TCZ y anakinra), leucopenia (RTX) y trombopenia (TCZ) |
| Autoanticuerpos | Descritos con terapia anti-TNF con menor frecuencia que en adultos, títulos bajos, sin repercusión clínica aparente |
| Enfermedad inflamatoria intestinal | Descrita ocasionalmente con ETN y anakinra |
| Uveítis | Descrito ocasionalmente, más frecuente con ETN |
| Enfermedad desmielinizante | Descrita excepcionalmente con todos los anti-TNF y abatacept |
| Psoriasis | Descrito excepcionalmente con todos los anti-TNF |
ADA: adalimumab; ETN: etanercept; IFX infliximab; RTX rituximab; TCZ tocilizumab.
Antes de iniciar el tratamiento, se debe descartar la existencia de infecciones latentes (Mantoux y serología de hepatitis) realizando posteriormente un seguimiento clínico y analítico periódico. Los controles deben ser realizados por facultativos con experiencia en el manejo de estos fármacos.
AbataceptEs una proteína de fusión constituida por el dominio ex-tracelular de CTLA4 (antígeno 4 asociado al linfocito T citotóxico) unido al fragmento Fc de la IgG116. Su diana es la molécula B7, sin cuya señal coestimuladora no se pueden activar los linfocitos T. Su indicación es la AIJ poliarticular (tabla 1), siendo también utilizado como uso compasivo para las uveítis asociadas a AIJ refractarias al tratamiento habitual y a terapia anti-TNF.
EfectividadEl 50% de los pacientes que reciben abatacept alcanza el ACRped50 a los 4 meses de tratamiento, logrando el ACR-ped70 el 28%16. Esta mejoría se mantiene en el tiempo17. Es muy interesante observar que los pacientes que no han recibido anteriormente terapia anti-TNF responden mejor al fármaco16.
SeguridadPresenta un buen perfil de seguridad con escasas reacciones infusionales e infecciones graves, aunque se ha descrito un caso (entre 153 pacientes) de enfermedad desmielinizante.
Terapia anti-interleucina-1Se empezó a utilizar en pacientes con AIJ sistémica (AIJs) al confirmar que estos presentaban una sobreexpresión de IL-118 revolucionando su tratamiento. La primera molécula empleada fue anakinra, un antagonista del receptor de IL-1, que se utiliza para esta indicación como uso compasivo.
EfectividadSe dispone de pocos estudios. Inicialmente responden más del 60% de los enfermos19, aunque las recaídas son frecuentes. La respuesta clínica, cuando existe, es inmediata, motivo por el que algunos autores lo utilizan como terapia inicial de la AIJs20.
SeguridadEl EA más habitual son las reacciones locales que, aunque tienden a disminuir con el tiempo, representan un problema ya que el fármaco se administra a diario. Otros EA incluyen IRVA (infección respiratoria de vías altas), cefalea, neutropenia, anemia y elevación de transaminasas. En un paciente se describió la aparición de enfermedad de Crohn.
Posteriormente, se han comercializado otros anti-IL-1, ca-nakinumab, cuyos resultados iniciales en el tratamiento de la AIJs son muy prometedores21, y rilonacept1.
Terapia anti-interleucina-6Al igual que sucede con la IL-1, la expresión de IL-6 está muy aumentada en pacientes con AIJs22. Tocilizumab (TCZ) es un anticuerpo monoclonal cuya diana terapéutica es el receptor de IL-6 y cuya indicación es el tratamiento de la AIJs.
EfectividadEn el único ensayo clínico publicado el porcentaje de pacientes con AIJs que alcanzaron el ACRped50 y 70 a las 6 semanas de tratamiento fue del 86 y el 68%, respectivamente23. A las 48 semanas habían alcanzado estos porcentajes el 94 y el 90% de los pacientes, respectivamente. También se ha utilizado con éxito en pacientes con AIJ poliarticular, alcanzándose índices ACR-ped70 en el 88% de los enfermos a las 48 semanas.
SeguridadLos EA más frecuentes son las IRVA y otras infecciones no graves. También se han registrado citopenias, principalmente neutropenia y trombopenia, así como elevaciones de LDH y AST/ALT. En adultos son frecuentes las alteraciones del perfil lipídico.
La utilización en la práctica clínica de estos fármacos en AIJs ha puesto de manifiesto la existencia de 2 poblaciones de pacientes, una que responde a terapia anti-IL-1 rápidamente y de manera continuada, y otra, generalmente con más articulaciones afectadas, en que mejora la sintomatología sistémica persistiendo la articular; esta población parece responder a TCZ24.
RituximabEs un anti CD20 muy poco utilizado en el tratamiento de la AIJ. El único ensayo clínico publicado con rituximab (RTX) incluía a 55 niños con AIJs y poliarticular refractaria a FAME y anti-TNF; a las 48 semanas el 70% alcanzaba el ACR-ped7025. Esta respuesta, sin embargo, se obtenía con una elevada tasa de EA incluyendo reacciones infusionales (31%), infecciones (neumonía en el 14%, por Pneumocystis en 6/8), neutropenia (14%) e hipogammaglobulinemia (20%).