Puntos clave
La Organización Mundial de la Salud (OMS) ha señalado la obesidad infantil como el reto en salud pública más importante del siglo xxi y ha estimado que en el año 2010, globalmente, 42 millones de niños menores de 5 años presentan sobrepeso1. En España, el estudio enKid en 2003 informó de una prevalencia de un 13,9% para la obesidad y de un 26,3% para el sobrepeso y obesidad en conjunto2. La obesidad se asocia con un incremento de los factores de riesgo metabólicos y cardiovasculares. El síndrome metabólico (SM) es una entidad clínica heterogénea en la que coexisten múltiples alteraciones metabólicas y vasculares cuya concurrencia aumenta la probabilidad de sufrir enfermedad cardiovascular y diabetes tipo 2 (DM2). Hasta 2007, cuando la International Diabetes Federation (IDF) propuso una definición de consenso, se había intentado caracterizar el SM en los niños y adolescentes a través de la adaptación de definiciones propuestas para adultos.
DefinicionesEl SM puede considerarse el agrupamiento de numerosos factores de riesgo, entre ellos la hipertensión arterial (HTA), la dislipemia, la alteración en la tolerancia a la glucosa y la adiposidad de distribución central. Las descripciones sobre su agrupamiento se han desarrollado por lo menos durante los últimos 90 años. En 1988, Reaven acuñó el término de síndrome X para describir la conjunción de diferentes alteraciones metabólicas que aparecían simultáneamente y propuso la resistencia a la insulina como el hecho explicativo de la dislipemia, de la HTA y de la diabetes. Se propusieron diferentes nombres para este síndrome, como síndrome plurimetabólico, síndrome X plus o síndrome de resistencia insulínica, entre otros. Sin embargo, desde mediados de la década de los noventa la denominación más utilizada ha sido la de “síndrome metabólico”. En esta última década la definición del SM ha sido objeto de controversia, incluso su propia existencia como entidad ha sido debatida.
En 1998, la OMS3 propuso una definición del SM que fue seguida de otras. En 2001, la propuesta de simplificar el diagnóstico clínico realizada en el informe del National Cholesterol Education Program Adult Treatment Panel (NCEP ATP III)4 significó un importante cambio. Actualmente, las definiciones más utilizadas son las de la IDF de 20055 y la del NCEP ATP III revisada6 (tabla 1).
Definición del síndrome metabólico en adultos
| World Health Organization, 199910 |
|
| National Cholesterol Education Program Adult Treatment Panel III Report, 20019,11 | Tres de los 5 siguientes:
|
| International Diabetes Federation, 20054 | Obesidad central definida como perímetro abdominal ≥ 94cm en varones y ≥ 80cm en mujeres de origen europeo (hay valores específicos para otros grupos étnicos)b más 2 de los otros 4:
|
AAD: Asociación Americana de Diabetes; HDL: lipoproteínas de alta densidad; HTA: hipertensión arterial; IMC: índice de masa corporal; PAS presión arterial sistólica; PAD: presión arterial diastólica.
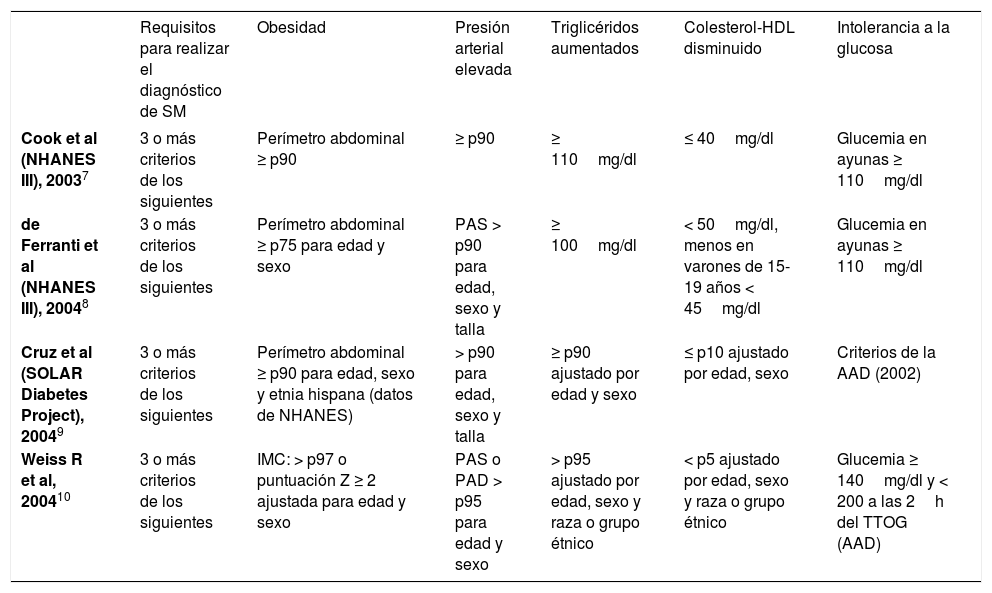
Se han realizado numerosos intentos de caracterizar el SM en el niño y adolescente. A lo largo de los últimos años los estudios que se han publicado han utilizado modificaciones de las definiciones existentes para adultos con unos criterios y puntos de corte para esos valores variables en función del autor7–10. Este hecho ha puesto de manifiesto la necesidad de un consenso en los criterios como base para futuros estudios; una definición unificada que pueda ser utilizada para valorar la prevalencia y los factores de riesgo en niños y adolescentes (tabla 2).
Definiciones del síndrome metabólico en la infancia y adolescencia
| Requisitos para realizar el diagnóstico de SM | Obesidad | Presión arterial elevada | Triglicéridos aumentados | Colesterol-HDL disminuido | Intolerancia a la glucosa | |
|---|---|---|---|---|---|---|
| Cook et al (NHANES III), 20037 | 3 o más criterios de los siguientes | Perímetro abdominal ≥ p90 | ≥ p90 | ≥ 110mg/dl | ≤ 40mg/dl | Glucemia en ayunas ≥ 110mg/dl |
| de Ferranti et al (NHANES III), 20048 | 3 o más criterios de los siguientes | Perímetro abdominal ≥ p75 para edad y sexo | PAS > p90 para edad, sexo y talla | ≥ 100mg/dl | < 50mg/dl, menos en varones de 15-19 años < 45mg/dl | Glucemia en ayunas ≥ 110mg/dl |
| Cruz et al (SOLAR Diabetes Project), 20049 | 3 o más criterios de los siguientes | Perímetro abdominal ≥ p90 para edad, sexo y etnia hispana (datos de NHANES) | > p90 para edad, sexo y talla | ≥ p90 ajustado por edad y sexo | ≤ p10 ajustado por edad, sexo | Criterios de la AAD (2002) |
| Weiss R et al, 200410 | 3 o más criterios de los siguientes | IMC: > p97 o puntuación Z ≥ 2 ajustada para edad y sexo | PAS o PAD > p95 para edad y sexo | > p95 ajustado por edad, sexo y raza o grupo étnico | < p5 ajustado por edad, sexo y raza o grupo étnico | Glucemia ≥ 140mg/dl y < 200 a las 2h del TTOG (AAD) |
AAD: Asociación Americana de Diabetes; HDL: lipoproteínas de alta densidad;
PAS presión arterial sistólica; PAD: presión arterial diastólica; TTOG: test de tolerancia oral a la glucosa.
En 2007, la IDF publica su definición de SM en niños y adolescentes11. Su intención ha sido la de proporcionar una herramienta que sea aceptada universalmente, fácil de utilizar para el diagnóstico precoz y que permita estimar la prevalencia global del SM y realizar comparaciones válidas entre diferentes países (tabla 3).
Definición de consenso de la IDF del síndrome metabólico en niños y adolescentes
Grupo de edad entre 6 y menos de 10 años
|
Grupo de edad entre 10 y menos de 16 años
|
Grupo de edad de 16 años o mayores
|
HDL: lipoproteínas de alta densidad; HTA: hipertensión arterial; PAD: presión arterial diastólica;
PAS: presión arterial sistólica; SM: síndrome metabólico.
La definición de la IDF divide a los niños y adolescentes por su edad en 3 grupos:
- —
De 6 a < 10 años.
- —
De 10 a < de 16 años.
- —
≥ 16 años.
Los menores de 6 años han sido excluidos al no haber datos suficientes sobre este grupo de edad.
La obesidad abdominal, medida a través del perímetro abdominal, es factor sine qua non en los 3 grupos. Esta decisión se apoya en el hecho de que el perímetro abdominal en los niños es un factor predictor independiente de resistencia a la insulina, valores lipídicos y presión arterial, además de la presencia de una evidencia inequívoca del peligro que la obesidad abdominal supone en el adulto. La decisión de establecer el punto de corte en el percentil 90ha sido motivada por el hecho de que varios estudios de prevalencia previos7,10 habían establecido ese punto, así como porque los niños con un perímetro abdominal por encima de ese percentil tienen más posibilidades de tener múltiples factores de riesgo12.
Lectura rápida
El síndrome metabólico (SM) puede considerarse el agrupamiento de numerosos factores de riesgo, entre ellos la hipertensión, la dislipemia, la alteración en la tolerancia a la glucosa y la adiposidad de distribución central. Las descripciones sobre el agrupamiento de los diferentes factores se han desarrollado por lo menos durante los últimos 90 años.
DefinicionesA lo largo de los últimos años, los estudios que se han publicado han utilizado modificaciones de las definiciones existentes para adultos con unos criterios y puntos de corte para los valores variables en función del autor. La definición para niños y adolescentes de la International Diabetes Federation (IDF) de 2007 los divide por su edad en 3 grupos: a) de 6 a < 10 años; b) de 10 a < de 16 años, y c) ≥ 16 años. La obesidad visceral, medida a través del perímetro abdominal, es factor sine qua non en los 3 grupos. El resto de los criterios son los triglicéridos elevados: ≥ 150mg/dl, el colesterol unido a las lipoproteínas de alta densidad (cHDL) reducido < 40mg/dl, la presión arterial sistólica elevada ≥ 130 o diastólica ≥ 85mmHg y la glucemia plasmática en ayunas ≥ 100mg/dl o diabetes tipo 2 previamente conocida.
Para los valores de corte de los triglicéridos y del cHDL, la IDF ha tomado los del adulto del ATP III. El punto de corte para la alteración de la glucosa en ayunas es el recomendado por la Asociación Americana de Diabetes (AAD) y aceptado también en la revisión del ATP III6,13 y el punto de corte para la presión arterial sigue las recomendaciones del National High Blood Pressure Education Program (NHBPEP)14.
La IDF considera esta definición un punto de partida, cuyos criterios deberán ser revisados en función de los resultados de los estudios que se publiquen.
Lectura rápida
Los estudios prevalencia del SM en los niños y adolescentes tienen la limitación de que al no haber existido hasta 2007 una definición de consenso como tal los criterios diagnósticos no sean homogéneos. En EE.UU. la prevalencia en adolescentes del estudio NHANES (1988–1994) fue del 4,2% y puso de manifiesto que aumentaba mucho en sujetos con obesidad (28,7%). Cerca del 80% de los adolescentes que presentaba SM tenían sobrepeso u obesidad. El estudio sobre el grupo procedente del NHANES 1999–2000 reveló que la prevalencia había ascendido al 6,4%. En España, en 2007 un estudio de una población de obesos de entre 6–14 años encontró el SM en el 18,6% de los sujetos, con una frecuencia mayor en sujetos puberales (26,2%) que en prepuberales (12,7%).
Los estudios prevalencia del SM en los niños y adolescentes tienen la limitación de que al no haber existido hasta 2007 una definición de consenso como tal los criterios diagnósticos no son homogéneos.
Cook et al en 20037 estudiaron un grupo de adolescentes entre 12–19 años procedentes del National Health and Nutrition Examination Survey (NHANES 1988–1994). Encontraron una prevalencia del 4,2% y pusieron de manifiesto que aumentaba mucho en sujetos con sobrepeso u obesidad (28,7% en obesos, 6,8% en sujetos con sobrepeso y 0,1% en sujetos normales). Cerca del 80% de los adolescentes que presentaba SM tenían sobrepeso u obesidad. Duncan et al15, sobre 991 adolescentes entre 12–19 años procedentes del NHANES 1999–2000, informaron que la prevalencia había ascendido al 6,4%.
En 2007, Goodman et al16, en una población escolar de 1.098 adolescentes, encuentran una prevalencia entre el 3,4 y el 5,2% en función de la definición utilizada, siendo en los obesos de entre el 14,8 y 23,6%. También observa que el diagnóstico categórico de SM durante la adolescencia es inestable.
En España, López Capapé et al en 200617 estudian una población con un índice de masa corporal (IMC) por encima de 2 desviaciones estándar y encuentran una prevalencia del 18%. Tapia et al en 200718 estudiaron una población de obesos de entre 6–14 años y encontraron SM en el 18,6% de los sujetos con una frecuencia mayor en sujetos puberales (26,2%) que en prepuberales (12,7%). Esta prevalencia es más baja que la hallada en los estudios realizados en niños obesos americanos por Cook et al (28,7%)7, Cruz et al (30%)9, Weiss et al (38,7%)10 y de Ferranti et al (31,2%)8, pero similar a la encontrada por Yoshinaga et al en Japón (17,7%)19 y Agirbasli et al en Turquía (21%)20.
Lectura rápida
El estudio Bogalusa mostró que el sobrepeso infantil está relacionado con el desarrollo de factores de riesgo cardiovascular en el adulto. En adultos está bien establecido que el exceso de grasa visceral está asociado a un aumento del riesgo cardiovascular, independientemente de la grasa corporal total. Hay evidencias de que el perímetro abdominal en los niños es un predictor independiente de resistencia a la insulina, valores lipídicos y presión arterial, todos ellos componentes del SM. La correlación entre el perímetro abdominal y la grasa visceral se ha demostrado en niños y jóvenes.
En 2004, la OMS comunicó que se estimaba que 22 millones de niños menores de 5 años y el 10% de los niños entre los 5 y 17 años presentaban sobrepeso o eran obesos. Actualmente estima que son unos 42 millones, y que 35 millones de ellos habitan en países en vías de desarrollo1. En España, el estudio enKid en 2003 ya informó de una prevalencia de la obesidad de un 13,9% y de un 26,3% de sobrepeso y obesidad2.
El estudio Bogalusa mostró que el sobrepeso infantil está relacionado con el desarrollo de factores de riesgo cardiovascular en el adulto y esto es atribuible a la tendencia que existe a mantener el sobrepeso u obesidad de la infancia al pasar a la edad adulta21.
El grado de adiposidad durante la infancia es un fuerte predictor de obesidad, resistencia a la insulina22 y anomalías lipídicas en la edad adulta23 y se ha asociado significativamente con el desarrollo del riesgo cardiovascular en los adultos jóvenes24.
En adultos, está bien establecido que el exceso de grasa visceral está relacionado con un aumento del riesgo cardiovascular, independientemente de la grasa corporal total25. Hay evidencias de que el perímetro abdominal en los niños es un predictor independiente de resistencia a la insulina26, valores lipídicos y presión arterial, todos ellos componentes del SM27. La correlación entre el perímetro abdominal y la grasa visceral se ha demostrado en niños y jóvenes28. En la actualidad se dispone de curvas percentiladas de perímetro abdominal para niños españoles29.
La grasa visceral produce citocinas proinflamatorias (interleucina 6 [IL-6] y factor de necrosis tumoral alfa [TNF-α]) y adipocitocinas (adiponectina y leptina) cuya función secretora parece estar directamente asociada con la obesidad y la resistencia a la insulina30. La hiperexpresión por el tejido adiposo y sus macrófagos de IL-6 y TNF-α participa indirectamente en un aumento de la lipólisis y de la síntesis hepática de ácidos grasos, aumentando de esta forma los valores séricos de ácidos grasos y triglicéridos. La cascada inflamatoria desencadenada por estas citocinas se incrementa con la hiperinsulinemia. Además, la IL-6 y el TNF-α disminuyen la señal del receptor de la insulina produciendo el aumento de la RI31.
Por otra parte, la proteína C reactiva (PCR) se produce en el hígado y está regulada por las citocinas inflamatorias, fundamentalmente IL-6 y TNF-α. Se ha localizado en las placas ateroscleróticas y en el infarto agudo de miocardio (IAM), donde inicia la activación del complemento. En adolescentes sanos se ha asociado significativamente con la RI y los componentes del SM. Sin embargo, al ajustar sus valores en función de la grasa corporal esta asociación resulta atenuada, lo cual sugiere que la obesidad precede el incremento de la PCR32. Las relaciones temporales y causales son inciertas.
Respecto al papel que podría desempeñar el estrés oxidativo, modelos experimentales en animales sugieren que la obesidad precoz ocasionada por una dieta muy calórica y rica en grasas produce un aumento del estrés oxidativo vascular y disfunción endotelial, previamente al desarrollo de la RI y al estrés oxidativo sistémico33. En adolescentes, se ha documentado una asociación significativa entre la HTA y el estrés oxidativo, independiente del IMC34. También existen relaciones significativas entre el estrés oxidativo con la adiposidad y la RI35. Este tema se perfila como una importante área para futuras investigaciones.
El papel del cortisol como mediador de la acumulación visceral de grasa, de la RI y de la DM2 se ha demostrada en animales. Hay evidencias convincentes de la asociación entre el cortisol elevado y el distrés psicológico con la distribución grasa de predominio abdominal en adultos36. Los datos sugieren que el cortisol es importante tanto para el aumento de la adiposidad visceral como en la promoción del SM.
Lectura rápida
La resistencia insulínica (RI) como el eje central de la patogenia del SM es defendida por muchos autores. En la práctica clínica diaria, la medida analítica del grado de RI resulta muy complicada, por lo que se ha sustituido por la medida de la grasa visceral a través del perímetro abdominal. La hiperinsulinemia en ayuno, marcador de RI, se asocia con la aterosclerosis y la enfermedad cardiovascular. Mientras el páncreas es capaz de compensar la RI la glucemia permanece dentro de los límites normales. Sin embargo, en algunos individuos la capacidad de las células β se erosiona a través del tiempo y desemboca en una diabetes tipo 2 (DM2). Los factores que hacen que en algunos individuos progrese la alteración hasta una DM2 no son actualmente bien conocidos, aunque se sabe que existe una fuerte predisposición familiar.
La HTA es un componente fundamental del SM6 y se comporta como un factor de confusión respecto a la RI dada la relación independiente existente entre HTA y obesidad.
El aumento en el tono del sistema nervioso simpático (SNS) se ha asociado en los adolescentes con la obesidad y tanto la insulina como la leptina parecen tener un efecto directo sobre la actividad de éste.
Algunos estudios han mostrado la correlación entre los valores de insulina en ayunas con la presión arterial en niños y adolescentes37. Otros estudios en adolescentes38, sin embargo, no han encontrado correlaciones significativas entre la presión arterial con la insulina en ayunas, la RI, el nivel de triglicéridos, el cHDL y el colesterol unido a las lipoproteínas de baja densidad (cLDL). Sin embargo, cuando los factores del SM se consideraron como un cluster en vez que de forma independiente, y la comparación se realizó entre los niños con presión arterial alta y con presión arterial baja, en los niños con presión arterial alta la presencia del cluster de factores fue significativamente mayor. En 2007 el estudio longitudinal Fels describió una fuerte asociación entre la HTA en la infancia y el desarrollo del SM en la edad adulta39.
Lectura rápida
La hipertensión arterial (HTA) se comporta como un factor de confusión respecto a la RI dada la relación independiente existente entre HTA y obesidad. El aumento en el tono del sistema nervioso simpático (SNS) se ha asociado en los adolescentes con la obesidad, y tanto la insulina como la leptina parecen tener un efecto directo sobre la actividad de éste. Cuando los factores del SM se consideran como un cluster en vez que de forma independiente y se comparan niños con presión arterial alta y con presión baja, en los niños con presión arterial alta la presencia del cluster de factores es mayor.
Las anomalías lipídicas y en particular la elevación de los TG y el descenso del cHDL están fuertemente asociadas con la RI40. Sin embargo, se desconoce aun si es la RI la que induce la dislipemia o si ambas son consecuencia de un mecanismo subyacente común. Los datos del Bogalusa Heart Study han mostrado que los niños con sobrepeso presentan unos valores significativamente más elevados de colesterol total, cLDL, TG y más bajos de cHDL que los niños con un peso normal41. Se ha propuesto la existencia del “fenotipo de la cintura hipertrigliceridémica” en adultos como predictor del SM. En un estudio en adolescentes y tomando como puntos de corte los criterios del ATP III modificados para TG séricos (≥ 110mg/dl) y perímetro abdominal ≥ p90 para edad y sexo se muestra la presencia simultánea de estos criterios junto a una acumulación de otras anomalías metabólicas, característica del SM42.
La apolipoproteína CIII, un marcador de lipoproteínas ricas en TG que están aumentadas en el SM, retrasa el aclaramiento de TG. Esto puede explicar por qué hay una preponderancia de partículas LDL pequeñas y densas en el contexto de síndrome metabólico, junto con la hipertrigliceridemia. Estas partículas pueden tener un potencial aterogénico aumentado. Se ha demostrado en niños una alta prevalencia de estas partículas en asociación con obesidad abdominal, grasa visceral y RI43. En la raza negra la hipertrigliceridemia es menos frecuente y el nivel de apolipoproteína CIII es racialmente más bajo. Dado que la dislipemia como en la actualidad está definida es menos frecuente en ellos, aunque ello no signifique que presenten un menor riesgo de DM2 o de enfermedad cardiovascular, se postula que quizás deberían establecerse en la raza negra otro tipo de umbrales para definir la dislipemia.
Lectura rápida
Las anomalías lipídicas y en particular la elevación de los triglicéridos (TG) y el descenso del c-HDL están fuertemente asociadas con la resistencia insulínica. Sin embargo se desconoce aún si la RI es la que induce la dislipemia o si ambas son consecuencia de un mecanismo subyacente común.
TratamientoActualmente no existe un tratamiento específico para el agrupamiento de factores de riesgo en los niños más allá de reducir la obesidad, incrementar la actividad física y tratar los diferentes componentes del SM.
La RI como el eje central de la patogenia del SM es defendida por muchos autores y queda reflejado este hecho en su importancia como criterio diagnóstico en los criterios de la OMS3. Dada la dificultad que conlleva en la clínica diaria la determinación analítica del grado de RI, la medida de la grasa visceral a través del perímetro abdominal se ha posicionado como el factor sine qua non en la definición de la IDF por su relación con el desarrollo de la enfermedad cardiovascular y la RI.
El papel de la insulinemia en el desarrollo de enfermedad cardiovascular es objeto de controversia. Se sabe que la hiperinsulinemia en ayuno, marcador de RI, se asocia con la aterosclerosis y la enfermedad cardiovascular44.
Hay evidencias de que la insulina actuaría directamente en la patogenia de la enfermedad cardiovascular pero contrariamente también se le han constatado efectos que dificultan la aterogénesis. Es posible que la hiperestimulación crónica del receptor de la insulina por la hiperinsulinemia produzca respuestas alternativas y la acción de la hormona se vea modificada.
Tanto la alteración en la respuesta a la insulina del hígado como del tejido adiposo como de ambas, puede llevar a la acumulación de ácidos grasos (AGL) circulantes que pueden conducir al aumento compensatorio de insulina por parte de las células β pancreáticas45. Con el paso del tiempo los individuos con RI llegan a presentar hiperinsulinemia. Mientras el páncreas es capaz de compensar la RI la glucemia permanece dentro de los límites normales. Sin embargo, en algunos individuos la capacidad de las células b se erosiona a través del tiempo y desemboca en una DM246.
Considerada una enfermedad del adulto, en la última década y paralelamente al aumento de la obesidad infantil, el diagnóstico de la DM2 ha sido mucho más frecuente. En función de la composición étnica de la población estudiada, entre el 8 y 50% de los adolescentes diagnosticados de diabetes presentan una DM2. Datos del estudio NHANES III revelan que la prevalencia de DM2 en los adolescentes es de 4,1/1.00047, coincidiendo su aumento con el aumento del sobrepeso y el sedentarismo en la infancia (tabla 4)48.
Criterios para el diagnóstico de la diabetes de la Asociación Americana de Diabetes48
|
Los niños con DM2 normalmente están asintomáticos y presentan de una leve a moderada hiperglucemia durante la adolescencia junto con obesidad, signos de RI y otros componentes del SM. Debido a lo relativamente reciente del problema en los adolescentes, hay pocos datos de seguimiento a largo plazo.
Los individuos obesos desarrollan diferentes grados de RI, pero no todos desarrollan intolerancia a la glucosa. Los factores que hacen que en algunos individuos progrese la alteración hasta una DM2 no son actualmente bien conocidos, aunque se sabe que existe una fuerte predisposición familiar. Cuando la DM2 comienza en la infancia, el riesgo de aterosclerosis acelerada es mayor que cuando la enfermedad comienza en la edad adulta.
Otras enfermedades relacionadas con el síndrome metabólicoEn las mujeres, el exceso de grasa visceral se relaciona con el hiperandrogenismo y éste, frecuentemente, se asocia con la RI49. Estas alteraciones metabólicas tienen lugar claramente en las mujeres adolescentes con SM y que presentan también un alto riesgo de padecer un síndrome del ovario poliquístico.
La prevalencia de esteatosis hepática no alcohólica, otra enfermedad asociada al SM, es difícil de estimar en niños, ya que su diagnóstico se realiza mediante biopsia hepática. Un estudio de 200650 encontró una prevalencia del 38% en autopsias de niños obesos.
Factores de riesgo y líneas para futuras investigacionesLos hijos cuyos padres presentan el SM tienen un riesgo alto de desarrollarlo ellos mismos, dado que comparten factores genéticos y ambientales. La importancia de una identificación precoz de estos niños no debe de ser minusvalorada.
Los resultados de los estudios longitudinales a largo plazo que se están realizando aportarán una importante información sobre la etiología y progresión del SM en los niños y adolescentes.
Las líneas de investigación sobre las que se han realizado recomendaciones de estudio son11,31:
- —
Las bases moleculares del SM.
- —
El papel que la predisposición genética y el entorno prenatal y neonatal tienen en el desarrollo de una futura RI y el SM; el bajo peso al nacer y el patrón de crecimiento.
- —
Las diferencias raciales/étnicas que existen en los mecanismos y las vías que conducen al SM.
- —
La relación entre exposición al medio ambiente o a toxinas y el desencadenamiento del síndrome.
- —
El estudio de la leptina y su mecanismo de regulación del peso corporal, así como de la adiponectina durante la infancia y adolescencia. Determinar su valor como predictores de la aparición del SM en la edad adulta.
- —
Estudio en la primera infancia de las vías que unen la RI y la obesidad con otros componentes del SM.
- —
El papel que desempeña el tratamiento médico de la RI, en la prehipertensión, en los cambios vasculares precoces, en la elevación de los triglicéridos y en el descenso del cHDL.
- —
La estabilidad del fenotipo del SM a lo largo de la infancia y adolescencia en estudios a gran escala.
- —
Seguimiento de cohortes multiétnicas hasta la edad adulta que determinen la historia natural y la efectividad de las intervenciones, en concreto sobre el estilo de vida.
Las intervenciones con una combinación de dieta y actividad física son las que parecen proporcionar las mayores mejoras en los componentes del SM. Actualmente, no existe un tratamiento específico para el agrupamiento de los factores de riesgo en los niños más allá de reducir la obesidad, incrementar la actividad física y tratar los diferentes componentes del SM. Además, Goodman et al en 200716 realizaron el seguimiento de un grupo de adolescentes y encontraron una inestabilidad en el diagnóstico categórico de SM que podría reflejar una baja utilidad clínica durante esta época de la vida y el uso de fármacos específicos para el SM durante la adolescencia, por tanto, podría ser prematuro (tabla 5).
Recomendaciones terapéuticas de la American Heart Association
| Comentario general | Paso 1 | Paso 2 |
|---|---|---|
| Estilo de vida | ||
| Todos: evaluación de la dieta, educación | Adecuar las calorías al crecimiento. Calorías en forma de grasa 25-35% de las que en forma de grasa saturada < 7% y grasa trans < 1%;colesterol < 300mg/día | |
| IMC p85-p95 | Mantener ese IMC para conseguir que < p85 al aumentar de edad Si el IMC > 25kg/m2, mantener el peso En los niños de 2–4 años conseguir reducciones del IMC logrando un aumento de peso < 1kg por cada 2cm de crecimiento líneal | |
| IMC > p95 | Adolescentes: pérdida de 1–2kg/mes para reducir IMC; niños más jóvenes: mantener el peso | Remitir al dietista |
| IMC ≥ p95 y comorbilidad | Pérdida de 1–2kg/mes para lograr un IMC más saludable; evaluar la necesidad de tratamiento de las comorbilidades | Remitir al dietista ± tratamiento farmacológico |
| Actividad física | Realizar una historia individualizada enfocada al tiempo que se emplea en el juego activo y frente a una pantalla. Objetivo: ≥ 1h de juego activo diario + TV-ordenador-videojuegos ≤ 2h al día. Fomentar la actividad en cada encuentro | Remitir a un especialista en ejercicio físico |
| Presión arterial | ||
| PAS ± PAD = p9095 o PA > 120/80mmHg (obtenida en 3 momentos diferentes a lo largo de 1 mes) más exceso de peso | Pérdida de peso 1–2kg/mes para lograr un IMC más saludable mediante la disminución de la ingesta calórica y el aumento de la actividad física | Remitir al dietista |
| PAS ± PAD > p95 inicial (confirmada en el plazo de 1 semana) o durante 6 meses PAS o PAD > p95 | Tratamiento farmacológico | |
| Triglicéridos | ||
| TG = 150–400mg/dl | Disminuir los azúcares simples; dieta baja en grasa saturadas y trans | |
| TG = 150–1.000mg/dl más exceso de peso | Remitir al dietista para el manejo de la pérdida de peso; formación sobre equilibrio energético y recomendaciones sobre actividad física (véase arriba) | Si TG 700–1.000mg/ dl: considerar fibratos o niacina si > 10 años de edad |
| TG ≥ 1.000mg/dl | Considerar fibratos o niacina | |
| Glucosa | ||
| Glucemia en ayunas 100–126mg/dl más exceso de peso | Pérdida de peso 1–2kg/mes para lograr un IMC más saludable mediante la disminución de la ingesta calórica y el aumento de la actividad física | |
| Glucemia en ayunas 100–126mg/dl repetidamente | Remitir al endocrinólogo | Tratamiento farmacológico sensibilizador a la insulina por el endocrinólogo |
| Glucemia casual > 200mg/dl o > 126mg/dl en ayunas Mantener HbA1c, < 7% | Remitir al endocrinólogo; tratamiento para la diabetes | |
IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TG: triglicéridos. Tomada de Steinberger et al. Circulation. 2009.