Puntos clave
El ronquido habitual durante el sueño, el signo guía del aumento de resistencia de la vía aérea superior (VAS), es extremadamente frecuente durante la infancia. Se calcula que tiene una incidencia del 10% entre la población preescolar y escolar1–8. No todos los niños con ronquido habitual presentan síndrome de apnea-hipoapnea obstructiva del sueño (SAHOS), aunque se ha establecido que puede estar presente entre el 2 y el 3% de la población infantil9,10. La máxima incidencia se observa sobre los 2 o 3 años y disminuye antes de los 9 años de edad11, y es un trastorno más frecuente en el sexo masculino.
Las principales consecuencias del SAHOS son problemas de conducta, dificultades de aprendizaje, retraso en el crecimiento, repercusiones cardiocirculatorias y pulmonares, y afectación de la calidad de vida de estos pacientes. Con un tratamiento adecuado, el SAHOS y sus complicaciones suelen desaparecer en la mayoría de los niños12.
Fisiopatología clínicaEl SAHOS consiste en la obstrucción completa (apnea) y/o parcial (hipoapnea) recurrente de la VAS durante el sueño, con persistencia de la actividad de los músculos respiratorios accesorios y diafragma, un reducido o ausente flujo aéreo nasobucal, hipercapnia y desaturación oxihemoglobínica. Los eventos respiratorios pueden estar acompañados de arousals o microdespertares que son responsables de la fragmentación del sueño del niño.
En el SAHOS infantil predomina la hipoapnea, mientras que en los adultos es más frecuente la apnea.
En la infancia, la causa más frecuente del SAHOS es la hipertrofia adenoidea y amigdalar. Es importante mencionar también el rápido incremento en las 2 últimas décadas de la prevalencia de obesidad infantil, que ha provocado un cambio de las características demográficas y antropométricas del niño que es derivado a la unidad de sueño para la evaluación del ronquido habitual. En Estados Unidos, a principios de los años noventa, menos del 15% de los pacientes pediátricos remitidos a una unidad de sueño eran obesos. Sin embargo, los datos obtenidos en los últimos 2 o 3 años demuestran que más del 50% de los niños derivados por sospecha de SAHOS cumplen criterios de obesidad.
Así pues, y considerando que la obesidad tiene un papel importante en la fisiopatología de la obstrucción de la VAS durante el sueño, y que desde el punto de vista fisiopatológico tanto la hipertrofia adenoamigdalar como el depósito de grasa en estructuras de la VAS desempeñan una función en este síndrome, se han propuesto 2 grupos o tipos diferenciados de SAHOS en niños: tipo I y tipo II.
El SAHOS tipo I se asocia a una marcada hipertrofia adenoamigdalar en ausencia de obesidad y en el SAHOS tipo II el niño presenta principalmente obesidad y una moderada o incluso leve hipertrofia adenoamigdalar.
Además, sería también necesario añadir un tercer grupo de SAHOS, el de pacientes con mala oclusión dental, que también muestran un perfil clínico distinto, pero que de momento no está bien definido12.
Lectura rápida
El ronquido habitual, el signo guía del aumento de resistencia de la vía aérea superior (VAS), está presente en el 10% de la población infantil, y la incidencia del síndrome de apnea-hipoapnea obstructiva del sueño (SAHOS) es del 2-3%.
Fisiopatología clínicaEl SAHOS es la obstrucción completa (apnea) y/o parcial (hipoapnea) recurrente de la VAS durante el sueño, con persistencia de la actividad de los músculos respiratorios, que provocan una desaturación de la hemoglobina e hipercapnia. En el SAHOS infantil predomina la hipoapnea, mientras que en el del adulto es más frecuente la apnea.
En la tabla 1 se recogen los principales factores de riesgo para el desarrollo de SAHOS. La infección de la VAS y la rinitis alérgica no son causas primarias de SAHOS, pero pueden desencadenar o agravar los síntomas clínicos en pacientes predispuestos13.
Principales factores de riesgo de síndrome de apnea-hipoapnea obstructiva del sueño
| Hipertrofia adenoamigdalar |
| Obesidad |
| Malformaciones craneofaciales con retrognatia, micrognatia, macroglosia, hipoplasia mediofacial, alteración en la base craneal, cuello corto y/o hendidura labiopalatina (por ejemplo, síndrome de Down, Treacher-Collins, Pierre-Robin, Pfeiffer, Crouzon, Apert, Klippel-Feil, acondroplasia) |
| Enfermedades neurológicas |
| Enfermedades neuromusculares (por ejemplo, enfermedad de Duchenne) |
| Parálisis cerebral infantil |
| Alteraciones neurológicas adquiridas (por ejemplo, traumatismo craneoencefálico, tumor) |
| Malformaciones estructurales del tronco cerebral (por ejemplo, síndrome de Moebius) |
| Otras enfermedades |
| Enfermedades por depósito (por ejemplo, mucopolisacaridosis) |
| Metabolopatías (por ejemplo, déficit de piruvatocinasa, déficit de carnitina, déficit de tirosinhidroxilasa) |
| Laringomalacia |
| Drepanocitosis |
El síntoma más común en el niño con alteraciones respiratorias durante el sueño es el ronquido, aunque no todos los niños que roncan tienen SAHOS. El pediatra debe intentar diferenciar, a partir de los datos clínicos, entre un niño con ronquido habitual y un niño afectado de SAHOS, a menudo polisintomático. Por otro lado, el SAHOS puede presentarse con ronquido escaso o nulo en el lactante.
El paciente con hipertrofia adenoamigdalar presenta, con frecuencia, obstrucción nasal y respiración bucal nocturna. En casos de importante hipertrofia adenoamigdalar también se presenta respiración bucal diurna, voz gangosa e incluso disfagia. Dado el aumento de la resistencia del flujo por la vía aérea, el paciente tiene un sueño intranquilo, con movimientos frecuentes, y puede adquirir posturas peculiares para optimizar la vía aérea, como la hiperextensión cervical14. El aumento de trabajo respiratorio ocasiona sudoración profusa, uso de musculatura respiratoria accesoria y, en ocasiones, movimiento toracoabdominal paradójico. Cuando se produce una apnea obstructiva el niño mantiene una lucha respiratoria ineficaz, con interrupción transitoria del flujo aéreo y, por lo tanto, desaparición del ronquido. Es infrecuente la cianosis clínica durante la apnea, aunque puede observarse en los casos graves. Tras el evento respiratorio puede producirse un arousal, que en ocasiones se traduce en despertar, aunque debe tenerse en cuenta que la mayoría de los arousals son corticales, sólo evidenciables mediante polisomnografía nocturna (PSG). Las parasomnias (sonambulismo, terrores nocturnos, etc.) también son más frecuentes en este grupo de pacientes15 y algunos niños con SAHOS, e incluso otros con ronquido habitual, presentan un aumento de la incidencia de enuresis nocturna16.
Por la mañana, los niños con respiración bucal nocturna suelen despertarse sedientos y con sequedad bucal. Los niños escolares pueden aquejar cefalea matutina en caso de hipoventilación nocturna, mientras que los lactantes y los niños en edad preescolar pueden mostrarse irritables. Estos síntomas mejoran durante las primeras horas de la mañana.
La fragmentación del sueño impide un descanso reparador, por lo que el niño afectado de SAHOS puede presentar un aumento del cansancio diurno y peor rendimiento escolar. La excesiva somnolencia diurna es más infrecuente que en el adulto, pues sólo la refieren el 7% de los padres, aunque su presencia aumenta hasta el 13-20% cuando se valora por la prueba de latencias múltiples en el laboratorio de sueño. En el niño con SAHOS son frecuentes las alteraciones conductuales y hasta el 30% de los casos presentan déficit de atención y/o hiperactividad. Algunos estudios demuestran una menor puntuación en tests de inteligencia, sin que haya resultados concordantes acerca de la repercusión en la memoria17.
En cuanto al aspecto nutricional, en el SAHOS es frecuente encontrar los 2 extremos: el niño con hipertrofia adenoamigdalar, que presenta fallo de medro a pesar de una ingesta adecuada debido a un aumento del consumo calórico por el trabajo respiratorio nocturno, y el niño con SAHOS asociado a obesidad. También se ha relacionado el SAHOS con una disminución de crecimiento somático. La coexistencia de SAHOS y reflujo gastroesofágico es frecuente y debe investigarse18.
Respecto a los efectos cardiovasculares se conoce que los episodios hipóxicos repetidos pueden ocasionar hipertensión pulmonar secundaria e incluso cor pulmonale, en edades precoces. En el adulto, el SAHOS se asocia a gravedad y prevalencia elevadas de síndrome metabólico (coexistencia de obesidad, resistencia a la insulina, dislipemia e hipertensión arterial). En el niño esta asociación no es tan evidente pero ya hay varios estudios que demuestran un aumento de resistencia a la insulina, hasta en el 30% de los pacientes con SAHOS obesos, y alteración de la homeostasia lipídica y aumento de los factores proinflamatorios en niños con SAHOS, sean obesos o no. Estos hallazgos predisponen a una mayor incidencia de futuras complicaciones cardiovasculares isquémicas. Dichos estudios también demuestran la reversibilidad de las alteraciones metabólicas tras el tratamiento del SAHOS12. En el niño la hipertensión arterial sistémica es menos frecuente que en el adulto, aunque pueden apreciarse discretas alteraciones cuando se realizan estudios con determinación de la presión arterial durante 24h.
Por último, el SAHOS tiene un impacto significativo sobre la calidad de vida (quality of life, QOL) de estos pacientes. Estudios mediante cuestionarios en niños con SAHOS demuestran que hay una importante afectación de la QOL, con puntuaciones similares a las de los niños con artritis idiopática juvenil. Estos índices se normalizan tras el tratamiento del SAHOS y posteriormente se mantienen a largo plazo19.
Lectura rápida
Estos trastornos respiratorios pueden acompañarse de arousals o microdespertares que causan la fragmentación del sueño; esto impide un descanso reparador y aumenta las alteraciones conductuales, como el déficit de atención y/o hiperactividad, lo cual supone un peor rendimiento escolar. Los signos nocturnos más destacados son la respiración bucal y los ronquidos, las pausas respiratorias y el aumento del esfuerzo respiratorio, el sueño inquieto nocturno, la hiperextensión cervical, la sudoración excesiva y la enuresis nocturna. El SAHOS tiene un impacto significativo sobre la calidad de vida de los pacientes, que se normaliza tras el tratamiento.
Las técnicas diagnósticas que se utilizan en los niños son las siguientes:
- 1.
Historia clínica completa, haciendo especial hincapié en la presencia de síntomas y/o signos relacionados con el sueño (tabla 2).
Tabla 2.Signos y síntomas de síndrome de apnea-hipoapnea obstructiva del sueño
Ronquido habitual (más de 3 noches por semana) Respiración bucal y limitación al flujo nasal Sueño agitado con frecuentes despertares nocturnos Aumento del esfuerzo respiratorio (tiraje) Pausas respiratorias observadas por los padres Posturas anómalas durante el sueño (hiperextensión cervical) Sudoración profusa Parasomnias (terrores nocturnos, pesadillas) Enuresis nocturna Cianosis Cefalea o irritabilidad matutina Cansancio o excesiva somnolencia vespertina - 2.
Exploración física completa, con especial atención a la anatomía craneofacial y de las VAS: nasofaringoscopia.
- 3.
La radiografía lateral de cavum es útil y fiable para la valoración de la disminución de la luz rinofaríngea por hipertrofia adenoidea, pero no para la valoración de la hipertrofia amigdalar. En el SAHOS tiene un valor diagnóstico mínimo20.
- 4.
Estudio de sueño nocturno por PSG: la PSG nocturna realizada en el laboratorio de sueño es la técnica diagnóstica de elección10. Consiste en el registro continuo y supervisado del estado de vigilia y de sueño espontáneo mediante el registro de:
- a)
Variables neurofisiológicas: electroencefalograma, electrooculograma, electromiograma tibial y submentoniano. Permite la valoración de los estadios y la arquitectura del sueño.
- b)
Variables cardiorrespiratorias con registro de:
- —
Flujo oronasal: para la valoración de eventos respiratorios: apneas, hipoapneas y limitaciones del flujo, mediante termosensores y cánulas nasales.
- —
Esfuerzo respiratorio: para la clasificación de los eventos respiratorios en centrales, obstructivos o mixtos mediante pletismografía de impedancia o bandas piezoeléctricas torácicas y abdominales. El método de referencia para la medición de los eventos respiratorios es el catéter esofágico aunque es muy poco utilizado en niños en nuestro medio.
- —
Valoración del intercambio gaseoso: saturación de oxígeno por oximetría de pulso y medida del CO2 espirado o transcutáneo.
- —
Frecuencia cardíaca.
- —
Ronquido.
- —
Posición corporal.
- —
- a)
- 5.
Alternativas diagnósticas a la PSG: diferentes estudios han intentado buscar alternativas diagnósticas a la PSG mediante la utilización de cuestionarios basados en el espectro de manifestaciones clínicas, registros de audiovídeo, oximetría de pulso nocturna o PSG de siesta diurna, pero la gran variabilidad de resultados obtenidos con bajas sensibilidades hace que en la práctica clínica diaria se siga considerando la PSG como la técnica diagnóstica de referencia10,11.
Dada la edad de los pacientes, requiere un entorno específico adecuado, adaptarse al horario de los niños y personal entrenado tanto en la realización de la técnica como en su interpretación.
Los criterios diagnósticos utilizados en el adulto no pueden emplearse en los niños (tabla 3). El criterio de pausas respiratorias ≥ 10s para definir un evento respiratorio en los adultos no es correcto en niños, ya que períodos más cortos son capaces de producir descensos de la saturación de la oxihemoglobina y aumentos de la presión arterial de CO221. En el año 2006 se publicaron los valores polisomnográficos de normalidad en niños22 y la American Academy of Sleep Medicine (AASM)23 en 2007 editó los criterios para la identificación de apneas y su clasificación, de hipoapneas, de limitaciones al flujo, de hipoventilación nocturna y de respiración periódica en niños (tabla 4).
Lectura rápida
El diagnóstico del SAHOS se basa en la historia clínica, la exploración física y los estudios de sueño nocturno. La polisomnografía, que mide variables neurofisiológicas y cardiorrespiratorias, es la técnica de elección. Los criterios polisomnográficos del niño son diferentes a los utilizados en los adultos. La poligrafía respiratoria, que mide variables cardiorrespiratorias pero excluye las neurofisiológicas, se acepta como alternativa para el diagnóstico de SAHOS en el adulto, pero en el niño no se ha validado adecuadamente.
TratamientoEl tratamiento de elección en presencia de una hipertrofia adenoamigdalar y SAHOS moderado o grave es la adenoamigdalotomía, que es la resección total del tejido adenoideo y parcial del tejido amigdalar. Las ventajas de esta técnica respecto a la amigdalectomía total son menos dolor y menos hemorragias, una recuperación más rápida y la conservación de la función inmunológica.
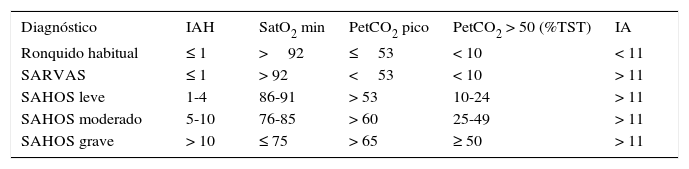
Clasificación diagnóstica de los trastornos respiratorios del sueño en niños
| Diagnóstico | IAH | SatO2 min | PetCO2 pico | PetCO2 > 50 (%TST) | IA |
|---|---|---|---|---|---|
| Ronquido habitual | ≤ 1 | >92 | ≤53 | < 10 | < 11 |
| SARVAS | ≤ 1 | > 92 | <53 | < 10 | > 11 |
| SAHOS leve | 1-4 | 86-91 | > 53 | 10-24 | > 11 |
| SAHOS moderado | 5-10 | 76-85 | > 60 | 25-49 | > 11 |
| SAHOS grave | > 10 | ≤ 75 | > 65 | ≥ 50 | > 11 |
IA: índice de arousals por hora de sueño; IAH: índice de apnea-hipoapnea por hora de sueño; PetCO2 > 50 (%TST): tiempo total de sueño con CO2 espirado superior a 50mmHg (en porcentaje); SARVAS: síndrome de aumento de resistencia de la vía aérea superior; SatO2 min: saturación de oxihemoglobina mínima (en porcentaje); PetCO2 pico: valor máximo de CO2 espirado (en mmHg).
Tomada de American Thoracic Society21.
Eventos respiratorios nocturnos
| Apnea obstructiva | Cese del flujo respiratorio durante 2 o más ciclos respiratorios con persistencia del movimiento toracoabdominal |
| Apnea central | Ausencia de esfuerzo inspiratorio y uno de los siguientes: 1) duración mínima de 20s. 2) Duración de 2 o más ciclos respiratorios asociado a arousal*, despertar, desaturación ≥ 3% y/o bradicardia |
| Apnea mixta | Se inicia igual que una apnea central y finaliza como una obstructiva. Duración mínima de 2 ciclos respiratorios |
| Hipoapnea | Descenso en la amplitud del flujo ≥ 50% del basal, al menos durante 2 ciclos respiratorios. El evento está asociado con un arousal*, despertar y/o desaturación ≥ 3% |
| RERA (respiratory related arousals) | Con cánula nasal se objetiva una caída ≥ 50% en la amplitud del flujo. Con catéter esofágico se observa un aumento progresivo del esfuerzo respiratorio durante el evento. En ambos casos, el evento se acompaña de ronquido, respiración ruidosa, elevación de CO2 o evidencia visual de aumento de esfuerzo respiratorio. Duración de al menos 2 ciclos respiratorios |
| Hipoventilación | CO2 > 50mmHg durante 10-25% del tiempo total de sueño, medido por CO2 espirado o transcutáneo |
| Respiración periódica | Presencia de > 3 apneas centrales, de > 3s de duración, separadas por menos de 20s de respiración normal |
Tomada de American Academy of Sleep Medicine23.
La utilización de vídeos domésticos ha sido poco investigada. La PSG de siesta diurna es útil si el resultado es positivo para el SAHOS, pero un resultado negativo no lo excluye y requiere la realización de una PSG nocturna completa.
Algo similar ocurre con la oximetría de pulso, en la que incluso un resultado positivo debe ser interpretado con cautela y previa exclusión de enfermedades respiratorias, que pueden dar lugar a falsos positivos.
La poligrafía respiratoria (PR), que se ha aceptado como una alternativa para el diagnóstico de SAHOS en el adulto, en el niño no ha sido adecuadamente validada24.
Los sistemas portátiles o de PR son sistemas diseñados inicialmente para su utilización en el domicilio y que típicamente incluyen la medida de variables cardiorrespiratorias pero no de variables neurofisiológicas. Las variables medidas son: flujo oronasal (generalmente medido con termístor y/o cánula nasal), esfuerzo respiratorio (torácico y/o abdominal), saturación de oxígeno por oximetría de pulso, posición corporal, ronquido y frecuencia cardíaca. Son técnicas no vigiladas y que no permiten intervención durante su realización.
Hay pocos estudios realizados con PR en niños y en ellos se ha incluido población de alto riesgo de SAHOS, con escaso número de pacientes y sin comparar simultáneamente con la PSG, obteniéndose resultados discordantes24–27.
Un grupo español ha publicado recientemente un estudio en 53 niños con sospecha clínica de SAHOS, a los cuales se les realizó simultáneamente PSG y PR en el laboratorio de sueño. Considerando como diagnóstico de SAHOS la presencia de un índice de apneas/ hipoapneas por hora de sueño (IAH) ≥ 3 en la PSG y un índice de eventos respiratorios (IER) ≥ 3 en PR, la coincidencia diagnóstica fue del 84,9%28.
Lectura rápida
La amigdalotomía es un proceso apto para ser realizado en la unidad de cirugía ambulatoria. El SAHOS leve con un índice de apneas/ hipoapneas (IAH) por hora de sueño de 1–4 se puede tratar con corticoides tópicos nasales y montelukast, y en el SAHOS con un IAH superior a 4 puede realizarse una adenoamigdalotomía. La ventilación no invasiva tiene indicación en niños con SAHOS residual tras tratamiento quirúrgico o en casos de contraindicación quirúrgica, siendo la presión aérea positiva continua (CPAP) la modalidad ventilatoria de elección.
La causa fundamental del SAHOS pediátrico es la hipertrofia adenoamigdalar y el tratamiento consiguiente es la adenoamigdalotomía29,30.
Actualmente está aumentando cada vez más la indicación quirúrgica por problemas obstructivos de la vía respiratoria y va disminuyendo la indicación por causa infecciosa31,32.
Hasta hace poco, las amígdalas hipertróficas obstructivas se extirpaban en su totalidad para resolver la obstrucción. Si se tiene en cuenta que el tejido amigdalar presenta características protectoras importantes, está indicado resecar solamente el tejido que causa obstrucción dejando restos de tejido amigdalar en los lechos amigdalares, preservando así la función inmunológica y siendo al mismo tiempo menos agresivo quirúrgicamente33. Esta intervención se denomina amigdalotomía y se realiza con equipos de láser o de radiofrecuencia.
Las ventajas principales de la amigdalotomía con respecto a la amigdalectomía son que:
- —
Disminuye el dolor postoperatorio al conservarse la cápsula amigdalar y no afecta al plano muscular subyacente34,35.
- —
Produce menos hemorragias secundarias tardías y mínima hemorragia intraoperatoria36.
- —
La recuperación es más rápida, habitualmente sin pérdida de peso, y está causada por la odinodisfagia postoperatoria37.
- —
Conserva la función inmunológica del tejido linfoide amigdalar38.
Se han estudiado los resultados a largo plazo y no se han encontrado diferencias significativas en las tasas de reaparición de ronquido y/o sintomatología de SAHOS con ambas técnicas37,39.
En los niños con SAHOS y que además padecen 4 o más episodios de amigdalitis bacterianas al año se debe practicar siempre una amigdalectomía, es decir, una resección completa de todo el tejido amigdalar.
Por las características de ser una intervención poco invasiva, de corta duración, con recuperación rápida del niño y dolor postoperatorio previsible de intensidad leve y moderada, la amigdalotomía es un procedimiento apto para ser realizado en la unidad de cirugía ambulatoria (UCA), siempre que el paciente cumpla con los criterios de la UCA (tabla 5).
Criterios de cirugía ambulatoria para la adenoamigdalotomía
| Actitud positiva de la familia frente a la cirugía ambulatoria |
| No hay malformaciones craneofaciales que afecten gravemente a la vía aérea |
| No hay patología cardiopulmonar de base |
| No hay sospecha de SAHOS grave |
| > 3 años de edad |
| No hay contraindicación anestésica |
| No hay amigdalitis de repetición (< 4 amigdalitis/año) o crónica |
SAHOS: síndrome de apnea-hipoapnea obstructiva del sueño.
En el tratamiento del SAHOS siempre se debe reducir el tejido amigdalar y adenoideo, ya que practicar uno de los procedimientos aisladamente puede ser insuficiente y llevar a resultados parciales40,41.
La gradación del SAHOS se debe establecer en función de la PSG nocturna, que es el método de referencia en el diagnóstico de esta enfermedad. Dada la poca disponibilidad de la PSG en nuestro medio, frecuentemente la indicación de tratamiento sigue basándose en criterios clínicos.
Cuando se dispone de los resultados de una PSG nocturna, el algoritmo de actuación que se aplica en nuestro centro es el siguiente:
- 1.
IAH 0–1 (no SAHOS): conducta expectante.
- 2.
IAH 1–4 (SAHOS leve): tratamiento médico durante 3–4 meses y nueva valoración posterior.
- 3.
IAH mayor de 4 (SAHOS moderado y grave): tratamiento quirúrgico con adenoamigdalotomía o adenoamigdalectomía.
Otras intervenciones que se practican con mucha menos frecuencia en niños son la uvulofaringopalatoplastia, la septoplastia, la reducción de cornetes, la distracción maxilar o mandibular y la glosopexia.
El tratamiento médico está indicado en el SAHOS leve. Se utilizan 2 tipos de medicamentos: los corticoides tópicos nasales para descongestionar las fosas nasales y el cavum, disminuyendo así la resistencia del paso del aire hacia los pulmones, y el montelukast, que es un antileucotrieno con efecto antiinflamatorio sobre el tejido linfoide, capaz de provocar una mejoría clínica y radiológica en niños afectados de un SAHOS leve, con un IAH entre 1-442.
La obesidad es una causa que predispone al SAHOS por la infiltración grasa de los tejidos blandos del paladar y de la hipofaringe, disminuyendo la luz de la VAS durante el sueño. Ante un niño obeso con SAHOS se debe explicar a los padres la relación entre la obesidad y el síndrome, e indicar que baje de peso. Un niño obeso con SAHOS siempre debe ser valorado por el otorrinolaringólogo por si puede beneficiarse de una intervención quirúrgica. En este caso, ha de ser intervenido de adenoamigdalotomía y no esperar a que baje de peso antes de la intervención, aunque los resultados pueden ser menos satisfactorios que en niños normales43.
La ventilación no invasiva (VNI) es una modalidad de tratamiento que proporciona soporte ventilatorio al paciente sin invasión de su vía aérea. Actualmente la efectividad de esta posibilidad terapéutica en el SAHOS está bien establecida, y hay numerosos trabajos que demuestran la reversibilidad de las alteraciones polisomnográficas y la desaparición de los síntomas clínicos tras su aplicación44,45.
La VNI tiene indicación en aquellos niños con SAHOS residual, moderado o grave, tras el tratamiento quirúrgico adenoamigdalar. En algunas series, la persistencia del SAHOS tras la cirugía alcanza el 20% de los casos46. También es útil, en casos de SAHOS moderado o grave, como puente a la espera de la solución quirúrgica. Puede ser una primera opción terapéutica en los pacientes obesos con malformación craneofacial o enfermedades neuromusculares sin posibilidad de tratamiento quirúrgico o con persistencia de SAHOS tras dichos procedimientos47.
El soporte ventilatorio con presión positiva mantiene la permeabilidad de la VAS y evita el colapso al final de la espiración, lo que facilita la ventilación, normaliza el intercambio gaseoso y disminuye el trabajo de los músculos inspiratorios.
La modalidad ventilatoria de elección en el SAHOS es la presión aérea positiva continua (CPAP). La presión aportada debe ser suficiente para lograr la desaparición de los eventos respiratorios durante el sueño (RERA): apneas obstructivas, hipoapneas, arousals relacionados con eventos respiratorios e incluso el ronquido. En el caso de que el paciente muestre disconfort, intolerancia o no sea posible la ventilación efectiva con la anterior modalidad, se aconseja la ventilación con 2 niveles de presión, inspiratoria y espiratoria (BiPAP)48. Siempre que sea posible, se aconseja la nivelación de la presión durante el estudio polisomnográfico49.
La VNI requiere un aparato generador de presión positiva, una tubuladura, una interfase (mascarilla que une el circuito al paciente) y cinchas de fijación. En general, la interfase de elección es la nasal, dado su mayor confort y seguridad, pero al realizar VNI en pacientes afectados de SAHOS con frecuencia debe recurrirse a interfase nasobucal dado que la respiración bucal que presentan estos pacientes ocasiona fuga en el circuito. No es imprescindible intercalar un sistema de humidificación en el paciente que sólo requiere VNI nocturna, aunque debe ser valorado si el paciente presenta molestias y/o intolerancia por la sequedad del aire a alta presión48.
Recientemente se ha publicado un estudio en el que se administra CPAP con gafas nasales de alto flujo con 20l/m de aire. Los autores concluyen que produce una mejoría del IAH equiparable a la CPAP convencional y que podría llegar a ser una alternativa terapéutica, si bien se requieren más estudios pues en éste sólo se incluyen 12 pacientes50.
La traqueotomía es el último recurso terapéutico, ya que gracias a los avances en los métodos de VNI, esta técnica se ha abandonado y prácticamente no se realiza.
En el SAHOS el empleo de oxigenoterapia aislada es desaconsejable. Puede ser ineficaz para la reversión de los síntomas e incluso peligrosa al promover la acumulación de CO2 por disminución del estímulo ventilatorio hipóxico y del mecanismo de arousal en el paciente con hipoventilación crónica.