Puntos clave
- •
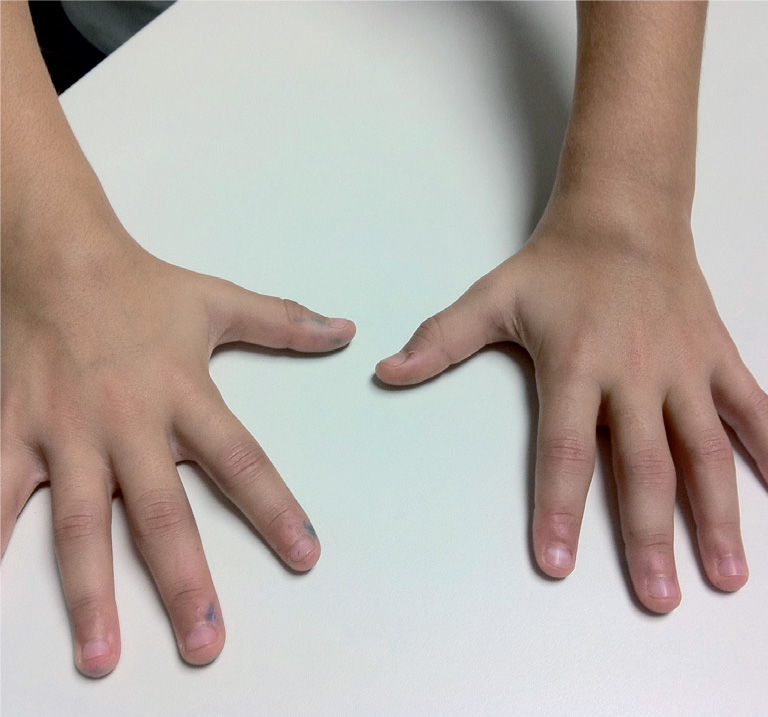
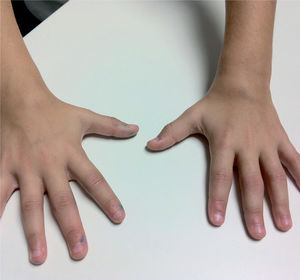
Nunca se ha de considerar una articulación tumefacta como normal.
- •
La uveítis anterior en el contexto de una artritis idiopática juvenil (AIJ) a menudo es asintomática, por lo que los controles oftalmológicos periódicos en estos pacientes son obligatorios.
- •
Lo que determina el pronóstico en la púrpura de Schönlein-Henoch es la afectación renal, por lo que el seguimiento de estos pacientes viene dado por ésta.
- •
Ante un niño con hipertransaminasemia, hay que pensar también en el origen muscular de la misma y no centrarse exclusivamente en la causa hepática.
- •
El metotrexato se emplea en artritis desde los años setenta y a las dosis en que se usa en los pacientes reumatológicos los efectos secundarios son, en general, leves y reversibles.
- •
Los agentes biológicos constituyen una terapia eficaz, pero con una experiencia limitada, por lo que no se trata de un tratamiento de primera línea y cuando se utiliza, han de realizarse controles clínicos y analíticos frecuentes.
Es difícil abarcar en unas páginas las diferentes áreas de la reumatología pediátrica que nos podemos encontrar en nuestra consulta de atención primaria (AP). Sin embargo, hemos intentado centrarnos en aquellas patologías más frecuentes, tratando de aclarar conceptos y enfocándolo de la manera más práctica posible.
Por ello, hablaremos de la artritis idiopática juvenil (AIJ), ya que es la enfermedad reumática crónica más frecuente en la infancia; de la ya sobradamente conocida púrpura de Schönlein-Henoch (PSH), intentando dar unas pautas para su manejo desde AP, y de la dermatomiositis juvenil (DMJ), para que la tengamos presente en el diagnóstico diferencial de una hipertransaminasemia.
Por último, hemos querido dedicar una parte a los distintos tratamientos que aplicamos en estos pacientes, así como su seguimiento, incluyendo un apartado sobre su vacunación.
Artritis idiopática juvenilEs la enfermedad reumática crónica más frecuente en la infancia (con una incidencia de 10 y una prevalencia de 80 de cada 100.000 niños menores de 16 años).
Esta enfermedad ha recibido distintos nombres (artritis crónica juvenil, en Europa; artritis reumatoide juvenil, en América) al utilizar diferentes criterios diagnósticos, lo que dificultaba la interpretación de los estudios. Por esto, la International League of Associations for Rheumatology impulsó la emisión de unos criterios diagnósticos que definieran formas clínicas homogéneas de la enfermedad, a la que denominaron AIJ, y que se pudieran aplicar mundialmente1.
Para el diagnóstico de AIJ en cualquiera de sus formas, se precisa que la artritis persista durante al menos 6 semanas, comience antes de los 16 años y se hayan excluido otras causas. Es importante destacar que es una enfermedad que cursa en brotes2.
Las formas clínicas de AIJ se definen en función del número de articulaciones afectadas, la presencia de síntomas sistémicos, de entesitis (inflamación de los puntos de inserción de los tendones en el hueso), etc. Se denomina oligoartritis (40–60% del total de AIJ) si hay afectación de 4 o menos articulaciones durante los primeros 6 meses de la enfermedad; si ya ha pasado este tiempo y se «extiende» a más de 4 articulaciones, se denomina oligoartritis extendida y, si no se «extiende», oligoartritis persistente. Se denomina poliartritis si en los primeros meses afecta a 5 o más articulaciones, pudiendo ser factor reumatoide (FR) positivo (3–5%) o negativo (20–25%). La presencia de síntomas sistémicos (fiebre, exantema, serositis, órgano o adenomegalias), independientemente del número de articulaciones afectadas, define a la AIJ sistémica (10–15%). Las restantes categorías incluyen la artritis psoriásica (5%), definida por la presencia de artritis y psoriasis o sus estigmas, y la artritis relacionada con entesitis (10–15%), que se asimila a la espondiloartropatía juvenil. Por último, los pacientes cuya artritis no puede ser clasificada en las categorías anteriores se incluyen en el grupo de indiferenciadas (8%)1,2.
Nos centraremos en las 2 más frecuentes:
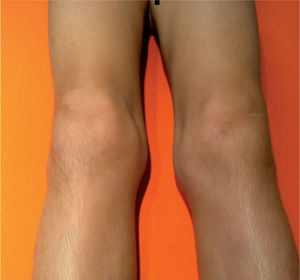
Artritis idiopática juvenil oligoarticularPredomina en el sexo femenino y habitualmente aparece antes de los 6 años de edad. Las articulaciones más frecuentemente afectadas
Lectura rápida
Es la enfermedad reumática crónica más frecuente en la infancia, para cuyo diagnóstico se precisa que la artritis persista durante al menos 6 semanas, comience antes de los 16 años y se hayan excluido otras causas, tratándose de una enfermedad que cursa en brotes. Es muy importante la exploración de todas las articulaciones, aunque el paciente no refiera molestias ni tumefacción a ese nivel, además de ser fundamental no considerar nunca como normal una articulación tumefacta.
Su manifestación extraarticular más frecuente es la uveítis anterior, que a menudo es totalmente asintomática, por lo que los controles oftalmológicos son obligatorios en pacientes con diagnóstico de artritis idiopática juvenil (AIJ), aunque no tengan síntomas oculares, puesto que si el proceso inflamatorio no se controla, aparecen sinequias, queratopatía en banda, cataratas, glaucoma y pérdida progresiva de agudeza visual.
Las determinaciones analíticas de anticuerpos (ANA, FR) son una herramienta de clasificación, pronóstico y manejo de la enfermedad, sin utilidad para el diagnóstico; por otro lado, hay que mantener un alto grado de sospecha ante síntomas o signos indicativos de otra enfermedad autoinmunitaria, puesto que a menudo se asocian.
La manifestación extraarticular más frecuente de esta entidad es la uveítis, apareciendo en el 10–34%, según las series. La inflamación ocular afecta inicialmente al iris y al cuerpo ciliar (iridociclitis), pero puede haber también coroiditis. El comienzo es insidioso y a menudo totalmente asintomático. Puede afectar a un ojo o a ambos. Aparece con anterioridad a la artritis en un 5% de los casos. Es más frecuente en los primeros años tras el comienzo de la artritis y su evolución es independiente de ésta. Los pacientes con ANA positivos tienen más riesgo de desarrollarla. Por todo esto, los controles oftalmológicos son obligatorios en pacientes con diagnóstico de AIJ, aunque no tengan síntomas oculares, puesto que si el proceso inflamatorio no se controla, aparecen sinequias, queratopatía en banda, cataratas, glaucoma y pérdida progresiva de agudeza visual.
Artritis idiopática juvenil poliarticular factor reumatoideo negativoSe trata de un grupo heterogéneo que, a su vez, algunos autores han subdividido en 3 subtipos. Uno de ellos es muy similar a la AIJ oligoarticular, excepto por el número de articulaciones afectas, siendo artritis asimétricas, de predominio en niñas. El segundo subtipo se caracteriza por sinovitis simétricas de grandes y pequeñas articulaciones en niños en edad escolar. El tercer subtipo corresponde a la denominada artritis «seca», con escaso derrame articular, pero aparición progresiva de contracturas en flexión. El diagnóstico de este último subtipo suele retrasarse por plantear un diagnóstico diferencial más complejo y la respuesta al tratamiento en general es peor.
También en esta forma de AIJ la manifestación extraarticular más frecuente es la uveítis, por lo que los controles oftalmológicos en estos niños son obligatorios2.
Queda claro entonces que, en lo que respecta a la AIJ, las determinaciones analíticas de anticuerpos (ANA, FR) son una herramienta de clasificación, pronóstico y manejo de la enfermedad, sin utilidad para el diagnóstico.
Las enfermedades autoinmunitarias se han asociado a enfermedades reumáticas, como la artritis reumatoide y el lupus eritematoso sistémico. Sin embargo, se han hecho pocos estudios epidemiológicos acerca de esta asociación en niños, pero en los que hay, se concluye que los niños con AIJ presentan una prevalencia aumentada de tiroiditis autoinmunitaria, hipotiroidismo subclínico y enfermedad celíaca. También se asocia a la diabetes tipo 1, y en estos casos, hasta un 22% tiene una tercera enfermedad autoinmunitaria. Por lo tanto, en estos niños hay que mantener un alto grado de sospecha ante síntomas o signos indicativos de otra enfermedad autoinmunitaria, e incluso muchos reumatólogos infantiles ya realizan controles periódicos a sus pacientes en este aspecto3.
Púrpura de Schönlein-HenochSe trata de una vasculitis leucocitoclástica de vaso pequeño, mediada por inmunocomplejos IgA. Típicamente afecta a la piel, el intestino y los glomérulos, y se acompaña de artritis o artralgias.
Es la vasculitis sistémica primaria más frecuente en la edad pediátrica (típicamente en niños entre 3 y 10 años), con una incidencia de 61 a 240 por millón de niños y por año, según distintos estudios en diferentes países.
De acuerdo con los criterios de clasificación de la EULAR/PRINTO/PRES, un paciente tiene PSH en presencia de púrpura (en general palpable) o petequias de predominio en los miembros inferiores (criterio obligatorio), más uno de los 4 siguientes:
- 1.
Dolor abdominal.
- 2.
Histopatología con vasculitis leucocitoclástica o glomerulonefritis proliferativa con depósitos de inmunocomplejos IgA.
- 3.
Artritis o artralgia.
- 4.
Afectación renal.
Con estos nuevos criterios, la sensibilidad y la especificidad para la clasificación de la PSH es del 100 y el 87%, respectivamente.
Presenta un predominio estacional, siendo más frecuente en primavera. Se han descrito como desencadenantes una amplia variedad de agentes infecciosos (estreptococo, Mycoplasma…). De hecho, muchos casos comienzan tras una infección de vía aérea alta, por lo que al inicio de la enfermedad puede haber fiebre y malestar general.
La púrpura presenta una distribución característica en los miembros inferiores y nalgas, simétrica, estando generalmente respetados la cara, el pecho y el abdomen. Los brotes de púrpura pueden prolongarse durante varios meses tras el inicio de la enfermedad, aunque en general suelen ser cada vez menos «aparatosos». Pueden ser desencadenados por traumatismos leves y asociarse urticaria y/o angioedema.
Alrededor de los dos tercios de los niños presentan manifestaciones articulares al inicio de la enfermedad, siendo los tobillos y las rodillas las más frecuentemente afectadas, resolviéndose en más o menos tiempo, sin secuelas articulares. Puede preceder a la púrpura en un 25% de los casos.
Las tres cuartas partes de los niños desarrollan síntomas abdominales, que van desde dolor cólico leve a dolor intenso con vómitos incoercibles. En un 14% de los niños aparece antes de las manifestaciones cutáneas. También se ha observado hemorragia digestiva en algunas ocasiones. Otras complicaciones mucho menos frecuentes son la invaginación, la perforación intestinal y la pancreatitis aguda.
Los estudios indican que entre un 20–61% presentan afectación renal, siendo más frecuente en aquellos niños que tuvieron sangre en las heces. Se puede presentar en grados variables de gravedad: microhematuria, proteinuria, síndrome nefrítico, síndrome nefrótico o un cuadro mixto nefrítico-nefrótico. Esta afectación normalmente aparece entre unos días y pocas semanas tras la primera manifestación clínica. Sin embargo, en ocasiones, aparece hasta 2 meses o más después.
Otros órganos que pueden afectarse, aunque mucho menos frecuentemente, son: el sistema nervioso central (vasculitis cerebral), los testículos (orquitis) y los pulmones (hemorragia pulmonar).
Un tercio de los niños con PSH tienen síntomas y signos durante menos de 14 días, otro tercio entre 2 y 4 semanas y el tercio restante más de 4 semanas. Las recurrencias de la enfermedad ocurren en un tercio de los niños, generalmente dentro de los primeros 4 meses tras el inicio. Estas recurrencias son más frecuentes en aquellos niños que tuvieron afectación renal.
El diagnóstico se basa en las manifestaciones clínicas, pero se precisan pruebas complementarias para el diagnóstico diferencial con otras entidades como la púrpura trombocitopénica inmunitaria (PTI). En la PSH el recuento plaquetario es normal o incluso elevado, mientras que en la PTI está bajo por definición. También es necesario realizar un análisis de orina para detectar afectación renal.
En cuanto al manejo de esta entidad, la amplia mayoría de los casos sólo requiere tratamiento sintomático: reposo relativo (para evitar la aparición de lesiones con los traumatismos y por la afectación articular), dieta blanda y analgesia/antiinflamatorios no esteroideos (AINE) para el dolor. Sin embargo, si existiera importante afectación digestiva, se precisa poner al niño a dieta absoluta, con fluidoterapia por vía intravenosa. En este caso, y también en los casos en que exista afectación cutánea intensa, artritis con impotencia funcional, afectación testicular importante o manifestaciones renales graves, se hace necesario el uso de corticoides.
Con respecto al seguimiento de estos niños por parte del pediatra de AP, se ha de individualizar cada caso, sobre todo en función de
Lectura rápida
En los casos en que exista clínica digestiva importante, afectación cutánea intensa, artritis con impotencia funcional, gran afectación testicular o manifestaciones renales graves, se hace necesario el uso de corticoides.
La afectación renal normalmente aparece entre unos días y pocas semanas tras la primera manifestación clínica, aunque, en ocasiones aparece hasta 2 meses o más después, siendo esta afectación renal la que determina el pronóstico y, por tanto, el seguimiento de estos pacientes.
Dermatomiositis juvenilAnte un niño con elevación de las transaminasas, no hay que pensar exclusivamente en que el origen sea hepático, sino valorar si pudiera ser muscular.
Con respecto a los autoanticuerpos (anti-Jo-1, anti-PM-Scl, anti-Mi-2, anti-U1-RNP, etc.), son de escasa utilidad en pediatría, ya que a pesar de ser específicos, son muy poco prevalentes.
Tratamientos en reumatologíaSe recomienda evitar las combinaciones de antiinflamatorios no esteroideos, utilizándolos a la mínima dosis eficaz y, si se van a utilizar de manera prolongada, emplear gastroprotección, bien con omeprazol, bien con ranitidina.
Lectura rápida
Dentro de los fármacos modificadores de la enfermedad FAME (fármacos que intentan evitar la aparición de brotes, no siendo curativos), el más empleado es el metotrexato (MTX), que puede administrarse por vía oral o subcutánea, en cuyo caso se administra igual que cualquier otro inyectable y se desecha de la misma forma, no siendo tóxico en ningún caso para la persona que lo manipula; el efecto antirreumático del MTX es independiente del ácido fólico, por lo que administrar éste no disminuirá la efectividad de aquél, pero sí puede disminuir sus efectos secundarios.
Los corticoides intraarticulares son la alternativa terapéutica más eficaz y con menos efectos colaterales para las formas oligoarticulares; en lo que respecta al tratamiento con corticoides por vía oral, antes de iniciarlo, se ha de realizar una prueba de Mantoux (también en el caso de las infiltraciones), glucemia y descartar infección; usar la dosis mínima eficaz, en el menor número de tomas al día (preferiblemente por la mañana); bajarlos de un modo lento e individualizado y vigilar la presión arterial.
- 1.
Si no ha habido afectación renal, se han de realizar visitas cada 15 días para realizar tira de orina y toma de presión arterial el primer mes. Después visitas mensuales hasta cumplirse los 6 meses desde el inicio de la enfermedad. Esto es así porque las complicaciones renales se desarrollan en las 4 primeras semanas en el 85% de los casos y en los primeros 6 meses en la práctica totalidad de los niños.
- 2.
Si hubiera afectación renal leve (microhematuria o proteinuria leve aisladas), las visitas han de ser más frecuentes y actuar según evolución, ya que si la proteinuria persistiera, sería necesario derivar a nefrología infantil. En estos casos, el seguimiento puede prolongarse varios años, aunque hay que tener en cuenta que sólo el 5% de los niños con esta afectación leve inicial desarrolla una afectación renal persistente.
- 3.
Si hay afectación renal grave, derivar a nefrología infantil.
Es muy importante informar a los padres de los órganos diana más frecuentes en esta enfermedad para que no se vean sorprendidos por nuevos síntomas, así como el plan de seguimiento y los motivos de consulta en Urgencias (que serían prácticamente los mismos para los que precisarían terapia corticoidea)4,5.
Dermatomiositis juvenilEs una vasculopatía sistémica de pequeño vaso de etiología autoinmunitaria. Se trata de la miopatía inflamatoria pediátrica más frecuente (85%), con una incidencia de 2 a 3 por millón de niños y por año. Se caracteriza por:
- 1.
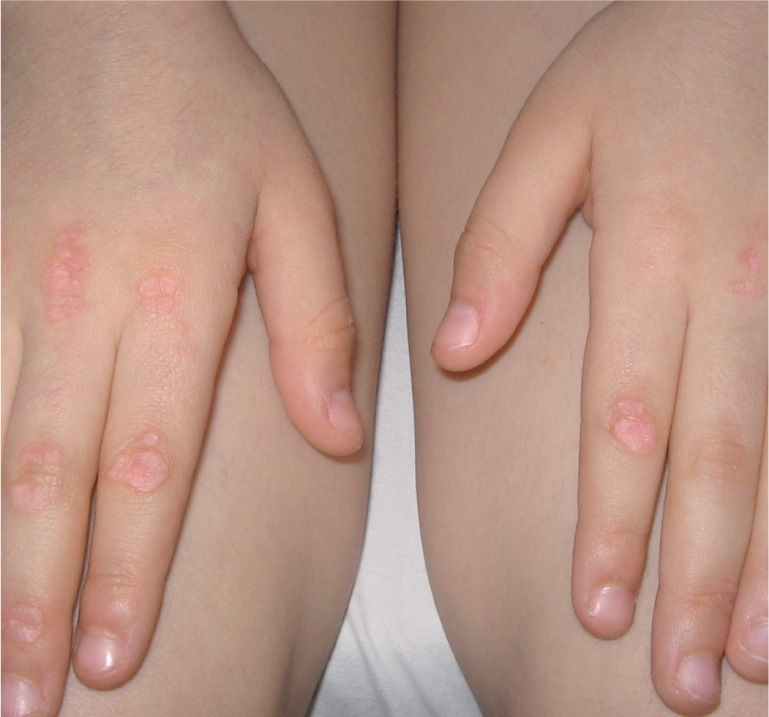
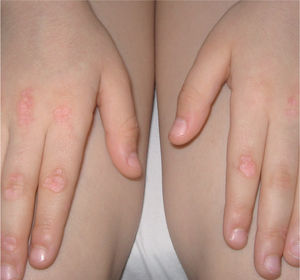
Lesiones cutáneas características, como son el rash en heliotropo, las pápulas de Gottron (fig. 3), las telangiectasias palpebrales y/o periungueales y las ulceraciones.
- 2.
Debilidad muscular proximal simétrica, siendo los grupos musculares más afectados los flexores del cuello, los abductores del hombro y los flexores y extensores de la cadera.
- 3.
Elevación de las enzimas musculares (creatincinasa [CK], aldolasa, GPT/GOT, LDH), aunque en un 10–17% de los casos los niveles séricos son normales, y a veces sólo se eleva alguna de ellas. Por este motivo, ante un niño con elevación de las transaminasas, no hay que pensar exclusivamente en que el origen sea hepático, sino valorar si pudiera ser muscular6–8.
En cuanto al diagnóstico de esta entidad, debemos decir que la resonancia magnética está desplazando cada vez más a otras técnicas más invasivas, como el electromiograma o la biopsia muscular. Sin embargo, no está disponible en todos los centros y en aproximadamente un 25% de los casos precisará que el paciente sea anestesiado de manera general9. Con respecto a los autoanticuerpos (anti-Jo-1, anti-PM-Scl, anti-Mi-2, anti-U1-RNP, etc.), son de escasa utilidad en pediatría, ya que a pesar de ser específicos, son muy poco prevalentes10.
En el tratamiento de la DMJ se emplean:
- 1.
Fármacos de primera línea: corticoides (prednisona por vía oral o bolos de metilprednisolona por vía intravenosa) y metotrexato (MTX).
- 2.
De segunda línea: inmunoglobulinas vía intravenosa, ciclosporina, azatioprina, pudiendo ser combinadas.
- 3.
De tercera línea: micofenolato, ciclofosfamida.
- 4.
Terapias adyuvantes: hidroxicloroquina, terapia tópica para las lesiones cutáneas, fotoprotección, fisioterapia.
- 5.
Otros todavía no bien establecidos: rituximab, anti-TNF, otras terapias biológicas6.
Los fármacos empleados en reumatología se pueden dividir en los siguientes grupos terapéuticos (tabla 1):
- 1.
Antiinflamatorios no esteroideos. No modifican la evolución de la enfermedad, siendo utilizados para tratar el dolor, la rigidez articular o la fiebre (AIJ sistémica) asociadas. Ningún AINE ha demostrado ser claramente más eficaz que otro en este sentido. Sólo están aprobados para su uso en AIJ por la Food and Drug Administration, y posteriormente por la Agencia Europea del Medicamento, el ibuprofeno, el naproxeno y la tolmetina, esta última poco usada en nuestro medio. En cuanto a las dosis empleadas, se utiliza el ibuprofeno a 30–40mg/kg/día en 3–4 dosis diarias, y el naproxeno a 15–20mg/kg/día en 2 dosis.
Con respecto a la gastrotoxicidad, a pesar de los escasos estudios en AIJ, se puede afirmar que los AINE producen sintomatología y complicaciones gastrointestinales (naproxeno > ibuprofeno) con un RR similar al de los adultos. Sin embargo, la tasa de hospitalizaciones y complicaciones es mucho más baja en niños, por lo que esta toxicidad puede pasar desapercibida11. Por lo tanto, se recomienda evitar las combinaciones de AINE, utilizándolos a la mínima dosis eficaz y emplear gastroprotección, bien con omeprazol (1–3mg/kg/día en una única dosis diaria), bien con ranitidina (8mg/kg/día en 2 dosis)12.
- 2.
Fármacos modificadores de enfermedad (FAME). Se trata de aquellos medicamentos que actúan sobre la actividad de la enfermedad y la frenan, es decir, intentar evitar la aparición de brotes, no son curativos. En este grupo se hallan incluidos el MTX, la sulfasalacina, la hidroxicloroquina y la leflunomida13. Hablaremos exclusivamente del MTX, por ser el más empleado con diferencia. Es un análogo del ácido fólico y un inhibidor de la dihidrofolato reductasa. Este fármaco se usa en artritis desde los años setenta y es el primer FAME con utilidad documentada en AIJ14. También se ha empleado con buena respuesta en otras enfermedades reumáticas, como la dermatomiositis o la esclerodermia.
Lectura rápida
Los agentes biológicos constituyen una terapia eficaz, pero con una experiencia limitada (el primero en utilizarse fue el etanercept en 2000), por lo que no se trata de un tratamiento de primera línea y cuando se utiliza, han de realizarse controles clínicos y analíticos frecuentes.
VacunaciónEn cuanto a las vacunas de virus vivos atenuados, no han de administrarse entre 2 semanas antes y 3 meses después de un tratamiento inmunosupresor o terapia biológica. Si el paciente está en tratamiento con un FAME y la enfermedad está estable, puede ser vacunado. En cuanto a los corticoides, se considera dosis inmunosupresora de prednisona: > 2mg/kg/día o, en mayores de 10kg, > 20mg/día, durante un periodo mayor de 2 semanas; respecto de la vacunación de la gripe, ésta se recomienda en estos pacientes.
Se inicia habitualmente por vía oral, en una toma semanal en ayunas, a una dosis de 10mg/m2. Las pérdidas gastrointestinales se cifran en torno al 20%. Por ello, si no existe respuesta en unos 3 meses, se ha de pasar a administrar la misma dosis por vía subcutánea (y aumentar la dosis hasta 15–20mg/m2 si aun así no se consigue respuesta). Es muy probable que, sobre todo al principio, los pacientes acudan a su centro de salud semanalmente para ponerse su medicación. En este sentido, es importante destacar que el MTX se administra igual que cualquier otro inyectable subcutáneo y se desecha de la misma forma, no siendo tóxico en ningún caso para la persona que lo manipula. De hecho, el plan es que los padres aprendan a inyectárselo a sus hijos y, con el tiempo, que sean los propios niños quienes se lo pongan. La aparición en el mercado de las jeringas precargadas ha facilitado mucho las cosas en estos aspectos.
En cuanto a los efectos secundarios, los más frecuentes son las náuseas y los vómitos, que pueden disminuir administrando suplementos de ácido fólico o folínico 24–48h después del MTX, no existiendo diferencias significativas entre ellos, salvo su coste (el ácido folínico es de 3 a 5 veces más caro que el fólico). El efecto antirreumático del MTX es independiente del ácido fólico, por lo que administrar éste no disminuirá la efectividad de aquél. Otro efecto secundario es la elevación moderada de las transaminasas (ojo al consumo de alcohol en adolescentes), sobre todo coincidiendo con infecciones concomitantes, que habitualmente se resuelve al reducir la dosis. Las alteraciones hematológicas y renales con el MTX son infrecuentes. Además, el MTX puede causar anomalías fetales, por lo que debe advertirse a las adolescentes de la necesidad de prevenir el embarazo.
Este tratamiento se suele mantener entre 6 y 12 meses después de haber conseguido la remisión de la enfermedad (no hay actividad)13,15.
- 3.
Corticoides. Son los antiinflamatorios más potentes y eficaces, pero su uso ha de limitarse por su sobradamente conocida toxicidad, siendo el retraso del crecimiento uno de los efectos secundarios más importantes en la infancia. Por ello, ha de utilizarse la menor dosis eficaz el menor tiempo posible. Es preferible administrarlos en una sola toma por la mañana, aunque puede intentarse la administración de una dosis más alta en días alternos. Los pulsos intravenosos se usan en situaciones graves, tales como el inicio de una dermatomiositis con marcada actividad, miocarditis, síndrome de activación macrofágica…
La AIJ poliarticular puede precisar corticoides asociados a FAME para poder controlar el brote. Por otro lado, los corticoides intraarticulares son la alternativa terapéutica más eficaz y con menos efectos colaterales para las formas oligoarticulares, siendo el fármaco utilizado el acetónido de triamcinolona.
Así pues, respecto del uso de los corticoides, se recomienda:
- —
Antes de iniciarlo, realizar una prueba de Mantoux (también en el caso de las infiltraciones), glucemia y descartar infección.
- —
Usar la dosis mínima eficaz, en el menor número de tomas al día.
- —
Descenso lento e individualizado.
- —
En tratamientos prolongados, añadir calcio y vitamina D diarios.
- —
Vigilar la presión arterial.
- —
- 4.
Inmunosupresores e inmunomoduladores. Son fármacos como la azatioprina, la ciclofosfamida, la ciclosporina, el micofenolato o la gammaglobulina por vía intravenosa. Muy poco utilizados en las enfermedades de las que hemos hablado, excepto en la dermatomiositis, pero como fármacos de segunda o tercera línea, por lo que no nos detendremos en ellos en el presente artículo.
- 5.
Terapia biológica. El desarrollo mediante ingeniería genética de «agentes biológicos» dirigidos contra las diferentes moléculas inflamatorias o células implicadas en la patogenia de las enfermedades reumáticas en general, y de la AIJ en particular, supone un avance terapéutico significativo en el tratamiento de aquellos pacientes que han tenido efectos secundarios o que han sido refractarios al tratamiento convencional con MTX, corticoides intraarticulares, etc. En la actualidad, disponemos de fármacos contra el factor de necrosis tumoral alfa: etanercept, infliximab y adalimumab; contra la interleucina-1 (IL-1): anakinra y canakinumab; contra la IL-6: tocilizumab, y contra el antígeno 4 asociado a linfocitos T citotóxicos (CTLA-4): abatacept.
Fármacos empleados en reumatología pediátrica.
| Grupo farmacológico | Fármaco y nombre comercial | Presentación |
|---|---|---|
| AINE | Ibuprofeno. Dalsy©, Junifen© | Jarabe 100mg/5ml, 200mg/5ml, comp. bucodispersables o no, sobres, etc. (200mg, 400mg, 600mg) |
| Naproxeno. Naprosyn© | Cáps. 250mg, comp. y sobres 500mg. FM | |
| FAME | Metotrexato vo y sc (Metoject©) | Comp. 2,5mg Jeringas precargadas (mg/ml): 7,5/0,15, 10/0,2, 15/0,3, 20/0,4, 25/0,5 |
| Corticoides | Prednisona. Dacortin© | Comp. 2,5, 5, 10, 30 y 50mg. FM |
| Metilprednisolona. Urbason© | Comp. 4, 16, 40mg | |
| Deflazacort. Zamene© | Comp. 6, 30mg, jarabe 22,75mg/ml | |
| Acetónido de triamcinoloona intraarticular. Trigon Depot© | Ampollas 40mg/ml | |
| IS | Azatioprina. Imurel© | Comp. 50mg. FM |
| Ciclofosfamida. Genoxal© | IV | |
| Ciclosporina A. Sandimmun© | Cáps. 25, 50, 100mg. Jarabe 100mg/ml | |
| Micofenolato mofetilo. Cellcept© | Jarabe 1g/5ml, cáps. 250mg, comp., 500mg | |
| Gammaglobulina. Flebogamma©, Privigen© | IV | |
| Terapia biológica | Etanercept. Enbrel© | SC (viales, plumas) |
| Adalimumab. Humira© | SC (viales, plumas) | |
| Infliximab. Remicade© | IV | |
| Anakinra. Kineret© | SC (jeringas precargadas) | |
| Tocilizumab. Roactemra© | IV | |
| Abatacept. Orencia© | IV |
AINE: antiinflamatorios no esteroideos; Comp: comprimidos; caps: cápsulas; FAME: fármacos modificadores de la enfermedad; FM: posibilidad de fórmula magistral; IV: vía intravenosa; SC: subcutáneo; VO: vía oral.
Los agentes biológicos constituyen una terapia eficaz, pero con una experiencia limitada (el primero en utilizarse fue el etanercept en 2000), por lo que no se trata de un tratamiento de primera línea y cuando se utiliza, han de realizarse controles clínicos y analíticos frecuentes1.
Se necesita conocer el estado basal de todos aquellos pacientes que van a recibir un tratamiento de base para su enfermedad reumatológica, tanto somatométrico como analítico:
- —
Peso, talla, superficie corporal.
- —
Hemograma, reactantes de fase aguda (CK y aldolasa en dermatomiositis), transaminasas, perfil renal y básico de orina.
- —
Mantoux y serologías.
Periódicamente (habitualmente mínimo cada 3 meses), los niños en tratamiento se realizan analíticas con el objetivo de detectar posibles efectos secundarios de la medicación, que de otro modo podrían pasar desapercibidos.
En cuanto a la vacunación de estos niños, según el documento de consenso SEIP-CAV de la Asociación Española de Pediatría, se trata de pacientes con un mayor riesgo de infección debido a una alteración inmunológica por la enfermedad o por el tratamiento de base de su enfermedad. Siempre que sea posible, deben administrarse todas las vacunas del calendario vacunal y éste debe actualizarse en cualquier sujeto antes de iniciar dicho tratamiento.
Se recomienda no administrar ningún tipo de vacuna de virus vivos atenuados (VVA) entre 2 semanas antes y 3 meses después de un tratamiento inmunosupresor. No se conocen su eficacia y su seguridad en pacientes en tratamiento con inmunomoduladores o mediadores inmunitarios recombinantes, pero, dado que algunos anticuerpos monoclonales inducen reactivación de tuberculosis y predisponen a infecciones oportunistas, no se recomienda su administración a pacientes con estos tratamientos. Estudios en niños con AIJ han demostrado que la vacuna triple vírica y la del virus de la varicela zóster se pueden administrar de forma segura en estos pacientes, incluso en tratamiento con FAME. Sin embargo, estos estudios se han realizado sobre pacientes con enfermedad estable, por lo que se sigue recomendando evitarlas en pacientes con enfermedad activa. En cuanto a la vacunación con virus inactivos (gripe), en general se recomienda su uso en estos pacientes.
Respecto del tratamiento con corticoides, se considera dosis inmunosupresora de prednisona: > 2mg/kg/día o, en mayores de 10kg, > 20mg/día, siempre que se administre durante un periodo mayor de 2 semanas. Estas dosis son lo suficientemente inmunosupresoras como para no confiar en la seguridad de la administración de VVA. Sin embargo, este tipo de vacunas no está contraindicado cuando los corticoides son administrados a días alternos con preparaciones de vida media corta o cuando la vía utilizada es la intraarticular16.