Cuando hablamos de proliferaciones melanocitarias benignas, nos referimos especialmente a los nevos melanocíticos (NM), que forman parte de la piel normal. Estas proliferaciones se pueden clasificar de una forma sencilla en congénitas o adquiridas. La incidencia de NM congénitos (NMC) en el recién nacido oscila entre el 0,2 y el 6%; en cuanto a los NM adquiridos (NMA), la incidencia aumenta durante de la infancia y la pubertad, y se adquieren el máximo de elementos a los 25 años de edad1–3.
Los NM son un factor de riesgo para el desarrollo de melanoma maligno. Globalmente, se cita un aumento de incidencia de este tumor, no sólo en adultos, sino también en niños. Afortunadamente, el melanoma es muy raro en la infancia, con una incidencia anual de 0,7 por millón en niños de edades comprendidas entre los 0 y los 9 años. En el niño prepúber y en el adolescente, continúa siendo infrecuente el melanoma, salvo en los casos con factores predisponentes de riesgo, como sucede en las situaciones de immunodepresión, síndrome del nevo atípico, xeroderma pigmentosum o en individuos con un gran número de nevos4.
Los pediatras son la primera línea de detección de una posible lesión melánica maligna, y un diagnóstico temprano puede condicionar el pronóstico vital. Por ello, vale la pena remarcar la importancia del conocimiento de los diferentes tipos de lesiones pigmentadas más prevalentes en la infancia (aunque sea de forma somera), así como los signos de alarma o las pautas de actuación a seguir.
Factores de riesgo en la génesis de los nevos y de progresión a melanomaParece claro que la radiación ultravioleta (UV) (sobreexposición solar) es la causa externa (ambiental) más importante en la génesis del melanoma2,5. Llama la atención que sólo el 20-30% de los melanomas aparecen asociados a un NM, o, lo que es lo mismo, que una gran proporción de melanomas aparecen sobre piel aparentemente normal. Los factores de riesgo en la génesis del melanoma, ya sea por transformación maligna de un nevo previo o de novo, con toda seguridad se deban a diferentes factores interrelacionados (individuo, ambiente). Las características fenotípicas personales (fenotipo I-II, piel clara, pelo claro, especialmente pelirrojos), las condiciones ambientales (exposición solar, cabinas de bronceado) y la susceptibilidad en el ámbito molecular (mutaciones en el gen BRAF y en el gen que codifica la proteína receptora de la melanocortina 1) son las hipótesis más aceptadas y referidas6–8.
La depresión inmunitaria, independientemente de su causa (quimioterapia, infección por el virus de la inmunodeficiencia humana, trasplante de órganos) acrecienta el número de nevos y el riesgo de melanoma multiplicado de 3 a 6. El número de nevos adquiridos es el factor de riesgo más importante en el desarrollo de melanoma, de forma particular en el caso de los nevos atípicos (displásicos). Este fenómeno se acrecienta en el caso del síndrome del nevo atípico familiar, en el que se asocia un gran número de nevos de características atípicas y un riesgo importante de aparición de melanoma9.
El riesgo de melanoma sobre nevo congénito aparece sobre todo en los primeros 10 años de vida y de localización posterior y axilar. Es importante conocer que no se conocen transformaciones malignas de los nevos satélites10. En el caso de xerodema pigmentosum, el riesgo de melanoma se multiplica por 2.000.
Nevos melanocíticos adquiridosEn este apartado, vamos a describir los NMA comunes (NMAC) que no son muy frecuentes en la infancia y aparecen a partir de los 6–12 meses de edad, y que aumentan en número y tamaño con el crecimiento corporal. Se caracterizan por ser simétricos, están bien circunscritos y guardan una coloración uniforme. Pueden asentar en cualquier área corporal cutánea, anejos (uñas, cuero cabelludo), semimucosas y mucosas. Los diferentes rasgos clínicos de los NMA reflejan también los diferentes aspectos histológicos entre ellos, y así generan una clasificación clinicopatológica11 (tabla 1).
De mayor importancia por la posibilidad de malignización y por su expresividad clínica, son otra serie de lesiones melánicas, que describiremos en el grupo de NMA (tabla 2).
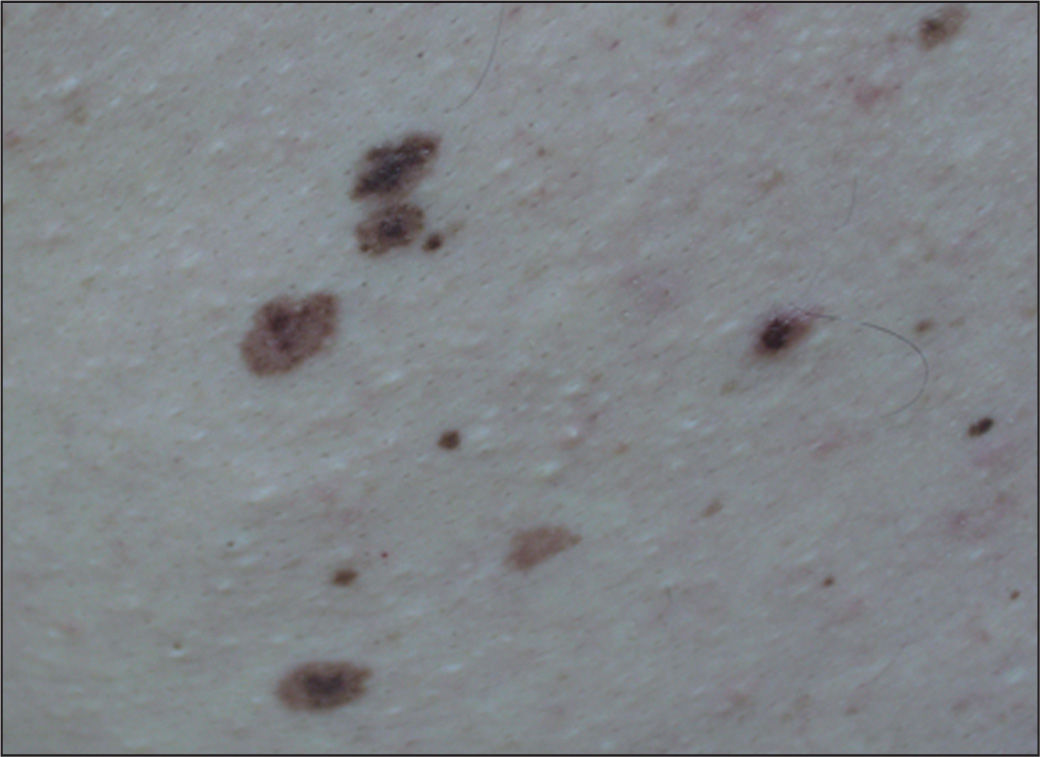
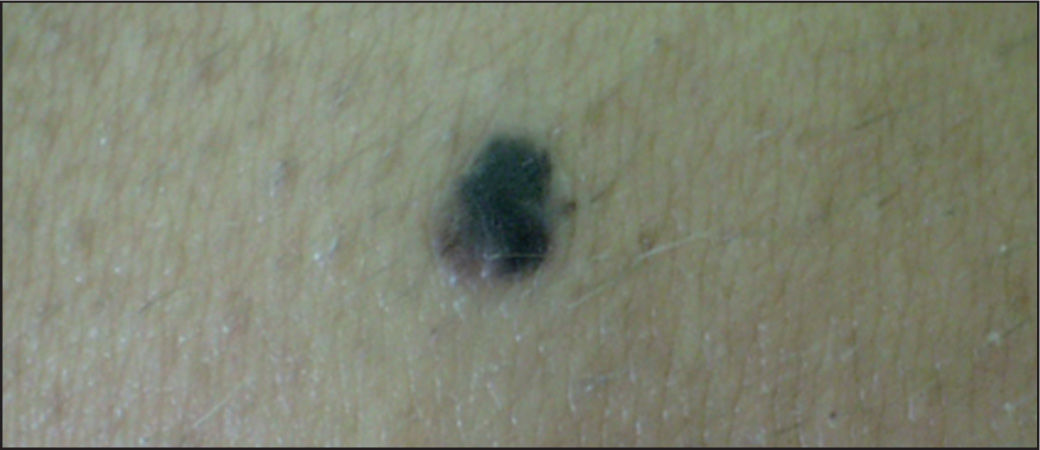
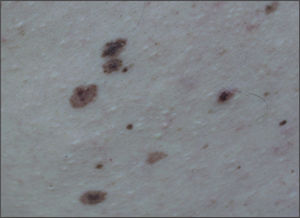
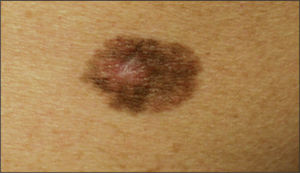
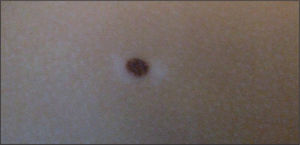
A diferencia del NMAC, suele ser de tamaño mayor (> 6mm de diámetro), predomina el componente maculoso respecto al papuloso, y presenta unos bordes mal definidos, con pigmentación variable con diferentes tonalidades (marrón oscuro/claro, rosado) (figs. 1 y 2). Desde el punto de vista histológico, presentan unas características particulares, con melanocitos atípicos, hiperplasia melanocitaria y desorden arquitectural. Con frecuencia, asientan en pacientes con un gran número de nevos, hecho relacionado directamente con el riesgo de melanoma12,13. incluso algún trabajo reciente apunta que tener múltiples nevos atípicos es un factor de riesgo más significativo que el número total de nevos9. Estos nevos suelen aparecer durante la infancia y la adolescencia, y pueden ser un marcador del síndrome del nevo displásico familiar14,15.
Es recomendable seguir controles periódicos, fotografiarlos y por dermatoscopia16. Ante cualquier lesión sospechosa, siempre se deberá extirpar y realizar un estudio histológico.
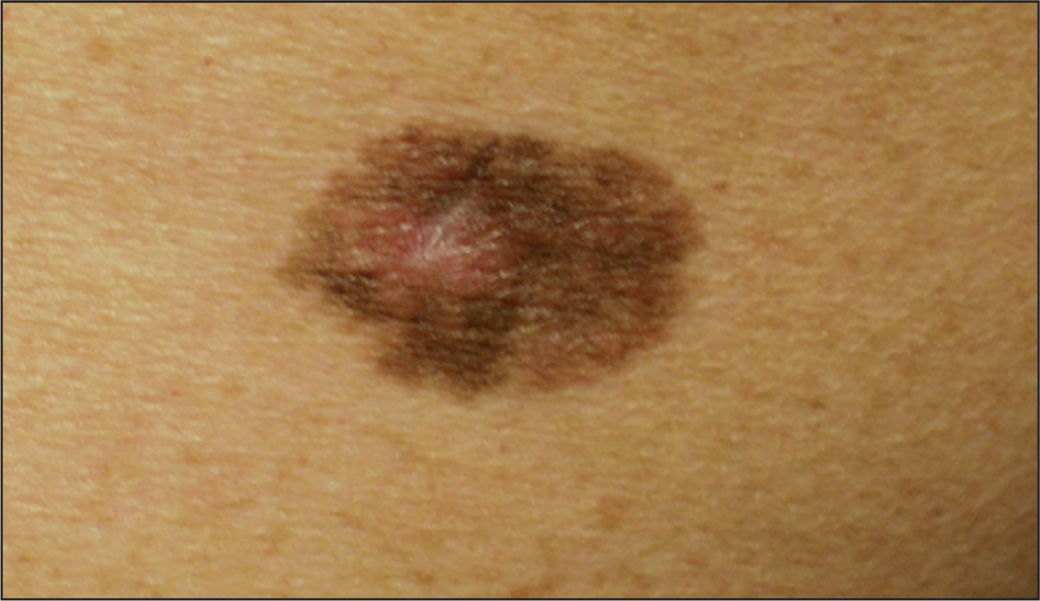
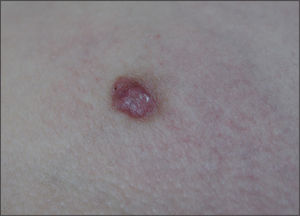
Nevo de SpitzDescrito también como “melanoma juvenil benigno” o “melanoma prepuberal”, suele afectar sobre todo al niño o adulto joven, y tiene una incidencia aproximada del 1% de los tumores melanocíticos. Histológicamente, es similar a un melanoma maligno y, desde el punto de vista clínico, suele ser una lesión pápulo-nodular, con una superficie lisa de color rosado o marrón claro y bien delimitado con aspecto angiomatoso y localización preferente facial (fig. 3). Clínicamente, se puede confundir fácilmente con xantogranuloma juvenil, un botriomicoma o un histiocitoma benigno, entre otros. En ocasiones pueden agruparse varias de estas lesiones en zona circunscrita (nevo de Spitz agminata), o generalizado por todo el cuerpo, con más de 100 lesiones, a excepción de mucosas y palmo-plantar.
El comportamiento de estas lesiones es benigno, aunque se ha reportado algún caso de nevo con características spitzoide, con metástasis linfáticas incluso en la edad pediátrica17. Probablemente, este tipo de nevos se deba extirpar siempre de forma especial si las lesiones son de gran tamaño (> 1 cm) o si son atípicas clínica o dermatoscópicamente.
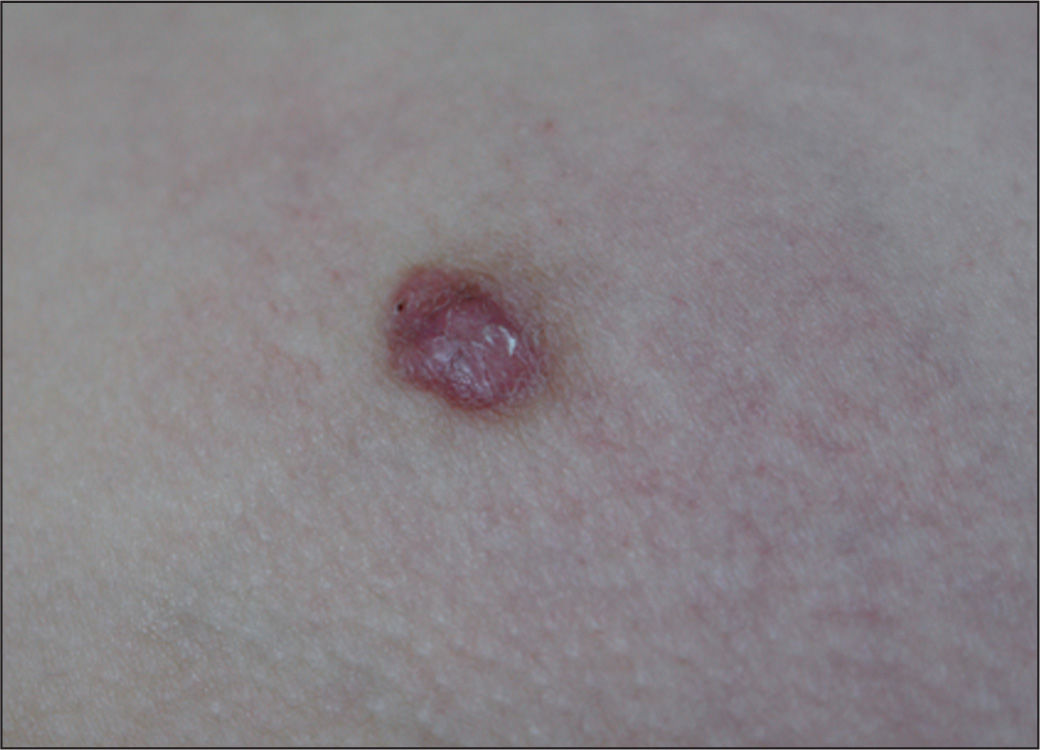
Nevo melanocítico de células fusiformes (nevo de Reed)Se considera como una variedad de nevo de Spitz, de predominio femenino y en el adulto joven, caracterizado por una lesión muy pigmentada, que aparece de forma relativamente rápida, se localiza de forma predominante en las extremidades inferiores, suele ser de pequeño tamaño (6mm), bien delimitado y de color homogéneo. Es una lesión benigna, pero de aspecto inquietante, que suele requerir su extirpación4.
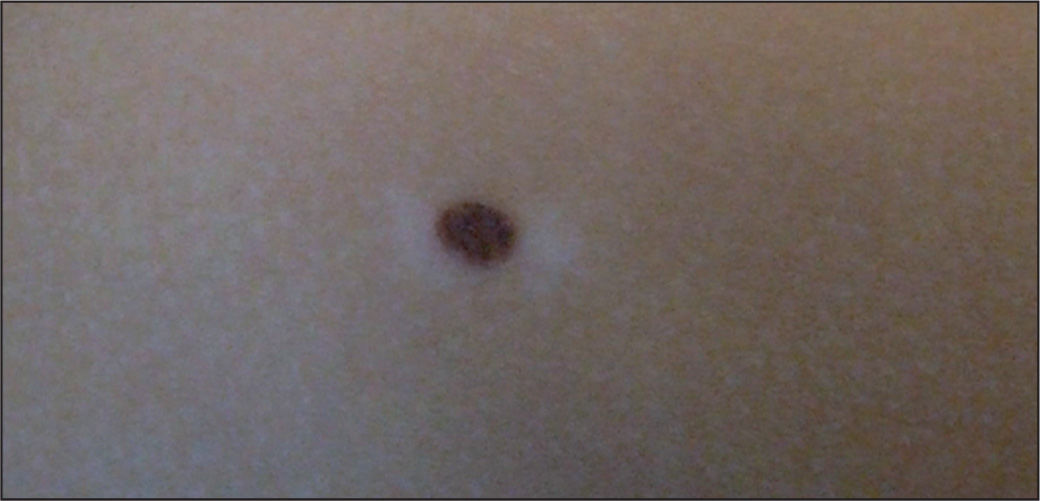
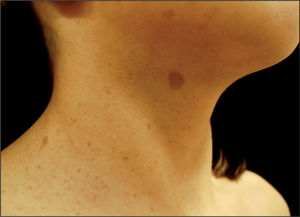
Nevo de Sutton o halo nevoCaracterizado de un halo acrómico circular alrededor de uno o varios nevos melanocíticos, compuestos o dérmicos como consecuencia de un fenómeno de regresión espontánea, que progresivamente provoca la desaparición de la lesión y deja un área despigmentada de aspecto vitiligoide (fig. 4). Este fenómeno se observa en su mayoría entre los 10 y los 20 años, sobre todo en el tronco, y es consecuencia de un infiltrado inflamatorio rico en linfocito que destruye progresivamente el nevo. La abstención terapéutica es la norma, salvo si esta despigmentación se produce de forma irregular y aparece en adultos. El papel de la dermatoscopia no ayuda a diferenciar el fenómeno de halo nevo de un nevo estrictamente benigno18.
Nevo azulEs la forma más frecuente de melanocitosis dérmica. Se puede presentar en el niño, pero aparece sobre todo en el adulto, en forma de una lesión redondeada bien delimitada, de coloración azulada o grisácea, que asienta de forma preferente en la cara y las extremidades superiores (fig. 5). La evolución suele ser benigna, aunque se ha informado de casos de malignización en nevo azul celular, que son los de tamaño mayor (> 1 cm). En este tipo de lesiones, la dermatoscopia puede ser útil19.
Nevo SpilusTambién llamado nevo sobre nevo, es una lesión solitaria, no pilosa, aplanada, de color marrón y aspecto parcheado, debido a unas pequeñas lesiones de color marrón oscuro parecidas a efélides que aparecen en su interior (fig. 6). Puede estar presente al nacer, aparecer en la infancia, en la adolescencia o a cualquier edad. El tamaño puede oscilar entre 1 y 20 cm de diámetro, y puede aparecer en cualquier área. Tiene el mismo potencial de malignización que otro tipo de nevo, y no parece ser necesaria su extirpación sistemática, salvo que presente algún rasgo de atipia20. Hay una serie de datos que ayudan a poder detectar los casos de más riesgo y obligar a un seguimiento, dentro de la baja incidencia de malignización. Estos son: los casos presentes desde el nacimiento, los mayores de 4 cm y los gigantes o zosteriformes21.
Nevo de OtaDentro de las melanocitosis dérmicas, hemos de reconocer esta lesión en forma de mácula de coloración azulada-grisácea, localizada de forma unilateral en el territorio de las 2 ramas superiores del trigémino, y puede afectar a la esclerótica y la conjuntiva unilateral. Puede aparecer de forma exclusiva en la infancia y persistir hasta la edad adulta. Se ha reportado algún caso de malignización, asociado a melanoma de coroides22.
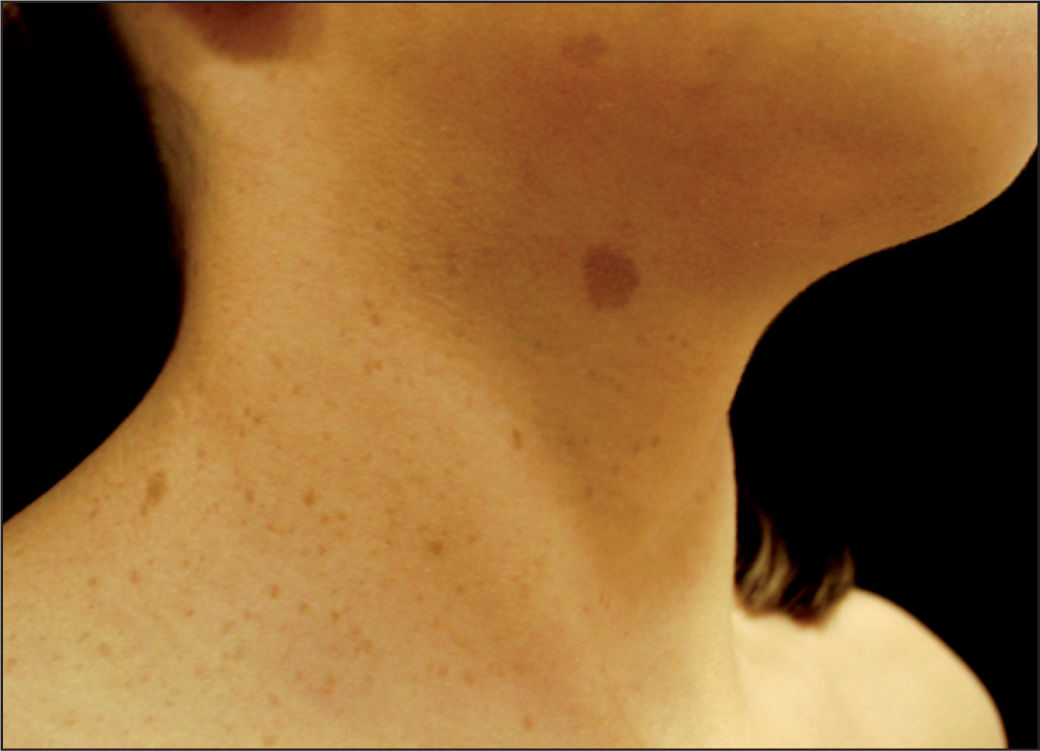
Nevo de ItoEs comparable al nevo de ota, asentado en la región acromioclavicular y deltoidea (fig. 7). Ambos, se caracterizan por presentar melanocitos elongados en la zona de la dermis, entre los haces de colágeno, y es más frecuente en razas orientales23.
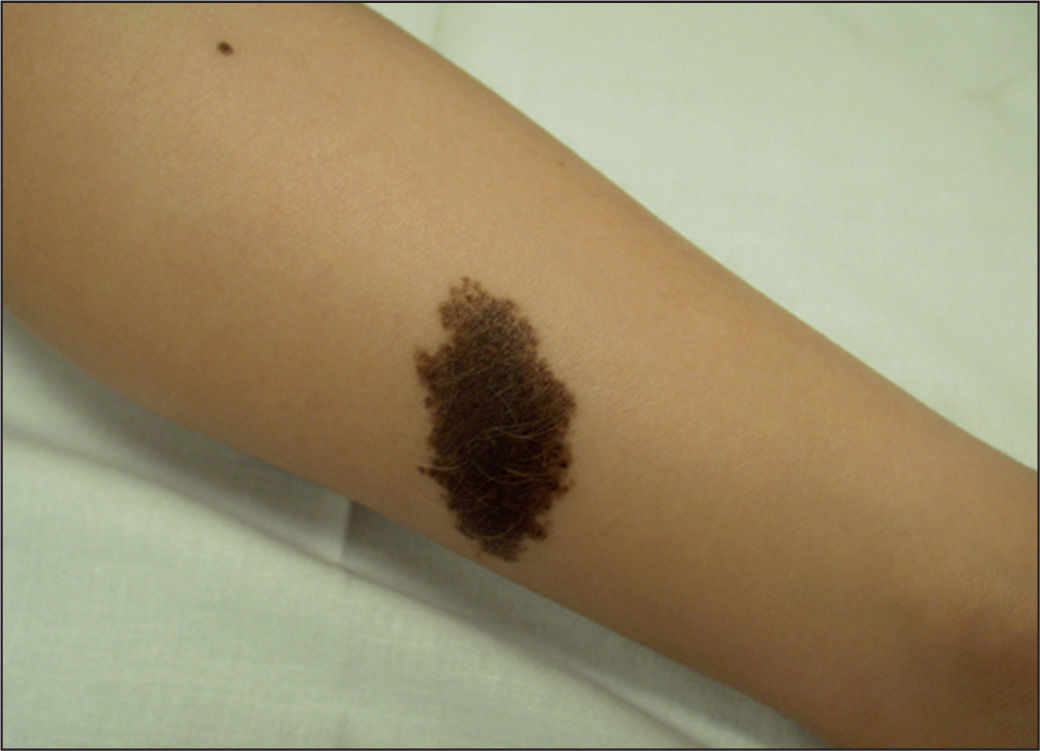
Nevo de BeckerSe clasifica dentro de los nevos epidérmicos, más que un verdadero NM. Puede aparecer en la infancia o en la pubertad, especialmente en varones, y se manifiesta después de una exposición solar. Aparece primero como una mácula pigmentada marronácea, de bordes irregulares, con predilección por la región escapular, pectoral, el dorso de la extremidad superior y el hombro. Por regla general, asienta de forma unilateral, y con el tiempo (1–2 años) aparecen pelos toscos que pueden desplazar el área de pigmentación. La etiología es desconocida, aunque parecen tener un cierto papel los andrógenos al ser más frecuente en varones de edad puberal y asociarse con hipertricosis. No precisa tratamiento, excepto por una cuestión estética (láser o escisión). Se han descrito casos de anomalías asociadas como hipoplasia mamaria unilateral, pectus carinatum, asimetría de la extremidad, espina bífida, agenesia del músculo pectoral, entre otras24,25.
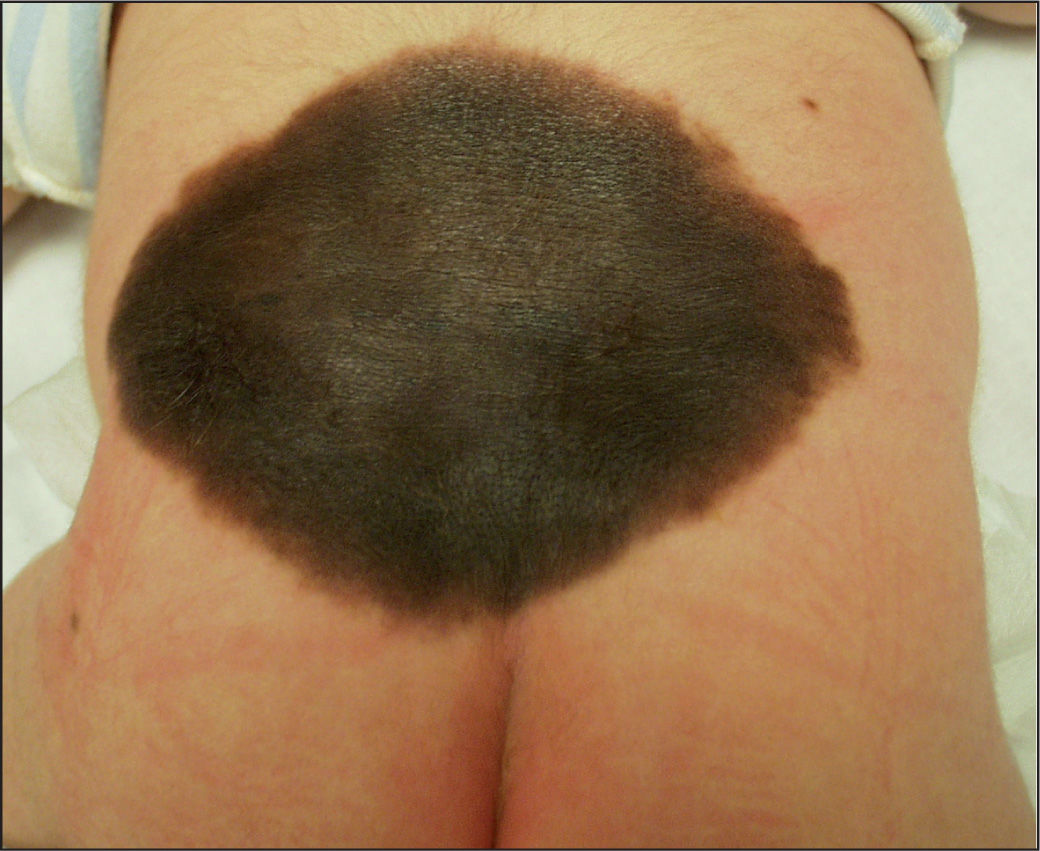
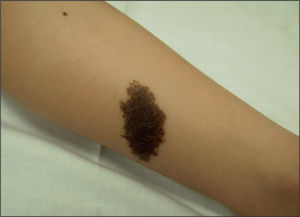
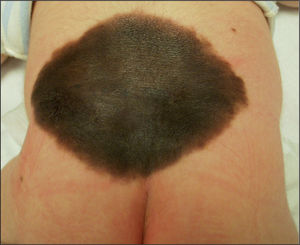
Nevos melanocíticos congénitosPor definición, están presentes al nacer o en las primeras 2 semanas de vida, aunque existen los llamados NMC “tardíos”, que aparecen durante los primeros meses de vida, e incluso hasta los 2 años de edad. Merecen una consideración aparte y que se les dedique una atención especial. Típicamente se subdividen, según su tamaño, en 3 categorías: a) pequeños (menores de 1,5 cm); b) intermedios (1,5-19,9 cm), y c) gigantes (20 cm) (fig. 8). Aunque si se hace un estudio comparativo de las superficies corporales entre un adulto y un neonato, en el caso de los NMC gigantes parece corresponder a 9 cm en el polo cefálico y 6 cm en el cuerpo26.
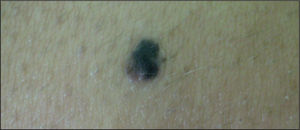
Es de aparición esporádica y más común en niñas. Afecta con más frecuencia la zona posterior del tronco, seguido de la cara, el cuero cabelludo y las extremidades. En algunos casos, puede afectar a más de un 50% de la superficie corporal. Suele tener una pigmentación y textura irregulares, con un aspecto infiltrado y multinodular en ocasiones, con un vello grueso y tosco. Puede experimentar cambios de color y textura en su evolución, como el aumento de vello, grosor, oscurecimiento o aclaramiento, aumento o disminución de los nódulos, o incluso aparición de erosiones27. Hasta casi un 80% de los nevos melanocíticos congénitos gigantes (NMCG) se acompaña de lesiones névicas pequeñas, alrededor de la lesión principal y por el resto de la piel, llamadas “satélites”, que pueden aparecer al nacer o desarrollarse progresivamente durante la infancia (fig. 1).
Los NMCG que afectan a las extremidades inferiores pueden asociarse a atrofia de la extremidad afectada. Se estima que el riesgo acumulativo probable en toda la vida de transformación maligna en el caso del NMCG es del 5-15%6–8. Este riesgo parece ser mayor en los primeros años de vida (3–5 años), aunque los melanomas asociados a NMCG son menos del 3% de todos los melanomas pediátricos28. La localización de estos nevos en la línea media centroespinal puede asociarse con la posibilidad de una melanosis neurocutánea, que podría llegar al 25% de los pacientes neurológicamente asintomáticos, y que obliga a emplear técnicas de imagen con resonancia magnética29–31.
Se desconoce el pronóstico, pero presentan un riesgo de desarrollar melanoma cerebral, que no puede tratarse quirúrgicamente, así como síntomas por la melanosis (convulsiones, hipertensión intracraneal, retraso). En estos casos es recomendable evitar la cirugía radical.
Estos datos obligan a plantearse una estrategia clínicoterapéutica en estos niños, consensuada y de forma temprana. Este tipo de lesiones son un auténtico problema de tratamiento por su tamaño y las lesiones satélites, que hacen que su extirpación completa sea imposible. Es importante ofrecer una explicación correcta a los padres de la probabilidad de aparición de melanoma, las diferentes posibilidades de tratamiento recomendables y sus posibles complicaciones. Hay que instruirles en realizar autovaloraciones mensuales y explicarles que precisarán un seguimiento continuado cada 3–6 meses. Se deben tomar fotografías del nevo gigante y de los satélites, y biopsiar cualquier zona sospechosa.
En general, la mayoría de autores parecen estar de acuerdo en recomendar una extirpación quirúrgica radical, que comience a partir de los 6 meses de edad si es posible, para evitar riesgo de anestesia, cirugía y muerte súbita10. Se debe procurar que ésta sea lo más completa posible y llegar hasta la fascia muscular, para disminuir la posibilidad de malignización de los NM que asientan en la grasa subcutánea. Este tratamiento debe individualizarse, por lo que en ocasiones se requieren múltiples intervenciones, plastias y expansores tisulares (fig. 2). En nuestra experiencia, el inicio temprano de la cirugía tiene múltiples ventajas: aparte de la prevención del desarrollo de un posible melanoma, el niño en este período tan temprano tiene una piel mucho más elástica y se consiguen extirpaciones mucho más amplias. Además, es menos consciente de la morbilidad que se le está infligiendo. En las lesiones muy atípicas, con diferentes tonos de coloración, negruzcas, de rápido crecimiento, puede considerarse su exéresis-biopsia en las primeras semanas de vida, para una valoración histológica. Los nevos satélites parecen tener un riesgo prácticamente nulo de malignización y se extirpan si los padres lo desean o si fueran de aspecto atípicos o de seguimiento difícil32.
Se han empleado otras técnicas menos intervencionistas, como pueden ser la dermoabrasión, raspado o láser, que por el momento no parecen tener un papel curativo, sino más bien paliativo, y más como indicación estética que como indicación verdaderamente preventiva de una posible malignización.
Además del riesgo de degeneración maligna en el caso del NMCG, hay que evaluar las posibles alteraciones cutáneas y extracutáneas asociadas (tabla 3).
Anomalías cutáneas y extracutáneas asociadas a nevo melanocítico congénito gigante
| Hipotrofia/hipertrofia de la extremidad afectada |
| Schwannoma fascicular |
| Lipoma |
| Linfangioma |
| Manchas mongólicas ectópicas |
| Hemangioma capilar |
| Manchas café con leche |
| Pólipo fibroepitelial |
| Hidrocefalia, convulsiones, retraso mental |
| Criptorquidia |
Los signos cutáneos pueden ser un dato básico para el diagnóstico de diferentes alteraciones congénitas. En una revisión realizada en 1993, Marghoob et al33 ponen de manifiesto la relación de diferentes tipos de NM con cuadros mal formativos congénitos, y remarcan la importancia de la descripción del tipo específico de lesiones. Múltiples publicaciones utilizan el término de nevo de forma incorrecta y lo confunden con manchas café con leche, efélides o lentigos, o no especifican el tipo de nevo presente (melanocítico, epidérmico, etc.).
Síndromes asociados a la presencia de nevos melanocíticos
| Nevos congénitos |
| Síndrome de Carney (incluidos LAMB y NAME) |
| Síndrome del nevo epidérmico |
| Melanosis neurocutánea |
| Neurofibromatosis tipo I |
| Síndrome del envejecimiento prematuro |
| Disrafismo espinal oculto |
| Nevos adquiridos |
| Síndrome del nevo displásico |
| Síndrome de Langer-Giedion |
| Nevos congénitos y/o adquiridos |
| Síndrome EEC |
| Síndrome de Goeminne |
| Síndrome de Kuskokwin |
| Síndrome de Noonan |
| Síndrome de Turner |
| Displasia tricoodontooniquial |
LAMB: lentigos, mixoma auricular, mixomas mucocutáneos, nevo azul;
NAME: nevos, mixoma auricular, neurofibroma, mixoide, efélides.
Se ha de realizar con otras lesiones pigmentadas que también pertenecen al sistema melanocitario, pero que no son proliferaciones verdaderas.
En primer lugar, y por orden de frecuencia, hemos de considerar los lentigos, que son lesiones maculosas de pocos milímetros de tamaño, con un pigmento marrón oscuro distribuido de forma uniforme, que no se altera con la exposición solar, a diferencia de las efélides (vulgarmente pecas) que presentan una coloración marrón clara o rosada y aumentan en número y color con la exposición solar. Por regla general, los lentigos se presentan de forma aislada, pero pueden ser el marcador cutáneo de un síndrome complejo, como la lentiginosis periorificial asociada a poliposis intestinal en el síndrome de Peutz-Jeghers o el síndrome de Leopard.
Las manchas café con leche son unas lesiones planas, redondas u ovaladas, bien delimitadas, con una pigmentación marrón clara, como su nombre indica. Con frecuencia están presentes al nacer y se pueden encontrar en el 10-20% de individuos normales. El tamaño puede oscilar entre 1 cm o menos de diámetro, hasta 15–20 cm o más. De todos es conocida su relación con la neurofibromatosis, aunque hay otra serie de síndromes menos conocidos de los cuales forman parte (síndrome de Watson, displasia fibrótica poliostótica, síndrome de Bloom, entre otros).
También hemos de incluir en la lista de diagnóstico diferencial tumores cutáneos pigmentados benignos (dermatofibromas) o malignos (carcinoma basocelular pigmentado y el mismo melanoma maligno en fases iniciales).
Asesoramiento médico y familiar (tabla 6)Prácticamente todos somos portadores de algún NM, y la mayor parte de estas lesiones son intrascendentes. La transformación maligna de un NM en la infancia es infrecuente, excepto en el caso de los NMCG. La indicación de exéresis de un nevo puede ser de orden estético (a cargo del paciente y valorando siempre la localización y el riesgo de cicatriz) o médico. Las indicaciones médicas son para nevos con riesgo de malignización (atípicos, cambios bruscos en coloración, tamaño, hemorragia espontánea), en los localizados en áreas de traumatismo y roce frecuente y en el caso del nevo congénito. El fenotipo névico (es decir, el número y el tipo de nevos de un individuo resultante de la genética y del efecto de las exposiciones solares) no es un precursor de una posible malignización, pero constituye un excelente marcador de riesgo de melanoma34.
En el caso de los NM de tamaño mediano o pequeño, no hay datos claros de cuál debe ser la actitud. Algunos autores recomiendan la exéresis de las lesiones más fuertemente pigmentadas, en el caso de historia familiar de melanoma o en lesiones de difícil seguimiento clínico (p. ej., localización en cuero cabelludo). Por otra parte, se debería evitar la morbilidad de una exéresis en regiones de riesgo de posible desfiguramiento. Verdaderamente, en estos casos de mala definición terapéutica, se ha de imponer el lógico criterio profesional. Es muy importante tener una buena relación con los padres y explicar el caso detalladamente, así como consensuar criterios de actuación y planificación. Se puede ofrecer la exéresis preventiva en localizaciones con buena cicatrización y de poca agresividad, siempre intentando esperar a que el niño tenga la edad suficiente para colaborar a la hora de realizarla con anestesia local (el riesgo de melanomas en estos casos es muy bajo antes de la pubertad).
En el caso de abstención terapéutica, se debe plantear un seguimiento periódico, con realización de fotografías periódicas y, en los últimos años, se impone la revisión dermatoscópica en manos expertas, especialmente en los casos en que se detectan cambios clínicos, y puede ser de utilidad para la indicación de tratamiento quirúrgico35,36.
La exposición solar acumulativa a lo largo de los años está claramente ligada al riesgo de cáncer de piel nomelanoma. En el melanoma, el riesgo se relaciona principalmente con la sensibilidad solar y con un exceso de exposición solar durante la infancia. El papel educacional de los pediatras es básico en este sentido, sobre todo acerca del consejo, a padres y niños, de una protección solar adecuada, y hay que hacer entender que, más que una protección, han de evitar una sobreexposición, y no pensar que al aplicar cremas de protección se puede permitir que se esté más horas bajo el sol sin riesgos.
Está fuera de dudas que es imprescindible una protección contra el sol, sobre todo durante la infancia y la adolescencia, particularmente si es un individuo de piel clara con múltiples nevos o atípicos. Es importante aconsejar cremas que protejan contra la radiación UVA, dado que la mayoría protegen contra los UVB, pero pocas contra los UVA. Así, la mayoría de cremas provocan una falsa sensación de protección, debido a que no se produce una quemadura solar y, como consecuencia, se está más expuesto a los UVA que en el caso de que no se hubiera aplicado la crema protectora. Aparte de las cremas protectoras, se ha de recomendar el uso de prendas de vestir, gafas de sol e incluso sombreros. Hay diversos estudios en los que se demuestra que la protección con prendas de vestir reduce de forma evidente el número de nevos en niños5. Finalmente, no se debe olvidar que los adolescentes han de ser informados del efecto perjudicial de las lámparas de bronceado.
Por último, a pesar de la rareza del melanoma antes de la pubertad, es importante pensar en su posibilidad, incluso sin lesiones predisponentes. De forma inversa, su diagnóstico ha de evaluarse con mucha cautela y solicitar la opinión de más de un experto.