Las infecciones por neumococo (Streptococcus pneumoniae) continúan siendo una causa importante de morbimortalidad en todo el mundo. Las formas de infección neumocócica en niños se pueden clasificar en:
- —
Enfermedades invasoras: bacteriemias, meningitis, neumonías bacteriémicas.
- —
Infecciones no invasoras: otitis media aguda, sinusitis, neumonías.
El neumococo es un colonizador habitual de la nasofaringe, pero cada serotipo tiene una capacidad colonizadora e invasora diferente. En los últimos años se han producido cambios indiscutibles en la epidemiología de la enfermedad neumocócica invasora (ENI) en todo el mundo1,2. Por una parte, la presión antibiótica favorece la selección de cepas resistentes y cambios en la colonización nasofaríngea, y por otra, la introducción de la vacuna antineumocócica conjugada heptavalente ha influido en el reemplazo de los serotipos colonizadores y puede dar lugar a un incremento de enfermedad por serotipos no vacunales3,4.
Puntos clave
La vacuna antineumocócica conjugada heptavalente (VNC7) Prevenar© fue comercializada por Wyeth en EE.UU. en el año 2000 y en Europa en 2001. La repercusión sobre la carga global de enfermedad ha sido indudable, con disminución del 60-90% de casos de ENI5. Paralelamente, se han producido variaciones en la prevalencia de los diferentes serotipos neumocócicos, y se ha encontrado una disminución de enfermedad causada por serotipos vacunales y aumento de los no vacunales6. Los serotipos neumocócicos cuya prevalencia se ha incrementado de forma más significativa han sido: 1, 5, 7F y 19A.
Por otra parte, el cambio observado en la prevalencia de los distintos serotipos se ha visto acompañado de una variación de los cuadros clínicos. La más importante ha sido el fuerte ascenso en la frecuencia de empiemas y neumonías bacteriémicas según datos de numerosos países, incluido España. El serotipo más frecuentemente implicado en este incremento ha sido el 1, seguido del 19A, 3 y 7F7,8.
Diversos estudios han mostrado una reducción significativa en la incidencia de meningitis neumocócica, especialmente de los casos producidos por serotipos vacunales. Este descenso, sin embargo, se ha visto acompañado de un incremento de los casos producidos por serotipos no vacunales, sobre todo 19A9,10. También se ha comprobado un cambio en la etiología de la otitis media aguda, con reducción de Streptococcus pneumoniae e incremento de Haemophilus influenzae no tipable11.
En relación con las resistencias del neumococo a los antibióticos, una gran proporción de las mismas se asocia a los serotipos 6A, 6B, 9V, 14, 19F, 19A y 23F, todos ellos colonizadores frecuentes de la nasofaringe, y por lo tanto expuestos a la presión selectiva de los antibióticos12. La disminución de la colonización nasofaríngea por las cepas vacunales tras la introducción de la VNC7 es, probablemente, el principal mecanismo por el que estas vacunas disminuyen las resistencias13.
De todo lo anterior se desprende que los cambios producidos en la epidemiología de la enfermedad neumocócica justifican la necesidad de ampliar la protección a un mayor número de serotipos de neumococo.
Nuevas vacunas antineumocócicasLas principales características en el diseño de las nuevas vacunas antineumocócicas han sido la inclusión de mayor número de serotipos y la selección de nuevas proteínas transportadoras para su conjugación. Se han desarrollado varias combinaciones, siendo dos las vacunas que han completado el desarrollo clínico requerido para su comercialización: una vacuna decavalente (VNC10) Synflorix® (GlaxoSmithKline) y una vacuna tridecavalente (VNC13) Prevenar 13® (Pfizer). Ambas vacunas han sido aprobadas por la Agencia Europea del Medicamento (EMA), basándose en los niveles de anticuerpos frente al polisacárido capsular y en los títulos de actividad opsonofagocítica que la Organización Mundial de la Salud (OMS) ha definido como parámetros indirectos de protección14, ya que no resultaba ético realizar estudios de eficacia en ENI, enfermedad para la que ya existe una vacuna eficaz como es Prevenar®.
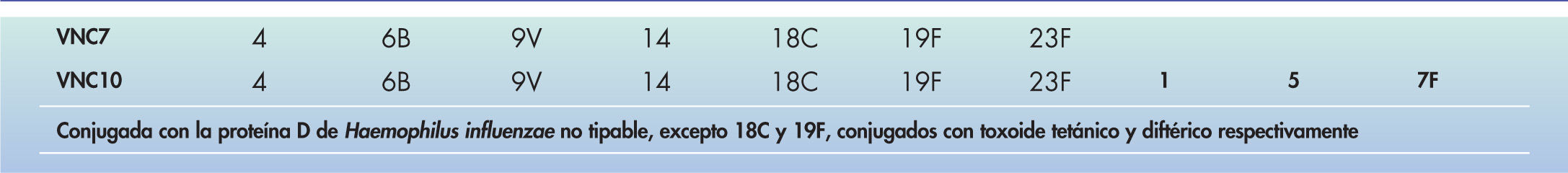
Vacuna antineumocócica conjugada decavalente (VNC10)Esta vacuna fue autorizada por la EMA en marzo del 2009, con indicación para la prevención de la ENI y OMA por neumococo en niños de 6 semanas a 2 años de edad. En España está disponible desde finales de agosto de 2009. Contiene polisacáridos para los mismos serotipos neumocócicos que la VNC7 (4, 6B, 9V, 14, 18C, 19F y 23F), más los serotipos 1, 5 y 7F (fig. 1). Como proteína de conjugación utiliza la proteína D, una forma no lipídica recombinante de la proteína D de H. influenzae no tipable, en todos los serotipos neumocócicos, excepto en el 18C y en el 19F, conjugados con toxoide tetánico y diftérico, respectivamente.
Estudios de no inferioridad inmunológica han demostrado que, aplicando los criterios establecidos por la OMS, la VNC10 no es inferior a la VNC7 para los serotipos comunes. Además, para los serotipos adicionales contenidos en esta vacuna, la respuesta inmunológica inducida cumple los parámetros de protección establecidos, y la dosis de refuerzo genera una adecuada memoria inmunológica para todos los serotipos que contiene15.
Existen también estudios que demuestran que la vacuna decavalente puede utilizarse como dosis de recuerdo en primovacunados con Prevenar®, obteniéndose una respuesta similar para los serotipos que comparten ambas vacunas16. La VNC10 puede coadministrarse con otras vacunas del calendario, ya que no se producen interferencias significativas en la inmunogenicidad ni mayor reactogenicidad17.
Vacuna antineumocócica conjugada tridecavalente (VNC13)Esta vacuna contiene polisacáridos para 13 serotipos neumocócicos conjugados con el toxoide diftérico CRM197: los 7 serotipos de la VNC7 más los serotipos 1, 3, 5, 6A, 7F y 19A (fig. 2). La VNC13 fue aprobada por la EMA en diciembre de 2009, indicada para la prevención de la ENI, neumonía y OMA causada por neumococo en niños entre 6 semanas y 5 años de edad y ha sido comercializada recientemente en España.
Los estudios realizados demuestran que la VNC13 es tan eficaz como VNC7 en la prevención de la enfermedad neumocócica causada por los 7 serotipos comunes, y que además amplía la cobertura de la VNC7 contra la enfermedad neumocócica causada por los 6 serotipos adicionales. La VNC13 cumple los criterios de no inferioridad inmunológica frente a la VNC7 para los serotipos comunes, así como los parámetros de protección frente a los 6 serotipos que amplía, considerando los criterios inmunológicos establecidos por la OMS. La dosis de refuerzo induce una adecuada memoria inmunológica. No existen interferencias inmunológicas significativas ni se incrementa la reactogenicidad cuando se coadministra con otras vacunas del calendario18.
Diversos estudios indican que sólo es necesaria una dosis de VNC13 como recuerdo en primovacunados con VNC7 para obtener una adecuada respuesta inmunitaria para los 6 serotipos adicionales. Además, ya que para los 7 serotipos comunes las 2 vacunas son idénticas y el perfil de inmunogenicidad es similar, se puede recomendar sustituir la VNC7 por la VNC13 para completar la pauta en cualquier momento del calendario, tanto en la primovacunación como en la dosis de recuerdo19.
La pauta actual de primovacunación para ambas vacunas consiste en 3 dosis con un intervalo mínimo de un mes entre ellas. Se recomienda una dosis de recuerdo al menos 6 meses después de la primovacunación, preferiblemente entre los 12 y 15 meses de edad. La VNC10 sólo está aprobada hasta los 24 meses de vida, mientras que la VNC13 lo está hasta los 5 años16,19.
Es indudable que estas vacunas desempeñan un papel importante en el control de la ENI al disminuir la carga global de la enfermedad. Específicamente, la prevención de las infecciones por los serotipos 1 y 5 se traducirá en una disminución de las neumonías bacteriémicas y las que cursan con empiema. La repercusión sobre el 19A también puede disminuir la carga de ENI en forma de empiema y meningitis, así como las tasas de resistencias de neumococo a los antibióticos20. Resulta más difícil cuantificar la repercusión de las nuevas vacunas en la carga de enfermedad no invasora, ya que los marcadores indirectos de protección no están tan bien definidos en la neumonía y la OMA como en la ENI. Es muy posible que la VNC13 amplíe la efectividad frente a OMA observada con la VNC7 al incluir serotipos implicados en la misma, como el 19A. Por otra parte, la vacuna predecesora de la VNC10, una vacuna 11-valente experimental, redujo la incidencia de cualquier tipo de OMA en un 33,6%, y la reducción fue del 35% para la OMA por H. influenzae no tipable21.
También es difícil predecir el papel de las nuevas vacunas en la prevención de neumonías neumocócicas no bacteriémicas. Aunque el 10-40% de las neumonías de los niños son neumocócicas, no existen estudios amplios que determinen los serotipos implicados, aunque es probable que sean los mismos que los causantes de neumonías bacteriémicas22. De ser así, las nuevas vacunas pueden mejorar la efectividad ya comprobada con la VNC7 en la prevención de estas neumonías.
Pautas de transición entre vacunas antineumococicasDado que ambas vacunas están ya disponibles en nuestro país, y basándose en las especificaciones e indicaciones de las fichas técnicas de ambas vacunas, es necesario definir las estrategias de transición23 para pacientes que hayan recibido dosis previas de vacunas antineumocócicas conjugadas.
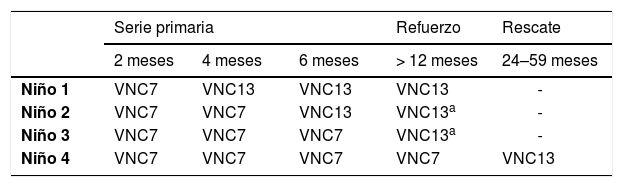
Los esquemas de transición de la VNC7 a la VNC13 en niños que no han completado la vacunación y el rescate en niños completamente vacunados se presentan en la tabla 1. Las VNC7 y VNC13, con el mismo carrier proteico, son totalmente intercambiables, de manera que cualquier niño en el que se haya iniciado la vacunación con VNC7, podrá continuar con VNC13 hasta completar la inmunización19.
Pautas de transición de la VNC7 a la VNC13 en niños que no han completado la vacunación y rescate en niños completamente vacunados
| Serie primaria | Refuerzo | Rescate | |||
|---|---|---|---|---|---|
| 2 meses | 4 meses | 6 meses | > 12 meses | 24–59 meses | |
| Niño 1 | VNC7 | VNC13 | VNC13 | VNC13 | - |
| Niño 2 | VNC7 | VNC7 | VNC13 | VNC13a | - |
| Niño 3 | VNC7 | VNC7 | VNC7 | VNC13a | - |
| Niño 4 | VNC7 | VNC7 | VNC7 | VNC7 | VNC13 |
Tomada de Comité Asesor de Vacunas de la Asociación Española de Pediatría24.
Por el contrario, la VNC10, con distinta proteína de conjugación, no puede intercambiarse en la serie de primovacunación con la VNC7. Sin embargo, esta vacuna podría utilizarse como dosis de refuerzo en el segundo año de vida en aquellos niños que hayan completado la serie de primovacunación con 3 dosis de VNC716. Los individuos que han iniciado la vacunación con VNC10 deben completar toda la serie de inmunización (primovacunación y refuerzo) con la VNC10 y no existen datos que documenten la intercambiabilidad, ni la transición a la VNC13.
En los niños vacunados con VNC7 que no hubieran recibido en la primovacunación, al menos, 2 dosis de VNC13, la ficha técnica establece la indicación de administrar 2 dosis de esta vacuna, separadas por un intervalo mínimo de 2 meses. No obstante, se contempla como alternativa la administración de una sola dosis de VNC13 en el segundo año de vida en primovacunados con VNC7. Esta indicación está incluida en las recomendaciones oficiales de diferentes países y también en Madrid23.
Los niños de hasta 59 meses de edad que previamente hayan recibido la pauta completa con cualquiera de las vacunas antineumocócicas conjugadas VNC7 o VNC10 pueden beneficiarse de una dosis adicional de VNC13, administrada con, al menos, 2 meses de intervalo tras la última dosis de vacuna antineumocócica, lo que permite ampliar su protección a los serotipos que incorpora esta nueva vacuna23.
Esquemas de vacunaciónLas coberturas de vacunación en las diferentes comunidades autónomas, excepto en Madrid, han sido variables e insuficientes para inducir una potente inmunidad de grupo. En situaciones de vacunación no sistemática, en los lactantes que inician la vacunación antineumocócica a los 2 meses de edad, debe seguir utilizándose el esquema de inmunización 3 + 1, con 3 dosis de primovacunación más una dosis de refuerzo en el segundo año de vida. Una primovacunación con 2 dosis, en ausencia de inmunidad de grupo, puede dejar al niño en situación de riesgo frente a algunos serotipos neumocócicos menos inmunógenos, como el 6B y el 23, hasta que no se administre la dosis de refuerzo24. Cuando la vacunación se inicie más tarde, el número de dosis dependerá de la edad del niño, como se señala en la tabla 2.
Pautas de vacunación antineumocócica, según la edad, utilizando exclusivamente las nuevas vacunas conjugadas
| Edad actual | N.° de dosis de las nuevas vacunas conjugadas |
|---|---|
| 6 semanas-6 meses | Tres dosis de primovacunacióna más un refuerzob en el 2.° año de vida |
| 7–11 meses | Dos dosis con un intervalo mínimo de un mes, más una tercera dosis de refuerzob en el 2° año de vida |
| 12–23 meses | Dos dosis separadas por un intervalo de, al menos, 2 meses |
| 2–5 añosc | Una sola dosisd |
Dosis de refuerzo en el 2° año de vida, con un intervalo mínimo de 2 meses con la dosis previa. Preferiblemente entre los 12 y los 15 meses de edad.
En pacientes inmunodeprimidos se recomiendan 2 dosis de Prevenar13® separadas, al menos, por un intervalo de 2 meses. Las dos dosis son recomendables incluso en niños que hayan recibido previamente todas las dosis de Prevenar® y ninguna de Prevenar 13®. Además, deberá completarse la inmunización antineumocócica con la vacuna polisacárida de 23 serotipos. Tomada de Comité Asesor de Vacunas de la Asociación Española de Pediatría24.
Si, como es deseable, se decide instaurar la vacunación universal frente a neumococo, serán las autoridades sanitarias quienes tendrán que diseñar las estrategias y pautas de vacunación más efectivas y eficientes.