La tomografía computarizada por emisión de fotón único (SPECT) cerebral aporta información sobre la perfusión y el metabolismo cerebral permitiendo una aproximación a la fisiopatología de las enfermedades del sistema nervioso central (SNC) del niño, sus secuelas y los trastornos del desarrollo en los primeros años de vida. No se encuentran series de estudios de niños normales por razones éticas, por lo cual su interpretación depende de los hallazgos clínicos y del electroencefalograma, la tomografía computarizada (TC), la resonancia magnética (RM) y la tomografía por emisión de positrones (PET).
Las pruebas de imagen están indicadas cuando se sospecha enfermedad intracraneal, antecedente de trauma, epilepsia refractaria, psicosis infantil o trastornos resistentes a tratamientos convencionales1.
Se utilizan radiotrazadores como exametazima (HMPAO) o bicisitato (ECD) marcados con 99mTc, prefiriendo el ECD por tener menor dosis de radiación efectiva en cuerpo entero. Es imprescindible la inmovilidad de la cabeza durante la exploración, para lo que se utilizan bandas de sujeción y, en algunas ocasiones es necesaria la sedación del paciente.
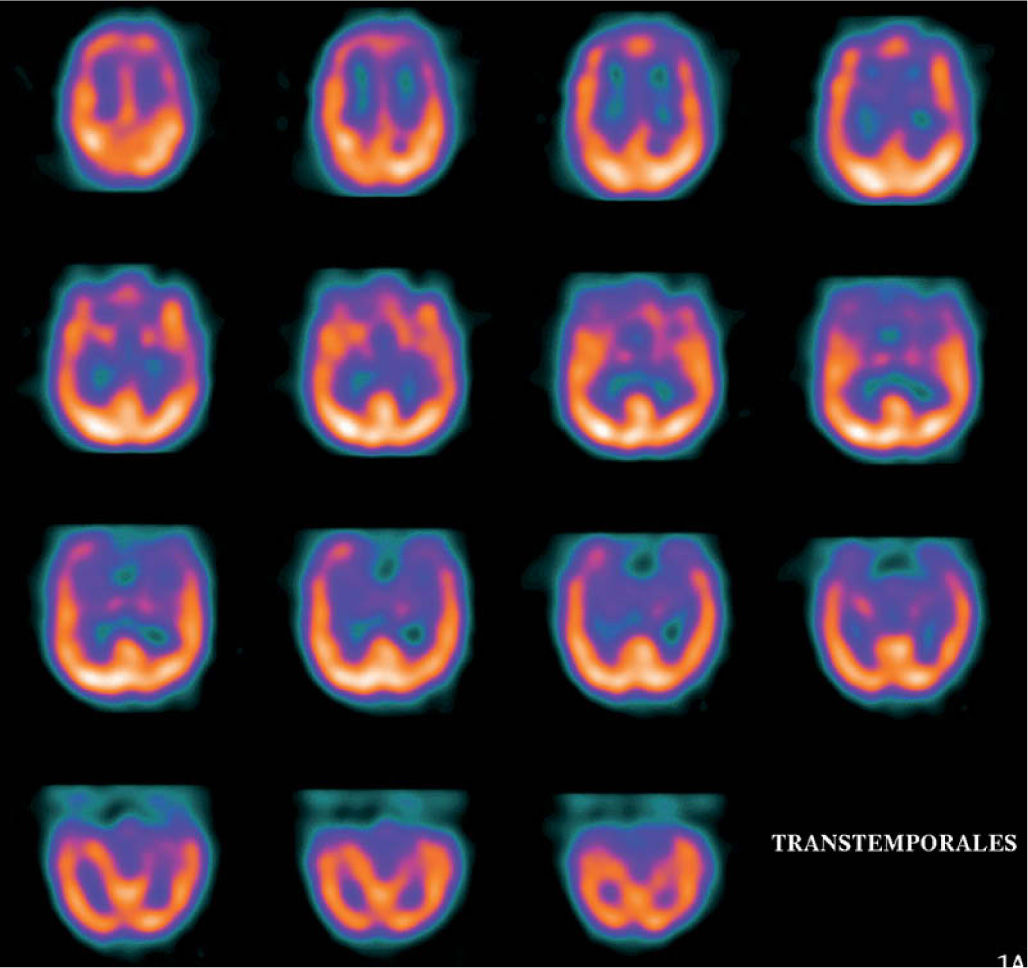
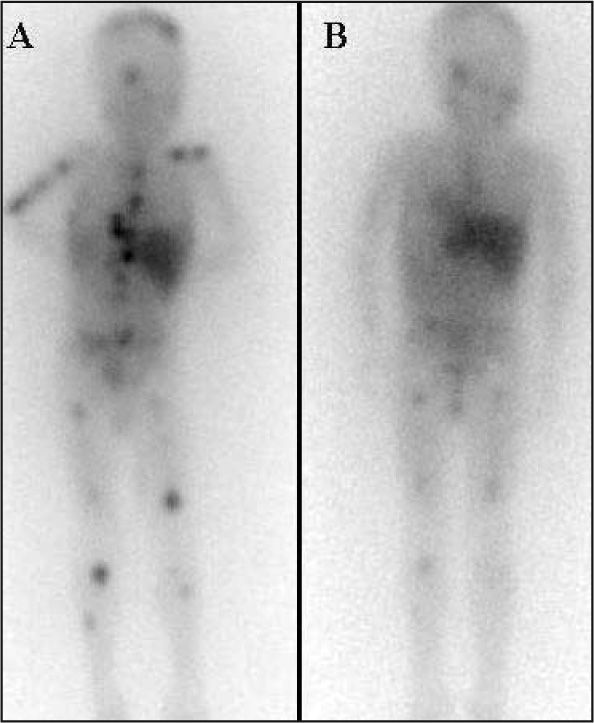
En la epilepsia2 se puede realizar la SPECT en diferentes tiempos: ictal, peri e interictal y postictal, analizando los hallazgos según la etapa fisiopatológica. Está indicada en crisis parciales complejas de localización temporal, como estudio prequirúrgico. Si el estudio se realiza en fase interictal se aprecia una reducción del flujo sanguíneo en la región epileptógena en el 50-70% de los casos (fig. 1).
Tanto la SPECT de perfusión como la PET presentan hallazgos más o menos específicos para los trastornos del lenguaje, déficit de atención hiperactivo, síndromes con autismo de base orgánica, síndrome de Gilles de la Tourette, esquizofrenia, trastornos obsesivos-compulsivos, trastornos afectivos y depresión, estrés postraumático y anorexia nerviosa, siempre como técnica complementaria a la imagen anatómica de TC y RM.
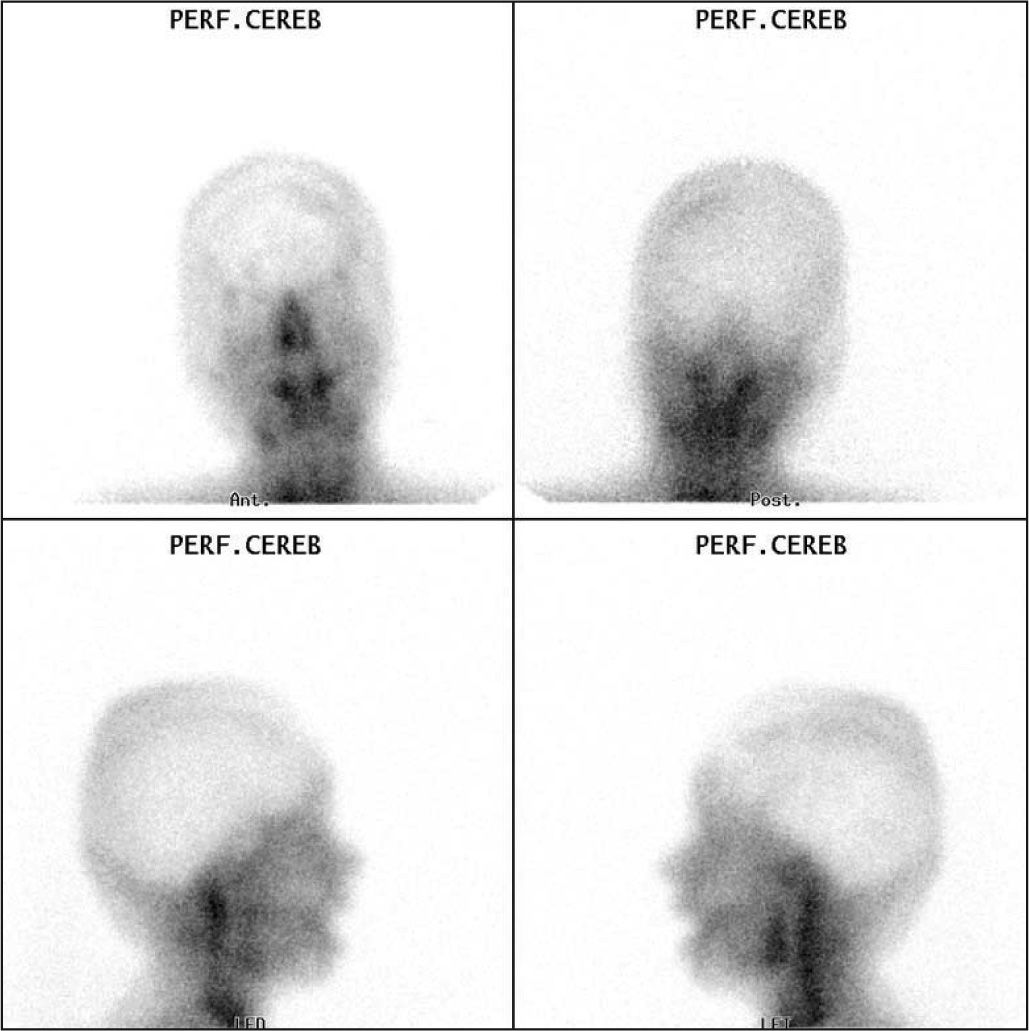
Especial mención merece el diagnóstico de muerte cerebral (fig. 2) ya que en este caso es una prueba sólo comparable con la arteriografía, con muy buena sensibilidad y especificidad.
Medicina nuclear en cardiología pediátricaEl desarrollo de la ecocardiografía, la RM y la TC multidetector han conseguido los principales avances en la valoración de imagen, no invasiva, de la anatomía en la cardiología pediátrica. Los métodos con radionúclidos no tienen resolución anatómica para valorar de forma precisa la morfología en las cardiopatías congénitas, sin embargo, aportan valoración cuantitativa de las consecuencias fisiológicas de la enfermedad estructural cardíaca3,4. Son aplicables a niños de todas las edades y muy reproducibles lo cual es muy útil si es necesario hacer valoraciones seriadas.
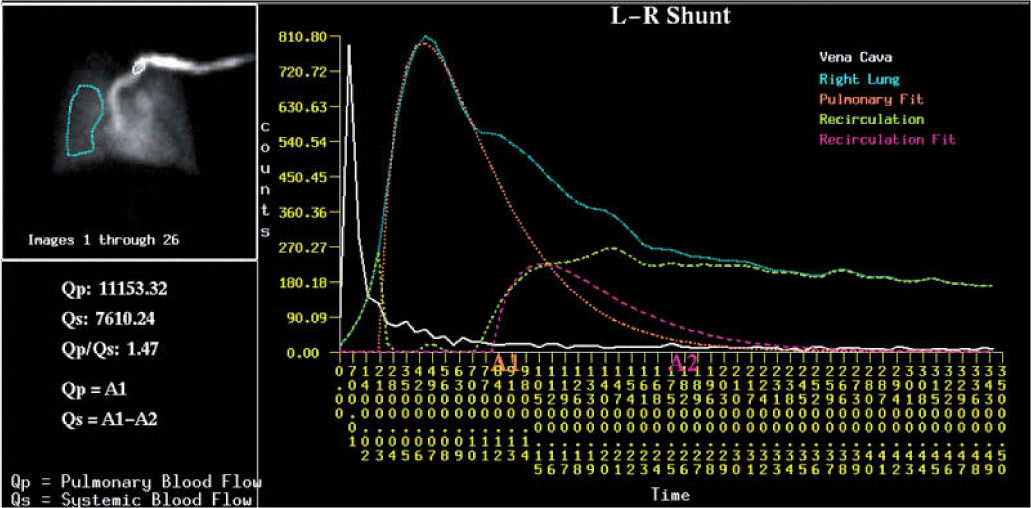
Las técnicas empleadas en medicina nuclear son: la angiocardiografía isotópica de primer paso para la detección y cálculo de cortocircuitos intracardíacos (fig. 3); la ventriculografía en equilibrio para el análisis de la función ventricular, la contractilidad segmentaria, la respuesta de la función ventricular al ejercicio, la función diastólica y los volúmenes ventriculares; la gammagrafía de perfusión miocárdica para la detección de defectos de perfusión, en relación con anomalías de las arterias coronarias, ateroesclerosis por dislipemias, enfermedad de Kawasaki o lesiones coronarias iatrogénicas producidas en el curso de la cirugía de las cardiopatías congénitas.
Puntos clave
La ventilación se realiza con la inhalación de aerosoles de 99mTc-DTPA (pentetato de tecnecio), por medio de una máscara, y refleja la ventilación regional pulmonar. La perfusión sanguínea pulmonar se determina con la inyección intravenosa de macroagregados de albúmina (MAA) marcados con 99mTc que produce temporalmente microembolizaciones en el lecho precapilar del pulmón, en una distribución proporcional al flujo arterial regional, sin producir alteraciones hemodinámicas.
En la edad pediátrica, la realización de estudios de perfusión y ventilación pulmonares se utiliza para el diagnóstico de bronquiectasias, sospecha de cuerpo extraño en árbol bronquial, fibrosis quística, fístulas arteriovenosas pulmonares, aplasia o hipoplasia arterial pulmonar y valoración pulmonar tras cirugía cardíaca.
TiroidesLa gammagrafía tiene un papel importante en la investigación de rutina de la enfermedad tiroidea benigna y maligna, junto a las determinaciones analíticas, la ecografía y la biopsia por punción.
Los trazadores más usados son yodo 131 y 123 (131I, 123I) y 99Tc metaestable (99mTc). El 123I es el isótopo ideal para estudiar el tiroides en la edad pediátrica por su corta vida media (0,55 días) y por la emisión de radiación gamma, siendo además adecuada para la detección con gammacámaras. Las desventajas incluyen una disponibilidad más limitada y su elevado coste. El pertecnectato de 99mTc es un anión monovalente que como el yodo es captado por la célula tiroidea y no es organificado por lo cual da una buena imagen de la morfología y función de la glándula con poca radiación para el paciente.
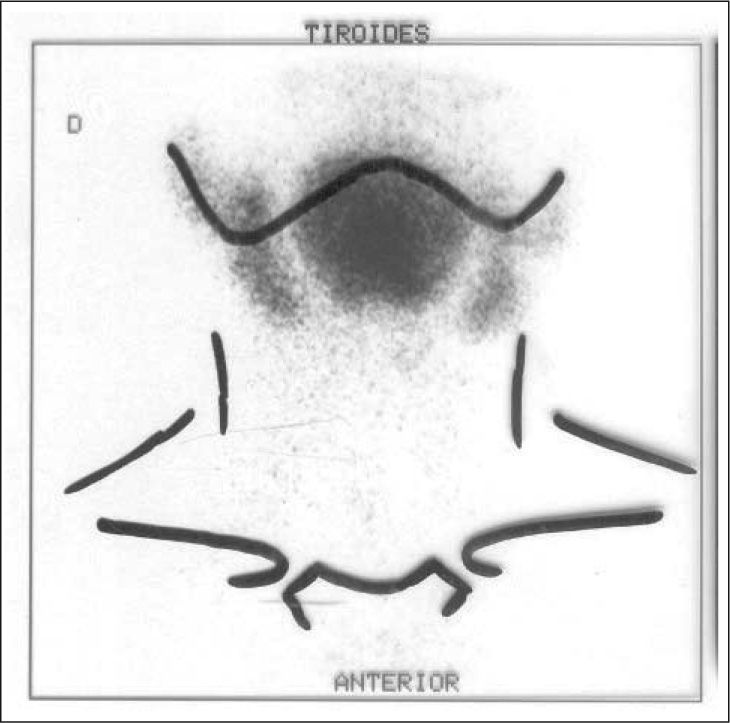
La principal indicación en la edad pediátrica es el diagnóstico del hipotiroidismo congénito para valorar la existencia de tiroides ectópico (sublingual) (fig. 4), quiste tirogloso o la ausencia de tiroides.
Oncología pediátricaDe forma general las técnicas de medicina nuclear aportan información sobre la funcionalidad tumoral, extensión, esta-dificación, comportamiento frente al tratamiento administrado y recidiva tumoral.
Tanto para linfomas de tipo Hodgkin como en los no hodgkinianos la gammagrafía con galio 67 (67Ga) tiene una gran especificidad al inicio del estudio de la enfermedad y una sensibilidad muy buena, siendo aún mayor en el linfoma de Hodgkin. También presenta muy buena especificidad para los estudios postratamiento. La gammagrafía con 67Ga es muy útil como parámetro pronóstico en el linfoma de Hodgkin, ya que los cambios de la imagen después de un tratamiento indica un pronóstico favorable, determinando así que niños que mantienen una gammagrafía positiva tras el tratamiento deberían ser candidatos a un tratamiento más agresivo5.
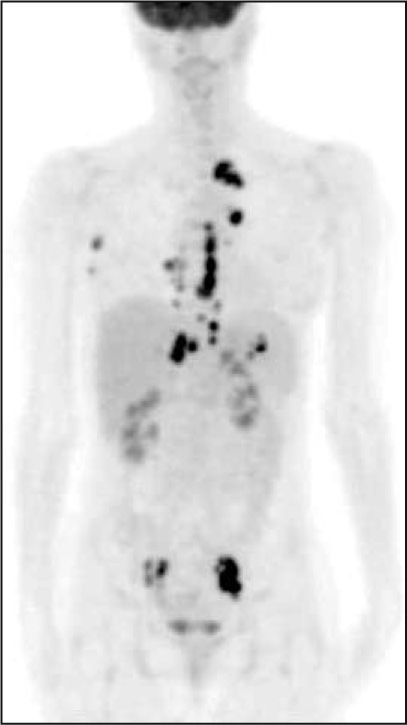
En el estudio de la extensión local del neuroblastoma se usa la RM, TC y gammagrafías con varios radiofármacos. Estas pruebas se usan también en la localización del tumor primario en niños que se presentan con enfermedad diseminada o síndrome paraneoplásico. La metaidobenzilguanidina (MIBG) marcada con 123I es un análogo de la guanetidina, similar a la noradrenalina, siendo captada por las células cromafines, y permite obtener imágenes del tejido simpático adrenérgico patológico con un 85% de sensibilidad diagnóstica6. Su indicación principal es el diagnóstico de los feocromocitomas, localizados en médula adrenal o ectópicos, y en los neuroblastomas, y también es útil para tumores carcinoides, paragangliomas y carcinoma medular de tiroides. En el neuroblastoma la gammagrafía con MIBG (fig. 5) diagnostica el tumor o las metástasis en más del 90% de los niños afectados, con una especificidad que se aproxima al 100%.
La 123I-MIBG se utiliza también para el tratamiento de tumores neuroendocrinos en estadio III y IV inoperable, como tratamiento paliativo en enfermedad progresiva, metástasis recurrentes o cuando la terapia convencional ha fallado, ya que presenta una menor capacidad de invasión y toxicidad que la quimioterapia, inmunoterapia y radioterapia externa. Otra posibilidad en casos de enfermedad recurrente es la combinación de 123I-MIBG con terapia hiperbárica, con elevadas dosis de quimioterápicos o radiación total corporal, pero en estos últimos casos la toxicidad aumenta considerablemente5.
La localización de tumores con indio 111 (111In)-pentreótido en casos de neuroblastoma refleja la presencia de receptores de somatostatina tipo 2 en algunas células del tumor, así mismo se usa en la detección de lesiones esqueléticas. La gammagrafía ósea con 99mTc- HDP también detecta extensión ósea de la enfermedad, sin embargo, no es capaz de distinguir entre enfermedad activa y tejido osteoblástico reparativo.
También se ha utilizado la 123I-MIBG como técnica intraoperatoria, por medio de la cirugía radiodirigida en tumores de la cresta neuronal, presentando una sensibilidad del 91% y especificidad del 55%, que aumenta al 92 y 85% respectivamente cuando se marcaba con 125I 7.
La radiología, ecografía, RM y TC son las técnicas más comúnmente empleadas en la estadificación anatómica y detección de metástasis del tumor de Wilms. La gammagrafía con talio 201 (201Tl) puede ser diagnóstica. La captación de FDG también está descrita, aunque la excreción renal de la FDG es un factor limitante.
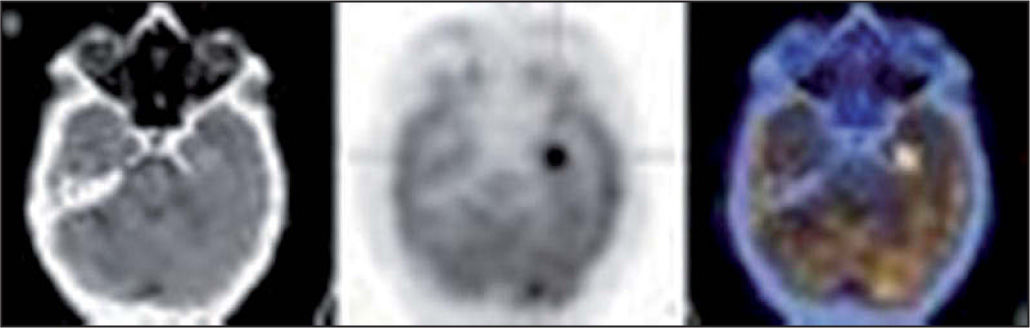
La imagen de RM y la TC son las principales modalidades de imagen usadas en la estadificación y seguimiento de niños con tumores cerebrales, sin embargo son incapaces de distinguir tumor residual o viable tras la cirugía o radiación. La tomogammagrafía por emisión de fotón único (SPECT) con 201Tl y 99mTc-MIBI se utiliza en el diagnóstico de tumores intracraneales y valoración de respuesta al tratamiento permitiendo diferenciar tejido residual o cicatricial posttratamiento.
PET Y PET/TC en oncología pediátricaLa incorporación de la PET ha tenido un indiscutible impacto en oncología. El cambio en el manejo clínico del paciente oncológico atribuible a la PET o a la PET-TC se cifra entre el 30 y el 50% en las distintas series y patologías8.
La PET-TC ha demostrado ser superior a la PET sola, permitiendo una localización precisa en la TC de las anomalías metabólicas vistas en la PET, y ser superior a la TC sola, porque permite la caracterización metabólica de los hallazgos normales y anormales vistos en la TC, incrementando la confianza diagnóstica y reduciendo la interpretación de imágenes equívocas9,10.
En la realización de la PET es fundamental la colaboración de los padres. El niño debe estar en ayunas como mínimo 4h antes de la exploración, para evitar niveles elevados de insulina en sangre y reducir la glucemia. Debe permanecer en reposo desde 15min antes, hasta 45min después de la inyección de la fluorodesoxiglucosa (FDG), para evitar captación muscular de la glucosa. Puede ser necesaria la sedación en los niños que no vayan a colaborar en la exploración, por la edad, claustrofobia o patología neurológica. La dosis de FDG recomendada en pediatría es de 6MBq/ kg. Para disminuir la dosimetría se recomienda aumentar la ingesta de líquidos el día de la prueba para forzar la eliminación urinaria.
La PET-FDG tiene una mayor captación en los linfomas de alto grado (fig. 6), tiene alta sensibilidad en la detección de lesiones ganglionares y extraganglionares como las hepáticas, esplénicas, gástricas y óseas, que no son detectadas por los métodos de estadificación convencionales. Permite además obtener información sobre la existencia de enfermedad activa postratamiento, diagnóstico precoz de recidiva tumoral y control a largo plazo de masas residuales. La sensibilidad de la PET es mayor que la de la gammagrafía con 67Ga en todos los casos, pero su disponibilidad es menor5. La PET-FDG en la evaluación inicial ha demostrado cambiar el estadio de la enfermedad y el tratamiento en un 10 a 23%8. En la valoración de respuesta al tratamiento, la persistencia de captación de FDG tras uno o varios ciclos de quimioterapia indica mal pronóstico, siendo además un factor predictivo de recidiva tumoral. Una PET-FDG negativa después de una quimioterapia completa no excluye la presencia de enfermedad microscópica residual.
Los neuroblastomas son tumores metabólicamente activos9 y son capaces de concentrar de forma ávida la FDG previamente a la quimioterapia o radioterapia, la captación postratamiento suele ser menor. La imagen con MIBG se ha considerado superior a la PET-FDG en delimitar la enfermedad residual, una ventaja del PET es la adquisición de imágenes a los 60min de la administración de la FDG mientras que con la MIBG se deben esperar entre 24 y 48h, pero presenta la desventaja de no poder determinar infiltración en médula ósea debido a su alta captación fisiológica. La utilidad principal de la PET-FDG es la evaluación de neuroblastomas conocidos o sospechados que no son capaces de verse en la imagen con MIBG.
En los sarcomas de partes blandas, la PET permite la diferenciación entre los tumores de bajo y alto grado histológico, así como la detección de metástasis y recurrencia tumoral. Como en otros tumores es capaz de diferenciar persistencia de tumor viable de los cambios (fibrosis, necrosis) posterapéuticos.
Con respecto a los tumores cerebrales se acepta que con la PET-FDG existe un hipermetabolismo en los tumores de alto grado (fig. 7) y un hipometabolismo en tumores de bajo grado o tejido necrótico y se considera método de elección en la diferenciación de tumor viable de los cambios postratamiento. Los tumores con mayor captación de FDG tienen peor pronóstico y mayor grado de malignidad histológica. El desarrollo de hipermetabolismo en un tumor de bajo grado sugiere transformación celular y mal pronóstico.
El uso combinado de PET-FDG y RM en la planificación de la biopsia cerebral estereotáxica ha demostrado que mejora la sensibilidad diagnóstica en lesiones infiltrativas mal definidas y reduce el tamaño de la muestra en áreas funcionales de alto riesgo8.