Los procedimientos de medicina nuclear presentan unas características que los hacen óptimos para los pacientes pediátricos: aportan información morfofuncional, baja dosis de radiación, facilidad de realización, no invasivos y baja o nula incidencia de efectos adversos. Deben realizarse por personal experimentado y es fundamental conseguir la colaboración tanto del niño, si procede, como de los padres o acompañantes, proporcionando previamente la información necesaria acerca de la exploración que hay que realizar.
En general, son pruebas que no necesitan preparación del paciente, excepto ayunas en exploraciones del aparato digestivo y buen estado de hidratación en estudios renales. La técnica de administración del radiotrazador suele ser por vía intravenosa (i.v.), las venas de elección son la antecubital y las del dorso de las manos, en algunas ocasiones se debe recurrir a la administración epicraneal (lactantes y prematuros), o a la yugular en estudios cardíacos de primer paso.
La dosimetría es fundamental en los pacientes pediátricos y se debe conseguir el mejor estudio con la menor dosis de radiación posible, el Paediatric Task Group de la Sociedad Europea de Medicina Nuclear editó unas directrices1 para el cálculo de dosis en niños, obtenida de la corrección de las dosis de adultos, en función del peso y la superficie corporal.
La mayoría de los estudios requiere inmovilización del paciente, pero con un ambiente adecuado, la presencia de algún acompañante del niño durante la exploración y distintos métodos de fijación en forma de almohadas, tiras adhesivas, sacos de vacío o de arena, suele ser suficiente para obtener un estudio adecuado. Únicamente en casos excepcionales, en estudios de larga duración o por las características del paciente, es preciso utilizar un procedimiento de sedación farmacológica. El hidrato de cloral en forma de supositorios o solución es el que se emplea habitualmente a una dosis de 20–30mg/kg para lactantes y 50–70mg/kg en niños2.
En las últimas décadas se ha producido un incremento de las exploraciones de medicina nuclear en pediatría, las más frecuentes corresponden a nefrourología (alrededor del 50%) y estudios óseos (20%).
Puntos clave
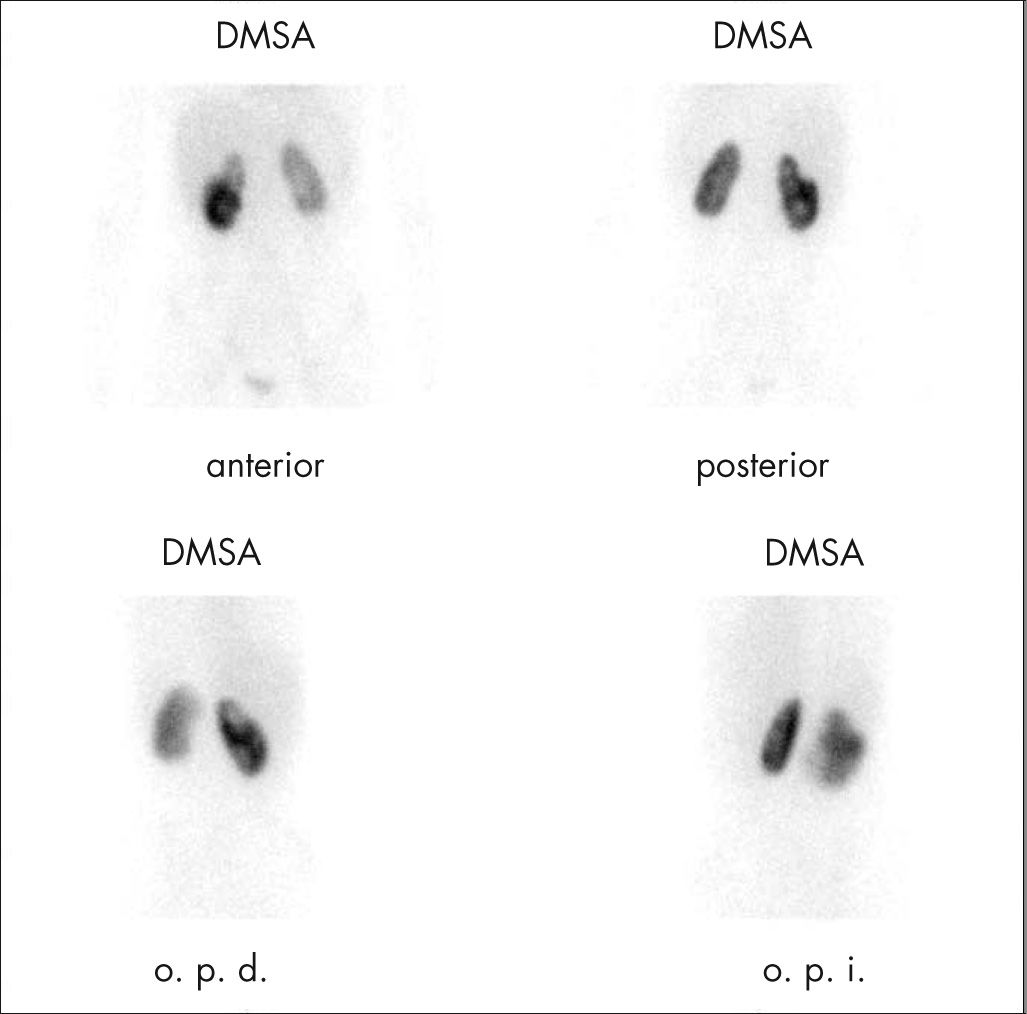
El radiotrazador de elección para el estudio cortical renal es el DMSA (ácido dimercaptosuccínico) marcado con 99mTc. Es captado por las células del túbulo contorneado proximal, directamente desde los vasos peritubulares, y permanece localizado en la corteza del riñón. Su baja extracción urinaria le confiere las características más apropiadas para valorar la morfología renal.
Procedimiento. No requiere preparación, excepto un nivel adecuado de hidratación. El DMSA se administra por vía i.v. (dosis de 0,04-0,05mCi/kg) y hay que esperar de 2 a 3h para la adquisición de las imágenes. Se adquieren proyecciones en posterior y oblicuas posteriores, y sólo en caso de malformaciones (riñón ectópico pélvico o en herradura) es necesario realizar imagen en proyección anterior.
En la interpretación de las imágenes se valora la localización, la forma, el tamaño y la distribución cortical del trazador. Permite el cálculo de la función renal diferencial seleccionando áreas de interés sobre cada riñón y áreas de fondo extrarrenales. En un estudio normal los riñones presentan una captación simétrica y homogénea en la corteza, con una captación menor en la zona central por la médula y sistema colector. El polo superior del riñón izquierdo puede aparecer aplanado por la impresión esplénica3. La función renal diferencial es del 50 ± 5% para cada riñón.
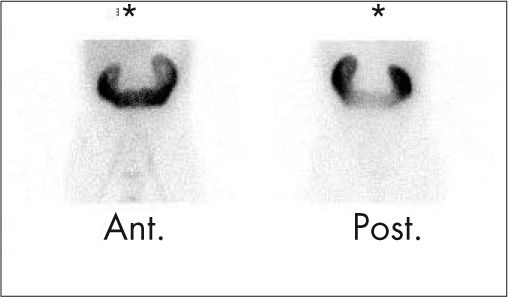
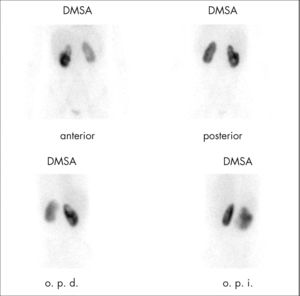
En la actualidad, las principales indicaciones de la gammagrafía renal son la pielonefritis aguda, la valoración de secuelas pospielonefritis y la nefropatía por reflujo. Otras posibles indicaciones son las malformaciones congénitas (ectopias, riñón en herradura [fig. 1], riñón multiquístico, malformaciones numéricas, etc.), lesiones ocupantes de espacio, nefropatías intersticiales y enfermedad vasculorrenal unilateral, por la valoración funcional que aporta la gammagrafía.
- –
Pielonefritis aguda (PNA): la gammagrafía mostrará una o varias áreas hipofijantes, de intensidad de captación variable, sin pérdida de volumen y con el contorno intacto (fig. 2). Aunque el diagnóstico de PNA se basa en la clínica y en la confirmación de urocultivos positivos, hasta en un 10% de niños con sospecha clínica de infección del tracto urinario superior, los cultivos de orina son negativos o equívocos. Aproximadamente el 65% de los casos con diagnóstico de PNA presenta anomalías en la gammagrafía renal y el riesgo de desarrollar cicatrices renales, para un riñón con alteración en la gammagrafía, alcanza el 30%, y es prácticamente inexistente en caso de DMSA normal4. Puede seleccionar a los pacientes que necesitan un tratamiento antibiótico por vía i.v. más largo y un seguimiento posterior para valorar la existencia de cicatrices y el estado de la función renal5,6.
- –
Secuelas pospielonefritis: las cicatrices renales se asocian con pérdida de volumen y aparición de defectos en cuña que rectifican la silueta renal. Para considerar que un defecto apreciado en la fase aguda de la pielonefritis es una cicatriz, debe permanecer sin cambios más de 6–12 meses tras la infección3,4.
- –
Nefropatía por reflujo: se aprecia un riñón de menor tamaño con una afectación difusa del parénquima y una disminución de su función relativa.
La gammagrafía renal con DMSA es más sensible que la ecografía, la urografía i.v. y el Doppler en la detección, tanto de las lesiones agudas como de las secuelas de la PNA. Debido a que los defectos no son específicos se debe asociar a la ecografía para descartar otras lesiones como abscesos, hidronefrosis, quistes o duplicidad renal que puedan producir los defectos apreciados.
CistogammagrafíaDel 30 al 50% de niños con infección del tracto urinario presenta reflujo vesicoureteral (RVU), cuando hay esta sospecha la técnica de elección inicial es la uretrocistografía miccional seriada (CUMS), que aporta información anatómica de la vejiga, valvas uretrales, uréteres y sistema pielocalicial, pero la CUMS no valora reflujos intermitentes y produce una dosis de radiación elevada.
La cistogammagrafía directa consiste en la introducción por vía vesical, tras sondaje, de un radiotrazador, habitualmente DTPA marcado con 99mTc, y adquisición de un estudio dinámico, en proyección posterior, en las fases de llenado, máxima repleción y vaciado de la vejiga. Es más sensible que la CUMS porque permite valorar las fases de llenado y vaciado y produce baja dosis de radiación.
La cistogammagrafía indirecta se obtiene a partir de un estudio de la función renal (renograma con MAG-3 99mTc por vía i.v.) y, cuando se alcanza el llenado vesical fisiológico se adquieren imágenes de la fase de vaciado. La ventaja sobre la directa es no requerir sondaje y valorar la función renal, pero presenta las desventajas de menor sensibilidad al no valorar la fase de llenado vesical, mayor dosimetría y no poder realizarse en niños pequeños por la necesidad de colaboración del paciente.
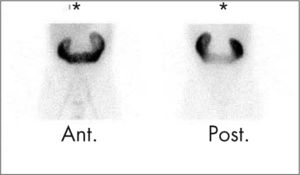
En la cistogammagrafía directa cualquier aparición de actividad en el tracto urinario se considera compatible con la existencia de RVU3 (fig. 3). Se clasifica en 3 grados:
- –
Grado I (leve): se visualiza sólo el uréter.
- –
Grado II (moderado): se visualizan uréter y pelvis renal leve o moderadamente dilatada. Equivale a los grados II y III de la CUMS.
- –
Grado III (severo): importante dilatación de uréter y pelvis renal. Grados IV y V de la CUMS.
Dada su elevada sensibilidad y baja dosis de radiación3,4 es la técnica de elección para el control de un RVU ya diagnosticado, durante el tratamiento conservador o después de tratamiento quirúrgico, en el cribado de RVU familiar y en estudios seriados del RVU causado por disfunción vesical (vejiga neurógena).
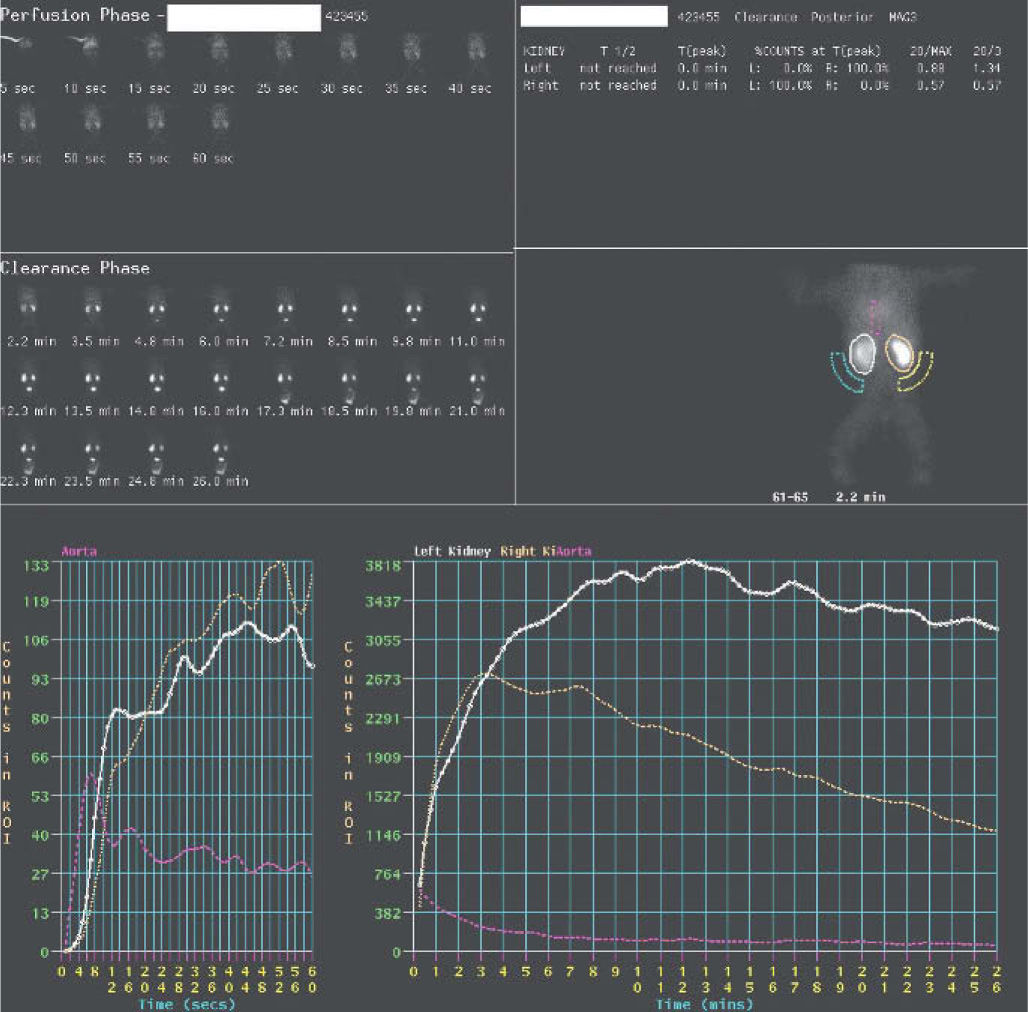
Renograma isotópicoEl MAG-3 marcado con 99mTc es el radiotrazador más empleado para los estudios de función renal, tiene una elevada fracción de extracción, experimenta filtración glomerular y excreción por secreción en los túbulos proximales. Su utilización permite el registro de una secuencia de imágenes que registran la llegada, captación y eliminación del radiotrazador, lo que permite obtener información de la morfología renal, de su perfusión, de la función renal relativa y de la excreción renal.
Preparación del paciente. Sólo precisa un adecuado estado de hidratación y evitar la realización de exámenes radiológicos con contraste en los días previos, ya que éstos pueden alterar la función renal. Es importante el vaciado previo de la vejiga (micción previa).
La adquisición del renograma se realiza con el paciente en decúbito supino y con el detector de la cámara en la zona lumbar, se inmoviliza al niño y el radiotrazador se administra en forma de embolada a dosis de 50μCi/kg y una dosis de diurético (furosemida 1mg/kg). Se adquieren una serie de imágenes secuenciales desde la inyección con una duración de 30min. En ocasiones es necesario obtener posteriormente una imagen posmicción.
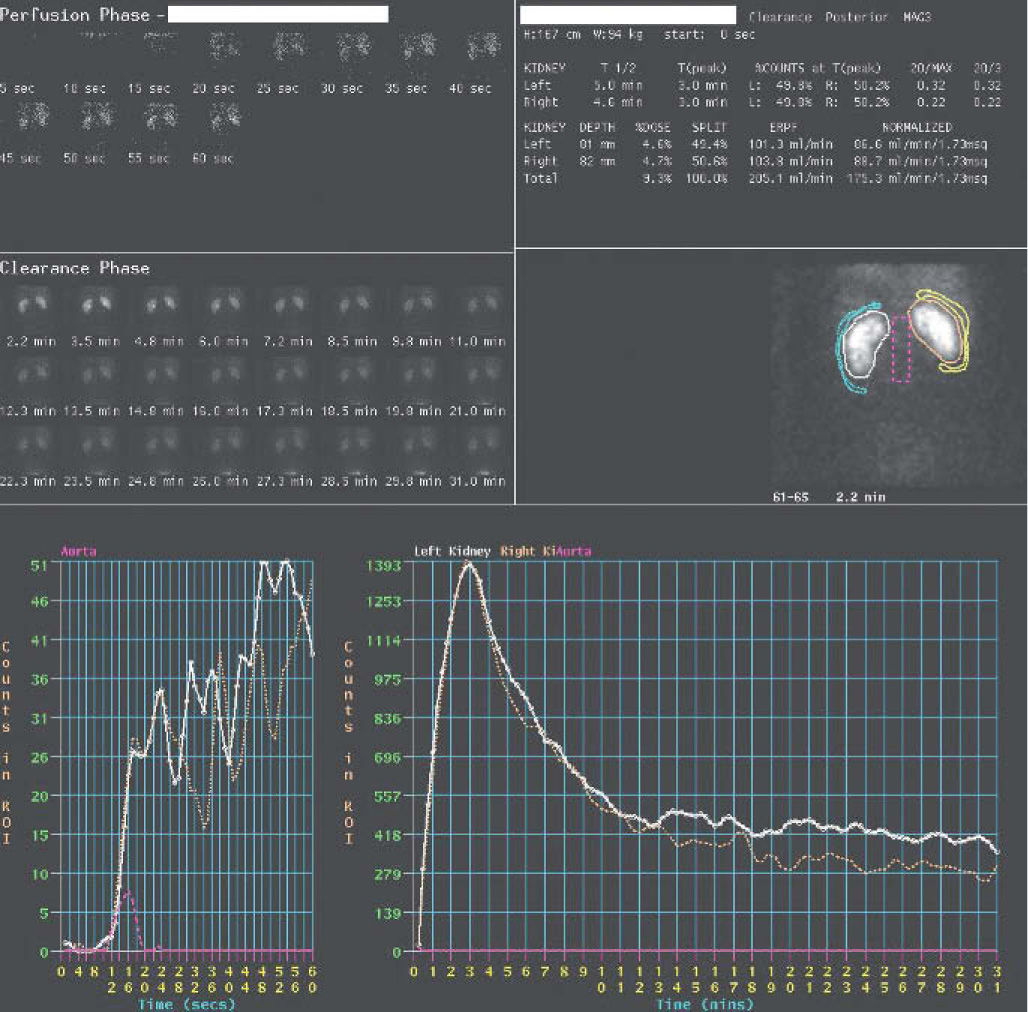
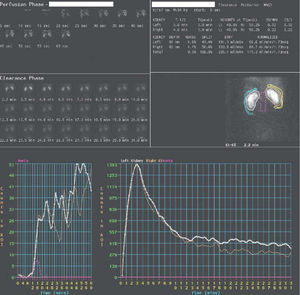
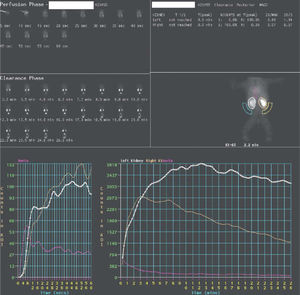
Para la interpretación de los resultados se valoran tanto las imágenes secuenciales como la curva (fig. 4), obtenida sobre áreas de interés en ambos riñones y áreas de fondo, llamada curva renográfica. Se independizan 3 fases: fase vascular, que representa la perfusión sanguínea renal; fase parenquimatosa, que representa la captación y tránsito intrarrenal del trazador hasta la pelvis, y fase excretora, que se corresponde con la eliminación. En el análisis cuantitativo de las curvas renográficas se obtienen la función renal diferencial, el tiempo máximo de llenado y el tiempo medio de eliminación (T1/2).
En un sistema obstruido se observa una anulación o disminución severa de la eliminación, en cambio, en un sistema con dilatación sin obstrucción (fig. 5) aparece un fenómeno de retención de actividad por efecto reservorio, y si se aumenta el flujo de orina, por medio del diurético, se consigue un aumento de la presión y eliminación posterior del radiotrazador.
Indicaciones del renograma isotópico. La indicación fundamental del renograma diurético isotópico es la identificación de los pacientes con sospecha de uropatía obstructiva y riesgo de deterioro de la función renal, tanto en su diagnóstico como en el seguimiento y planificación del tratamiento.
La estenosis de la unión ureteropélvica ocurre en el 13% de los niños con diagnóstico antenatal de dilatación de la pelvis renal7. El diagnóstico por ecografía depende de la demostración de una pelvis renal dilatada (moderada de 10–15mm o severa > 15mm), en ausencia de dilatación del uréter o vejiga. La ecografía posnatal, entre los 4 y 30 días de vida, define el grado de hidronefrosis y excluye la dilatación de uréteres y la existencia de RVU, diagnosticando la probable presencia de estenosis de la unión ureteropélvica. La realización del renograma con MAG-3 99mTc debe realizarse al mes de vida, ya que en neonatos la función renal aún es inmadura, y está indicada en caso de hidronefrosis significativa para valorar el nivel de función renal y el drenaje. En el seguimiento el control renográfico se realizará en función de los resultados ecográficos, cuando se detecta un aumento en los diámetros de la pelvis renal y como control poscirugía si ésta ha sido necesaria.
Otras indicaciones del renograma isotópico- –
Hipertensión vasculorrenal (HTVR): que en la edad pediátrica tiene una incidencia de entre el 1,5 y el 2,5%. Es la causa más frecuente de hipertensión arterial curable, por lo que su diagnóstico precoz es fundamental. En la actualidad el procedimiento de cribado de la HTVR es el renograma tras inhibidor de la enzima de conversión de la angiotensina (IECA) (captopril). Para su realización es preciso suspender previamente el tratamiento con IECA, diuréticos, inhibidores de los receptores de la angiotensina II y antagonistas del calcio. El día de la exploración, con el niño en ayunas, se administra por vía oral captopril a dosis de 1mg/kg 1h antes del estudio, controlando la presión arterial. Posteriormente se realiza el renograma de forma similar al descrito previamente. Si se obtiene un estudio patológico hay que realizar un renograma basal, sin IECA, en día diferente, para realizar un estudio comparativo.
Si el renograma post-IECA es normal, la probabilidad de HTVR es menor al 10%. Si no hay modificación, la probabilidad de HTVR es intermedia, pero si hay una diferencia significativa entre el basal y el post-IECA hay una alta probabilidad (> 90%) de HTVR.
- –
Trasplante renal: el renograma permite valorar tanto la patología parenquimatosa del injerto como las complicaciones posquirúrgicas vasculares o urológicas. Es un método no invasivo, más precoz que las alteraciones bioquímicas y con posibilidad de repetir las exploraciones a lo largo del tiempo.
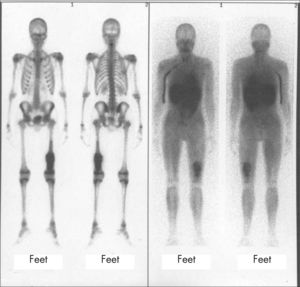
La gammagrafía ósea (GO)8 es una imagen funcional del flujo sanguíneo óseo y de su actividad metabólica. Esta capacidad de detectar los cambios funcionales, que preceden a los cambios estructurales, es lo que hace a esta técnica ser más precoz y sensible que la radiología, pero también es la causa de su relativa inespecificidad.
Se utilizan complejos de fosfato marcados con 99mTc por vía i.v. y, en general, se adquieren imágenes precoces (vascular y pool sanguíneo) en la mayoría de las exploraciones en pediatría. Las imágenes tardías se realizan a las 2–3h postinyección, deben abarcar el cuerpo entero9, sea en forma de rastreo o imágenes estáticas, ya que, en niños, síntomas focales pueden corresponder a patología sistémica o poliostótica. Otros trazadores utilizados para el estudio de la patología ósea son el 67Ga (galio) y leucocitos autólogos marcados, para el estudio de la infección, coloides 99mTc para valorar sistema reticuloendotelial y trazadores de viabilidad tumoral como el 201Tl (talio) o MIBI 99mTc y, en la actualidad, la tomografía con emisión de positrones (PET) para los tumores malignos óseos.
Las indicaciones fundamentales de la gammagrafía ósea en pediatría son: patología inflamatoria e infecciosa; traumatismos; necrosis avasculares; tumores benignos o malignos y displasias10.
Osteomielitis y artritis inflamatoriaEn las osteomielitis (OM) de lactantes y niños, la precocidad del diagnóstico y la instauración del tratamiento son muy importantes para la evolución y el pronóstico de la enfermedad. La GO es positiva a las pocas horas del inicio de los síntomas clínicos, mientras que la radiología puede persistir sin cambios de 10 a 20 días.
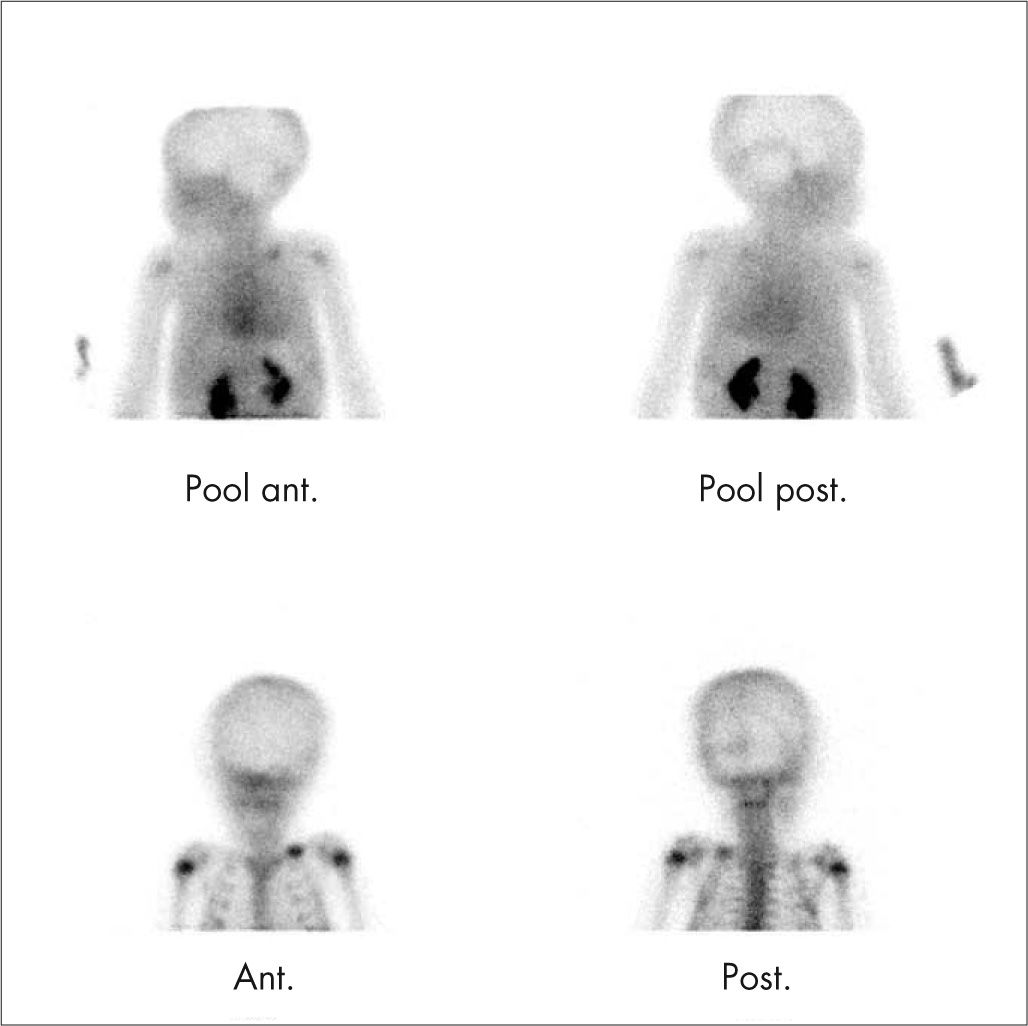
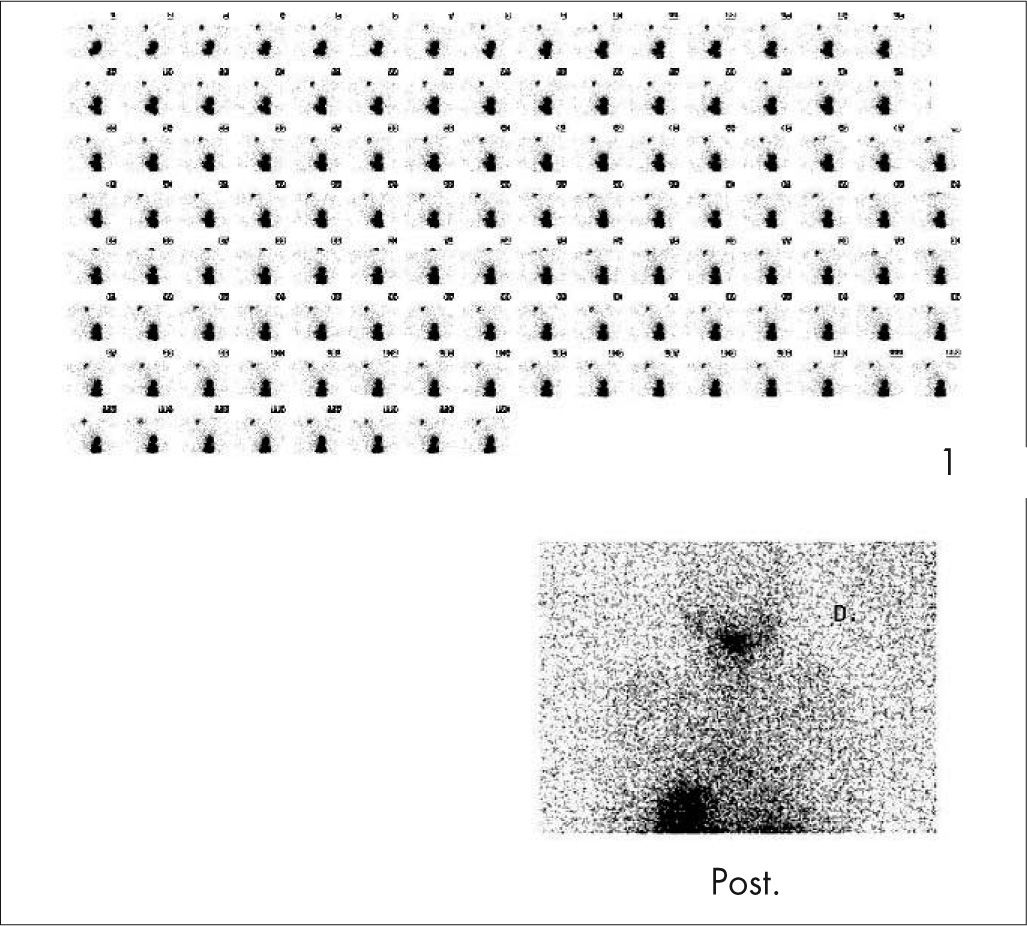
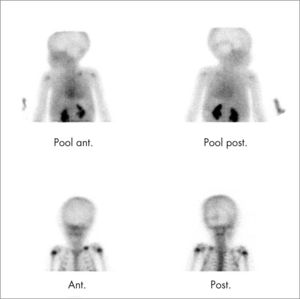
Ante una sospecha de proceso infeccioso se debe adquirir el estudio en 3 fases y obtener el estudio del cuerpo entero para descartar la presencia de OM multifocal. Se valoran como estudio positivo aumento del depósito del trazador, tanto en la fase precoz como tardía, con captación focal en el hueso (fig. 6). En el neonato las primeras fases de la OM cursan con aumento de la presión tisular, compresión vascular y vascularización disminuida, por lo que es más frecuente encontrar áreas hipocaptantes.
La GO puede diferenciar la OM de una celulitis sin afectación ósea. En la OM crónica la GO puede persistir alterada sin significado patológico durante períodos prolongados. En estos casos el seguimiento debe hacerse combinando la GO con 67Ga o leucocitos marcados.
En las artritis la GO detecta los cambios fisiológicos que aparecen en la sinovial inflamada, con captación periarticular en la fase precoz y aumento difuso en la tardía, mientras que en la sinovitis transitoria sin afectación ósea sólo aparecerá aumento de captación en la fase inicial.
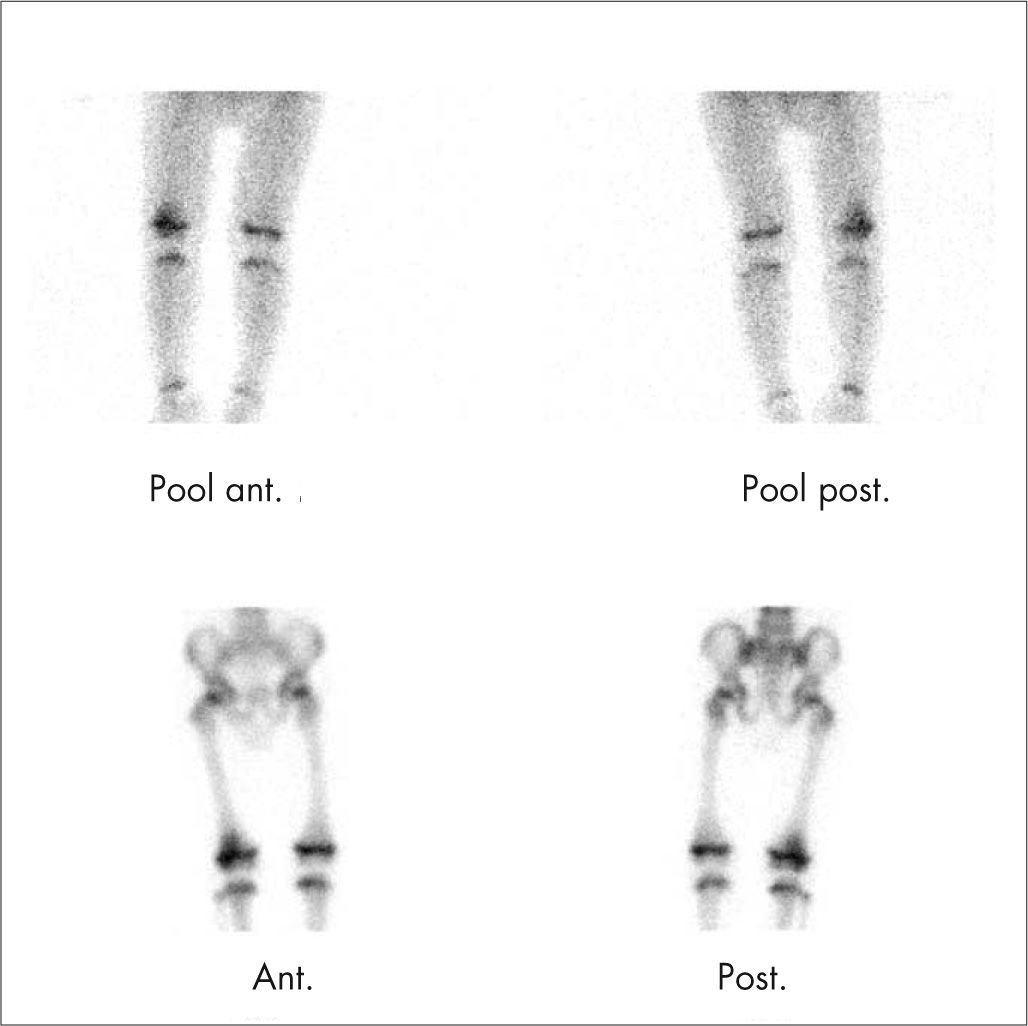
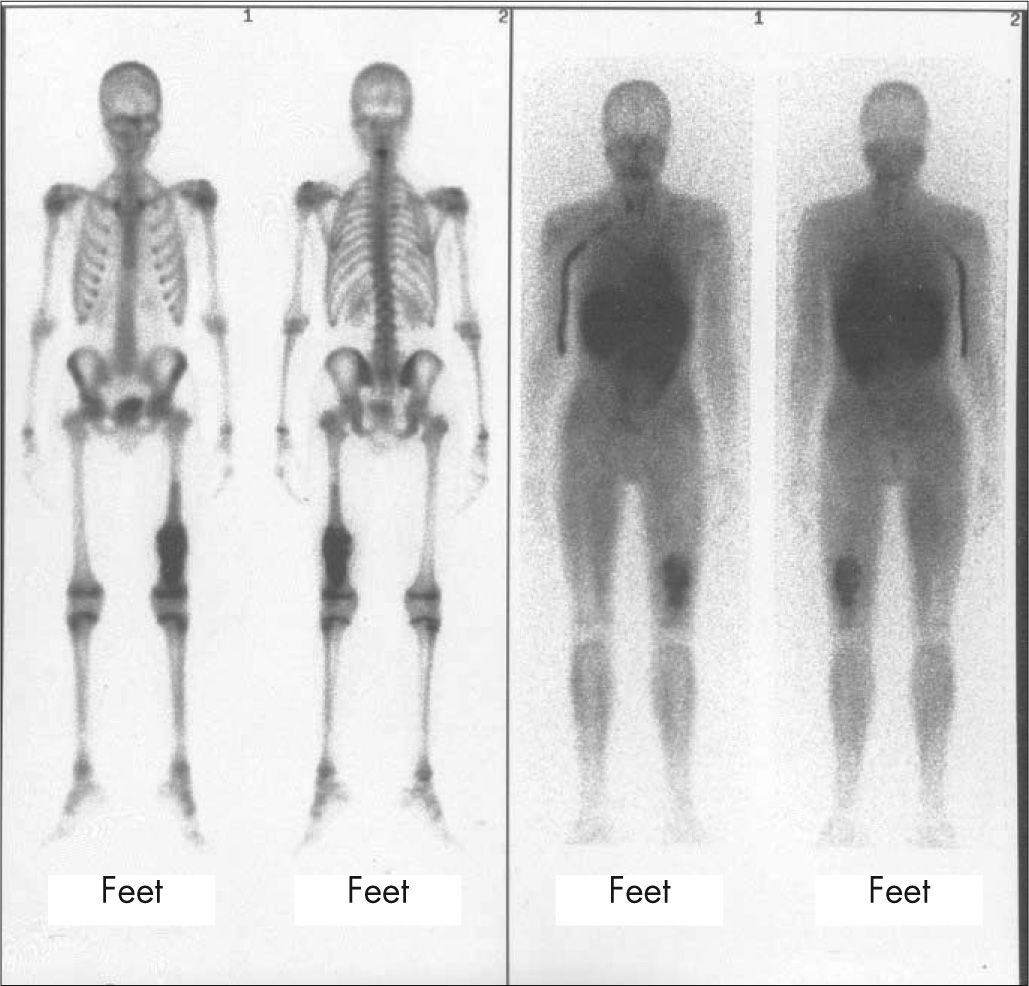
TraumatismosLas imágenes de fracturas óseas en niños mayores son similares al adulto y la mayoría se diagnostican con radiología, pero si ésta es negativa se debe realizar una GO. En niños menores, hasta 2–3 años, son frecuentes las fracturas en tallo verde que muestran en la GO una hipercaptación intensa pandiafisaria. En la edad pediátrica se producen epifisiólisis, fractura con desplazamiento de la fisis o cartílago de crecimiento, que puede diagnosticarse con la GO como zona hipocaptante en una metáfisis de hueso largo.
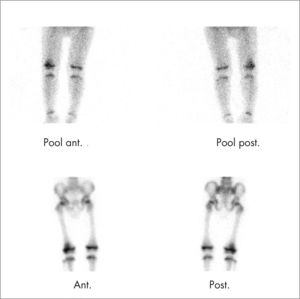
La GO es más sensible en la detección de fracturas ocultas (fig. 7) por su localización difícil de valorar con radiología, o en la sospecha de niños maltratados, con la ventaja en éstos de realizar un estudio de cuerpo entero, con mucha menor dosimetría que los estudios radiológicos.
El origen traumático es la causa más frecuente de dolor de espalda en niños, las lesiones de estrés son frecuentes en pacientes jóvenes que realizan actividad física. Otras causas de dolor de espalda son8 la espondilólisis-listesis, hernia de disco, enfermedad de Scheuerman, infección y tumor primario. La GO es útil en el diagnóstico diferencial. El hallazgo radiológico de espondilólisis no siempre justifica la presencia de dolor, pero si en un estudio tomográfico (SPET) se aprecia un aumento focal de hipercaptación en la pars interarticularis sí se confirma que la causa del dolor sea la espondilólisis.
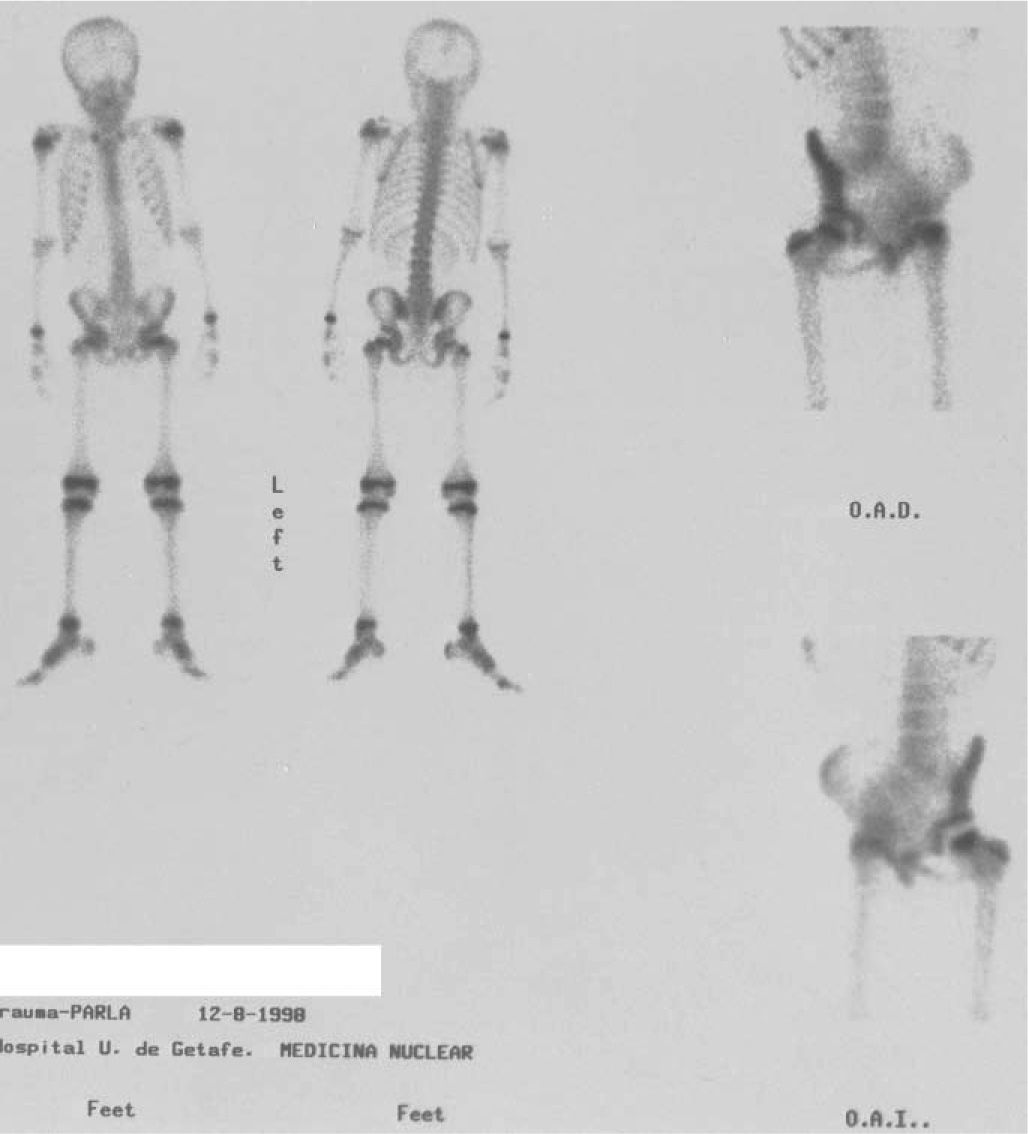
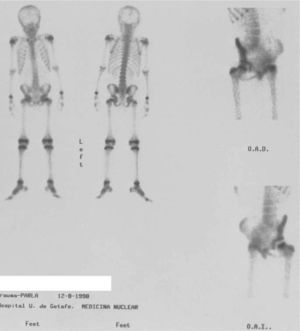
Necrosis avascularesEnfermedad de Legg-Calvé-Perthes (EP) es una necrosis aséptica total o parcial de la cabeza femoral, seguida por una fractura subcondral, revascularización y reparación de la lesión10. La mayoría de los casos se produce entre los 3 y 9 años de edad. Los hallazgos gammagráficos preceden a los cambios radiológicos en 4–6 semanas. La resonancia magnética (RM) produce imágenes más precoces que la radiología. La sensibilidad de la GO en la EP es del 98%, la especificidad del 97%, el valor predictivo positivo del 96% y el valor predictivo negativo del 98,5%. Con la combinación de la RM y la GO se alcanza una sensibilidad del 100%8.
El patrón gammagráfico típico de la EP en la fase inicial es la ausencia de captación en la cabeza femoral (fig. 8), si se realiza en fase de revascularización, en los controles sucesivos se observa un aumento de captación en la fase precoz, y un área hipocaptante con un halo de hipercaptación y un aumento de la captación en el cuello femoral y la metáfisis. Si en la GO persiste la zona hipoactiva cuando ya hay alteraciones radiológicas, la GO está indicando un retraso en el proceso de revascularización.
La RM valora mejor que la GO la extensión real de la necrosis y aporta información anatómica de la presencia de revascularización. Las desventajas de la RM son la baja disponibilidad, el alto coste y la necesidad de sedación en algunos casos, por lo que su uso está indicado en algunos pacientes donde la extensión de la fractura subcondral sea más de la mitad de la cabeza femoral.
Osgood-Schlatter: corresponde a la necrosis avascular de la tuberosidad anterior de la tibia. Es más frecuente en adolescentes que practican actividad física intensa. En la GO se aprecia en los estadios iniciales disminución de la vascularización y de la actividad osteoblástica y, con posterioridad, aumento de captación en la fase de reparación.
Tumores óseos primariosSe ha valorado la utilidad de la GO para diferenciar lesiones benignas de malignas. Una lesión que no tiene repercusión gammagráfica en la GO es improbable que sea maligna; al contrario, una lesión con aumento de captación en la fase precoz y tardía es más sugestiva de lesión maligna. En la práctica puede haber superposición en la apariencia gammagráfica entre lesiones benignas y malignas.
Los tumores óseos benignos que presentan una GO sin alteraciones son el fibroma no osificante, el defecto fibroso cortical, el condroma y el quiste óseo no complicado. En tumores poliostóticos, como la encondromatosis múltiple o la displasia fibrosa, la GO ayuda a valorar la extensión. El osteoma osteoide se aprecia en la GO, con una sensibilidad cercana al 100%, como una captación aumentada focal. Si está localizado en columna es necesario realizar estudio con SPET para descartar su presencia.
Los tumores óseos malignos primarios más frecuentes en la edad pediátrica son el sarcoma osteogénico y el sarcoma de Ewing. En la GO ambos tumores presentan un aumento de captación intenso (fig. 9), más marcado en el osteosarcoma. La principal utilidad de la GO es detectar metástasis endomedulares a distancia (skip metastases). El 2% de los osteosarcomas presenta metástasis óseas en el momento del diagnóstico, en algunos casos se detectan metástasis pulmonares que pueden captar el difosfonato. El sarcoma de Ewing presenta metástasis óseas en el 12% de los pacientes al diagnóstico. La principal ventaja de la GO es poder realizar un rastreo de cuerpo entero para determinar la afectación poliostótica y la presencia de metástasis. La GO no es útil para valorar la respuesta a la quimioterapia del tumor primario; para este fin se utilizan estudios con tomografía por emisión de positrones/ flúor-desoxi-glucosa, si hay disponibilidad, o trazadores oncotropos como el 201-Tl (talio).
Tumor de Ewing en tercio distal del fémur izquierdo. Imagen de la derecha: rastreo óseo de cuerpo entero con HDP 99mTc; imagen de la izquierda: rastreo de cuerpo entero con 201-Tl (talio). Se aprecia una mayor extensión con el trazador óseo por la reacción osteoblástica que se produce en la periferia del tumor.
En el 40-60% de los neuroblastomas la GO al diagnóstico muestra captación de difosfonatos en el tumor primario. El mecanismo de esta captación tumoral no es bien conocido, se ha atribuido a depósitos microscópicos de calcio intratumoral.
Al igual que en adultos, la GO es útil para detectar afectación ósea metastásica en fases precoces, aunque la distribución de las metástasis óseas no es la misma que en adultos. En los niños las zonas submetafisarias son las que reciben irrigación ósea más distal y, por lo tanto, la localización preferente de las lesiones metastásicas.
Displasia óseaLa GO evalúa la extensión de la displasia fibrosa. Puede encontrar lesiones únicas o múltiples. La afectación suele ser multifocal, en diáfisis de huesos largos y, en ocasiones, afectar predominantemente a una extremidad.
MEDICINA NUCLEAR GASTROINTESTINAL PEDIÁTRICAReflujo gastroesofágicoMuchos tests se han desarrollado para detectar reflujo gastroesofágico (RGE), como el esofagograma con bario, la endoscopia con biopsia, la manometría esofágica, la perfusión ácida y el test de RGE. El más sensible y específico es el test de RGE de Tuttle (pH-metría), el resto es relativamente insensible.
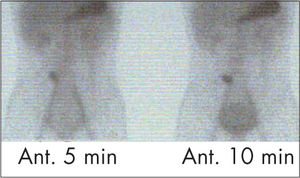
La gammagrafía gastroesofágica es el examen más sensible para el cribado de RGE, porque permite cuantificar el reflujo, puede valorar en imágenes tardías la aparición de captación pulmonar, confirmando aspiración, y puede usarse para el seguimiento de pacientes con tratamientos médicos o quirúrgicos, tiene la limitación de aportar poco detalle anatómico.
La técnica consiste en administrar, por vía oral, sulfuro coloidal marcado con 99mTc en dosis de 200μCi a 1mCi, disuelto en zumo de frutas, leche o agua con azúcar. Presenta las ventajas de ser fácil de realizar, no invasivo, no requiere sedación del paciente, es fisiológico, proporciona tiempos de observación prolongados (60 a 120min), lo que incrementa su sensibilidad, y puede detectar y cuantificar el RGE. Además, proporciona baja dosis de radiación comparado con otros estudios como la serie gastroduodenal. Para valorar la presencia de aspiración pulmonar se adquiere una imagen tardía en proyección posterior abarcando campos pulmonares (fig. 10).
Este test no se debe usar indiscriminadamente en niños que vomitan o tosen sin sintomatología específica, ya que podría tratarse de un caso de RGE fisiológico, que es un problema autolimitado que no requiere tests diagnósticos, debe reservarse para niños con síntomas crónicos que requieran tratamiento en los cuales se convierte en enfermedad por RGE.
El esofagograma con bario es esencial para evaluar las anomalías anatómicas que pueden simular la enfermedad de RGE, por lo que no se deben omitir en el proceso de evaluación. El test del reflujo ácido es altamente sensible, pero requiere la colocación de una sonda que mida el pH en el esófago, con lo cual es invasiva, no fisiológica y puede no detectar aspiración. La esofagocospia con biopsia puede detectar esofagitis u otras lesiones que pueden o no ser atribuibles al reflujo. La manometría esofágica permite determinar disminución de presiones que favorezcan el reflujo, siendo nada específica y poco sensible. El test de perfusión ácida de Berstein tiene resultados variables, por lo que debe reservarse en los casos en los que se quiere conocer la sensibilidad de la mucosa esofágica al ácido.
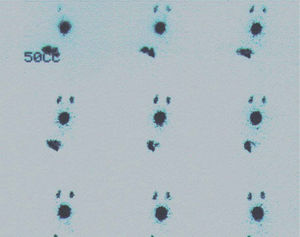
Vaciamiento gástricoEl estudio radioisotópico12 para valorar el vaciamiento y la motilidad gástricos es un estudio fisiológico, no invasivo, que aporta información cuantitativa y que se puede utilizar como método para valorar la efectividad de un tratamiento, es una prueba que se ha adaptado y aplicado en niños de todas las edades. Se realiza añadiendo a la toma del niño sulfuro coloidal marcado con 99mTc en dosis de 1mCi y se calcula el tiempo medio de vaciamiento y el porcentaje de actividad residual respecto a la inicial en diferentes tiempos (60 y 120min).
Los factores de posible error son en pacientes que se alimentan con sonda, sonda movilizada del estómago, marcado inadecuado de la fórmula, haber comido antes del estudio, vómitos abundantes, superposición de un asa intestinal al área del estómago y tiempo prolongado de la ingesta de alimentos.
Divertículo de MeckelEl divertículo de Meckel es la causa principal de hemorragia digestiva aguda en la edad pediátrica. La causa del sangrado es la ulceración de la mucosa del divertículo o de la mucosa ileal adyacente, por la presencia de mucosa gástrica ectópica en el divertículo (el 98% de los divertículos de Meckel sangrantes presentan mucosa gástrica ectópica).
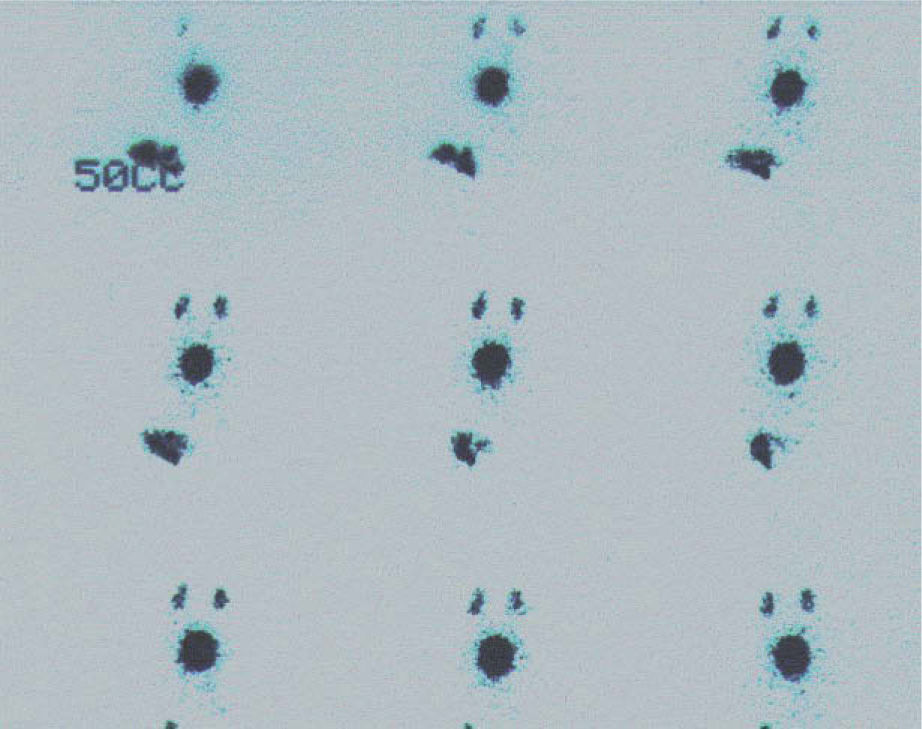
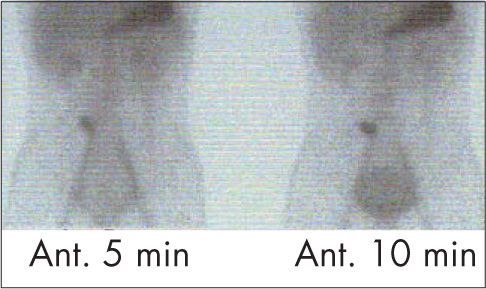
El 99mTc-pertecnetato se acumula en las células mucosas del epitelio gástrico y es activamente secretado. Tras su administración por vía i.v., se localiza en las paredes del estómago y en la posible mucosa gástrica ectópica. El estudio positivo13 mostrará un depósito focal, normalmente en cuadrante ínferoanterior derecho del abdomen, de aparición simultánea al estómago, en los primeros 30min de la exploración (fig. 11). La sensibilidad de la prueba es del 85% con una especificidad del 95%. Es la técnica de elección ante un sangrado rectal en la edad infantil con sospecha de divertículo de Meckel.
Para mejorar la captación del 99mTc-pertecnetato se utilizan estímulos farmacológicos, como la cimetidina a dosis de 20mg/kg/día por vía oral desde 48h antes de la prueba, o pentagastrina, 6μg/kg, por vía subcutánea media hora antes.
Aunque en la edad pediátrica su uso no es habitual, la detección de hemorragia gastrointestinal inferior, de cualquier etiología, se estudia en medicina nuclear con hematíes autólogos marcados con 99mTc. La ventaja de esta técnica es que detecta niveles de sangrado menores que la arteriografía, y puede valorar sangrados intermitentes, ya que la exploración puede prolongarse hasta 24h tras la administración de los hematíes marcados.
Estudios hepatobiliares en pediatríaLos métodos de medicina nuclear se basan esencialmente en el diagnóstico diferencial de la atresia biliar congénita (ABC) y la hepatitis neonatal (HN), dilatación quística de las vías biliares (quiste del colédoco, enfermedad de Caroli) y evaluación del trasplante hepático14.
Atresia biliar congénita/hepatitis neonatalAnte una hiperbilirrubinemia neonatal que se presenta de forma persistente antes de las 2 semanas de vida o que aparece a las 3 semanas después del nacimiento, hay que hacer el diagnóstico diferencial entre ABC y HN. La gammagrafía hepatobiliar con derivados del ácido iminodiacético (IDA) es una prueba sencilla de realizar, no invasiva, con una sensibilidad elevada (97%) y una especificidad del 82% en el diagnóstico diferencial
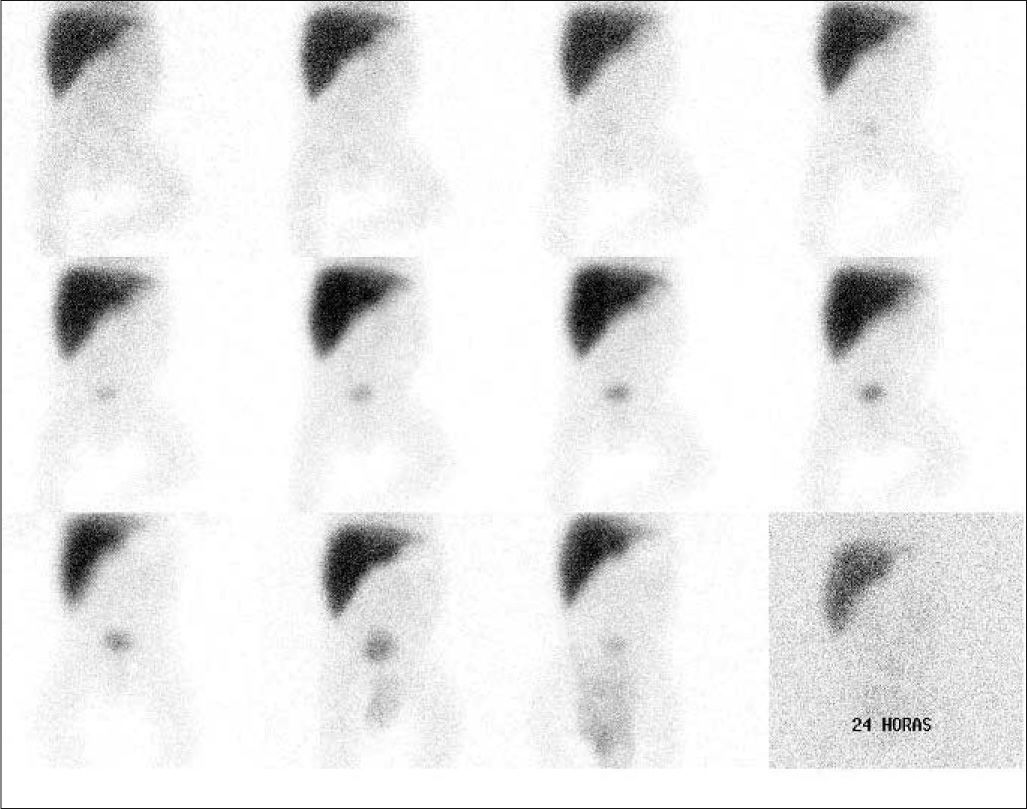
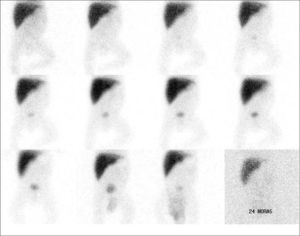
El radiotrazador de elección es el 99mTc-mebrofenin, que compite con la bilirrubina en la captación por el hepatocito más que otros derivados del IDA y, por lo tanto, puede usarse con valores elevados de bilirrubina sérica. El pretratamiento con fenobarbital (5mg/kg/día) durante 3 a 5 días antes de la gammagrafía mejora la sensibilidad de la prueba. El trazador se administra por vía i.v. y se adquieren imágenes secuenciales del abdomen, prolongando el estudio hasta la visualización de actividad intestinal o hasta 24h postadministración. La ausencia de visualización intestinal con una buena extracción hepática del radiotrazador es compatible con ABC (fig. 12).
Estudio en lactante con sospecha de atresia congénita de vía biliar. En las imágenes secuenciales, hasta 24h postinyección, se aprecia una captación adecuada por los hepatocitos, ausencia de visualización de vías biliares y de actividad intestinal, compatible con el diagnóstico de atresia.
En el quiste del colédoco el diagnóstico se realiza por ecografía y tomografía computarizada. La gammagrafía hepatobiliar con IDA confirma el diagnóstico al mostrar acúmulo del trazador en la cavidad quística. En la enfermedad de Caroli la ecografía objetiva los quistes intrahepáticos y la gammagrafía con IDA demuestra la dilatación quística de las vías intrahepáticas, con un tiempo de tránsito hepatobiliar normal, aunque puede aparecer retrasada la eliminación al intestino.
Valoración del trasplante hepáticoLa gammagrafía hepatobiliar puede detectar complicaciones biliares como fugas biliares (biliomas o fístulas) y estenosis de los conductos. En las complicaciones vasculares puede ayudar a identificar de forma precoz el infarto segmentario o la obstrucción total o parcial de la arteria hepática o la vena porta. En el rechazo las manifestaciones gammagráficas no son específicas pero es útil como técnica de seguimiento para evaluar un fallo hepático súbito o para evaluar la respuesta al tratamiento.
Enfermedad inflamatoria intestinalEl diagnóstico tanto de la enfermedad de Crohn como de la colitis ulcerosa se basa en la endoscopia con toma de biopsias, pero es difícil valorar con la endoscopia la extensión total de la enfermedad, sobre todo en fases agudas.
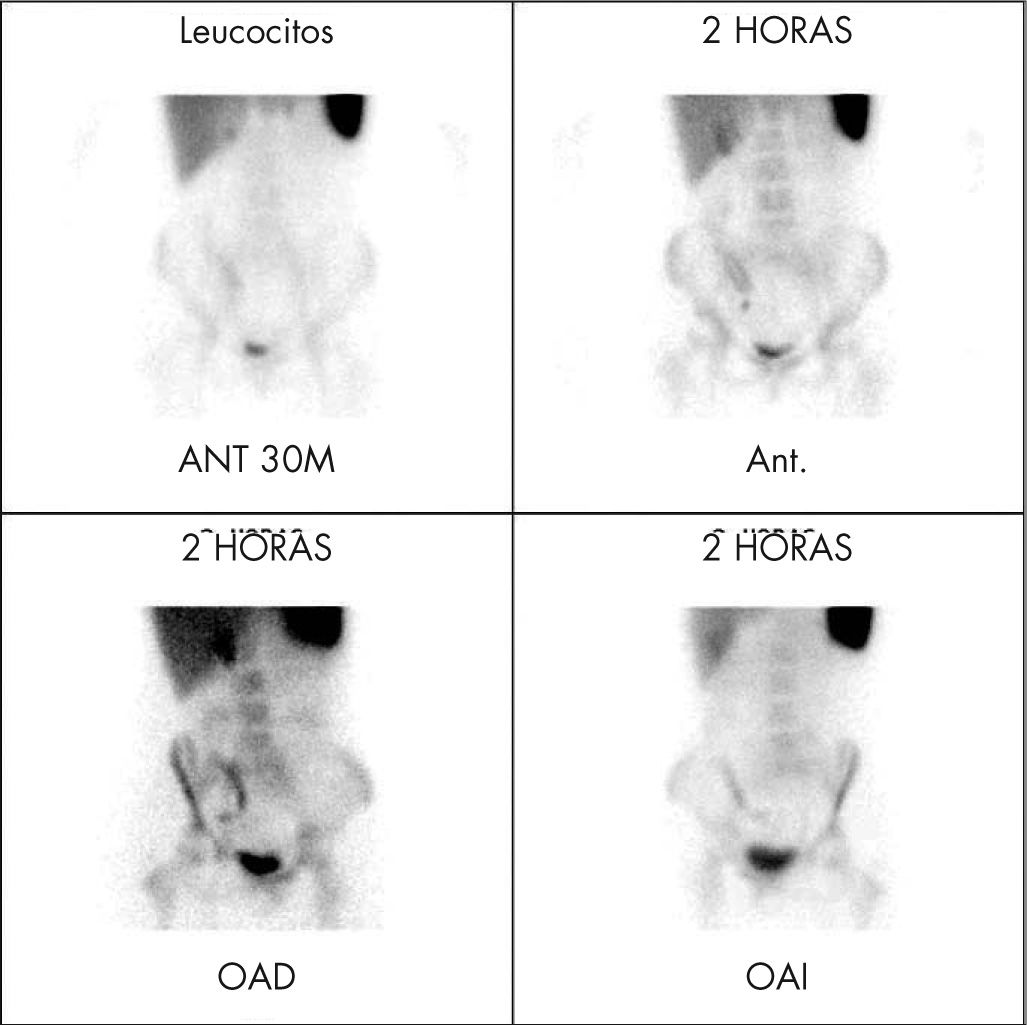
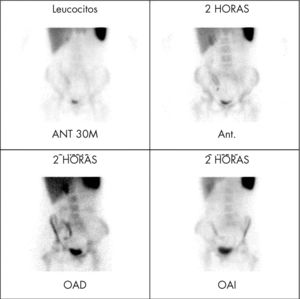
La exploración con leucocitos15 marcados con 99mTc- HMPAO, permite el estudio de todo el intestino, sin preparación previa del paciente, y se puede realizar en la fase aguda de la enfermedad. Tras la administración de los leucocitos marcados se adquieren imágenes, en proyección anterior y craneocaudal a los 30min y a las 2h (fig. 13). La sensibilidad supera el 90% y la especificidad es cercana al 100%, una gammagrafía normal descarta la existencia de enfermedad inflamatoria intestinal con alto grado de seguridad.
Estudio con leucocitos marcados en paciente con enfermedad de Crohn con sospecha clínica de reactivación de su enfermedad. Se aprecia depósito patológico de los leucocitos en el cuadrante inferior derecho del abdomen, lo que confirma una actividad inflamatoria activa en la región ileocecal.
Es útil realizarla en el seguimiento de la enfermedad para evaluar la eficacia del tratamiento y para diagnosticar posibles complicaciones.
Gammagrafía esplénicaCon el desarrollo de las técnicas de imagen, los estudios del bazo en medicina nuclear se limitan a situaciones donde es fundamental la información funcional. El estudio se realiza con hematíes autólogos marcados con 99mTc y desnaturalizados con calor para favorecer su atrapamiento por el tejido esplénico funcionante.
Las principales indicaciones son las esplenosis, los implantes esplénicos postesplenectomía y la presencia de bazos accesorios.