Puntos clave
- •
La encefalopatía hipóxico-isquémica (EHI), moderada o grave, afecta aproximadamente a cerca de 1‰ recién nacidos a término o casi término.
- •
La EHI constituye una causa importante de mortalidad y de discapacidad neurológica permanente, expresada por la presencia aislada o combinada de retraso del desarrollo, parálisis cerebral, trastorno neurosensorial, déficit cognitivo, trastorno conductual o epilepsia.
- •
La hipotermia moderada sostenida (terapéutica), cuando es iniciada en las primeras 6h de vida, reduce la prevalencia de muerte-discapacidad asociada a la EHI moderada-grave y aumenta el número de niños que sobreviven con función neurológica normal. El número de pacientes con EHI que precisan ser tratados para prevenir un caso de muerte o discapacidad está en un rango de 6 a 9 pacientes.
- •
La hipotermia terapéutica es una intervención segura cuando se aplica en unidades de nivel iii y siguiendo protocolos estrictos de enfriamiento y recalentamiento.
- •
Existen diversos equipos servocontrolados que permiten realizar esta terapia de forma eficiente y segura.
- •
Ofrecer esta intervención terapéutica requiere de un importante esfuerzo de coordinación entre todos los implicados en la atención de estos recién nacidos.
La agresión asfíctica alrededor del nacimiento y su correlato clínico, la encefalopatía hipóxico-isquémica (EHI), moderada o grave, afectan aproximadamente a cerca de 1 de cada 1.000 recién nacidos a término o casi término1. Ello traduce que aproximadamente cada año 500 recién nacidos en nuestro país presentarán, inmediatamente tras el nacimiento, un estado caracterizado por dificultad para iniciar o mantener la respiración, alteración para despertar y mantener la vigilia, alteración de la actividad motora, el tono muscular y los reflejos, y, con frecuencia, convulsiones. De este total, en la era prehipotermia cerca de 175 fallecían y al menos otros 130 presentaban ulteriormente discapacidad permanente: retraso del desarrollo, parálisis cerebral, trastorno neurosensorial, déficit cognitivo, trastorno conductual o epilepsia. Estas consecuencias hacen que la EHI constituya un problema sociosanitario relevante2.
Durante todo el siglo xx la EHI ha estado huérfana de intervenciones terapéuticas específicas, pero la demostración de que la hipotermia terapéutica es una terapia eficaz y segura ha conducido a que sea en el presente la terapia estándar para esta entidad patológica3. Esta anotación comenta esta novedosa intervención neuroprotectora, que constituye la más relevante incorporación al arsenal terapéutico pediátrico del último lustro y abre el camino a la terapia neuroprotectora específica para el daño hipóxico-isquémico.
Etapas fisiopatológicas de la lesión cerebral hipóxico-isquémicaLa lesión cerebral hipóxico-isquémica es un proceso complejo que comienza con la agresión y que continúa durante el período de recuperación. Este proceso consta de varias fases. De forma inmediata tras la agresión, tiene lugar un deterioro del metabolismo oxidativo (fase primaria de la lesión), pero tras la reperfusión se produce una recuperación parcial del mismo. Este período, denominado fase latente, corresponde al período de «ventana terapéutica»; un intervalo temporal que precede a la fase de daño secundario o demorado, durante la cual tienen lugar una serie de reacciones bioquímicas, celulares y moleculares en cascada que extienden y agravan el daño durante las horas siguientes y que conducen a la lesión cerebral4,5. Durante la fase latente, el inicio de una intervención terapéutica puede prevenir o aminorar la lesión cerebral. No se conoce la duración de la ventana terapéutica, pero estudios en humanos con espectroscopia de resonancia magnética indican que su duración no es mayor de 6–8h4.
Un punto crucial es la dependencia de la temperatura de los procesos destructivos. Mientras que la hipertermia incrementa el deterioro neurológico temprano, la mortalidad y la morbilidad neurológica5,6, una reducción de la temperatura cerebral de 3–4°C iniciada durante la fase de reperfusión o la fase latente previene o aminora la lesión cerebral7,8.
Mecanismo de acción de la hipotermiaAunque no se conocen completamente los mecanismos por los cuales la hipotermia moderada protege o reduce la lesión cerebral hipóxico-isquémica, el principal mecanismo parece ser la reducción del metabolismo cerebral (reducción de un 5% por cada grado centígrado de descenso). Además, la hipotermia parece actuar en otros procesos bioquímicos, celulares y moleculares que, durante la fase de fracaso energético secundario, conducen al daño tisular (tabla 1).
Mecanismos implicados en el efecto neuroprotector de la hipotermia.
| Reducción del metabolismo cerebral |
| Disminución de la excitabilidad neuronal |
| Reducción de la síntesis y liberación de radicales libres y óxido nítrico |
| Disminución de la peroxidación lipídica |
| Disminución de la liberación de aminoácidos excitotóxicos (glutamato) |
| Disminución de la actividad de la apoptosis |
| Preservación de antioxidantes endógenos |
La hipotermia terapéutica, reducción intencional de la temperatura cerebral de 3–4°C, constituye una intervención eficaz y segura para reducir la mortalidad y la discapacidad mayor asociadas a la EHI9–16. Este enfriamiento moderado es iniciado antes de las 6h de vida y, una vez alcanzada la temperatura diana (temperatura central de 33–34°C), esta es mantenida durante 72h, tras lo cual se realiza un recalentamiento lento (≤ 0,5°C por hora). Seis ensayos clínicos son especialmente importantes en el análisis de la hipotermia terapéutica10,11,13–16. Todos analizan como desenlace principal el resultado compuesto de: muerte y/o discapacidad mayor a una edad ≥18 meses. De estos ensayos clínicos, 2 utilizan hipotermia cerebral selectiva10,16 y los otros 4, hipotermia corporal total11–15. La eficacia y la seguridad observadas en los ensayos clínicos han sido ratificadas en 6 metanálisis, concluyéndose que la hipotermia terapéutica mejora la supervivencia y el neurodesarrollo de los recién nacidos con EHI moderada o grave (tabla 2)17–22 y que tanto la hipotermia cerebral selectiva como la corporal total son efectivas. Además, esta intervención es eficaz tanto en la EHI moderada como en la grave, si bien el efecto a los 18 meses es más importante en el subgrupo de EHI moderada (riesgo relativo [RR]: 0,67; intervalo de confianza [IC] del 95%, 0,56 a 0,81; número necesario a tratar [NNT]: 6) que en el de EHI grave (RR: 0,83; IC del 95%, 0,74 a 0,92; NNT: 7)22.
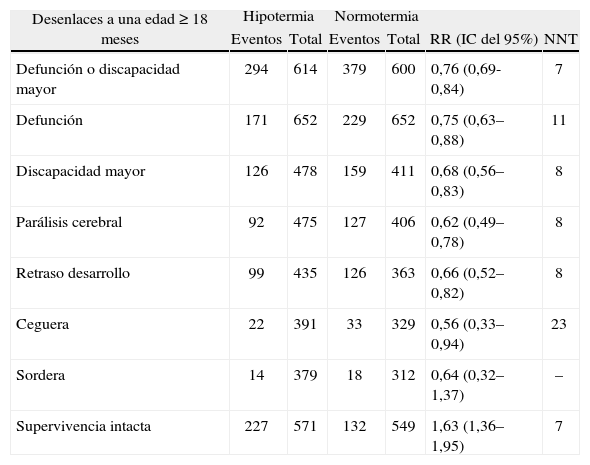
Eficacia de la hipotermia terapéutica. Resultado del Metanálisis de Tagin et al15. Este metanálisis incluye a 1.214 recién nacidos y 7 estudios.
| Desenlaces a una edad ≥ 18 meses | Hipotermia | Normotermia | RR (IC del 95%) | NNT | ||
| Eventos | Total | Eventos | Total | |||
| Defunción o discapacidad mayor | 294 | 614 | 379 | 600 | 0,76 (0,69-0,84) | 7 |
| Defunción | 171 | 652 | 229 | 652 | 0,75 (0,63–0,88) | 11 |
| Discapacidad mayor | 126 | 478 | 159 | 411 | 0,68 (0,56–0,83) | 8 |
| Parálisis cerebral | 92 | 475 | 127 | 406 | 0,62 (0,49–0,78) | 8 |
| Retraso desarrollo | 99 | 435 | 126 | 363 | 0,66 (0,52–0,82) | 8 |
| Ceguera | 22 | 391 | 33 | 329 | 0,56 (0,33–0,94) | 23 |
| Sordera | 14 | 379 | 18 | 312 | 0,64 (0,32–1,37) | – |
| Supervivencia intacta | 227 | 571 | 132 | 549 | 1,63 (1,36–1,95) | 7 |
NNT: número necesario a tratar; RR: riesgo relativo.
Incluye los estudios correspondientes a las citas 9–11 y 13–16.
Estas demostraciones han conducido a que esta intervención terapéutica sea considerada actualmente la práctica estándar terapéutica para la EHI moderada o grave3.
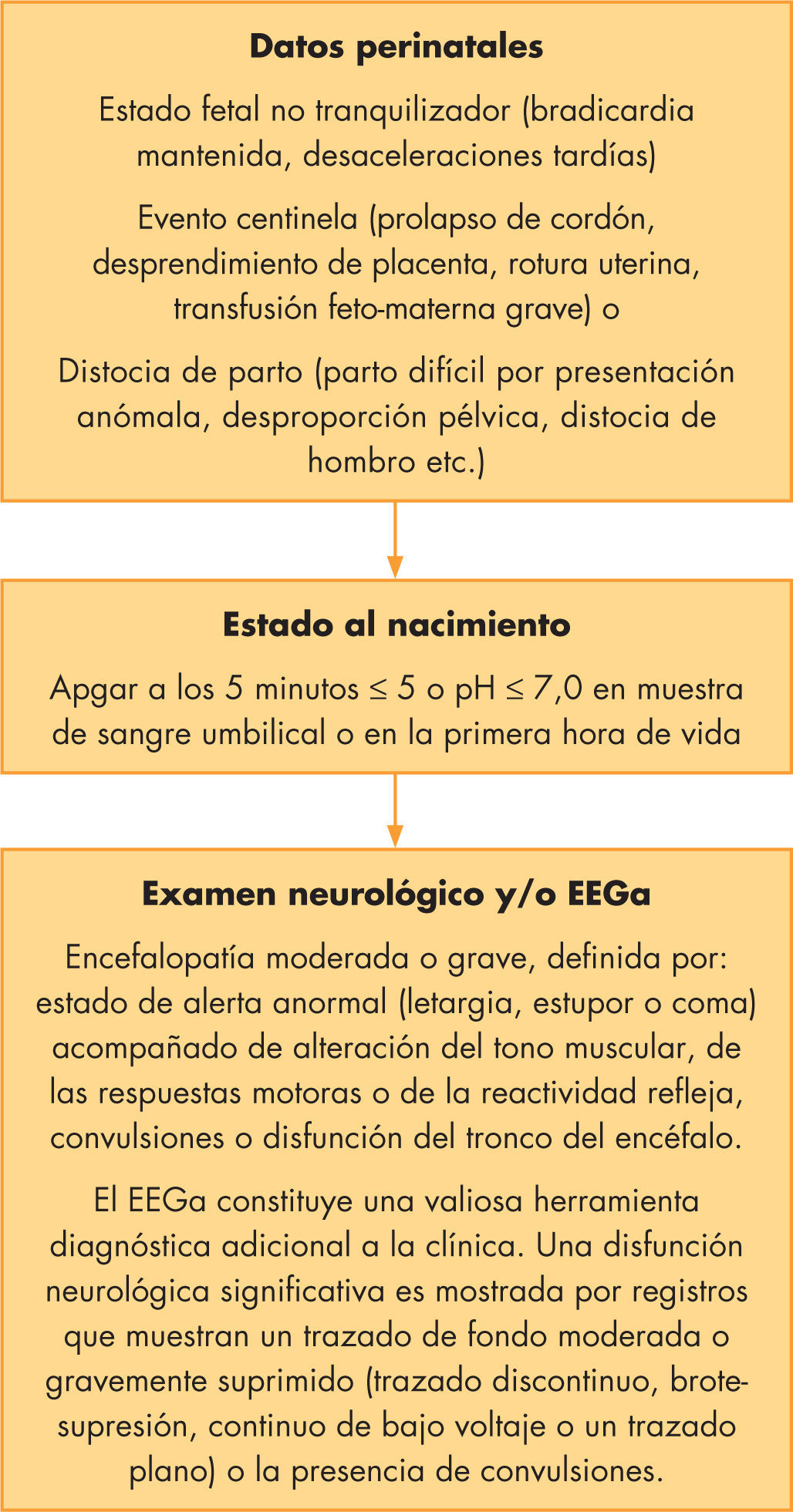
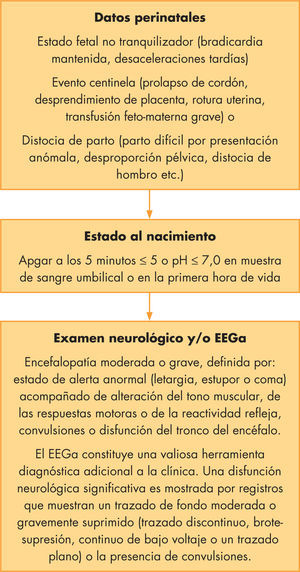
La hipotermia terapéutica en la práctica clínica: criterios de inclusión, exclusión y salidaLos criterios de inclusión utilizados en los ensayos clínicos han sido homogéneos y estrictos, y requerían la presencia de todas las siguientes condiciones (fig. 1):
- —
Edad gestacional a término o casi término (≥ 35 semanas de gestación).
- —
Antecedentes perinatales de potencial agresión hipóxico-isquémica perinatal.
- —
Signos clínicos de encefalopatía moderada o grave.
- —
Edad igual o inferior a 6 h al inicio de la hipotermia terapéutica.
Los criterios de exclusión utilizados fueron los siguientes:
- —
Recién nacidos prematuros con edad gestacional inferior a 35 semanas.
- —
Edad superior a 6h de vida.
- —
Restricción del crecimiento con peso inferior a 1.800g.
- —
Anomalías congénitas mayores.
- —
Paciente moribundo en el que se decide limitación del soporte intensivo.
No obstante, estos estrictos criterios de inclusión y exclusión no pueden trasladarse exactamente a la aplicación de la hipotermia en la práctica clínica23–25. En nuestro centro, actualmente enfriamos a recién nacidos asfícticos de 34 o más semanas de gestación y a neonatos con colapso posnatal y, debido a la ausencia de otras terapéuticas y dada la seguridad de esta intervención, muchos centros (entre ellos el nuestro) prolongan la ventana de inclusión en el programa de hipotermia cerebral para la asfixia perinatal a las primeras 12h de vida. La exclusión sobre la base de la presencia de malformaciones congénitas mayores debe ser reconsiderada, limitándose solo a aquellos pacientes con anomalías del desarrollo cerebral que impacten notable en el neurodesarrollo ulterior23.
Métodos y sistemas de enfriamientoEl objetivo de la hipotermia cerebral moderada es reducir la temperatura cerebral a 33–34°C. Con este fin, se han utilizado 2 métodos: enfriamiento craneal selectivo o hipotermia corporal total. La base del primero es que el cerebro del recién nacido produce el 70% del calor corporal total. El enfriamiento selectivo del cerebro trata de minimizar los posibles efectos adversos derivados del enfriamiento sistémico. No obstante, la única manera de reducir la temperatura en las áreas profundas del cerebro es reducir la temperatura corporal central a 34°C26,27. La hipotermia corporal total moderada consigue un enfriamiento similar de las estructuras cerebrales profundas y no asocia una mayor incidencia de efectos adversos11–15,22.
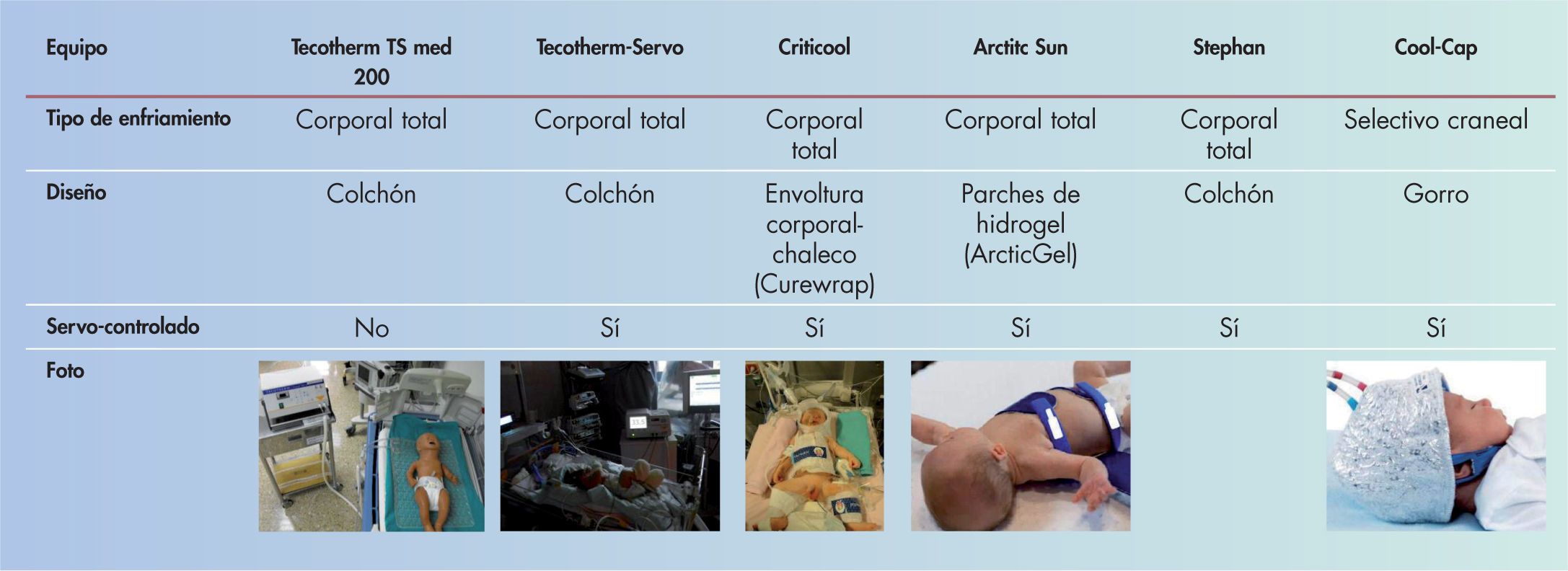
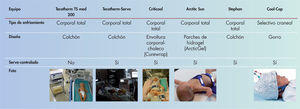
Existen sistemas de hipotermia sencillos, como el enfriamiento natural mediante el apagado del calentador radiante, bolsas de gel o ventiladores. Sin embargo, la mayoría de unidades emplean equipos tecnológicos que pueden ser servocontrolados o con control manual de la temperatura (fig. 2). Los sistemas servocontrolados suponen una menor carga de trabajo de enfermería, ofrecen más seguridad y son más eficaces en mantener de modo estable la temperatura diana durante el enfriamiento28.
Etapas del tratamiento con hipotermiaLas 3 fases de la hipotermia terapéutica son: inducción del enfriamiento, mantenimiento estable del mismo y recalentamiento.
- 1.
Inducción: aunque se desconoce la velocidad de enfriamiento óptima, los estudios experimentales indican que la hipotermia es más beneficiosa cuanto antes se inicie23. En esta fase puede producirse sobreenfriamiento, aunque esto parece evitarse con los modernos aparatos servocontrolados. Con la hipotermia pasiva en sala de partos o el enfriamiento durante el transporte, muchos recién nacidos ingresan ya próximos a la temperatura diana de alrededor de 33,5°C. Entonces se decidirá si continuar o no con el tratamiento en función del examen neurológico y el resultado del electroencefalograma integrado por amplitud (EEGa).
- 2.
Mantenimiento: la temperatura central (rectal o esofágica) diana en esta fase es de 33–34°C en el caso de la hipotermia corporal total y de 34–35°C en el enfriamiento selectivo de la cabeza. Deben evitarse fluctuaciones de la temperatura y vigilarse desplazamientos de las sondas de temperatura.
- 3.
Recalentamiento: debe ser lento, a razón de 0,2–0,5°C a la hora, alcanzándose la normotermia en un plazo mínimo de 6–8h. Un recalentamiento rápido conlleva riesgo de hipotensión y convulsiones3. En esta fase y en las horas siguientes debe evitarse la hipertermia, la cual empeora la cascada neurotóxica y el pronóstico neurológico29,30.
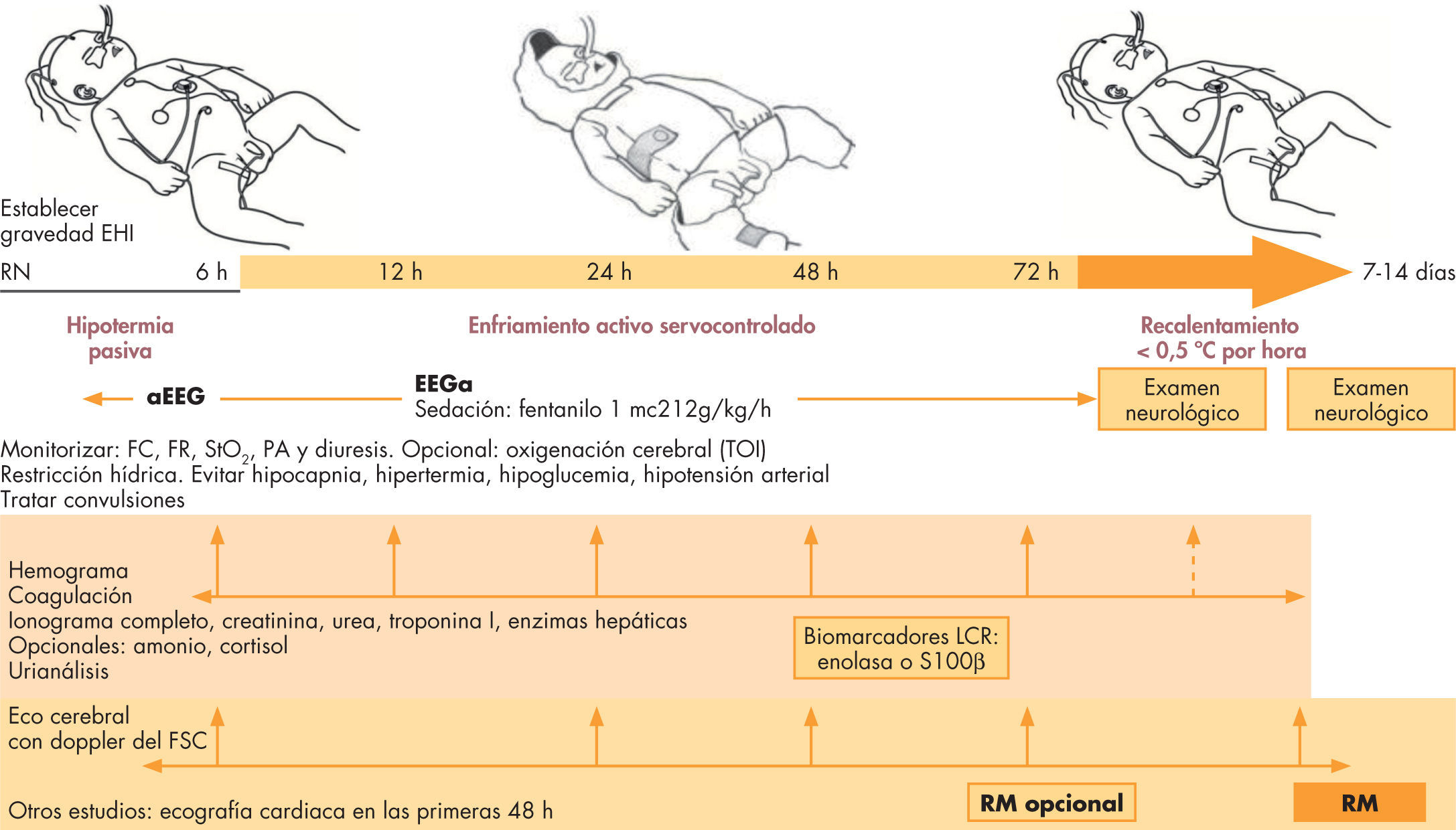
Los únicos efectos sistémicos relacionados con la hipotermia son: trombocitopenia (no asociada a sangrados ni aumento de transfusiones), bradicardia sinusal e hipotensión que condiciona una mayor necesidad de soporte inotrópico. Así, el enfriamiento no se asocia a complicaciones importantes, siempre y cuando se haga dentro de unidades terciarias y siguiendo protocolos estrictos. Con los equipos actuales de enfriamiento controlado, la dificultad en el manejo del recién nacido con EHI no reside en ninguna de las fases de esta terapia24, sino en el manejo integral de: a) los problemas asociados con la disfunción multiorgánica por daño hipóxico-isquémico; b) los factores de comorbilidad, y c) los efectos sistémicos y metabólicos de la hipotermia. Por ello, durante el ingreso, además de un estrecho control neurológico y de la actividad electrocortical, es preciso realizar evaluaciones seriadas con el fin de identificar y tratar todos aquellos factores que impactan nocivamente en la salud del bebé con agresión hipóxico-isquémica (fig. 3).
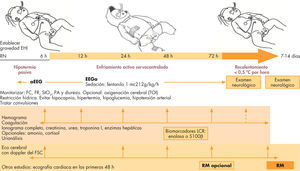
Esquema de manejo y control del recién nacido con encefalopatía hipóxico-isquémica. EEGa: encefalopatía integrada por amplitud; EHI: encefalopatía hipóxico-isquémica; FC: frecuencia cardiaca; FR: frecuencia respiratoria; FSC: flujo sanguíneo cerebral; LCR: líquido cefalorraquídeo; PA: presión arterial; RM: resonancia magnética; RN: recién nacido.
A continuación, se detallan algunos de los principales aspectos del manejo clínico del recién nacido con EHI en tratamiento con hipotermia.
Manejo respiratorio- —
La pCO2 debe tratar de mantenerse entre 40–50mmHg. La hipotermia reduce la producción de CO2. Además, es frecuente la respiración de Kussmaul, con aumento de la exhalación de CO2 para compensar la acidosis metabólica, que conduce a hipocarbia. Para evitar la hipocarbia reduciremos el volumen minuto (evitando la modalidad asistida/controlada) y la frecuencia respiratoria. Pueden emplearse cámaras espaciadoras para incrementar el espacio muerto. No obstante, la hipocapnia a menudo es difícil de controlar en las primeras horas de vida.
- —
Los valores de los gases sanguíneos, especialmente la pCO2, se ven afectados por la hipotermia. La pCO2 desciende aproximadamente un 4% por cada grado centígrado que disminuye la temperatura central. Si realizamos gasometrías sin corregir para la temperatura real se sobreestima la pCO2. Por ello, las gasometrías deben corregirse para la temperatura real y en caso de no hacerlo, es preciso multiplicar el valor de pCO2 por el valor de corrección de 0,83.
- —
Solo un ensayo clínico ha apreciado un mayor riesgo de hipertensión pulmonar en los pacientes en hipotermia12. La hipotermia terapéutica no contraindica la administración de óxido nítrico inhalado.
La hipotermia conlleva una reducción del gasto cardiaco y la frecuencia cardiaca. Esta bradicardia sinusal (descenso de aproximadamente 14 lpm por grado centígrado de disminución de la temperatura) no tiene repercusión clínica y no se ha descrito una mayor frecuencia de otros tipos más graves de arritmia9–16,22. El objetivo es mantener una adecuada presión arterial (40–50mmHg), para lo cual puede ser necesario soporte con fármacos vasoactivos.
CoagulaciónLa asfixia perinatal puede provocar coagulopatía por daño hepático o coagulación intravascular diseminada, las cuales pueden ser potencialmente agravadas por la hipotermia. Además, la hipotermia asocia trombocitopenia, que es moderada (10–39%) y tardía (nadir a las 72–96h).
Efectos inmunológicosLa hipotermia tiene efectos inmunosupresores y antiinflamatorios, pero no se ha observado que la hipotermia moderada asocie un mayor riesgo de infección.
Efectos sobre el metabolismo de fármacosLa indicación de un fármaco no se modifica por la hipotermia, pero esta puede alterar los parámetros farmacocinéticos del mismo, particularmente en aquellos con metabolismo hepático. La hipotermia puede alterar el flujo hepático, el aclaramiento y el volumen de distribución del fármaco, así como la absorción del mismo, lo que puede conducir a toxicidad (con más frecuencia) o por el contrario a fracaso terapéutico. Además, el recalentamiento también puede conllevar cambios farmacocinéticos. Por ello, es preciso la monitorización de niveles farmacológicos y el ajuste de la dosis según los niveles31.
EstrésLa hipotermia puede provocar estrés por frío, que en los neonatos con formas no extremadamente graves de EHI, se manifiesta en forma de hipertonía flexora, temblor y otros signos de hiperexcitabilidad. Asimismo, una frecuencia cardiaca superior a 120 lpm puede indicar estrés en un neonato en hipotermia. El alivio del estrés puede trascender a los aspectos éticos, ya que en modelos animales, el estrés y/o dolor contrarrestan el efecto neuroprotector de la hipotermia. Además, los opioides parecen tener propiedades neuroprotectoras per se, lo que parece ser refrendado en estudios de neonatos asfícticos32 y sugerido en un ensayo clínico sobre hipotermia15.
La evidencia disponible aconseja sedar a todos los neonatos con EHI durante la hipotermia terapéutica. Sin embargo, los cambios farmacocinéticos y/o farmacodinámicos del fentanilo o la morfina condicionan la necesidad de una reducción de la dosis estándar de sedación. Dado que se desconoce qué régimen terapéutico consigue la máxima eficacia terapéutica con el mínimo riesgo de aparición de efectos secundarios, recomendamos un tratamiento dinámico en el que la dosis sea la mitad de la utilizada en condiciones de normotermia y esta se modifique de acuerdo a la presencia de signos de estrés térmico.
Nutrición y fluidosEn los ensayos clínicos publicados, los neonatos se mantuvieron a dieta durante el enfriamiento y la incidencia de enterocolitis (ECN) fue baja, y similar entre pacientes hipotérmicos y normotérmicos9–16. En los protocolos escandinavos, los recién nacidos reciben alimentación trófica con leche materna, y no se ha descrito un mayor riesgo de ECN. No obstante, es recomendable prudencia e individualizar la decisión de acuerdo con la gravedad de la disfunción multiorgánica.
GlucosaEl objetivo es mantener cifras de glucemia de 70–100mg/dl. El neonato con EHI tiene riesgo de hipoglucemia, especialmente en las primeras horas, la cual puede agravar aún más el daño cerebral, y debe tratarse agresivamente. Los pacientes en hipotermia pueden presentar cifras de glucosa más elevadas que aquellos normotérmicos.
ElectrolitosEs importante mantener cifras normales de iones en sangre. En caso de hipocalcemia no es recomendable administrar cargas de calcio, debido a que el aumento de calcio intracelular puede desencadenar diferentes mecanismos de muerte celular de la cascada neurotóxica de la EHI. Debe diagnosticarse y tratarse la hipomagnesemia, dado que su déficit puede favorecer el daño excitotóxico.
Cuidados de la piel y los tejidos blandosEl enfriamiento con mantas, envolturas o parches puede provocar isquemia cutánea y favorecer la aparición de úlceras por presión. Además, el frío puede provocar isquemia o cristalización y ulterior necrosis de la grasa subcutánea.
Implicaciones de que la encefalopatía hipóxico-isquémica haya dejado de ser una entidad huérfana de terapiaDado que la EHI significativa afecta solo al 1‰ de los recién nacidos vivos en nuestro entorno, la mayoría de las unidades neonatales solo asisten un pequeño número de pacientes con EHI nacidos intramuros por año1,2. Por ello, con el fin de ofrecer programas de alta calidad asistencial atendidos por equipos humanos expertos y con los recursos tecnológicos adecuados, es preciso concentrar los recursos y racionalizar el desarrollo de los programas de asistencia integral (con hipotermia) al neonato con EHI, lo que obliga a la centralización de pacientes y programas en los centros terciarios de cada área geográfica33. La implantación de esta terapia en una unidad de neonatología de nivel iii es un proceso que debe ser abordado en etapas2,3,33.
Debido a que la EHI perinatal es una verdadera urgencia neurológica, es preciso establecer una rápida y bien ordenada actuación operativa con una adecuada delineación de las acciones a realizar en cada una de las etapas asistenciales; desde el paritorio al cuidado intensivo y, dentro de este, las acciones durante las fases de enfriamiento, mantenimiento, recalentamiento y, finalmente, durante la convalecencia del paciente antes del alta.
Como la mayoría de los neonatos que desarrollan EHI nacen en hospitales sin programas establecidos de hipotermia, se impone la necesidad de un traslado urgente del paciente con sospecha de EHI a los centros de referencia. El estrecho marco temporal de oportunidad terapéutica obliga a establecer un protocolo de actuación conjunta entre las unidades de neonatología de nivel i- ii y los centros coordinadores de emergencias médicas con las unidades de nivel iii que ofrezcan esta terapia34.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.