- Puntos clave
- •
Se entiende como ginecomastia la proliferación de la glándula mamaria en el varón. Tiene un presentación etaria bimodal, con un predominio en la pubertad (95% de los casos en edad infantil)
- •
La ginecomastia puberal se presenta típicamente iniciada la pubertad (Tanner II–III)
- •
es habitualmente bilateral, acompañada de síntomas leves y generalmente transitorios
- •
Es preciso diferenciarla de la adipomastia, que consiste en el acúmulo de tejido adiposo sin hiperplasia glandular.
- •
Cuando la ginecomastia presenta un comportamiento en tiempo y evolución compatible con la normalidad, no es necesaria la solicitud rutinaria de pruebas complementarias.
- •
La ginecomastia fuera del periodo fisiológico puede reflejar problemas hormonales, enfermedades sistémicas o procesos tumorales. Una exhaustiva historia clínica y exploración física ayudada de un estudio hormonal son necesarias para descartar patología subyacente
- •
En la ginecomastia puberal, el tratamiento médico no ha demostrado a largo plazo una tasa de curación superior a la resolución espontánea
Se define ginecomastia como la proliferación de tejido glandular mamario en el varón, de manera uni o bilateral, y asociado o no a síntomas clínicos, como molestias o tensión local.
La prevalencia de ginecomastia es variable atendiendo a criterios relativos al tamaño glandular (entre 0,5–2cm de diámetro), método de medición o síntomas asociados 1. En la edad puberal, los datos oscilan desde una prevalencia del 69% hasta el 4%, en el más completo estudio de incidencia publicado sobre adolescentes entre 10 y 19 años 2. Es preciso, además, considerar un probable infradiagnóstico asociado a factores psicológicos y al buen pronóstico evolutivo de esta entidad.
La edad de presentación en población infantil se sitúa hasta en un 95% en el periodo puberal y tan sólo en un 5% fuera de esta etapa 1.
A pesar de tratarse de un proceso generalmente autolimitado, la ginecomastia puede reflejar una alteración endocrinológica importante o incluso un proceso tumoral grave. Por otro lado, son frecuentes los sentimientos de vergüenza y baja autoestima en adolescentes que presentan estos cambios físicos. Por todo ello, son necesarios todos los esfuerzos destinados a su evaluación y tratamiento cuando sea preciso.
FisiologíaEmbriológicamente, la glándula mamaria comienza su desarrollo a partir de la sexta semana de gestación. Se compone de 2 tejidos diferenciados: el epitelio glandular ductal y el tejido conectivo periductal. En la pubertad, se produce en la mujer un crecimiento sostenido del tejido glandular y mesenquimal motivado por los valores elevados de estrógenos sanguíneos y facilitado por otras hormonas que ejercen una acción permisiva. En el varón, por contra, tras una proliferación transitoria durante el periodo puberal, acontece una progresiva involución a la atrofia en la edad adulta.
La síntesis hormonal de estrógenos está regulada por el complejo enzimático estrógeno-sintetasa, codificado por el gen CYP19 y localizado en el cromosoma 15q21. Metaboliza de modo irreversible la transformación de testosterona en estradiol y se expresa, en diferentes proporciones, en tejidos como la placenta, el tejido adiposo, el ovario, el hígado, el testículo, el cerebro y en la propia glándula mamaria. En menor cuantía, esta enzima cataboliza el paso de androstendiona de origen suprarrenal a estrona. También interviene la 17βOH-esteroide deshidrogenasa en la conversión reversible de testosterona a androstendiona, y de estradiol a estrona.
Estas hormonas circulan unidas en un elevado porcentaje (95%) a una globulina plasmática, la SHBP (sex hormone binding protein), quedando una fracción libre funcional variable (aproximadamente el 5%). Modificaciones en la concentración de SHBP o interacciones en su unión con las hormonas sexuales, como las motivadas por algunos fármacos, pueden alterar la relación testosterona/estradiol en la sangre.
HistologíaLa histología de la ginecomastia es indistinguible en relación con la causa que lo produce, no así en función del tiempo de evolución del proceso. Se distinguen 2 fases en el desarrollo evolutivo tisular:
- 1.
Fase proliferativa. Existe un crecimiento glandular por hiperplasia del tejido epitelial ductal y conectivo. Presenta, además, edema del estroma periductal con aumento de la vascularización. Se desarrolla fundamentalmente durante los 2 primeros años y es susceptible de regresión si desaparece la causa que la origina.
- 2.
Fase fibrótica. Se caracteriza por una invasión colágena del tejido intersticial con fenómenos de hialinización y fibrosis, así como dilatación ductal. La desaparición de la causa, por lo general, no suele revertir el fenómeno.
Lectura rápida
La ginecomastia en la edad infantil es un proceso muy frecuente que, por lo general, responde a cambios hormonales fisiológicos y transitorios. No obstante, en los adolescentes son habituales los sentimientos de vergüenza o baja autoestima que acompañan a esta entidad, justo en el momento en el que perciben la imagen propia como más importante.
La glándula mamaria comienza su desarrollo en la sexta semana y la histología es idéntica en ambos sexos en el momento del nacimiento. Posteriormente, los cambios hormonales propician, tras un leve crecimiento puberal, la atrofia glandular en el varón.
En diversos estudios ha quedado patente la acción inhibitoria de los andrógenos en la proliferación ductal mamaria frente a otras moléculas que la estimulan, fundamentalmente los estrógenos. En la actualidad, se asume que la ginecomastia se ocasiona por un disbalance en la relación estrógenos/andrógenos, con un predominio de los primeros3–5. No obstante, se considera que existen otros factores locales y endocrinológicos implicados. Se han identificado en la mama, receptores de progestágenos, prolactina, insulina y leptina, cuya acción se cree que permite y modula la actividad glandular 1,6.
Se ha observado asociación familiar en al menos un 50% de los casos7. Sin embargo, no se han podido objetivar valores sanguíneos más elevados de estrógenos en niños con ginecomastia frente aquellos sin ella, por lo que se intuye que existen diferencias interindividuales en la sensibilidad tisular al estímulo estrogénico.
Aunque se carece de datos referidos a edad pediátrica, los estudios en población general recogen las siguientes etiologías más frecuentes 1,3,5:
- —
25% idiopática.
- —
25% persistencia puberal.
- —
10–20% fármacos.
- —
8% cirrosis/malnutrición.
- —
8% hipogonadismo primario.
- —
3% tumores.
- —
2% hipogonadismo hipofisiario.
- —
1,5% hipertiroidismo.
- —
1% enfermedad renal.
En edad pediátrica, diferenciamos la ginecomastia en función del momento y la instauración, ya que éste se asocia con frecuencia a su significación clínica y etiología.
Ginecomastia neonatalPresente en cierto grado hasta en un 50–70% de los recién nacidos. Refleja una condición fisiológica generada a partir de la síntesis en la unión fetoplacentaria de elevadas cantidades de estrona/estradiol a partir de dehidroepiandrostendiona (DHEA).
Se observa siempre antes de las 3 semanas de vida, en muchos casos ya en el momento del parto. La resolución es espontánea, coincidente con el descenso en los valores de estrógenos y gonadotrofinas. Un curso clínico compatible con la normalidad y una resolución completa < 2 años de vida no hacen necesarios la solicitud de pruebas complementarias ni adoptar terapias específicas.
En las formas de inicio tardío o si la afectación es unilateral, sobre todo ante sangrado por pezón o afectación cutánea local, se recomienda descartar pubertad precoz evolutiva o el desarrollo de neoplasias.
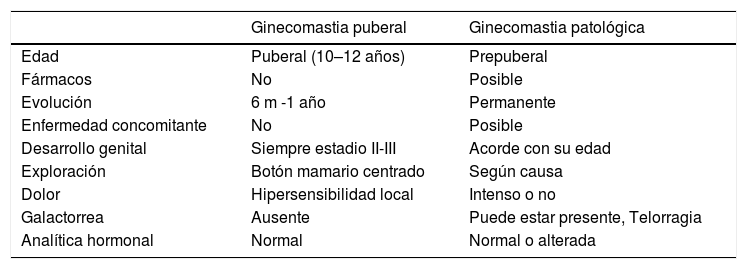
Ginecomastia puberalSe manifiesta en forma de una masa firme concéntrica, de consistencia gomosa, bajo el pezón mamario. De predominio bilateral (75%), habitualmente es < 4cm de diámetro. Puede ser asintomática o provocar molestias leves con la presión o el roce. La ginecomastia puberal no suele manifestarse como primer signo de una pubertad normal, sino que habitualmente se inicia en un estadio de Tanner II–III, con tamaño testicular de 8–10ml y en edades comprendidas entre los 10 y los 13 años 2. Signos físicos, como la galactorrea o los cambios cutáneos, no son hallazgos frecuentes, por lo que su presencia obliga a descartar causas no fisiológicas (véase la tabla 1).
Diagnóstico diferencial entre ginecomastia puberal y patológica.
| Ginecomastia puberal | Ginecomastia patológica | |
|---|---|---|
| Edad | Puberal (10–12 años) | Prepuberal |
| Fármacos | No | Posible |
| Evolución | 6 m -1 año | Permanente |
| Enfermedad concomitante | No | Posible |
| Desarrollo genital | Siempre estadio II-III | Acorde con su edad |
| Exploración | Botón mamario centrado | Según causa |
| Dolor | Hipersensibilidad local | Intenso o no |
| Galactorrea | Ausente | Puede estar presente, Telorragia |
| Analítica hormonal | Normal | Normal o alterada |
No se conoce con claridad su fisiopatología, aunque se especula con un probable origen multifactorial. Por un lado, el predominio estrogénico en las fases iniciales de la pubertad no queda suficientemente contrarrestado por los niveles bajos de andrógenos generados tras los pulsos nocturnos de LH. Por otro lado, la mayor afinidad de la globulina fijadora de hormonas sexuales (SHBG) por la testosterona justifica un aumento de la fracción libre de estradiol cuando disminuye esta proteína transportadora durante el inicio puberal. Un aumento de la actividad aromatasa, por último, provocaría un incremento de los valores de estrona/estradiol a partir de DHEA/DHEA-S y testosterona 8.
El crecimiento es generalmente autolimitado en el tiempo. Se observa la resolución espontánea en un 75 y 90% a los 2 y los 3 años, respectivamente, quedando un 10% de los casos en los que persiste a los 20 años 1.
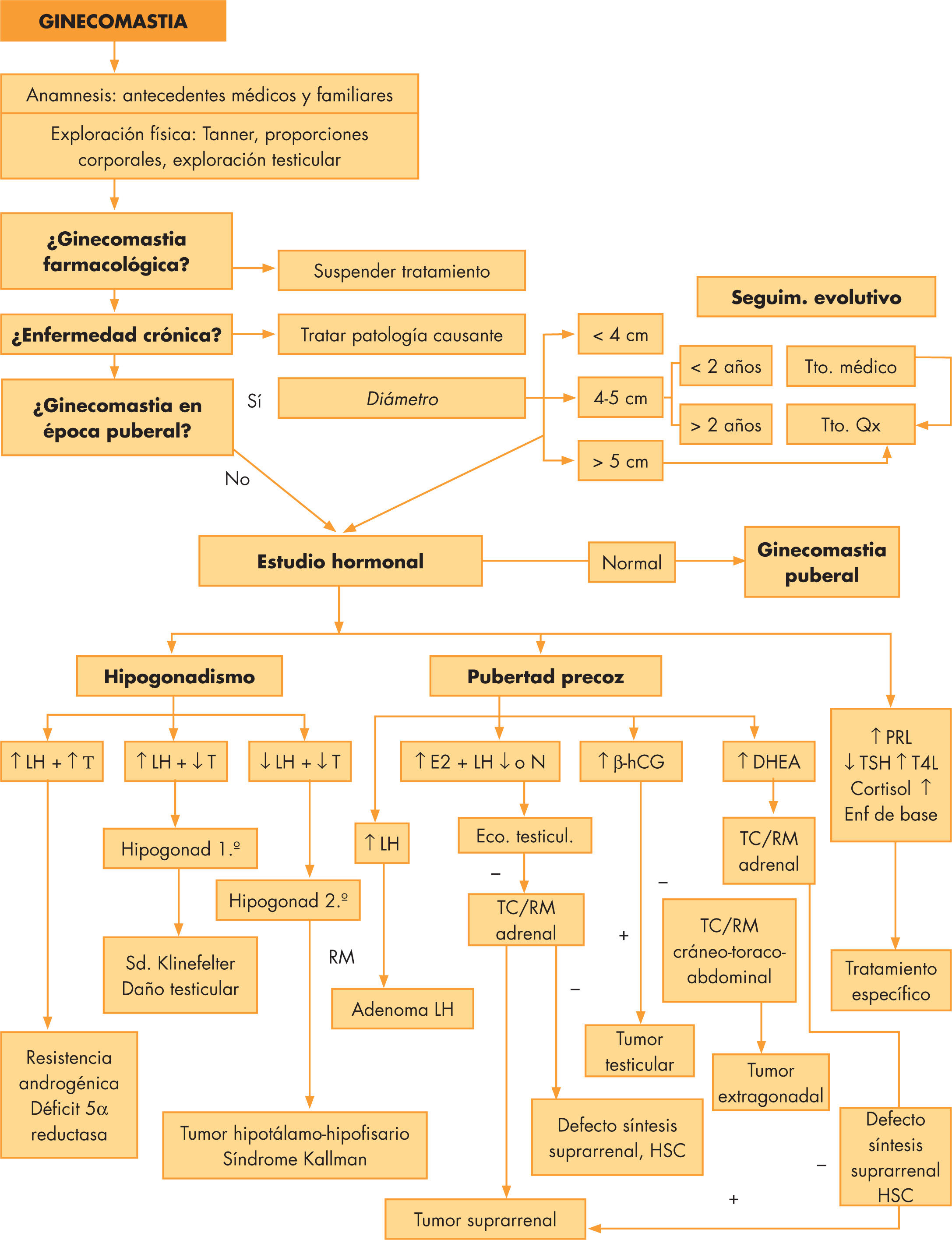
La realización de pruebas complementarias en esta patología no está indicada por lo general, salvo en las siguientes circunstancias:
- —
Ginecomastia de gran tamaño (> 4cm de diámetro).
- —
Evolución rápida y progresiva.
- —
Presencia galactorrea.
- —
Testes pequeños y escasa virilización o pubertad detenida.
- —
Masas en testes o abdomen.
- —
Bocio.
- —
Talla muy alta, crecimiento acelerado y/o hipogenitalismo.
En su ausencia, es razonable adoptar una actitud conservadora con seguimiento clínico cada 4–6 meses, contestando las dudas que surjan y tratando de tranquilizar al paciente 5,9.
Ginecomastia no puberalEn los casos de ginecomastia fuera del periodo puberal, cuando se manifieste como primer signo puberal o, por el contrario, al término de este proceso, es necesario descartar enfermedad orgánica subyacente antes de ser catalogada como idiopática. Distinguimos los siguientes mecanismos fisiopatológicos en la génesis de la ginecomastia fuera del periodo puberal (véase la tabla 2):
- 1.
Aumento en los valores de estrógenos circulantes:
- a.
Exógenos: se han descrito casos de ginecomastia en niños con progenitores usuarios de cremas de contenido hormonal, preparados cosméticos de fabricación casera con elevado contenido en fitoestrógenos 10,11 o tras el consumo excesivo de productos cárnicos con alto contenido hormonal.
- b.
Endógenos: aunque infrecuentes en edad pediátrica, existen diversas patologías que incrementan los valores de estradiol/estrona circulantes.
- —
Tumores productores de hCG 12. De diversa estirpe histológica (carcinoma embrionario, coriocarcinoma, corioepitelioma, etc.), son de localización habitualmente gonadal, aunque pueden ubicarse en otros órganos; pulmón, hígado, mama, cerebro... Debido a su homología estructural con la LH, la hCG estimula la secreción testicular de testosterona, lo cual, en última instancia, incrementa la conversión periférica y favorece el ambiente estrogénico.
- —
Tumores de células de Leydig y Sertoli. En general, estos tumores provocan ginecomastia por un bloqueo enzimático en la síntesis de testosterona a nivel del citocromo P450c17, al tiempo que una elevación de SHBG disminuye la fracción libre de esta hormona. Estos últimos se presentan relacionados con el síndrome de Peutz-Jeghers, en los que la ginecomastia acontece por un exceso de aromatización a nivel de células tumorales. Se diagnostica por elevación de inhibina B en sangre con valores suprimidos de FSH por contrarregulación.
Lectura rápida
Dada la actual prevalencia de obesidad en la población infantil, es habitual la derivación a consulta especializada de pacientes con acúmulos grasos en la región mamaria (adipomastia) y que difieren de la ginecomastia en su valoración y manejo.
Hasta el 95% de los episodios de ginecomastia infantil ocurren dentro del periodo puberal. Entre la causas no puberales se engloban las siguientes: idiopática, fármacos, hipogonadismos, tumores, tóxicos, enfermedades sistémicas, etc.
Lectura rápida
Aunque infrecuente dentro de las causas de ginecomastia no puberal, es preciso descartar la presencia de tumores productores de estrógenos o sus precursores. Pueden localizarse en testículo, suprarrenales y otras vísceras (hígado, pulmón, cerebro, mama, etc.).
El síndrome de Klinefelter, al igual que otros casos de hipogonadismo primario, presenta una elevada incidencia de ginecomastia. En el caso especial de la trisomía 47XXY, el riesgo de presentar carcinoma embrionario es aproximadamente 20 veces el de la población normal.
En la anamnesis no se debe olvidar recoger datos sobre el consumo de fármacos, contacto con tóxicos, drogas o productos hormonales, así como la relación con el desarrollo sexual del paciente. Es preciso anotar antecedentes personales de enfermedades crónicas o patología testicular e información de episodios similares en familiares.
En general, la ginecomastia en la edad puberal de inicio y curso normal es un diagnóstico clínico y no requiere estudios rutinarios de laboratorio o imagen.
- —
Tumores suprarrenales. Son malignos, infiltrantes y de pronóstico sombrío. Se diagnostican por un incremento en sangre de DHEA, androstendiona y, consecuentemente, por transformación periférica, de estrona.
- —
Síndrome de exceso de aromatasa. Enfermedad familiar de herencia genética heterogénea que afecta al gen CYP19 13,14. En el varón se manifiesta con seudopubertad precoz heterosexual, talla final disminuida y ginecomastia. En la mujer, se describe seudopubertad precoz isosexual, talla baja, macromastia y aumento del riesgo de carcinoma endometrial y de mama.
- —
La obesidad parece interferir en la síntesis testicular de testosterona, además de favorecer la generación de estrógenos en el tejido adiposo 1,4,15.
- —
El hipertiroidismo, por incremento de la producción de estrógenos y estimulación de la producción de SHBG que disminuye la testosterona libre. En el hipotiroidismo primario, el exceso de TRH estimula la producción de prolactina, que induce hipogonadismo.
- a.
- 2
Disminución de los valores de andrógenos:
- a.
Hipogonadismo. Cualquier etiología que afecte a la síntesis gonadal de andrógenos, ya sea por un fallo primario testicular o por alteración de la secreción de gonadotrofina, puede ser causa de ginecomastia. El hipogonadismo es expresión clínica de una amplia variedad de etiologías, entre ellas:
- —
Alteraciones cromosómicas. El síndrome de Klinefelter (47XXY) es la cromosomopatía más frecuentemente asociada a ginecomastia.
- —
Disgenesias gonadales. Los trastornos en la génesis testicular causados por alteraciones en el número o la composición de los gonosomas pueden ocasionar ginecomastia en el contexto clínico de seudohermafroditismo y otras anomalías de la diferenciación sexual.
- —
Trastornos de la síntesis de testosterona:
- 1.
Formas tardías (no clásicas) de deficiencia de 3β hidroxiesteroide deshidrogenasa: esta enzima interviene en la síntesis de las 3 líneas hormonales suprarrenales.
- 2.
Deficiencia de 11β hidroxilasa: algunas formas graves pueden generar ginecomastia prepuberal.
- 3.
Formas tardías de deficiencia de 17 hidroxiesteroide deshidrogenasa, enzima que cataliza el paso de androstendiona a testosterona y de estrona a estradiol: estos pacientes presentan valores elevados de androstendiona y estrona, y reducidos de testosterona y estradiol.
- 4.
Daño testicular: cualquier causa de lesión testicular ya sea de origen infeccioso (parotiditis, TBC, lepra), químico (quimioterapia) o físico (radioterapia) puede alterar la síntesis hormonal, favoreciendo la ginecomastia.
- 1.
- —
- 3
Defecto en la acción de los andrógenos. El síndrome de resistencia a los andrógenos se origina por una mutación del gen codificante del receptor androgénico (AR) localizado en Xq11–12. En las formas parciales, los pacientes presentan, ya en el momento del nacimiento, seudohermafroditismo masculino con criptorquidia, micropene e hipospadias y ginecomastia en la pubertad. La forma completa se denomina de feminización testicular o síndrome Morris, con caracteres sexuales secundarios femeninos y genitales internos rudimentarios. Otras alteraciones relacionadas menos frecuentes serían la enfermedad de Kennedy o la ausencia de enzima 5α-reductasa 1,17.
- 4
Incremento en la relación cuantitativa estrógenos/andrógenos. La función testicular es sensible a múltiples enfermedades crónicas y agentes lesivos (véase la tabla 3) que provocan, por distintos mecanismos, disfunción testicular en la síntesis hormonal gonadal y en la espermatogénesis 1,9,16:
- a.
Hepatopatías crónicas. Pueden generar signos de hipogonadismo entre otros, por: a) disminución del metabolismo hepático de los estrógenos; b) menor degradación de la androstendiona (facilitando su transformación en estrona), y c) la existencia de valores aumentados de SHBP que disminuyen la fracción libre de andrógenos circulantes.
- b.
Insuficiencia renal crónica. Se ha constatado una prevalencia de ginecomastia del 50% en pacientes sometidos a diálisis por una posible disminución de la síntesis o un aumento de la degradación de testosterona, así como la interferencia de prolactina en la secreción de gonadotrofinas 8.
- c.
Procesos oncológicos. Hasta un 30% de los púberes con leucemia la padecen debido probablemente a la depresión testicular motivada por el proceso proliferativo, así como a factores psicológicos implicados como el estrés 1.
- d.
Enfermedades inflamatorias/debilitantes crónicas. Presentan signos de disfunción gonadal de probable etiología multifactorial (inflamación, fármacos, estrés, malnutrición).
- e.
Hipercortisolismo. El exceso de glucocorticoides inhibe la secreción pulsátil de GnRH y altera la respuesta células de Leydig a la LH, lo que se denomina insuficiencia testicular corticoidea.
- f.
Malnutrición/recuperación ponderal. La ginecomastia aparece en la fase de recuperación tras la situación de ayuno, asemejando una «segunda pubertad» sexual.
- g.
Otros. Si bien se desconocen los mecanismos últimos en algunos casos de esta condición, se considera probable una disfunción gonadal acompañante en la mayoría:
- —
Enfermedades del sistema nervioso central (lesión medular, distrofia miotónica de Steinert, atrofia muscular espinobulbar).
- —
Enfermedades inmunitarias (diabetes, Hashimoto, panarteritis nodosa, lupus eritematoso, etc.).
- —
Hipertensión arterial (por disminución de los valores de testosterona y sumado al tratamiento antihipertensivo).
- —
Síndrome de POEMS (polineuropatía, organomegalia, endocrinopatía, proteína M y alteraciones de la piel). Cursa con ginecomastia, insuficiencia suprarrenal primaria y secundaria, e hipotiroidismo.
- —
Anomalía de Poland.
- —
Lesión de nervios intercostales (herpes zóster, traumatismos torácico, cirugía torácica).
- —
Estrés. Se cree responsable de un porcentaje elevado de casos de ginecomastia transitorios e idiopáticos.
- —
Lectura rápida
Hallazgos que hagan sospechar la presencia de una neoplasia, casos de macroginecomastia (> 4cm), crecimiento rápido y sintomático o se acompañen de síntomas generales, se seguirán de un estudio bioquímico y hormonal. En el estudio hormonal, se solicitarán gonadotrofinas, prolactina, testosterona, estradiol, andrógenos suprarrenales, perfil tiroideo y β-hCG. La realización de ecografía/TC está indicada ante hallazgos físicos o bioquímicos que precisen descartar procesos tumorales.
El tratamiento debe ir dirigido en primer lugar a eliminar la causa, cuando ésta pueda establecerse.
Tabla 3.Etiología de la ginecomastia en la Infancia.
Ginecomastia fisiológica Neonatal Puberal Ginecomastia patológica Hipogonadismos Hipotálamo-hipofisarios Daño testicular Tumores testiculares De células germinales De células de Leydig De células de Sertoli Tumores Suprarrenales (adenoma y carcinoma) Cerebrales (embrionarios) Productores hCG (pulmón, riñón, estómago, hígado) Neoplasia mamaria (benigna o maligna) Trastornos suprarrenales Déficit idiopático de ACTH Hiperplasia suprarrenal congénita Hipercortisolismo Trastornos tiroideos Hipotiroidismo Hipertiroidismo Ginecomastia familiar Exceso de aromatasa Alteración de receptores Trastornos de la síntesis de testosterona. Enfermedades sistémicas Enfermedades graves Enfermedades neoplásicas Hepatopatía crónica Insuficiencia renal crónica Otros Enfermedades del sistema nervioso central: lesión medular,distrofia miotónica de Steinert, atrofia muscular espinobulbar) Lesión de nervios intercostales (herpes zóster, traumatismos) Enfermedades inmunitarias Desnutrición y periodo de realimentación Obesidad Hipertensión arterial Anomalía de Poland Síndrome de POEMS (polineuropatía, organomegalia, endocrinopatía, proteína M y alteraciones de la piel) Estrés Ginecomastia idiopática ACTH: hormona adrenocorticotropa
- a.
- 5.
Ginecomastia farmacológica. Se han identificado al menos 300 fármacos relacionados con la aparición de ginecomastia (véase la tabla 4), si bien no en todos se ha podido aclarar su fisiopatología. Se estima que es responsable de entre el 10 y el 25% de los casos en población general. Algunos de los mecanismos etiopatogénicos más frecuentes son:
- a.
Fármacos con efecto antiandrógeno. Por una alteración de la síntesis enzimática de testosterona: ketoconazol, espironolactona, metronidazol, antihistamínicos H2. Otros fármacos antiandrógenos (flutamida, acetato de ciproterona) actúan interfiriendo en la unión al receptor citosólico. La finasterida, por su parte, inhibe el paso enzimático a dehidrotestosterona.
- b.
Fármacos con efecto agonista estrogénico. Ya sea por efecto directo o por aumento de la conversión periférica: digoxina, fenitoína, hcG, andrógenos aromatizables…
- c.
Fármacos que provocan disfunción testicular: agentes alquilantes, clorambucilo, ciclofosfamida, drogas de abuso, alcoholismo…
- d.
Fármacos con efecto trófico. El uso de rGh se ha relacionado con ginecomastia en niños prepuberales sin asociar incremento de valores sanguíneos de estrógenos.
Tabla 4.Fármacos y otras sustancias responsables de ginecomastia.
Hormonas Análogos de la LH-RH Antiandrógenos: ciproterona, flutamida, espironolactona Andrógenos (por conversión periférica) β-HCG Clomifeno Derivados estrogénicos: cosméticos, alimentos, fitoestrógenos, fármacos Desoxicorticosterona Esteroides anabólicos y andrógenos aromatizables Finasterida Fludrocortisona y otros corticoides hGH Insulina Progesterona Antibióticos Antimicóticos: ketoconazol, metronidazol Antituberculosos: isoniacida, etionamida, tiacetazona Antiulcerosos Cimetidina Omeprazol Ranitidina Quimioterápicos Bleomicina Busulfán Ciclofosfamida Cisplatino Clorambucilo Metrotrexato Nitrosureas Procarbacina Vincristina Fármacos cardiovasculares Amiodarona Antagonistas del calcio: diltiazem Antihipertensivos: metildopa, reserpina Espironolactona Digitoxina (digital) Inhibidores de la ECA: captopril, enalapril Metildopa Fármacos que actúan sobre el SNC Anfetaminas Antidepresivos tricíclicos Diazepam Fenitoína Fenotiazinas Haloperidol Metoclopramida Metildopa Sulpirida Antidopaminérgicos Domperidona Metoclopramida Drogas Alcohol Anfetaminas Heroína Marihuana Metadona Otros Antirretrovirales Ginseng Quan Dong Griseofulvina Lovastatina Penicilamina Provastatina Vitaminas: E y D ECA: enzima de conversión de angiotensina; LH-RH: hormona liberadora de la hormona luteinizante; SNC: sistema nervioso central; β-HCG: hormona corionotrófica humana.
- a.
- 6
Ginecomastia idiopática. El diagnóstico de ginecomastia idiopática se realiza por criterios de exclusión una vez descartadas el resto de las etiologías. Es preciso realizar un seguimiento evolutivo de estos pacientes, ya que en algunos casos pueden aparecer signos o síntomas no referidos en un primer momento y que nos conduzcan al diagnóstico. Se formulan múltiples teorías en relación con la posible fisiopatología de esta condición, llegando algunos autores incluso a interpretarla como una variante de la normalidad.
Lectura rápida
En la ginecomastia puberal, se han ensayado múltiples tratamientos cuyo mecanismo hipotéticamente resolvería el disbalance hormonal existente. Sin embargo, en la práctica clínica, ningún estudio amplio y aleatorizado ha conseguido demostrar un beneficio real del tratamiento médico respecto de la resolución espontánea a largo plazo.
La actitud más establecida en la actualidad ante la ginecomastia puberal, a falta de nuevas evidencias, es el seguimiento evolutivo con observación clínica hasta su remisión. El tratamiento médico puede ser considerado ante casos de ginecomastia muy sintomática o marcados problemas psicológicos.
- a.
Mecanismos patogénicos de la ginecomastia.
| 1. Por aumento de estrógenos libres: |
| Secreción directa de estrógenos o sus precursores: |
| en la unidad materno-feto-placentaria |
| en los testes |
| en la glándula suprarrenal |
| Aromatización extragonadal de sus precursores |
| Desplazamiento de la SHBG (espironolactona y ketoconazol) |
| Menor metabolismo |
| Administración exógena de estrógenos o sustancias con acción estrogénica |
| 2. Por disminución de andrógenos libres: |
| Menor secreción (hipogonadismos, defecto síntesis testosterona, espironolactona, ketoconazol) |
| Mayor metabolismo (alcohol por incremento de la reductasa hepática) |
| Aumento de su unión a la SHBG |
| 3. Por defectos del receptor androgénico: |
| Congénitas de su estructura y función |
| Desplazamiento de los andrógenos de su receptor (ciproterona, flutamida, cimetidina) |
| 4. Por un aumento de la sensibilidad estrogénica de la glándula mamaria (expansión CAG) |
| 5. Estimulación farmacológica inespecífica de los receptores de estrógenos |
Modificada de Labarta et al1.
SHBG: globulina fijadora de hormonas sexuales
- —
Momento de inicio del proceso y curso evolutivo de los síntomas (velocidad de desarrollo, extensión bilateral, aparición de dolor) estableciendo su relación temporal con los cambios puberales.
- —
Presencia de otros síntomas acompañantes generales o locales que puedan sugerir patología de base: ganancia/pérdida ponderal, taquicardia, insomnio, dolor/molestias testiculares, dolor abdominal, etc.
- —
Posible exposición a fármacos (tópicoso sistémicos), productos cosméticos caseros o sustancias químicas sospechosas.
- —
Descartar el consumo crónico o abusivo de productos alimenticios con contaminación hormonal.
- —
Descartar patología de base que pueda afectar a la síntesis y el metabolismo hormonal masculino (hepatopatías, IRC, defectos congénitos suprarrenales, Cushing).
- —
Recoger antecedentes familiares de ginecomastia, investigando su causa, curso clínico y necesidad de tratamiento.
- 1.
Diferenciar ginecomastia real de seudoginecomastia (adipomastia, neoplasia) realizando la exploración de la glándula en posición decúbito supino o sedestación. Una técnica consiste en «pellizcar» la glándula con los primeros dedos de la mano desde la periferia hacia el pezón, percibiendo los cambios de la consistencia glandular al tacto. Puede ser de utilidad compararlos con el tacto y grosor del tejido adiposo subcutáneo en otra localización cercana.
- 2.
Buscar signos de enfermedad de base concomitante: estado nutricional, presencia de bocio, alopecia, hirsutismo, obesidad troncular, estrías cutáneas, signos y síntomas de afectación hepática o renal.
- 3.
Talla y proporciones corporales (Klinefelter). Determinar grado de desarrollo puberal (estadio de Tanner), volumen testicular y tamaño peneano. Palpar ambos testes en busca de masas u otras lesiones.
- 4.
Sospechar la afectación cancerosa de la glándula mamaria ante la existencia de un tumor o masa excéntrica, unilateral, irregular, de consistencia dura y adherida a planos profundos. Puede asociarse a afectación ganglionar locorregional, telorragia, retracción del pezón y otras lesiones cutáneas (ulceración). Hay que recordar que la cromosomopatía XXY se asocia a un incremento de la incidencia de carcinoma de mama en el varón (x20 de la población normal).
Quedan, por lo general, reservadas a situaciones de crecimiento explosivo, fuera del periodo normal, así como ante la presencia de signos sugerentes de organicidad. De igual modo, si persisten las dudas tras una historia y exploración detalladas, y en función de los hallazgos, se solicitará:
- —
Hemograma y bioquímica general. Función renal y hepática. VSG o PCR. Marcadores nutricionales.
- —
TSH, T4l, T3T.
- —
FSH, LH, prolactina.
- —
Testosterona, 17β-estradiol.
- —
DHEA-S, androstendiona, estrona.
- —
β-hCG.
- —
Cortisol libre urinario, hormona adrenocorticotropa (si obesidad).
- —
Cariotipo (si hipogonadismo).
- —
Ecografía mamaria o testicular si sospecha de neoplasia.
- —
TC en caso de sospecha de lesiones suprarrenales u otra localización extragonadal.
En la figura 1 vemos el algoritmo diagnóstico.
TratamientoLa ginecomastia patológica debe ser tratada en función de su etiología, retirando el agente inductor de la misma o corrigiendo, en lo posible, las alteraciones endocrinológicas responsables. En los casos de hipogonadismo primario o secundario, la administración de testosterona puede aumentar la ginecomastia por aromatización de los andrógenos.
En el caso de la ginecomastia puberal, la indicación de tratamiento debe individualizarse, ya que la resolución espontánea de la ginecomastia puberal es favorable en un elevado porcentaje de casos (> 90%), desapareciendo sin tratamiento en el plazo de 1–3 años. Factores de peor pronóstico son los antecedentes familiares positivos, la macroginecomastia (> 4cm), la presencia de síntomas físicos (dolor importante o crecimiento rápido) y la duración > 12 meses, ya que ésta condiciona mamas grandes y fibróticas, con una menor respuesta al tratamiento médico.
La opción farmacológica está aún pendiente de evaluación en población infantil 18. Son muchos los fármacos ensayados, pero el elevado porcentaje de resolución espontánea dificulta conocer la eficacia real del fármaco y su adopción universal supondría un sobretratamiento en muchos casos. De hecho, los estamentos gubernamentales (FDA, EMEA) actualmente no recogen ninguna opción farmacológica para esta indicación en población adolescente.
El danazol es un fármaco con acción androgénica débil que actúa inhibiendo la producción de estrógenos, al tiempo que suprime la secreción de gonadotrofinas hipofisiarias 19. La presencia de efectos secundarios, como ganancia de peso, síntomas de hiperandrogenismo o cambios de estado anímico, ha limitado su uso 20.
Se han empleado fármacos que bloquean en los tejidos diana, la unión de los estrógenos al receptor. El tamoxifeno es uno de los antiestrógenos más utilizados con esta indicación. Existe amplia experiencia de su uso y eficacia en población adulta, no así en edad puberal 21. En un estudio en jóvenes de 13 a 32 años, el tamoxifeno demostró una mayor eficacia en la disminución del tamaño glandular que aquellos tratados con danazol 22. Sin embargo, la tasa de recidiva tras la discontinuación del fármaco fue mayor en el primer grupo. Es bien tolerado y con escasos síntomas secundarios; no obstante, se han descrito casos de hipertransaminasemia y leucopenia 23. Es el fármaco de elección en caso de ginecomastia no fibrótica con síntomas locales importantes y/o problemas psicológicos asociados. Lawrence et al 7, en un estudio en población adolescente, compararon tamoxifeno y raloxifeno, otro inhibidor estrogénico, constatando una disminución de la ginecomastia en ambos grupos de tratamiento, siendo mayor en la cohorte del raloxifeno.
Los inhibidores de la aromatasa (testolactona y anastrozol) han sido otros de los fármacos estudiados para el tratamiento de la ginecomastia. Teóricamente, la inhibición de esta enzima debería resultar en un descenso de los valores de estrógenos en el tejido diana. La testolactona (10–40mg/kg/día) ha sido empleada en ginecomastia puberal con resultados contradictorios o inconcluyentes 24, pero en todo caso menores en comparación con el tamoxifeno. Los escasos estudios prospectivos con anastrozol notifican una reducción del 50% del tamaño glandular, si bien la comparación a largo plazo no parece aportar beneficios respecto de la opción de no tratar 25,26.
En conjunto, la bibliografía existente sobre las ventajas del tratamiento médico de la ginecomastia puberal en adolescentes está limitada por varios factores. Por un lado, existen pocos estudios controlados, aleatorizados y doble ciego frente a placebo. Tampoco existe uniformidad en los criterios de valoración del efecto. El seguimiento a largo plazo de los estudios publicados es insuficiente para comprobar la necesidad de tratamiento frente a la simple observación clínica.
En casos severos o crónicos con pocas posibilidades de regresión, refractarios al tratamiento o con mala evolución clínica, la solución quirúrgica en manos experimentadas ofrece buenos resultados estéticos y funcionales 27–29. Dada la escasa incidencia de malignidad, no parece necesario, de manera rutinaria, el examen histológico de la muestra 30.