Puntos clave
En niños no hay sintomatología específica de enfermedad por reflujo gastroesofágico (ERGE) ni que anticipe respuesta al tratamiento. En niños mayores, la anamnesis y la exploración física son suficientes para el diagnóstico e iniciar tratamiento. Grado de evidencia C.
La combinación de pH-metría + impedanciometría es superior a la pH-metría para la correlación reflujosíntomas. Grado de evidencia B.
La endoscopia no determina si la esofagitis es debida a reflujo. De realizarse, deben tomarse biopsias para descartar otras causas de esofagitis y diagnosticar esófago de Barret. Grado de evidencia B.
El tránsito superior no es útil para el diagnóstico de reflujo. La gammagrafía puede detectar aspiraciones secundarias a reflujo, pero no está recomendada en otros síntomas de reflujo. Grado de evidencia B.
No hay evidencia para realizar tratamiento empírico de reflujo en los niños con síntomas de ERGE. Grado de evidencia B.
En niños mayores y adolescentes con ardor y dolor torácico el tratamiento de prueba con antiácidos durante 4 semanas puede ser útil para determinar la causa. Si los síntomas persisten, se debe derivar al gastroenterólogo infantil. Grado de evidencia A.
El paso de contenido gástrico al esófago es un proceso fisiológico que ocurre en los lactantes, niños y adultos. Constituye un motivo de consulta frecuente (hasta el 50%)1 en pediatría y debe distinguirse a aquellos pacientes sin repercusiones clínicas de los que presenten sintomatología o complicaciones derivadas del mismo. Solo en este último grupo está justificada la evaluación diagnóstica y terapéutica encaminada a definir la gravedad del proceso, por un lado, y mejorar la clínica o evitar las complicaciones, por el otro.
A continuación, se revisan las principales medidas diagnóstico-terapéuticas para el manejo del reflujo gastroesofágico en pediatría.
DefiniciónEl reflujo gastroesofágico (RGE) es el paso retrógrado sin esfuerzo del contenido gástrico al esófago o la boca. Este proceso es un fenómeno natural favorecido en los niños por la inmadurez cardiohiatal fisiológica, que predomina en lactantes de 1 a 4 meses y que suele resolverse de forma espontánea entre los 12 a 18 meses. Cursa de forma asintomática, pudiendo aparecer varias veces al día con una duración menor a 3 min y predominando en el periodo posprandial (RGE fisiológico). Dada la naturaleza benigna del proceso, no requiere pruebas diagnósticas y puede ser manejado sencillamente con vigilancia clínica del paciente.
Cuando este proceso ocasiona síntomas o complicaciones en el paciente se define como enfermedad por RGE (ERGE). Su prevalencia en población pediátrica oscila del 1,8 al 8,2%2. Se debe a distintas alteraciones de los mecanismos de protección esofágica, como pueden ser: alteración aclaramiento esofágico, vaciamiento gástrico enlentecido, alteraciones en la reparación del epitelio esofágico, disminución de los reflejos neurológicos protectores de la vía aerodigestiva o relajaciones transitorias del esfínter esofágico inferior (EEI)3, siendo este último el principal causante del ERGE en neonatos, sobre todo prematuros.
DiagnósticoSe basa en la historia clínica, la exploración física y las pruebas complementarias. La anamnesis es imprescindible pero, dada la inespecificidad de los síntomas del RGE, en ocasiones puede ser necesaria la realización de pruebas adicionales. La nueva guía para el manejo del RGE de la ESPGHAN4, publicada en 2009, determina el diagnóstico de ERGE cuando las pruebas muestran un aumento de la frecuencia o duración del número de eventos de reflujo, esofagitis o asociación clara de síntomas o signos con el reflujo en ausencia de otros síntomas.
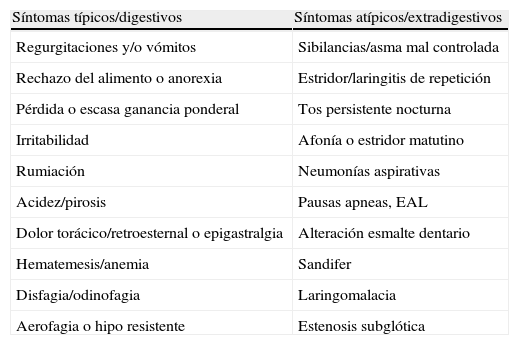
AnamnesisPodemos sospechar que un paciente tiene RGE cuando presenta una serie de síntomas y signos que pueden clasificarse en típicos o digestivos y atípicos o extradigestivos (tabla 1). La presentación de estos síntomas varía según la edad, siendo más frecuentes la ano
Lectura rápida
El RGE es una afección común en los niños que se manifiesta habitualmente con vómitos e irritabilidad. La mayoría de estos casos corresponden a un reflujo gastroesofágico (RGE) fisiológico, resolviéndose el problema de forma espontánea a partir de los 18 meses.
Diagnóstico. AnamnesisA la hora de realizar la historia clínica del paciente hay que tener presente que ningún síntoma es diagnóstico o predictor de respuesta al tratamiento y que habitualmente estos son inespecíficos. En niños mayores, la anamnesis y exploración física será suficiente para establecer el diagnóstico y seguimiento del niño con enfermedad por RGE (ERGE). En la anamnesis de estos pacientes es importante recoger datos que sugieran un proceso patológico. Cuando el paciente presente síntomas típicos (digestivos) o atípicos (extradigestivos) estará indicada la realización de pruebas complementarias para el diagnóstico de ERGE. En el caso de existir signos de alarma (signos de hipertensión intracraneal) deberán realizarse otras pruebas complementarias para el diagnóstico diferencial completo.
Síntomas y signos típicos y atípicos asociados a reflujo gastroesofágico4
| Síntomas típicos/digestivos | Síntomas atípicos/extradigestivos |
| Regurgitaciones y/o vómitos | Sibilancias/asma mal controlada |
| Rechazo del alimento o anorexia | Estridor/laringitis de repetición |
| Pérdida o escasa ganancia ponderal | Tos persistente nocturna |
| Irritabilidad | Afonía o estridor matutino |
| Rumiación | Neumonías aspirativas |
| Acidez/pirosis | Pausas apneas, EAL |
| Dolor torácico/retroesternal o epigastralgia | Alteración esmalte dentario |
| Hematemesis/anemia | Sandifer |
| Disfagia/odinofagia | Laringomalacia |
| Aerofagia o hipo resistente | Estenosis subglótica |
EAL: episodios aparentemente letales.
Es fundamental distinguir 2 grupos de pacientes con RGE: el «regurgitador feliz» («happy spitter»), que presenta regurgitaciones frecuentes sin otra sintomatología ni repercusión clínica acompañante, y el paciente con ERGE en el que el RGE causa signos o síntomas que provocan un deterioro del estado físico o de su calidad de vida.
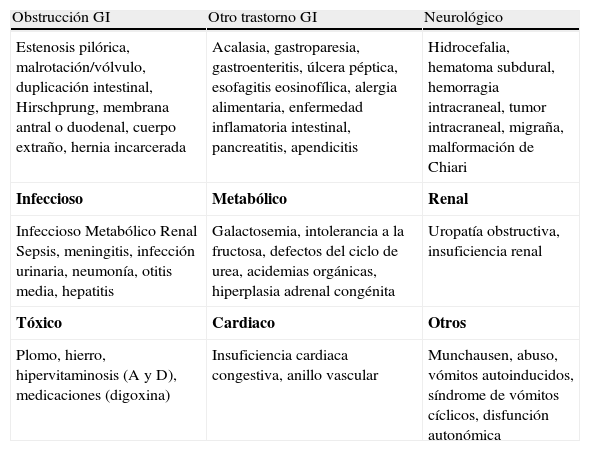
Los objetivos de la historia clínica y la exploración física son: descartar otras entidades que cursan con vómitos (tabla 2) basándose en la exclusión de signos de alarma (tabla 3), y diagnosticar complicaciones del RGE (p. ej., esofagitis, estenosis). Con la finalidad de definir el diagnóstico y monitorizar la gravedad de la enfermedad, se han publicado distintos cuestionarios (algunos pendientes de validación), basados en la clínica del paciente tanto en prematuros como en niños mayores, aunque no sustituyen a la pruebas invasivas en caso de ERGE grave o complicada6–10.
Diagnóstico diferencial del niño vomitador4
| Obstrucción GI | Otro trastorno GI | Neurológico |
| Estenosis pilórica, malrotación/vólvulo, duplicación intestinal, Hirschprung, membrana antral o duodenal, cuerpo extraño, hernia incarcerada | Acalasia, gastroparesia, gastroenteritis, úlcera péptica, esofagitis eosinofílica, alergia alimentaria, enfermedad inflamatoria intestinal, pancreatitis, apendicitis | Hidrocefalia, hematoma subdural, hemorragia intracraneal, tumor intracraneal, migraña, malformación de Chiari |
| Infeccioso | Metabólico | Renal |
| Infeccioso Metabólico Renal Sepsis, meningitis, infección urinaria, neumonía, otitis media, hepatitis | Galactosemia, intolerancia a la fructosa, defectos del ciclo de urea, acidemias orgánicas, hiperplasia adrenal congénita | Uropatía obstructiva, insuficiencia renal |
| Tóxico | Cardiaco | Otros |
| Plomo, hierro, hipervitaminosis (A y D), medicaciones (digoxina) | Insuficiencia cardiaca congestiva, anillo vascular | Munchausen, abuso, vómitos autoinducidos, síndrome de vómitos cíclicos, disfunción autonómica |
GI: gastrointestinal.
Signos de alarma de patología grave en niño vomitador o regurgitador4
| Vómitos biliosos o proyectivos |
| Sangrado digestivo |
| Vómitos de inicio > 6 meses |
| Escasa ganancia ponderal |
| Diarrea/estreñimiento |
| Letargia |
| Fiebre |
| Hepatoesplenomegalia |
| Fontanela abombada |
| Macro/microcefalia |
| Crisis |
| Distensión abdominal |
| Sospecha de alteración genética o metabólica |
Sin embargo, a día de hoy, ningún síntoma o cuestionario aislado es diagnóstico o predictor de respuesta al tratamiento o de gravedad, por lo que, en ocasiones, se requiere el uso de pruebas complementarias.
Pruebas complementariasLas indicaciones de pruebas complementarias para el diagnóstico de ERGE son: confirmar el diagnóstico e identificar complicaciones de ERGE. A continuación, resumimos las principales pruebas utilizadas y sus indicaciones:
- –
pH-metría esofágica: es la prueba de referencia de RGE. Se basa en la monitorización continua del pH esofágico intraluminal durante 24h. Mide la frecuencia y la duración de los episodios de reflujo esofágico ácido (ERA). Aunque en los niños no existe consenso universal acerca del método de evaluación (Jolley, Eule-Byrne, Vandenplas11), se usa el método Vandenplas en menores de 1 año, el Boix-Ochoa12 de 1 a 9 años y el DeMeester13 en mayores de 9 años y adolescentes. Está indicada fundamentalmente cuando la evolución no es favorable a pesar del tratamiento o para evaluar la eficacia del mismo, y para intentar correlacionar los síntomas atípicos o extradigestivos con el RGE (tabla 2). Es segura, barata, tiene una alta sensibilidad y especificidad para el diagnóstico de RGE (aunque no está bien establecida4) y una reproductibilidad del 80%. Sin embargo, presenta como inconvenientes14, que no es fisiológica, que no correlaciona los ERA con la intensidad de la ERGE o de esofagitis, que no valora el volumen refluido a esófago, la altura del mismo o el aclaramiento del bolo y que no detecta complicaciones. Otra limitación importante, especialmente en prematuros, es que no mide reflujos con pH > 4.
- –
Impedanciometría-pH-metría: la impedancia es la resistencia al paso de corriente eléctrica que se ejerce por el paso del material refluido (sólido, líquido o gas) entre 2 electrodos de la sonda. La combinación con la pH-metría supera las limitaciones de esta por separado, aportando una sensibilidad que puede llegar al 94,6% y una especificidad de hasta el 76,6% para el diagnóstico de ERGE15. Está especialmente indicado en recién nacidos, ya que es independiente del pH, detecta reflujos en periodo posprandial tanto débilmente ácidos como alcalinos y es especialmente útil para correlacionar reflujos no ácidos con síntomas cardiorrespiratorios (pausas apnea)16–18. Sin embargo, su interpretación requiere más tiempo y conocimientos, tiene una menor reproductibilidad19 por la variabilidad interobservador20 y su coste es más elevado. Además, no hay valores normales estandarizados en pediatría, y solo hay estudios en adultos y neonatos prematuros21.
- –
Manometría esofágica: mide el peristaltismo esofágico, las presiones del esfínter esofágico superior e inferior y la coordinación durante la deglución. Permite excluir o confirmar anomalías motoras esofágicas (acalasia) presentes en niños con problemas neurológicos. Está indicado en los niños en los que exista disfagia sin estenosis, esofagitis, síntomas atípicos o posibilidad de cirugía antirreflujo (aunque no predice el pronóstico de la funduplicatura)22,23. Su utilidad es limitada como prueba aislada, ya que no permite el diagnóstico de ERGE con buena sensibilidad y especificidad, y hay poca experiencia en niños24.
- –
Endoscopia y biopsia: permite visualizar directamente la mucosa esofágica para descartar complicaciones por ERGE (esofagitis) y excluir otras afecciones (esofagitis eosinofílica, infecciones por cándida, virus herpes simple y citomegalovirus, linfoma, enfermedad de Crohn). Está indicado en niños ya diagnosticados por pH-metría, con clínica compatible con esofagitis por RGE (hematemesis, dolor retroesternal, pirosis, disfagia) para clasificar su gravedad (Savary-Miller25, según criterios endoscópicos, y Los Angeles26, según criterios histológicos). Las guías más recientes definen esofagitis por reflujo como la presencia de erosiones esofágicas visibles por endoscopia alrededor de la unión gastroesofágica27. Sin embargo, se trata de una prueba incómoda e invasiva, con una correlación entre los hallazgos endoscópicos e histológicos bastante pobre, de modo que hasta en un 30–50% de los niños con ERGE la mucosa es endoscópicamente normal y viceversa: la histología puede ser normal o no específica de reflujo, en un paciente con esofagitis endoscópica14.
- –
Gammagrafía: consiste en la introducción de alimentos o fórmula marcada con tecnecio- 99 en el estómago con obtención de imágenes para detectar reflujo y aspiración, independientemente del pH gástrico. Es útil para detectar reflujos posprandiales, identificar anomalías motoras esofágicas, evaluar
Lectura rápida
Diagnóstico. Pruebas complementariasLas principales indicaciones de pruebas complementarias son: confirmar el diagnóstico e identificar complicaciones de ERGE. La prueba de referencia para el diagnóstico de ERGE es la pH-metría, dada su alta sensibilidad y especificidad, y su reproductibilidad del 80%. Es una manera válida para la medición de la exposición ácida esofágica pero tiene la importante limitación de no medir reflujos con pH > 4 (los más frecuentes en prematuros) y la incapacidad para graduar el RGE. La combinación de impedancia intraluminal de canales múltiples (pH-MII) es superior a la pH-metría para correlacionar el reflujo con los síntomas típicos y atípicos. Está especialmente indicada en neonatos, ya que detecta reflujos alcalinos independientemente del pH, pero tiene la limitación importante de la falta de valores normales estandarizados en pediatría. La endoscopia está indicada cuando sospechemos esofagitis o ERGE complicado para el diagnóstico diferencial de otras causas de esofagitis y descartar el esófago de Barret. El resto de las pruebas complementarias no están indicadas de forma rutinaria en el diagnóstico de ERGE.
el volumen refluido y la velocidad del vaciamiento esofágico y gástrico además de detectar broncoaspiración por reflujo28. Sin embargo, la falta de estandarización de la técnica, la ausencia de normas específicas para la edad y la incapacidad para detectar reflujos fuera de periodo posprandial, así como microaspiraciones29, hacen que este estudio no esté recomendado de rutina en el estudio de reflujo. Tiene una sensibilidad del 15–59% y una especificidad del 83–100% para diagnosticar ERGE comparado con la pH-metría4.Lectura rápida
Si se sospecha anomalías anatómicas (disfagia, odinofagia) puede estar indicada la realización de endoscopia o tránsito baritado. En pacientes en los que queramos descartar aspiración (por afección respiratoria crónica) puede ser necesario realizar una gammagrafía.
Tratamiento. Manejo prácticoActualmente, no hay evidencia y, por lo tanto, no está indicado un tratamiento empírico con fármacos antirreflujo en niños pequeños con sospecha de ERGE para el diagnóstico del mismo. En niños más mayores o adolescentes con dolor torácico sí puede ser útil un tratamiento limitado de 4 semanas con inhibidores de la bomba de protones (IBP) para determinar si el reflujo es el causante de su sintomatología.
- –
Radiología (tránsito esofágico superior con contraste de bario): es un control radiológico del paso de papilla de bario a través del esófago. Es útil para descartar anomalías anatómicas en un paciente con síntomas sugestivos de ERGE como: membranas, anillos, acalasia, fístulas traqueoesofágicas, malrotación, estenosis hipertrófica de píloro (EHP) o hernia hiato (HH)4. Sin embargo, tiene escaso rendimiento diagnóstico, elevada radiación, frecuentes falsos positivos (detecta reflujos no patológicos) y falsos negativos (por escasa duración del estudio), y depende de la subjetividad del radiólogo. Su sensibilidad es del 29–86%, la especificidad de 21–83% y el valor predictivo positivo del 80–82% comparado con la pH-metría30. Todo ello hace que su uso de rutina para el estudio del ERGE no esté justificado.
- –
Ecografía esofágica y gástrica: detecta el RGE como un patrón de ecos brillantes llenando el EEI en la unión esófago-gástrica. Permite descartar obstrucciones distales (EHP, membranas antrales o duodenales), medir la longitud y posición del EEI y detectar HH. Tiene la ventaja de ser inocuo, no radiar y una sensibilidad del 65% (hasta 95% en el periodo posprandial durante 15 min)31. Sin embargo, no informa de otros datos anatómicos, requiere un elevado tiempo, no cuantifica el RGE y su especificidad es del 11%. Por ello, no está indicado en el diagnóstico de ERGE4.
- –
Test de fluidos en oreja, pulmón y esófago: algunos estudios han postulado la posibilidad de usar la enzima gástrica «pepsina» de las secreciones óticas de niños con otitis media crónica para demostrar asociación al reflujo. Sin embargo, estudios más recientes no muestran dicha asociación32. Lo mismo ocurre con la detección de «lactosa, glucosa, pepsina» de los pulmones para detectar aspiración secundaria a reflujo o la monitorización de «bilirrubina» en esófago para el diagnóstico de reflujo duodenal4.
- –
Ensayo terapéutico empírico con antiácidos como test diagnóstico: a pesar de usarse este procedimiento en adultos con síntomas de dolor torácico, tos y dispepsia, en niños no hay evidencia para aprobar este ensayo como test diagnóstico33. Existe disparidad en los estudios en cuanto a tipo de antiácido, dosis y tiempo de ensayo terapéutico además de la posibilidad de una mejoría espontánea con placebo.
Antes de abordar el manejo terapéutico de un niño con RGE hay que plantearse la necesidad del mismo4: solo precisarán tratamiento aquellos niños con ERGE en los que el reflujo cause síntomas o produzca complicaciones; en estos casos, el tratamiento debe instaurarse lo antes posible. En el caso de tratarse de un «regurgitador feliz» es esencial tranquilizar y explicar a los padres que se trata de un proceso benigno cuya evolución previsible es la resolución espontánea sin tratamiento. Las pruebas complementarias pueden ser útiles a la hora de decidir la actitud terapéutica más idónea en cada paciente, si bien no en todos los casos encontraremos una buena correlación entre la clínica y las pruebas8.
Los objetivos del tratamiento del ERGE son4:
- 1.
Mejorar de la sintomatología.
- 2.
Resolver las lesiones histológicas.
- 3.
Evitar complicaciones.
- 4.
Reducir la utilización de recursos sanitarios.
Para ello, deben seguirse unas recomendaciones avaladas por la ESPGHAN y NASPGAN4. Los 3 escalones del tratamiento son:
- 1.
Medidas higiénico-dietéticas:
- –
Cambios en la alimentación. No parecen existir diferencias en el número de RGE entre niños alimentados con fórmula (LA) y aquellos con lactancia materna, aunque este último grupo tiene RGE más cortos34. La disminución del volumen de alimentación (aumentando el número de tomas al día) disminuye la frecuencia de RGE. Los espesantes (el más común, los cereales de arroz) han demostrado disminuir la frecuencia global de regurgitaciones y el volumen regurgitado pero no el número de RGE ni el tiempo de pH < 4 (índice de reflujo)4,35, aunque no hay un tipo de espesante que haya mostrado superioridad35. Las fórmulas comerciales antirregurgitación que contienen espesantes han demostrado los mismos beneficios con la ventaja de tener una densidad energética más apropiada que el espesante en sí. Ambos siguen teniendo una eficacia controvertida en la actualidad; se indicarían sobre todo en niños con irritabilidad, pérdida de peso o trastornos del sueño con ERGE demostrado, aunque su uso en monoterapia no es recomendable en niños con ERGE grave. En prematuros, la alimentación con sonda transpilórica está indicado cuando hay apneas resistentes a cafeína y evidencia clínica de ERGE aunque no es un tratamiento de primera línea36. En ellos, la primera medida sería el cambio de método de alimentación, de bolo a continuo o viceversa; alterar frecuencia de tomas para disminuir el volumen por cada toma y retirar la sonda nasogástrica entre comidas37. En niños con alergia a proteínas de leche de vaca diagnosticada, el reflujo mejora con las fórmulas hidrolizadas.
- –
Terapias de posicionamiento. En neonatos ingresados, la posición en decúbito prono o lateral izquierdo con monitorización, ha mostrado efectos beneficiosos disminuyendo el número de RGE ácidos38. En domicilio, solo se recomienda esta posición si el niño está despierto o por encima del año de vida por riesgo de muerte súbita asociado a la misma. En la primera hora posprandial, se colocará en decúbito derecho para favorecer el vaciamiento gástrico y posteriormente en decúbito izquierdo39. Hay controversia en la posición elevada o plana del cabecero de la cuna.
- –
Cambios de estilos de vida en niños y adolescentes. No hay evidencias científicas que aprueben o rechacen un tipo de dieta específica. Los expertos recomiendan disminuir la ingesta de cafeína, alcohol, chocolate, grasas, picantes que disminuyen la presión del EEI en adultos. La disminución de peso además mejora la sintomatología del RGE40. Algún estudio ha mostrado beneficios con dieta baja en hidratos de carbono. Se recomienda dormir de lateral izquierdo y elevar el cabecero de la cama4.
- 2.
Medidas farmacológicas:
- –
Supresores del ácido. Están considerados como tratamiento de primera línea antes que los procinéticos.
- a.
Bloqueadores de receptores de H2 de la histamina o anti-H2 (ranitidina, cimetidina, famotidina, nizatidina). Disminuyen la secreción ácida al inhibir los receptores de histamina de las células parietales del estómago. Neutralizan la acidez del material refluido aunque no disminuyen el número de episodios de RGE o su duración. La ranitidina es el fármaco más usado actualmente y el de primera línea en neonatos. A dosis de 5–10mg/kg/día, 2 veces al día, vía oral, disminuye el tiempo de pH < 4 al 44% comparado con 3 veces al día que lo hace en un 90%. Su efecto dura 6h. Su eficacia en esofagitis moderada y severa está estudiada en ensayos clínicos con cimetidina y nizatidina, aunque los expertos recomiendan extrapolar estos beneficios a la ranitidina y famotidina4. Deben usarse con precaución pues pueden aumentar el riesgo de infecciones respiratorias, disminuir el ritmo y la contractilidad cardiaca y acelerar la muerte neuronal en niños con encefalopatía hipóxico- isquémica. Su uso prolongado produce taquifilaxis tras 6 semanas de utilización. Otros efectos secundarios son la cefalea, el mareo, la alteración del ritmo intestinal, etc.
- b.
Inhibidores de la bomba de protones (IBP) (omeprazol, lanzoprazol, pantoprazol, rabeprazol, esomeprazol). Disminuyen la secreción ácida inhibiendo la bomba Na+/K+ ATPasa de la célula parietal gástrica e inhiben la acción de la gastrina, histamina y agentes muscarínicos. Los metaanálisis41 han demostrado superioridad con respecto a los anti-H2 y dentro de los IBP es el omeprazol el de mayor eficacia para la resolución de esofagitis por mayor acción, más duradera (hasta 4 días) y sin taquifilaxis. Su eficacia y la seguridad en prematuros no están demostradas y no ha demostrado superioridad frente a ranitidina en este grupo etario. Algunos estudios42 demuestran que comparado con placebo, reduce de forma significativa la acidez gástrica y el número de episodios de reflujo ácido pero no mejora los síntomas clínicos ni disminuye los reflujos medidos con impedancia. La dosis de este varía entre 0,7 y 2mg/kg/día una vez al día, con cubierta entérica, 30 min antes de la ingesta. Su uso puede prolongarse entre 6 meses y 2 años. En la actualidad, en Europa solo están aprobado el omeprazol y el esomeprazol. Ninguno está aprobado en menores de un año. Actualmente, está aumentando el número de prescripciones de IBP en niños con sospecha no confirmada de ERGE, si bien un estudio doble ciego aleatorizado y controlado con placebo no muestra mejoría de los IBP en estos casos. No están exentos de efectos secundarios como: idiosincrásicos (14%), hipergastrinemia, hipoclorhidria e hiperplasia de glándulas fúndicas. Hay estudios que asocian la hipoclorhidria con el aumento de riesgo de neumonía, enterocolitis necrotizante en prematuros, gastroenteritis (por alteración de la flora) y candidemia en niños.
- c.
Procinéticos. Actúan aumentando la peristalsis esofágica y acelerando el vaciamiento gástrico. Actualmente se consideran de segunda línea por sus efectos secundarios (fundamentalmente asociados a cisaprida), debiendo administrarse únicamente a pacientes sanos con RGE refractario al tratamiento antisecretor. Su uso de rutina no está justificado.
Lectura rápida
Tratamiento. Medidas higiénico-dietéticasEl primer escalón terapéutico a realizar en niños con RGE, ya sea o no sintomático, son las medidas higiénico-dietéticas. Hay evidencia científica que autoriza un ensayo terapéutico con fórmulas hidrolizadas durante 2 a 4 semanas en lactantes alimentados con fórmula artificial cuya sintomatología principal sean los vómitos (grado de evidencia B). Los espesantes de fórmulas han demostrado disminuir clínicamente las regurgitaciones. La mejor posición para disminuir los episodios de reflujo es el decúbito prono y lateral pero dado que esta posición se relaciona con síndrome de muerte súbita del lactante, no está indicada en niños menores de un año (salvo ingreso con monitorización), siendo el decúbito supino la recomendada. En niños mayores y adolescentes no hay evidencia científica de unas restricciones dietéticas extensas recomendándose para dormir una posición elevada de la cabeza y sobre el lado izquierdo.
- d.
Cisaprida. Es un agente serotoninérgico mixto que facilita la liberación de acetilcolina en la sinapsis del plexo mientérico. Como procinético, ha demostrado ser el más eficaz pero actualmente su uso está restringido por 2 razones. La primera se debe a los efectos secundarios, especialmente de arritmias por su capacidad para alargar el QT, quedando restringido su uso a pacientes con ERGE complicado, sin riesgo de arritmias, ingresados y que no responden a otros tratamientos. La segunda se debe a su efectividad limitada publicada en una revisión Cochrane de 200343 en la que, aunque reduce estadísticamente los parámetros pH-métricos, no mejora significativamente los síntomas clínicos del RGE.
- e.
Domperidona y metoclopramida. Son antidopaminérgicos que aumentan el tono del EEI y facilitan el vaciamiento gástrico. En ambos, su eficacia está controvertida y su seguridad limitada por los efectos secundarios (signos extrapiramidales), mayor en el caso de la metoclopramida. Este último ha sido revisado en 2004 por la Cochrane44, mostrando una reducción de los síntomas diarios y del IR pero sin afectar al resto de los parámetros pH-métricos y con efectos secundarios.
- f.
Eritromicina. Es un macrólido que acelera la motilidad antral sin efecto en la peristalsis esofágica. Se usa en pacientes con gastroparesia a dosis de 3–5mg/kg/dosis en 3 dosis.
- g.
Betanecol. Aumenta el tono del EEI y la velocidad de peristalsis esofágica gracias a su acción colinérgica muscarínica. Pero también de forma secundaria a esta, aumenta las secreciones salivares y bronquiales con riesgo de broncoespasmo, sobre todo en lactantes pequeños. Se ha comprobado su efectividad clínica (disminución de vómitos) y pH-métrica en niños con afectación neurológica con ERGE a 0,7mg/kg/día, en 3 dosis, 30 min antes de las tomas.
- h.
Baclofeno. Es un agonista del receptor GABA-B que inhibe las relajaciones transitorias del EEI y acelera el vaciamiento gástrico en niños. Tiene efectos secundarios como dispepsia, vértigo y somnolencia.
- a.
- –
Otros:
- a)
Antiácidos. Neutralizan la acidez gástrica, depuran la acidez esofágica y mejoran la presión del EEI, disminuyendo los síntomas de pirosis y dolor retroesternal, aliviando la esofagitis y previniendo los síntomas respiratorios desencadenados por el ácido. El hidróxido de magnesio y el de aluminio a dosis altas son tan efectivos como la cimetidina y su combinación con ácido algínico protege la mucosa esofágica eficazmente. En combinación con domperidona, administrados 30 min antes de las tomas a 0,5–10 cc/kg/dosis, parecen disminuir los síntomas clínicos y mejorar los parámetros pH-métricos. Sin embargo, por sus posibles efectos secundarios solo se usarían en periodos cortos, y en líneas generales no se recomiendan para ERGE4.
- b)
Agentes de barrera: sucralfato. Estimula la formación de prostaglandinas en la mucosa gástrica con acción citoprotectora. Es útil en el reflujo alcalino duodenogástrico a 0,7–3mg/dosis/día, aunque no está exento de riesgos (bezoar, intoxicación por aluminio). No se recomiendan como tratamiento único en el RGE4.
- a)
- –
- 4.
Tratamiento quirúrgico. Está indicado en pacientes con ERGE confirmado (y excluyéndose previamente otras causas de reflujo), con inadecuado control al tratamiento médico o dependencia de un tratamiento permanente, complicaciones del ERGE (manifestaciones respiratorias graves, esófago de Barret, estenosis péptica) y en pacientes con retraso mental grave. Los objetivos son los mismos que el tratamiento médico.
La técnica más empleada actualmente es la funduplicatura de Nissen. En las últimas décadas la técnica laparoscópica ha remplazado a la cirugía abierta por su menor morbilidad y estancia hospitalaria aunque el porcentaje de fallo en esta primera es mayor. Otros métodos endoscópicos de tratamiento endoluminal que se están empezando a desarrollar son la gastroplastia endoluminal, la radiofrecuencia, la inyección de polímeros y las prótesis expandibles de hidrogel.
El tratamiento quirúrgico no está exento de efectos secundarios, como la dificultad para vomitar y eructar, síndrome gasbloat, dumping, disfagia y otras complicaciones derivados de la cirugía como dehiscencia de la funduplicatura, perforación esofágica o laceraciones esofágicas y esplénicas45,46. Los pacientes con afección neurológica tienen más del doble de riesgo de complicaciones, 3 veces más morbilidad perioperatoria y 4 veces más riesgo de reoperación. Otra población de riesgo de fallo quirúrgico son los pacientes con alteración de la motilidad esofágica o acalasia.
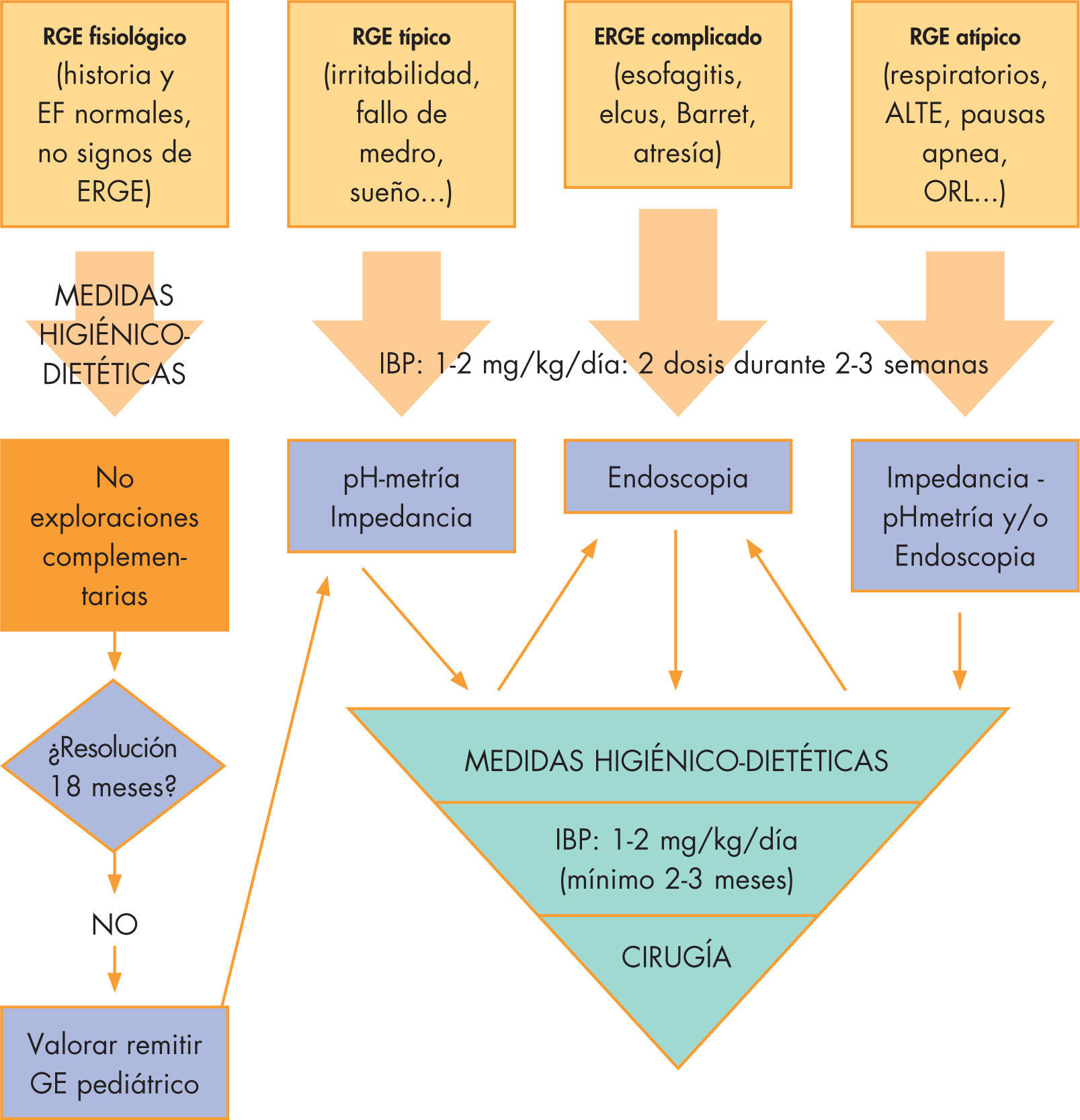
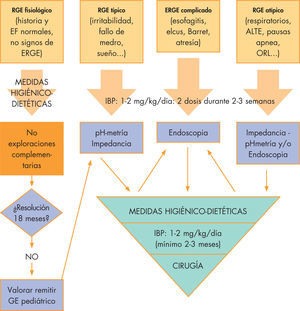
Manejo prácticoUna vez explicados los diferentes métodos diagnósticos y terapéuticos del RGE, se exponen en la figura 1 y en la tabla 4 un esque
Lectura rápida
En cuanto al manejo farmacológico, los inhibidores de la bomba de protones han demostrado ser superiores a los antagonistas de la histamina, y a su vez, superiores a los procinéticos, actualmente relegados a un segundo escalón dado sus efectos secundarios. Actualmente, no está justificado el uso rutinario de fármacos como metoclopramida, eritromicina, betanecol o domperidona para el tratamiento del ERGE. Otros tratamientos, como los antiácidos, alginatos o sucralfato, no están recomendados al haber alternativas disponibles más efectivas como los supresores del ácido.
Manejo práctico de la enfermedad por reflujo gastroesofágico. Basado en recomendaciones del Grupo de Trabajo ESPGHAN. ALTE: episodios aparentemente letales; EF: exploración física; GE: gastroenterólogo infantil; IBP: inhibidores de la bomba de protones; ORL: síntomas otorrinolaringológicos; RGE: reflujo gastroesofágico.
Manejo según el tipo de paciente4
| Tipo de paciente | Manejo práctico |
| 1. Vomitador recurrente | Realizar DXD de otras causas de vómitos (tabla 2) con pruebas de laboratorio y radiológicas |
| Vomitador feliz | Se diagnostica con HC y EF. No requiere pruebas complementarias (excepto si signos de alarma o persistencia más de 18 meses). Se maneja con medidas higiénico-dietéticas |
| Fallo de medro y regurgitador habitual | Realizar encuesta dietética a los padres. Educación nutricional. Descartar otras causas: analítica general, anticuerpos celiaquía y tránsito (tabla 2). Cambio de fórmula (hidrolizado de proteína de leche de vaca durante 2–4 semanas). Si fracaso: ingreso ± alimentación con sonda nasogástrica o nasoyeyunal |
| Niño irritable | Solo si se sospecha ERGE o si no se encuentra otra explicación: pH-metría ± impedancia y 2 semanas de tratamiento empírico con antisecretores. No recomendado IBP de forma rutinaria |
| RGE persistente > 18 meses | Está indicado realizar pruebas complementarias: endoscopia, pH-metría, impedanciometría, tránsito baritado |
| 2. Dolor torácico | Tras HC y EF: medidas higiénico-dietéticas e IBP durante 2–4 semanas. Si no mejora, derivar al GI. Si mejora: mantener IBP 8–12 semanas y si recae al retirarlos, derivar al GI |
| 3. Esofagitis | IBP durante 3 meses (si en 4 semanas no mejora: aumentar la dosis). Seguimiento clínico. Endoscopia de control solo si: síntomas atípicos, persistente o esofagitis de alto grado. Si persistente: IBP prolongado o cirugía |
| 4. Esófago de Barret | Es importante diagnosticarlo. Antes de biopsiar, tratar con IBP 12 semanas para visualizar mejor los puntos de referencia. Si no hay displasia, realizar seguimiento endoscópico cada 3–5 años hasta los 20 años y tratar igual que esofagitis con altas dosis IBP |
| 5. Disfagia/odinofagiaa y rechazo alimentob | No se ha establecido la relación con el RGE por lo que no se recomienda IBP si no hay otra causa que sugiera RGE. Realizar DXD con otras causas de esofagitisa (endoscopia) y con acalasiab (tránsito superior) |
| 6. Apnea, EAL | El RGE no es la causa más frecuente. El mejor método para demostrar asociación con RGE es la combinación pH/MII. El tratamiento con medidas dietéticas y posturales (prono con monitorización). Si fracasa y persisten los síntomas se recomienda cirugía. El tratamiento farmacológico no es eficaz |
| 7. Asma mal controlada | Si asma nocturna, dependencia a corticoides, asma mal controlada y síntomas de RGE (dolor torácico o regurgitaciones): tratar con IBP. Si es de predominio nocturno, sin otros síntomas de RGE: realizar pH/MII para diagnosticarlo, si se confirma tratar con IBP |
| 8. Neumonías recurrentes | Ni pH o pH/MII puede definir una relación causal con RGE. Se ha estudiado la concentración elevada de pepsina elevada en LBA y gammagrafía. Si es un paciente de alto riesgo, recomiendan cirugía. Si bajo riesgo: IBP, prueba SNG o SNY |
| 9. Síntomas ORL | Faltan estudios controlados para establecer relación con ERGE y la mejoría de los síntomas (laringitis, granulomas, otitis medias) con IBP o cirugía |
| 10. Erosiones dentales | Hay estudios que correlacionan ERGE con erosiones del esmalte dental, pero la indicación tratamiento en estos casos es incierto |
| 11. Sandifer | Poco común pero específico de ERGE. Es un mecanismo vagal a la exposición ácida del esófago. Se resuelve tratando el RGE |
| Grupos de riesgo de ERGE grave y crónico | |
| Neurológicos (PCI, Cornelia de Lange, Down | ERGE multifactorial y de difícil DXD. Tratamiento: medidas higiénico-dietéticas + IBP o baclofeno ± dieta elemental. Cirugía de alto riesgo (solo en complicaciones respiratorias) |
| Obesidad | Aumenta el riesgo de ERGE, Barret y adenocarcinoma esófago |
| Acalasia/alteración motilidad esofágica | Riesgo aumentado de ERGE, esofagitis, Barret tras dilataciones neumáticas o miotomía. Precisan seguimiento endoscópico y tratamiento con IBP ± cirugía (riesgo de recidiva) |
| Neumopatía crónica | En FQ: ERGE de diagnóstico tardío y con riesgo de esofagitis y adenocarcinoma. En DBP: relación con ERGE no clara |
| Transplante pulmonar | Asocian ERGE complicado por disfunción motora esofagogástrica que contribuye al desarrollo de bronquiolitis obliterante |
| Prematuros | Es diagnosticado y tratado frecuentemente, aunque falta una definición clínica, test diagnósticos válidos y evidencia del tratamiento |
DBP: displasia broncopulmonar; DXD: diagnóstico diferencial; EAL: episodios aparentemente letales; EF: exploración física; ERGE: enfermedad por reflujo gastroesofágico; FQ: fibrosis quística; GI: gastroenterólogo infantil; HC: historia clínica; IBP: inhibidores de la bomba de protones; LBA: lavado broncoalveolar; ORL: otorrinolaringológicos; PCI: parálisis cerebral infantil; pH/MII: pH-metría + impedanciometría; SNG: sonda nasogástrica; SNY: sonda nasoyeyunal.
El RGE es un proceso fisiológico que ocurre en pacientes sanos con resolución espontánea habitual a partir de los 18 meses. Sus manifestaciones clínicas pueden llegar a suponer el 50% de la enfermedad pediátrica. Es labor del clínico diferenciar a aquellos niños con vómitos e irritabilidad sin otra sintomatología asociada (regurgitador feliz), de los que padezcan signos de alarma o complicaciones (ERGE) y requieran un manejo diagnóstico-terapéutico adecuado. La técnica que mejor correlaciona los síntomas con el RGE es la combinación de pH-metría e impedanciometría. En el caso de ERGE complicada o síntomas atípicos, está indicada la endoscopia para descartar esofagitis y esófago de Barret. Si el paciente no tuviera otra sintomatología más que los vómitos o la irritabilidad, el seguimiento clínico y los consejos generales y dietéticos son suficientes. Sin embargo, si este problema persistiera más de 12 a 18 meses, o se asociara a otros síntomas o complicaciones, está indicado el tratamiento antirreflujo, fundamentalmente con inhibidores de la bomba de protones. Solo los pacientes con mal control terapéutico con fármacos o complicaciones graves del ERGE precisarán tratamiento quirúrgico. El manejo del paciente debe adaptarse a las condiciones fisiopatológicas de cada paciente y a las recomendaciones de la bibliografía reciente.