Puntos clave
La criptorquidia es una condición frecuente en pediatría. Afecta a un 3% de los recién nacidos a término y a un 1% de los niños de un año.
Se incluye actualmente dentro del llamado síndrome de disgenesia testicular, que englobaría también a hipospadias, infertilidad y cáncer testicular, y cuyo origen común se pondría de manifiesto por una alteración del desarrollo prenatal en la diferenciación de las células de Leydig, Sertoli y germinales1,2.
El objetivo de estudiar y tratar la criptorquidia es impedir sus potenciales secuelas a largo plazo, como son el cáncer y la infertilidad3. En muchos casos, la diversidad de definiciones encontradas en la literatura médica, así como las debatidas cuestiones acerca de su manejo, han dificultado y dificultan estudios homogéneos que permitan llegar a conclusiones prácticas. Este trabajo pretende realizar una revisión de los conocimientos actuales, las líneas de investigación y las últimas recomendaciones en cuanto a actuaciones, tratamiento y seguimiento.
Clasificación y nuevos conceptosTérminos tales como testículos no descendidos, testículos retráctiles, criptorquidia o mal descenso testicular han sido y son utilizados para designar la ausencia de uno o ambos testículos de la bolsa escrotal1. Un término adecuado que engloba a todos es escroto vacío, que es probablemente la mejor expresión del signo.
Se han descrito varias clasificaciones; la más aceptada es la que los divide en palpables y no palpables1,4.
Los palpables pueden ser retráctiles, no descendidos o ectópicos:
- —
Los retráctiles son aquellos que se encuentran fuera del escroto, pero que con algunas maniobras se consiguen descender hasta la bolsa escrotal. Al cesar dichas maniobras, vuelven a la situación previa.
- —
Los testículos no descendidos se encuentran permanentemente fuera de la bolsa escrotal y se encuentran localizados en un punto dentro de la trayectoria normal de descenso.
- —
Los ectópicos se sitúan fuera de la trayectoria normal, generalmente, en un lugar adyacente (crural, perineal, prepenil o en cavidad escrotal contralateral).
- —
Testículos no descendidos de forma iatrogénica son aquellos descendidos previamente que, tras cirugía sobre el área inguinal, quedan atrapados en una cicatriz del tejido cefálico adyacente al escroto.
Los testículos no palpables pueden ser intraabdominales (criptorquidia verdadera) o incluso estar ausentes (monorquia o anorquia). Actualmente se habla también de:
- —
Testículos en ascensor, como aquellos que ascienden intermitentemente debido a un aumento del reflejo cremastérico, pero descienden de manera espontánea o con maniobras físicas. No son subsidiarios de tratamiento y sólo requieren seguimiento posterior5.
- —
Testículos no descendidos de forma adquirida (testículos ascendidos): son difíciles de diferenciar de los testículos retráctiles. Parece que en el primer caso se trataría de testículos descendidos en el escroto durante el primer año de vida que posteriormente reascienden. Durante el crecimiento y el desarrollo normal, se produciría un fallo en la elongación del cordón espermático, secundario a la persistencia de un remanente fibroso del proceso vaginal que actuaría contrayendo el testículo hacia arriba1. Representan entre el 1 y el 2% de los testículos retráctiles6.
Lectura rápida
La criptorquidia es una condición frecuente en pediatría. Se incluye actualmente dentro del llamado síndrome de disgenesia testicular, que englobaría también hipospadias, infertilidad y cáncer testicular, y cuyo origen común se pondría de manifiesto por una alteración del desarrollo prenatal en la diferenciación de las células de Leydig, Sertoli y germinales.
El objetivo de estudiar y tratar la criptorquidia es impedir sus potenciales secuelas a largo plazo, como son el cáncer y la infertilidad.
Clasificación y nuevos conceptosLa criptorquidia sucede cuando uno o ambos testículos fallan en su proceso de migración hacia la base del escroto. Los testículos pueden encontrarse en cualquier punto de su trayectoria normal de descenso o, por el contrario, fuera de ésta.
La prevalencia actual varía del 2,5 al 5% en los nacidos a término y hasta un 30% de los nacidos pretérmino.
La criptorquidia congénita se puede resolver de manera espontánea en un importante porcentaje de casos en los primeros meses de vida, sobre todo durante el primer mes, momento en el que se produce un pequeño aumento en la secreción de testosterona endógena. Así, los 3 meses de vida se describe una prevalencia de entre un 1 y un 1,9% y al año de vida un 1%1.
Sin embargo, los datos no parecen comparables con los resultados obtenidos de los registros de orquidopexia, que muestran una prevalencia mucho mayor6. Diversos estudios reflejan cifras de hasta un 7% en edades prepuberales. Este aumento sería causante de lo que hoy se conoce como testículos no descendidos de forma adquirida (testículos reascendidos o casos graves de testículos retráctiles)1.
Factores ambientalesCualquier factor externo que actúe sobre el feto durante el desarrollo del gubernáculum y el descenso testicular puede incrementar el riesgo de criptorquidia en individuos genéticamente susceptibles. Tales factores pueden estar en relación con el feto y su entorno, causas maternas o exposición a agentes externos (tabla 1).
Factores de riesgo de la criptorquidia
| Factores de riesgo | |||
|---|---|---|---|
| Factores ambientales | Factores genéticos | ||
| Feto | Madre | Quíirnros | Deleciones homocigotos en los genes Insl3, RxfP 2 y HOX |
| Prematuridad | Diabetes | Talatos | |
| Peso < 2.500 g | Tabaco | Herbicidas | |
| PEG | Alcohol | Pesticidas | |
| CIR | Cafeína | Aditivos | |
| Insuficiencia placentaria | |||
CIR: crecimiento intrauterino retardado; PEG: pequeño para la edad gestacional.
Existe gran evidencia en la literatura médica de cómo factores como la prematuridad, el bajo peso al nacimiento (< 2.500 g) y ser pequeño para la edad gestacional influyen en el desarrollo de la criptorquidia no sindrómica1. El crecimiento intrauterino retardado (CIUR) parece ser el factor más importante. Algunas enfermedades asociadas al CIUR incluyen la trisomía 21, las alteraciones en la impronta genética, el síndrome de Silver-Russell y los defectos en la pared abdominal, que se asocian también a criptorquidia7.
Recientemente, se ha observado también una relación directa entre valores elevados de alfafetoproteína materna, criptorquidia y CIUR7,8. La función placentaria desempeña un papel primordial en el tamaño final del feto. Recientemente, se ha descrito en 2 estudios de cohortes7,9 la posible relación entre insuficiencia placentaria y criptorquidia. Aunque no se ha demostrado que sea una causa de esta, se ha visto que una alteración en la función placentaria podría producir un descenso en los niveles de HCG y en la producción fetal de testosterona que, a su vez, influiría en el descenso testicular.
Factores maternosEstudios epidemiológicos recientes sugieren una asociación entre diabetes materna (incluida la diabetes gestacional) y el aumento del riesgo de criptorquidia. Los motivos no están claros y parece que estarían en relación con diferencias en los niveles de hormona transportadora de esteroides sexuales (SHBG) entre la madre y el feto7,10.
Algunos estudios muestran una posible asociación entre exposición al humo del tabaco7,11 y el desarrollo de criptorquidia. Otros factores implicados han sido el consumo de alcohol y cafeína7,12 durante el embarazo, aunque problemas en la metodología de los trabajos hace que los resultados no sean concluyentes.
Exposición a agentes químicosAlgunos autores han descrito una posible relación entre el desarrollo de síndrome de disgenesia testicular y la exposición a determinados agentes. Se ha postulado sobre el papel etiológico de talatos13 (constituyente de algunos plásticos). En modelos animales de experimentación y con dosis elevadas, se ha demostrado su efecto en las células de Leydig, alterando su función y afectando a la expresión del Insl3 y a la síntesis de andrógenos1.
Se conoce el papel antiandrogénico14 de otros pesticidas, herbicidas, aditivos alimentarios, etc. Sin embargo, hasta la fecha, no se ha podido demostrar que exista una relación entre la exposición en humanos y el desarrollo de criptorquidia15.
Factores genéticosEstudios familiares basados en la experimentación animal sugieren la existencia de una relación entre susceptibilidad para desarrollar criptorquidia y herencia. Sin embargo, todavía no se conocen los genes implicados7.
Las mutaciones espontáneas en ratones que podrían estar en relación con el desarrollo de criptorquidia no sindrómica en humanos incluyen alteraciones en los genes Insl3, Rxfp 2 y HOX implicados en la proliferación del gubernáculum. Sin embargo, los estudios existentes son controvertidos7,16.
Lectura rápida
Puede llegar a afectar hasta a un 9% de los recién nacidos a término y hasta a un 30% de los pretérmino. En la mayoría de los casos, la etiología es desconocida. Poco se sabe acerca de los factores prenatales que intervienen en dicho descenso, aunque existe una evidencia emergente sobre la influencia endocrina y genética. Existe cada vez mayor evidencia de factores ambientales.
Criptorquidia como parte de otra enfermedadLa criptorquidia puede ocurrir como una alteración aislada en niños sanos o formando parte de otras enfermedades endocrinas, genéticas, diversos síndromes u otras anormalidades morfológicas.
Diagnostico. Estudios complementariosLa exploración física sigue siendo el patrón de oro del diagnóstico. Se precisan estudios complementarios (hormonales y/o pruebas de imagen) en determinadas situaciones (testículos criptorquídicos bilaterales, impalpables o en sospecha de trastorno de la diferenciación sexual).
La criptorquidia puede ocurrir como una alteración aislada en niños sanos o, por el contrario, la podemos encontrar formando parte de otras enfermedades endocrinas, genéticas, diversos síndromes u otras anormalidades morfológicas1.
El descenso testicular normal requiere un eje hipotálamo-hipofisario-testículo íntegro. Así, diversas malformaciones del sistema nervioso central o el hipogonadismo hipogonotrópico congénito pueden asociarse a criptorquidia.
Se asocia también a alteraciones en la diferenciación sexual (TDS), que deberán investigarse en su caso1,6. Por ejemplo, en caso de criptorquidia bilateral con fenotipo masculino habrá que descartar hiperplasia suprarrenal congénita, estados de hiperandrogenismo materno y deficiencia de aromatasa placentaria.
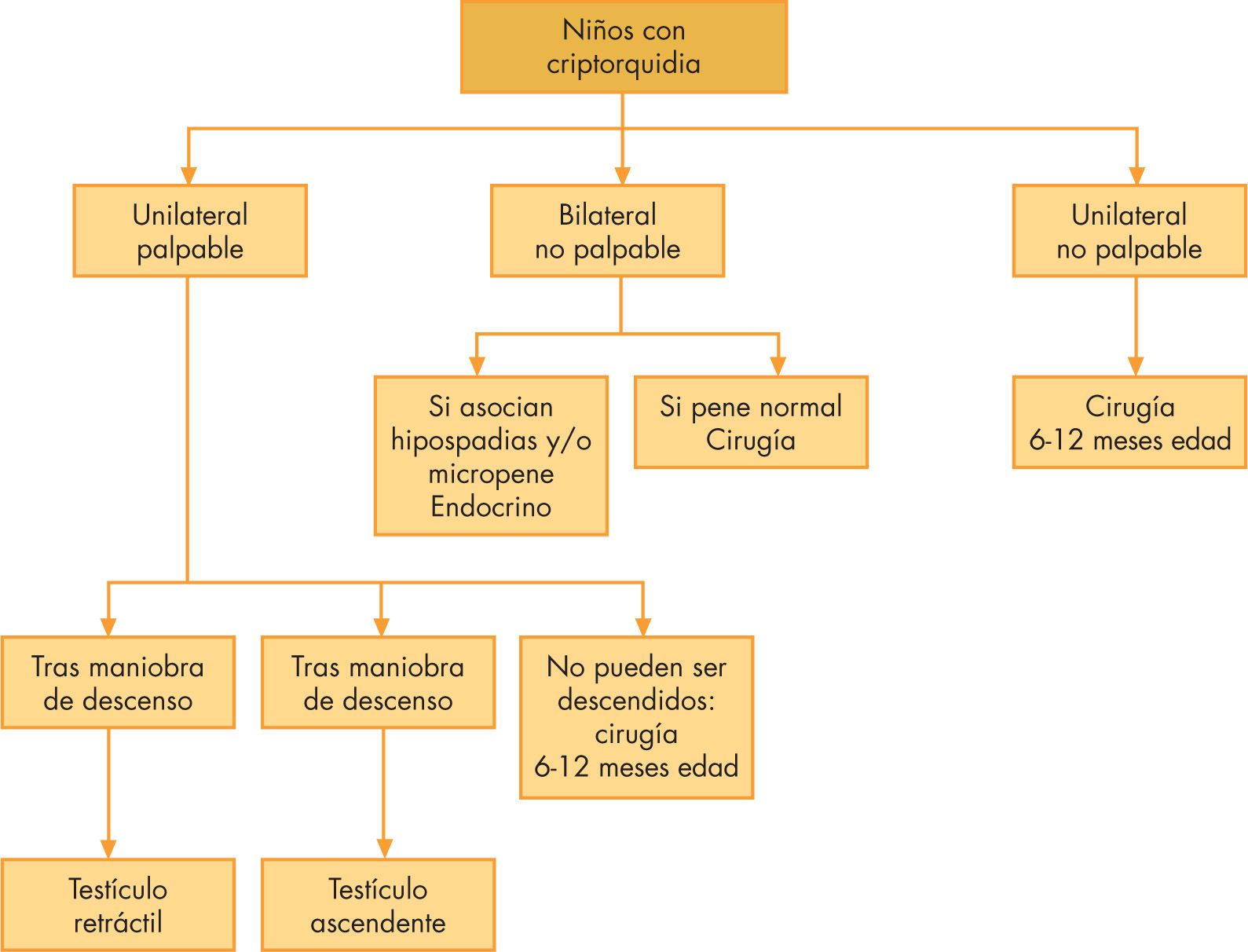
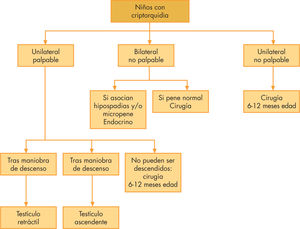
Diagnóstico: estudios complementariosAunque el diagnóstico certero de escroto vacío precisa la actuación de un examinador experimentado, hay un pequeño porcentaje de casos en se requieren otros exámenes. Se trata de los pacientes que asocian criptorquidia con escroto bífido y/o hipospadias, criptorquidia bilateral, y en los que durante el tratamiento quirúrgico se objetivan alteraciones anatómicas, pues pueden tratarse de formas de TDS, por lo que se precisa realizar los estudios genéticos y endocrinos adecuados6,17 (fig. 1).
Estudios hormonalesHay un gran debate acerca de los estudios que se deben realizar en pacientes con testículos impalpables. Mientras que algunos continúan defendiendo el papel de la exploración inguinal, otros demuestran que en una importante proporción de casos en que, aparentemente, se encuentran ausentes pueden identificarse por laparoscopia. En estos casos, podría ser útil la estimulación con HCG y valorar la respuesta de la testosterona17,18.
Una revisión retrospectiva que evalúa el valor relativo del estímulo con HCG en casos de criptorquidia bilateral, demostró un valor predictivo positivo máximo del 89% y negativo del 100%17,19 y es, por tanto, ciertamente predictivo de anorquia. Una respuesta positiva a la prueba sería sugestiva de la presencia de testículos de tamaño suficiente como para ser susceptibles de orquidopexia y de la presencia de células de Leydig. Algunos testículos criptorquídicos presentan exclusivamente células de Sertoli y, por tanto, no producirán testosterona tras la HCG. En estos casos, algunos autores defienden la medición de los valores de hormona antimuleriana (HAM), un marcador más sensible de la existencia de tejido testicular17,20.
Pruebas de imagenIncluyen la ecografía, la resonancia magnética (RM) y la angiorresonancia17 y están indicadas sobre todo en casos de testículos impalpables, aunque existen todavía controversias acerca de su beneficio sobre la exploración física. Relacionando la ecografía con la laparoscopia, algunos estudios muestran una disminución en el número de laparoscopias exploradoras17,20, y otros la incapacidad de aquélla para localizar e identificar correctamente los testículos17,21. Sin embargo, en la actualidad existe unanimidad en que ante un testículo no palpable o en el paciente obeso se realice una exploración ecográfica, ya que no es invasiva y tiene una sensibilidad del 76% y una especificidad del 100% en la localización testicular6,17.
No se han demostrado diferencias en el uso de la RM respecto de la ecografía para la localización testicular17,22.
La angiorresonancia, sin embargo, es susceptible de localizar tanto el tejido testicular como los vasos pampiniformes, proporcionando así información anatómica y funcional. En un estudio, esta técnica demostró una sensibilidad del 96% y una especificidad del 100%. Estos resultados permitirían evitar la laparoscopia exploradora en un 78% de los casos17,23.
La angiorresonancia se propone pues como la prueba complementaria de elección en los pacientes que la ecografía preoperatoria no es capaz de localizar tejido testicular. Sin embargo, la falta de disponibilidad en algunos centros hace que muchos autores sigan proponiendo la laparoscopia como técnica de elección.
Lectura rápida
Aunque, clásicamente, el tratamiento con gonadotropina coriónica humana (HCG) podía lograr hasta un 25% de los descensos testiculares, estudios recientes han mostrado posibles efectos deletéreos sobre el testículo. Esto, junto a su escasa eficacia, ha hecho que no se pueda recomendar de manera sistemática.
Tratamiento quirúrgico y pronósticoEl tratamiento quirúrgico continúa siendo de elección. Se recomienda la corrección de forma temprana en torno a los 6-12 meses de edad, con el fin de prevenir sus potenciales secuelas: cáncer e infertilidad. Es importante el seguimiento posterior de estos pacientes.
Los metaanálisis sobre el tratamiento con HGC y factor liberador de gonadotropinas (LHRH-a) en la criptorquidia han revelado un descenso en el 20-25% de los casos y ésta ha sido, hasta la fecha, la justificación para su uso24–26.
Sin embargo, estudios recientes han mostrado los posibles efectos deletéreos sobre el testículo. Teniendo en cuenta la escasa eficacia y los efectos adversos del tratamiento hormonal, no se puede recomendar de manera sistemática, y es necesario individualizar los casos18.
Estudios experimentales en roedores han demostrado que dosis elevadas de HCG producen cambios inflamatorios y otras alteraciones morfológicas en el testículo, que podrían ser causantes de daños permanentes27,28.
Publicaciones recientes muestran que los testículos de los pacientes que han recibido tratamiento con HCG experimentan un aumento de la apoptosis de las células germinales en comparación con los que habían recibido tratamiento quirúrgico. Es más, en el seguimiento posterior de estos niños hasta la edad adulta, se comprobó que el volumen testicular de los que habían recibido tratamiento con HCG fue un 50% menor29.
Indicaciones de tratamiento quirúrgicoA continuación, presentamos diversas posibilidades que determinan, al final, un tratamiento quirúrgico:
- —
Testículos no descendidos palpables: el tratamiento quirúrgico recomendado hoy día es la orquidopexia4.
- —
Criptorquidia unilateral no palpable: cuando los testículos son impalpables, se recomienda la realización de una laparoscopia exploradora para determinar el abordaje y la actuación quirúrgica más apropiados. Si los vasos se encuentran en el canal inguinal, se realizará un abordaje inguinal para localizar los testículos o el remanente testicular. Si se encuentra un testículo viable se realizará orquidopexia. En el caso del remanente testicular, se realizará extirpación de éste.
Si, por el contrario, los vasos desaparecen antes del anillo interno, se encuentran ausentes o terminan en fondo de saco, no es necesario continuar con exploración quirúrgica4,30,31.
- —
Criptorquidia bilateral no palpable: se realiza la puebla de estimulación con HCG o en los centros donde se encuentre disponible, determinación de los valores de HAM4,17. Posteriormente, se realizará una laparoscopia adoptando una actitud similar a los casos unilaterales. Los pacientes, en los que los hallazgos laparoscópicos muestren tejido testicular probablemente no funcionante, serán derivados a la unidad de endocrinología, para una evaluación y tratamiento puberal adecuado.
Existen diferencias importantes acerca de la relación beneficio/daño de la realización de biopsia testicular. Para algunos autores ésta incrementa el riesgo de alterar aún más la función de un testículo en el que quizá se encuentre ya comprometida. Datos actuales, sin embargo, muestran que la biopsia puede predecir la calidad del semen e identificar los cambios neoplásicos sin causar daño. En el seguimiento posterior de varones adultos no se ha detectado un aumento del riesgo de microlitiasis testicular ni otros datos sugestivos de daño testicular32,33. En todo caso, su realización se ha de individualizar.
PronósticoNos referimos a los dos temas sobre los que recae el objetivo de realizar el descenso quirúrgico del testículo: la fertilidad y el riesgo de neoplasia.
Repercusión sobre la fertilidadEstá en relación, sobre todo, con la edad en la que se lleva a cabo el tratamiento quirúrgico. Hoy día se propugna que debe realizarse durante el segundo semestre de vida4. El objetivo es preservar la maduración de la célula germinal. Entre los 3 y 12 meses de edad y, probablemente, como consecuencia del proceso ya conocido como “minipubertad”, el gonocito neonatal se transforma en una espermatogonia tipo A. Este paso, que resulta fundamental para asegurar la posterior fertilidad, se encuentra bloqueado en los testículos no descendidos, de ahí que la orquidopexia sea recomendada en la mayoría de los centros entre los 6 y 12 meses de edad4,34.
En el momento del nacimiento, los pacientes con criptorquidia albergan células germinales en los testículos; sin embargo, estas desaparecerán en torno a los 15 meses de edad. Así, cuanto más tarde se realice la cirugía, mayor será el riesgo de no encontrar células germinales. En la criptorquidia el número medio de espermatogonias y gonocitos hallados en la sección del túbulo, y en relación con los valores específicos según percentil de edad, muestran una correlación positiva con la cantidad de espermatozoides en el varón adulto29,35,36.
Cáncer testicularEl riesgo relativo de desarrollar cáncer testicular en los pacientes criptorquídicos es, aproximadamente, 5 veces mayor que en la población general3. Un metaanálisis reciente de 21 estudios de casos y controles sobre la epidemiología de los tumores de células germinales muestra un aumento del riesgo de cáncer en pacientes criptorquídicos entre un 3,5 y un 17,1 mayor que en los grupos control37.
Se estima que, aproximadamente, el 10% de todos los cánceres testiculares se encuentran asociados a criptorquidia.
Diversos estudios muestran que si el tratamiento quirúrgico se lleva a cabo antes de los 10 años de edad, este riesgo se iguala al de la población general3,38.
ConclusionesLa criptorquidia unilateral detectada en el período neonatal será derivada al cirujano o urólogo pediátrico si los testículos no han descendido de forma espontánea a la edad de 5-6 meses.
En caso de criptorquidia bilateral o genitales ambiguos, el paciente será inmediatamente derivado a endocrinología pediátrica.
Cuando se confirma el diagnóstico, la cirugía debe realizarse entre los 6 y los 12 meses de edad, y no más allá de los 18 meses.
Es preciso un seguimiento clínico e incluso ecográfico un año después de la cirugía.
En caso de criptorquidia bilateral, se recomienda además otra valoración en el período prepuberal. En los casos no intervenidos quirúrgicamente, deberá realizarse un seguimiento más estrecho durante los 3, 5, 7 y 10 años de edad para confirmar el diagnóstico de testículos ascendentes. Los niños que muestren un descenso espontáneo deberán ser valorados más frecuentemente, debido al elevado riesgo de reascenso. En el momento que se diagnostiquen de testículos retráctiles, deberán ser intervenidos quirúrgicamente.