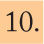El coma es un estado de disminución del grado de conciencia que condiciona una incapacidad de respuesta a estímulos externos y necesidades internas. El coma debe considerarse como un síntoma que acompaña a muchas situaciones clínicas, y no como una enfermedad. se definen diversos términos como somnolencia, letargia o estupor para describir diferentes grados de profundidad del coma, aunque resultan muy subjetivos, por lo que se utilizan cada vez con menos frecuencia. La descripción cuidadosa del estado clínico y su respuesta frente a diversos estímulos constituye la forma idónea de caracterizar los trastornos de la conciencia y el coma. La evaluación neurológica de un niño en coma tiene como objetivo identificar la causa, localizar la lesión y aplicar las medidas terapéuticas adecuadas1–3.
El estado de vigilia se mantiene por un sistema neuronal situado en la parte superior del troncoencéfalo y el tálamo, el sistema reticular ascendente activador, y sus conexiones con los hemisferios cerebrales. El resultado de una disminución de la actividad neuronal de los hemisferios o del sistema reticular ascendente activador provoca una alteración del grado de conciencia4–6.
Puntos clave
La corteza cerebral y la formación reticular son las estructuras principales implicadas en el mantenimiento del grado de conciencia. su correcto funcionamiento depende de una presión de perfusión suficiente para satisfacer las demandas energéticas cerebrales.
La sustancia reticular ascendente (sRA) es un conjunto de neuronas agrupadas en fascículos, que ascienden y descienden a lo largo del tronco del encéfalo hasta el diencéfalo y desde allí proyectan conexiones con la corteza cerebral (área motora, área sensorial y zonas de integración).
El daño de las neuronas implicadas en la SRA y/o el córtex cerebral causará una alteración de gravedad variable en el grado de conciencia.
- —
Daño de ambas estructuras por afectación cerebral difusa.
- —
Lesión del sistema nervioso central (SNC) infratentorial. Daño directo por compresión o destrucción de la sRA. origina directamente un estado comatoso.
- —
Lesión del SNC supratentorial. inicialmente provoca disminución del grado de conciencia. A medida que progresa la lesión, se favorece el desarrollo de herniación cerebral que daña el troncoencéfalo (y, por tanto, la SRA) y produce el coma. De esta forma, las lesiones hemisféricas localizadas pueden producir focalidad neurológica, pero no provocan disminución del grado de conciencia, a menos que afecten de forma difusa a ambos hemisferios cerebrales o distorsionen o desplacen las estructuras troncoencefálicas.
La hipoxia y el edema cerebral de causa diversa son el mecanismo fisiopatológico principal del coma en el paciente pediátrico1–7.
Lectura rápida
El coma es la expresión máxima de la disminución del grado de conciencia. Condiciona una incapacidad de respuesta a estímulos externos y necesidades internas. Debe considerarse como un síntoma que acompaña a diversas situaciones clínicas, y no como una enfermedad.
FisiopatologíaLa corteza cerebral y la formación reticular son las estructuras principales implicadas en el mantenimiento del grado de conciencia. El daño en sus neuronas causará una alteración de gravedad variable. Su correcto funcionamiento depende de una presión de perfusión suficiente para satisfacer las demandas energéticas cerebrales.
Las causas más frecuentes de coma en el niño son las infecciones del SNC, las infecciones sistémicas graves, el traumatismo craneoencefálico (TCE), la hipoglucemia, las intoxicaciones, las crisis comiciales y los estados poscríticos (tabla 1).
Etiología del coma
| Etiología del coma estructural en el niño |
|---|
| Traumatismo craneoencefálico: puede causar diversas alteraciones, como conmoción encefálica, hematoma epidural, hematoma subdural, hematoma parenquimatoso, hematoma intraventricular, hemorragia subaracnoidea, lesión axonal difusa |
| Infecciones del SNC: absceso, empiema: bacteriano, fúngico, parásitos (sin meningoencefalitis) |
Tumores del SNC:
|
Alteración vascular del SNC:
|
| Otros: hidrocefalia, seudotumor cerebri, migraña basilar |
| Etiología del coma metabólico en el niño |
|---|
| Encefalopatía hipoxicoisquémica |
| Intoxicaciones exógenas: narcóticos (morfina), hipnóticos, sedantes (benzodiacepinas); anticolinérgicos (antihistamínicos, fenotiacinas, atropínicos); etanol; monóxido de carbono; cianuro; insecticidas organofosforados; metales pesados (plomo, mercurio) |
Alteraciones medio interno cerebrales
|
Infecciones:
|
Trastornos epilépticos:
|
SNC: sistema nervioso central.
En el período neonatal destaca la encefalopatía hipoxoisquémica. En el lactante y el niño pequeño, predominan las infecciones del SNC, las infecciones sistémicas graves, la hipoglucemia y las metabolopatías. En niños mayores y adolescentes destaca el coma traumático y las intoxicaciones. En todos los grupos de edad hay que tener en cuenta la posibilidad de estado convulsivo, intoxicación y accidente cerebrovascular.
Coma de origen estructuralPredomina en niños mayores. Con frecuencia presenta una instauración rápida, brusca. se acompaña de focalidad neurológica y asimetría.
Las causas estructurales más frecuentes son: TCE, infección del SNC, hemorragia intracraneal y proceso expansivo intracraneal. En la exploración física es frecuente encontrar:
- —
Afectación supratentorial: progresión rostro-caudal, obnubilación hasta llegar al coma, edema de papila, hemiparesia contralateral, desviación de la mirada conjugada, posibilidad de herniación uncal y/o transtentorial.
- —
Afectación infratentorial: coma, anomalías pupilares, desviación de la mirada desconjugada, reflejos oculocefálicos (ROC) y oculovestibulares (ROV) alterados, afectación de pares craneales y signo de Babinski bilateral.
En general, afecta a lactantes y niños pequeños. La instauración suele ser progresiva y los hallazgos clínicos, simétricos.
Se produce por interrupción del aporte de sustratos energéticos (hipoxia, hipoglucemia) o por alteración de las respuestas neurofisiológicas y el equilibrio bioeléctrico de las membranas neuronales (alteraciones iónicas, desequilibrio bioeléctrico, acumulación de sustancias endógenas y/o exógenas neurotóxicas).
Las causas metabólicas más frecuentes son: isquemia-hipoxia, hipoglucemia, hiponatremia, intoxicación exógena, insuficiencia renal e insuficiencia hepática. En la exploración física destacan: respuesta pupilar conservada (en general), movimientos oculares conjugados, ausencia de asimetrías motoras, movimientos anormales frecuentes8–10.
Lectura rápida
La hipoxia y el edema son los mecanismos etiopatogénicos más frecuentes.
Debe pensarse en un coma de causa metabólica en niños pequeños, con una alteración de conciencia de instauración progresiva, simetría, respuesta pupilar conservada, ausencia de focalidad neurológica, movimientos anormales. Las causas metabólicas más frecuentes son: hipoglucemia, intoxicación, proceso infeccioso del sistema nervioso central (SNC), crisis comicial y estado poscrítico.
Hay una serie de cuadros que requieren un diagnóstico diferencial con el coma:
- —
Hipersomnia es una exageración del sueño fisiológico durante el cual el niño duerme de forma profunda y prolongada, y le cuesta despertar.
- —
Narcolepsia es un sueño irresistible de comienzo súbito. A diferencia del coma, se puede despertar al paciente, pero vuelve a dormirse rápidamente. La duración del cuadro se extiende de horas a días. Su etiología no se conoce, aunque se ha relacionado con lesiones reticuloencefálicas. si se acompaña de cataplejía, es decir, hipotonía generalizada, se denomina síndrome de Gelineau, correspondiente a una afectación reticulohipotalámica y reticuloespinal.
- —
Mutismo aquinético es un término empleado para describir una situación de inmovilidad aparentemente con alerta, que caracteriza a estados crónicos de alteración de la conciencia con períodos de sueño y otros de aparente vigilia, en los que no se puede demostrar actividad mental. Se produce tras lesiones que afectan a la integración reticulocortical, pero que respetan las vías corticoespinales.
- —
Síndrome del cautiverio por parálisis extensas (locked-in), aparece cuando el paciente, estando consciente, no puede manifestar sus respuestas a los estímulos por parálisis de las 4 extremidades y de los pares craneales inferiores. Se produce un bloqueo total de la comunicación verbal y motriz, y la capacidad de respuesta se limita a movimientos verticales de los ojos y al parpadeo. Se presenta en lesiones destructivas de la protuberancia o bulbo y en ciertas polineuritis graves. La incomunicación puede paliarse utilizando el parpadeo.
- —
Afasia completa es la falta de capacidad para comprender y producir el lenguaje. El paciente no puede expresarse, lo cual facilita su confusión con el coma; sin embargo, no implica un estado de inconsciencia. Es importante tener en cuenta que la falta de respuesta a estímulos no es igual a una falta de conciencia. Tal es el caso, por ejemplo, del botulismo o del paciente relajado con fármacos como el pancuronio. Ciertos procesos psiquiátricos, como la histeria en adolescentes o la esquizofrenia, pueden simular estados de coma. Se pueden desenmascarar por el contexto clínico, la exploración (reflejo cócleo-ocular o corneal) y el electroencefalograma (EEG).
- —
Estado vegetativo. El paciente que presenta este cuadro no tiene conciencia de sí mismo ni de su entorno, es incapaz de recibir o transmitir información, pero presenta ciclos rítmicos diarios de vigilia y sueño. Es el resultado final de cualquier daño agudo o proceso crónico que afecte gravemente los hemisferios cerebrales. Las causas más frecuentes son los traumatismos craneales y las lesiones que se producen después de un paro cardiorrespiratorio que ha dejado sin oxigenación las estructuras cerebrales, sin llegar a producir la muerte. Puede ocurrir en la fase terminal de malformaciones graves del sNC en el recién nacido y en diversas enfermedades metabólicas del niño pequeño. En estos pacientes, a pesar de la utilización de todas las medidas terapéuticas posibles, incluida la rehabilitación, no se obtiene ninguna mejoría. se produce una pérdida de las funciones cognitivas y de relación. se han perdido las funciones superiores cerebrales, es decir, de la corteza cerebral (hemisferios cerebrales) mientras persisten total o parcialmente las funciones sujetas al control del tronco encefálico. El diagnóstico se basa en criterios clínicos. según la Academia Americana de Neurología, se requieren 7 criterios: a) ausencia de conciencia de sí mismo y del entorno e incapacidad para interactuar con otros; b) la respuesta a estímulos visuales, auditivos y dolorosos, no posee carácter reproducible, propósito o conducta voluntaria; c) ausencia total de lenguaje expresivo o comprensivo; d) estado de vigilia intermitente manifestado por la existencia de ritmo vigilia/sueño; e) preservación de actividad hipotalámica y de troncoencéfalo que permita sobrevivir con atención médica; f) incontinencia de esfínteres, y g) variable preservación de reflejos craneales y espinales (pupilas y ROC, corneal, ROV, nauseoso y espinal)11.
Lectura rápida
Se sospechará un coma de causa estructural en niños mayores, con instauración súbita, asimetría y focalidad neurológica. Destacan el traumatismo craneoencefálico, accidentes cerebrovasculares, y los procesos expansivos intracraneales. Pueden requerir intervención neuroquirúrgica urgente.
Desde el punto de vista etiológico, según la edad, se observan diferentes posibilidades. En el período neonatal, destaca la encefalopatía hipoxicoisquémica. En el lactante y el niño pequeño predominan las infecciones del SNC, las infecciones sistémicas graves, la hipoglucemia y las enfermedadades metabólicas. En niños mayores y adolescentes, aparecen con mayor frecuencia el coma traumático y las intoxicaciones. En todos los grupos de edad, hay que tener siempre en cuenta la posibilidad de intoxicación, estado convulsivo y accidente cerebrovascular.
Se han propuesto distintas escalas para cuantificar la gravedad del coma: escala de Glasgow (GCS), escala Full Outline of Unresponsiveness (FOUR), escala de Seshia I-IV, etc. La más utilizada es la GCS.
Hay escalas específicas, así como adaptaciones de escalas convencionales, para realizar la cuantificación del coma en la infancia: GCS modificada, escala de Raimondi (niños pequeños 1–36 meses), escala de Traunes, escala de Murray (niños), escala de Tatman, escala de coma para neonatos de García Alix, etc. 12–17.
Escala de Glasgow12–14 (tabla 2)Escala propuesta y validada en 1975 por Jennett y Teasdale, y diseñada originalmente para el coma de origen traumático. En 1982, Simpson y Reilly presentaron una adaptación pediátrica (menores de 2 años). Puede aplicarse en la evaluación inicial, y también de forma periódica en el seguimiento del paciente. Consta de 3 apartados: respuesta motora (M), ocular (O) y verbal (V) siendo el componente de mayor valor pronóstico el motor. El resultado final es la suma del valor máximo obtenido en cada uno de los apartados, que oscila entre un valor mínimo de 3 y máximo de 15. Debe especificarse, no obstante, la puntuación total y la correspondiente a cada uno de los apartados (M, O, V). En caso de asimetrías, se considera el lado de mejor respuesta. Si el paciente está intubado por causa neurológica, el apartado verbal se puntúa con el mínimo y se denomina Vt.
Escalas de coma
| Escala de Glasgow | |
|---|---|
| Apertura ocular | |
| Espontánea | 4 |
| Al hablarle | 3 |
| Al dolor | 2 |
| No responde | 1 |
| Respuesta verbal | |
| Orientada | 5 |
| Desorientada | 4 |
| Palabras inapropiadas | 3 |
| Sonidos incomprensibles | 2 |
| No responde | 1 |
| Respuesta motora | |
| Obedece órdenes | 6 |
| Localiza el dolor | 5 |
| Flexión-retirada ante el dolor | 4 |
| Flexión anómala ante el dolor (decorticación) | 3 |
| Extensión en respuesta al dolor (descerebración) | 2 |
| No responde | 1 |
| Escala de medida de coma para neonatos (García Alix, 1997)* | |
|---|---|
| Respuesta ocular | |
| Focaliza y sigue al menos 30o | 5 |
| Apertura ocular espontánea | 4 |
| Apertura ocular al dolor | 3 |
| Reflejos oculocefálicos intactos | 2 |
| Reflejos oculocefálicos alterados | 1 |
| Reflejos oculocefálicos ausentes, pupilas fijas | 0 |
| Respiración y vocalización | |
| Llanto de tono normal | 5 |
| Gemido o llanto débil | 4 |
| Mueca | 3 |
| Respiración espontánea | 2 |
| Respiración periódica o atáxica | 1 |
| Apnea | 0 |
| Respuesta motora | |
| Movimientos alternantes suaves | 5 |
| Movimientos débiles o perezosos | 4 |
| Retirada del miembro estimulado | 3 |
| Movimientos estereotipados ante estímulos | 2 |
| Actitud de decorticación/ descerebración | 1 |
| Flaccidez | 0 |
| Escala de Glasgow modificada para niños pequeños | |
|---|---|
| Apertura ocular | |
| Espontánea | 4 |
| Al hablarle | 3 |
| Al dolor | 2 |
| No responde | 1 |
| Respuesta verbal | 0 |
| 2–5 años | |
| Palabras y frases adecuadas | 5 |
| Palabras inadecuadas | 4 |
| Llanto y grito exagerados | 3 |
| Gruñido | 2 |
| No responde | 1 |
| Menos de 2 años | |
| Sonríe, llora | 5 |
| Llora continuamente | 4 |
| Llanto y grito exagerados | 3 |
| Gruñido | 2 |
| No responde | 1 |
| Respuesta motora | |
| Movimientos espontáneos | 6 |
| Localiza el dolor | 5 |
| Flexión-retirada ante el dolor | 4 |
| Flexión anómala ante el dolor (decorticación) | 3 |
| Extensión en respuesta al dolor (descerebración) | 2 |
| No responde | 1 |
Ante cualquier niño en coma, se realizará siempre una estabilización inicial en la que se aplicarán las medidas de soporte vital habituales (permeabilidad de la vía aérea, ventilación y oxigenación eficaz y estabilidad hemodinámica, identificación y tratamiento de signos de alarma neurológicos). Posteriormente, se realizarán las medidas generales oportunas para evitar o disminuir la lesión cerebral secundaria, consecuencia de la noxa inicial, y se evitará y corregirá de forma temprana la hipoxia y la hipotensión arterial. Se realizará un seguimiento correcto del niño (temperatura, presión arterial, frecuencia cardíaca [FC], electrocardiograma [ECG], glucemia capilar, saturación de hemoglobina, frecuencia respiratoria [FR] y la canalización de al menos 2 vías venosas periféricas de grueso calibre).
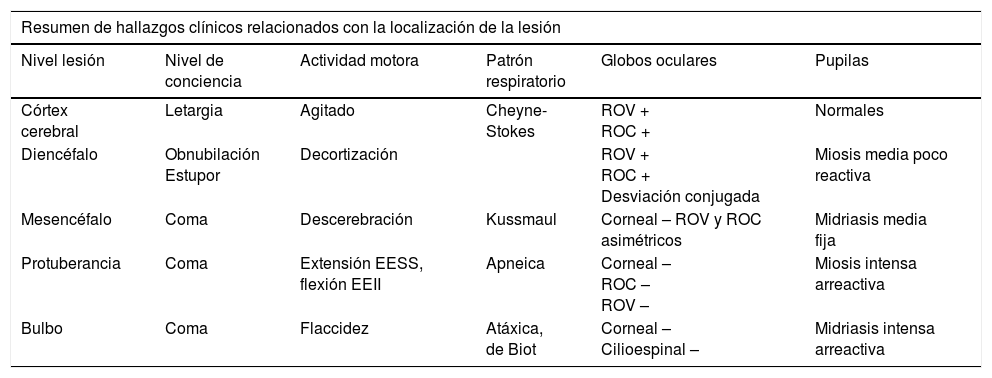
Hallazgos clínicos y localización de la lesión
| Resumen de hallazgos clínicos relacionados con la localización de la lesión | |||||
|---|---|---|---|---|---|
| Nivel lesión | Nivel de conciencia | Actividad motora | Patrón respiratorio | Globos oculares | Pupilas |
| Córtex cerebral | Letargia | Agitado | Cheyne-Stokes | ROV + ROC + | Normales |
| Diencéfalo | Obnubilación Estupor | Decortización | ROV + ROC + Desviación conjugada | Miosis media poco reactiva | |
| Mesencéfalo | Coma | Descerebración | Kussmaul | Corneal – ROV y ROC asimétricos | Midriasis media fija |
| Protuberancia | Coma | Extensión EESS, flexión EEII | Apneica | Corneal – ROC – ROV – | Miosis intensa arreactiva |
| Bulbo | Coma | Flaccidez | Atáxica, de Biot | Corneal – Cilioespinal – | Midriasis intensa arreactiva |
| Localización de la lesión y déficit motor/par craneal | |
|---|---|
| Lesión del córtex | Monoparesia |
| Lesión de la cápsula interna | Hemiparesia contralateral |
| Lesión del pedúnculo cerebral | Hemiparesia contralateral |
| Parálisis homolateral III/V | |
| Lesión de la protuberancia | Hemiparesia contralateral |
| Parálisis homolateral V, VI, VII, VIII | |
| Lesión del bulbo | Hemiparesia contralateral |
| Parálisis homolateral IX, X, XI, XII | |
| Lesión de la médula | Parálisis homolateral por debajo de la lesión |
| Localización de la lesión y patrón respiratorio | |
|---|---|
| Lesión del diencéfalo, ganglios base | Cheyne-Stokes |
| Lesión del mesencéfalo | Kussmaul, hiperventilación neurógena |
| Lesión de la protuberancia | Apnéustica |
| Lesión del bulbo | Atáxica, de Biot |
| Anomalías del tamaño pupilar | |||
|---|---|---|---|
| Bilateral | Unilateral (anisocoria) | ||
| Midriasis | Miosis | Midriasis | Miosis |
| Fisiológica | Fisiológica | Fisiológica | Fisiológica |
| Atropina | Opioides | Fármacos | Fármacos |
| Anfetaminas | Inhibidores de la colinesterasa | Lesión local | Lesión local |
| Cocaína | Migraña | Síndrome de Claude Bernard Horner | |
| Lesión del mesencéfalo | Lesión puente | ||
EEII: extremidades inferiores; EESS: extremidades superiores; ROC: reflejos oculocefálicos; ROV: reflejos oculovestibulares.
Aproximación diagnóstica
| Anamnesis |
|---|
| Características del coma |
| Enfermedad de base predisponente |
| Antecedentes familiares |
| Medicación habitual |
| Antecedentes: traumatismo, posibilidad de intoxicación, síntomas de hipertensión intracraneal, signos y síntomas de proceso infeccioso intercurrente, cirugía en días previos |
| Exploración clínica |
|---|
| Temperatura, glucemia capilar, presión arterial, frecuencia cardíaca y respiratoria, electrocardiograma, saturación de hemoglobina |
| Exploración general por aparatos y neurológica detallada |
| Signos meníngeos y de hipertensión intracraneal |
| Nivel de conciencia (escala de Glasgow) |
| Pupilas. Posición de los globos oculares. ROC/ROV/RC. Respuesta motora. Patrón respiratorio |
| Fondo de ojo |
| Exploraciones complementarias (individualizar, según la sospecha etiológica) |
|---|
| Analítica sanguínea básica: hemograma, coagulación, equilibrio ácido-base, ionograma, glucosa, fósforo, magnesio, urea, creatinina, aspartato-transferasa, alanina-transferasa, amonio, lactato, proteína C reactiva |
| Estudio microbiológico: cultivos, serologías |
| Punción lumbar: citología, bioquímica, tinción de Gram, cultivo, serologías, pterinas, aminoácidos y neurotransmisores |
| Análisis toxicológico: etanol, metales pesados, valores de paracetamol, salicilemia, etilenglicol, alcohol metílico, paraldehído, benzodiacepinas, opioides, éxtasis, cannabis, cocaína |
| Neuroimagen: ecografía transfontanelar, tomografía computarizada y/o resonancia magnética craneal |
| Electroencefalograma |
| Potenciales evocados del troncoencéfalo (sensoriales, auditivos, visuales) |
| Ecografía Doppler cerebral |
Cribado metabólico:
|
| Otras: arteriografía cerebral, carboxihemoglobina, metales pesados, hormonas tiroideas (T3, T4, hormona tirotropa), hormonas suprarrenales (hormona adrenocorticotropa, cortisol) |
RC: reflejo corneal; ROC: reflejo oculocefálicos; ROV: reflejo oculovestibular.
Sólo tras la estabilización y la reanimación inicial (ABC), se realizarán la anamnesis, la exploración clínica y las exploraciones complementarias dirigidas a identificar la causa del coma. Este interrogatorio puede realizarlo otro facultativo a la familia, mientras se realizan las maniobras comentadas1–6.
Lectura rápida
El sistema de valoración más utilizado en el coma es la escala de Glasgow. Hay una adaptación pediátrica. Consta de 3 apartados: respuesta motora (M), ocular (O) y verbal (V), y el componente de mayor valor pronóstico es el motor. El resultado final es la suma del valor máximo obtenido en cada uno de los apartados, que oscila entre un valor mínimo de 3 y máximo de 15. Es útil en la valoración inicial, en el seguimiento y tiene carácter pronóstico.
Aproximación diagnósticaEn la anamnesis, es fundamental recoger: forma de inicio del coma (brusco, progresivo), si se trata de un primer episodio o de recurrencia, síntomas acompañantes (fiebre, cefalea, vómitos, alteración del carácter), antecedentes (traumatismo, ayuno, posibilidad de ingesta de tóxicos) y la existencia de una enfermedad de base.
Se ha de interrogar sobre:
Enfermedad de basePortador de derivación ventriculoperitoneal, insuficiencia hepática, insuficiencia renal, metabolopatía, discrasia sanguínea, cardiopatía congénita embolígena, migraña, epilepsia, diabetes mellitus.
Antecedentes familiaresMigraña, epilepsia, psicosis y encefalopatías heredodegenerativas.
Medicación habitualTratamiento anticoagulan te, antiepilépticos, etc.
Características del coma- —
Instauración brusca o progresiva.
- —
Primer episodio o recurrencia. El carácter recurrente del coma inducirá a descartar procesos metabólicos, como los errores innatos del metabolismo de los hidratos de carbono (hipoglucemia por glucogenosis) o acidosis orgánicas (leucinosis, lacticoaciduria).
- —
Cuadro previo de excitabilidad neuronal (delirios, alucinaciones, temblores, convulsiones) o de depresión neurológica (somnolencia, letargia).
Lectura rápida
En la exploración clínica, hay que valorar: grado del coma (escala de Glasgow), respuesta pupilar (tamaño, simetría, reactividad), respuesta motora, reflejos oculocefálicos (no si hay sospecha de traumatismo cervical) y oculovestibulares, patrón respiratorio y signos meníngeos. Es vital identificar y tratar de forma temprana la hipertensión intracraneal y los signos de herniación cerebral inminente.
Ante la sospecha de un coma de origen estructural, ha de realizarse una tomografía computarizada craneal urgente.
Signos de proceso infeccioso del SNC: fiebre o febrícula, rigidez de nuca, cefalea, vómitos.
Signos de hipertensión intracraneal (HTIC): cefalea, vómitos en escopetazo o matutinos/ nocturnos, alteración del carácter y del rendimiento escolar, crisis comiciales, trastornos visuales.
Lectura rápida
Si hay sospecha de intoxicación, puede ser útil administrar de forma empírica antídotos, naloxona (opioides) y/o flumacenilo (benzodiacepinas). Se ensayará glucosa intravenosa para tratar una posible hipoglucemia.
Si no se puede descartar una lesión medular, se realizarán las medidas oportunas para asegurar la correcta inmovilización y estabilidad de la columna cervical.
Lectura rápida
Ante un niño en coma, tienen prioridad las medidas de reanimación y soporte vital: permeabilidad de la vía aérea, oxigenación y ventilación, estabilidad hemodinámica, e identificación y tratamiento de los signos de alarma neurológicos. Posteriormente, se aplicarán las oportunas medidas diagnósticas y de seguimiento y desarrollo del tratamiento definitivo.
- —
Traumatismo craneal. Puede haber ocurrido horas antes (hematoma epidural) o incluso en días previos (hematoma subdural subagudo o crónico).
- —
Posibilidad de intoxicación. Debe tenerse en cuenta siempre la posibilidad de intoxicación voluntaria o accidental ante un estado de coma de etiología poco clara, por lo que se investigará exhaustivamente la posibilidad de ingesta de fármacos o drogas a los que el niño haya podido tener acceso. La edad media de presentación es de 24 meses, siendo el 67% de los niños menores de 4 años. Una historia de pica puede asociarse a una ingestión eventual de sustancias tóxicas. Las causas de intoxicación más común fueron: toxicomedicamentosa (54,7%) (siendo el paracetamol la causa más común), productos domésticos (28,9%), alcohol (5,9%), monóxido de carbono (CO) (4,5%), drogas (1,5%).
- —
Cirugía en días previos (embolia, accidente anestésico, alteración electrolítica).
- —
Infección del área otorrinolaringológica. una sinusitis o infección odontológica puede dar lugar a una trombosis de seno venoso, empiema subdural o absceso frontal.
- —
Ayuno o ingesta escasa.
Ha de incluir siempre: frecuencia cardíaca, frecuencia respiratoria, presión arterial, ECG, saturación de hemoglobina y glucemia capilar. se realizará un examen clínico general y completo por aparatos, y se prestará una atención especial al examen neurológico: Glasgow, pupilas, funciones superiores (orientación espaciotemporal, compresión), pares craneales, reflejos osteotendinosos y cutáneos, reflejo cutaneoplantar, respuesta motora y sensitiva y signos cerebelosos.
Se buscarán especialmente: fiebre, signos de deshidratación, cianosis, ictericia, exantemas, hematomas o equimosis, señales de venopunción, signos meníngeos, fetor cetonémico, etc.
Signos de alarma: hipertensión intracraneal, herniación cerebral inminente18–22Es imprescindible reconocer los signos de alarma neurológicos (HTIC, herniación cerebral inminente) para establecer un tratamiento médico (medidas antiedema cerebral) y/o quirúrgico inmediato. Están constituidos por la tríada de Cushing (respiración irregular, bradicardia, hipertensión arterial), anisocoria, midriasis bilateral, bradipnea, parálisis del vi par craneal, movimientos de descerebración y/o decortización, focalidad neurológica. Hay 4 tipos de herniación cerebral:
- —
Externa: desplazamiento fuera de la bóveda craneal, secundario a fractura abierta y/o craniectomía descompresiva.
- —
Subfacial: consiste en el desplazamiento de la circunvolución del cuerpo calloso al lado contralateral, por debajo de la hoz.
- —
Transtentorial:
- a)
Lateral (uncus temporal): el uncus temporal a través del anillo tentorial.
- b)
Central: el lóbulo temporal a través del agujero tentorial.
- c)
Ascendente: el cerebelo superior hacia arriba a través de la tienda.
- a)
- —
Amigdalina: situación de máxima gravedad. Las amígdalas cerebelosas descienden a través del agujero occipital. Es causa de apneas, respiración atáxica, midriasis fija bilateral y abolición de los reflejos del troncoencéfalo.
Como se ha comentado, se cuantificará la intensidad del coma mediante la GCS, y se especificará la puntuación total y la de cada uno de los apartados (respuesta motora, ocular y verbal).
Un resultado en la GCS igual o inferior a 8 indica una afectación grave del grado de conciencia, con pérdida de los reflejos protectores de la vía áerea y necesidad de valorar la intubación endotraqueal y ventilación mecánica.
Examen pupilarHay que valorar la posición, el tamaño, la simetría y la reactividad a la luz (directa y consensuada).
El estrabismo convergente o divergente indica lesión de vi o iii par craneales. La desviación conjugada de la mirada con componente clónico es indicativa de crisis epiléptica. Los movimientos pendulares, nistagmo y crisis oculógiras apuntan disfunción del tallo cerebral.
Las lesiones diencefálicas presentan miosis poco reactiva, las mesencefálicas midriasis media fija, las protuberanciales miosis intensa y las bulbares midriasis intensa arreactiva. La intoxicación por opioides provoca miosis.
En general, los comas de causa metabólica conservan el reflejo fotomotor, salvo que hayan recibido ciclopléjicos (atropina).
También hay los siguientes movimientos oculares espontáneos: roving movimientos oculares erráticos horizontales (lesión hemisférica e integridad del tronco cerebral); bobbing, desviación conjugada brusca hacia abajo y retorno lento (lesión pontina), nistagmo de convergencia (lesión mesencefálica).
Reflejo corneal, reflejo oculocefálico y oculovestibularSu normalidad apunta la integridad del troncoencéfalo y viceversa.
- —
Reflejo corneal. La respuesta normal es un parpadeo al estimular la córnea con una gasa o torunda. Requiere el funcionamiento de los II, V y VII pares craneales, cuyos núcleos se sitúan en mesencéfalo, protuberancia y bulbo.
- —
Reflejo oculovestibular. Se realiza instilando agua caliente o fría en el conducto auditivo externo. En condiciones normales, los ojos se mueven hacia el lado estimulado con agua caliente y hacia el lado contrario al estímulo con agua fría. Es indispensable comprobar la integridad de la membrana timpánica previamente.
- —
Reflejo oculocefálico. También llamado “ojos de muñeca”. Está contraindicada su realización si hay sospecha o evidencia de lesión medular. Se realiza una rotación lateral de la cabeza. En condiciones normales, se comprueba una desviación conjugada de la cabeza en sentido contrario a la movilización.
Hay que valorar la postura corporal (decorticación, descerebración), el tono muscular (hipotonía, flaccidez, hipertonía, espasticidad), los reflejos osteotendinosos y cutáneos (presencia, ausencia, exaltación, simetría), el reflejo cutaneoplantar (normal = flexor, anormal = Babinski) y la presencia o no de fasciculaciones musculares.
- —
Lesión en córtex. Monoparesia.
- —
Lesión en la cápsula interna. Hemiparesia contralateral.
- —
Lesión en pedúnculo cerebral. Hemiparesia contralateral. Parálisis homolateral de los III y V pares craneales.
- —
Lesión en protuberancia. Hemiparesia contralateral. Parálisis homolateral de los V, VI, VII y VIII pares craneales.
- —
Lesión en bulbo. Hemiparesia contralateral. Parálisis homolateral de los IX, X, XI y XII pares craneales.
- —
Lesión en médula espinal. Parálisis homolateral por debajo de la lesión.
- —
Postura de decortización. El paciente presenta hiperextensión de extremidades inferiores y flexión de superiores. Indica lesión hemisférica bilateral con funciones del troncoencéfalo conservadas.
- —
Postura de descerebración. El niño presenta hiperextensión de las 4 extremidades. Su expresión máxima es el opistótonos. Indicativo de lesión mesencefálica grave.
- —
Flaccidez generalizada. Destaca una hipotonía generalizada con nula respuesta a estímulos. Pequeños estímulos pueden producir movimientos de liberación espinal. Indica lesión en el ámbito del bulbo.
En la práctica, puede presentar escasa utilidad, ya que frecuentemente estará enmascarado por medidas de soporte vital (intubación y ventilación mecánica). Los diferentes patrones respiratorios traducen distintos grados de lesión.
- —
Respiración de Cheyne-Stokes. La amplitud y la FR van aumentando progresivamente hasta llegar a un punto en el que vuelven a disminuir y llegar a la apnea para reiniciar el ciclo implica lesión diencefálica, ganglios de la base o de ambos hemisferios cerebrales.
- —
Hiperventilación neurógena central. Respiración profunda y taquipneica, traduce lesión en mesencéfalica baja o pontina alta. Es necesario distinguirla de la hiperventilación secundaria a alteraciones metabólicas.
- —
Respiración apnéustica. Se presenta una frecuencia lenta, con períodos largos de apnea e inspiración profunda posterior que se detiene en la fase de máxima inspiración. Se observa en lesiones de protuberancia inferior.
- —
Respiración atáxica o de Biot. Patrón respiratorio muy irregular y desorganizado, que se observa en lesión bulbar e indica parada respiratoria inminente.
Puede manifestarse como episodios de hipertermia, crisis de sudoración, erupciones cutáneas evanescentes, episodios de hipertensión o hipotensión arterial y variaciones de la FC.
Afectación del hipotálamoSospechar en todo niño en coma que presente trastornos de la termorregulación (hipotermia e hipertermia) y trastornos hidroelectrolíticos (diabetes insípida, síndrome de secreción inadecuada de la hormona antidiurética, síndrome de pérdida de sal).
Fondo de ojoEl papiledema es indicador de HTIC. La hemorragia subhialoidea puede indicar hemorragia subaracnoidea.
Exploraciones complementariasLas exploraciones complementarias siempre han de individualizarse según la situación clínica del paciente, la accesibilidad de la técnica y, sobre todo, según la sospecha diagnóstica. No hay ninguna exploración complementaria que tenga prioridad a las maniobras de estabilización inicial.
Lectura rápida
Las exploraciones complementarias han de individualizarse según la sospecha diagnóstica y el coste-beneficio para el paciente. Ninguna prueba diagnóstica tiene prioridad respecto a las medidas de soporte vital. Hay que valorar: la analítica sanguínea, la punción lumbar, el estudio microbiológico, el examen toxicológico, la carboxihemoglobina, la neuroimagen, el cribado metabólico, el estudio hormonal, etc.
Lectura rápida
No hay una neuroimagen de elección en el niño en coma. La exploración más apropiada dependerá de la disponibilidad técnica, de las características del paciente y de la orientación diagnóstica.
ElectroencefalogramaEn el niño en coma los hallazgos del EEG pueden indicar posibilidades diagnósticas: alteraciones focales que muestren lesión estructural, patrón brote-supresión en la encepalopatía difusa grave, etc. También permite valorar su gravedad y evolución.
Solicitar siempre una analítica sanguínea básica: hemograma, pruebas de coagulación, equilibrio ácido-base, ionograma, fósforo, magnesio, glucemia, función renal, función hepática, amonio, lactato, anión GAP, proteína C reactiva.
Según la sospecha clínica: carboxihemoglobina, etanol, hormonas tiroideas y suprarrenales (T3, T4, hormona tirotropa, cortisol). Puede administrarse glucosa antes de obtener ninguna determinación analítica23.
Estudios microbiológicosAnte sospecha de infección, solicitar el cultivo, la tinción de Gram y las serologías pertinentes en líquidos orgánicos y tejidos (sangre, líquido cefalorraquídeo, líquido pleural, líquido peritoneal, orina, heces, etc.).
Análisis de tóxicosEs posible determinar la presencia de tóxicos en plasma, orina, jugo gástrico, saliva, cabello, etc. En plasma: etanol, metales pesados, valores de paracetamol, salicilemia, etilenglicol, alcohol metílico, paraldehído.
En orina: benzodiacepinas, opioides, éxtasis, cannabis, cocaína. La administración empírica de naloxona o flumazenil puede ser útil si se sospecha intoxicación por mórficos o benzodiacepinas, respectivamente.
Punción lumbarEstá contraindicada si hay sospecha de HTIC (se realizará neuroimagen antes de realizarla), infección local en el lugar de punción, plaquetopenia/coagulopatía, inestabilidad hemodinámica o respiratoria.
Es posible determinar citología, bioquímica, tinción de Gram, cultivo, serologías, diagnóstico molecular por técnica de reacción en cadena de la polimerasa (PCR), pterinas, aminoácidos y neurotransmisores.
Neuroimagen cerebral: ecografía transfontanelar, tomografía computarizada craneal, resonancia magnética cranealEn general, puede decirse que no hay una neuroimagen de elección en el niño en coma. La exploración más apropiada dependerá de la disponibilidad técnica, de las características del paciente y de la orientación diagnóstica.
Ecografía transfontanelar. Es la neuroimagen inicial de elección en el neonato y el lactante con la fontanela abierta. Permite la detección de hemorragias (intraventriculares, parenquimatosas), dilatación ventricular, signos indirectos de encefalopatía hipoxoisquémica (aumento de ecogenicidad en región corticosubcortical, tálamo y ganglios de la base), signos de edema cerebral (ecogenicidad global con homogenización de estructuras). La técnica de Doppler ha permitido, además, identificar los vasos sanguíneos cerebrales, el estudio de la velocidad del flujo sanguíneo cerebral y el cálculo de los índices de resistencia cerebrovascular.
Tomografía computarizada craneal. Las ventajas de la tomografía computarizada (TC) son: a) facilidad de realización; b) rapidez (sobre todo si disponemos de TC helicoidal); c) mejor resolución en estructuras óseas y calcificaciones; d) mayor accesibilidad al paciente crítico (estructura de tubo abierta), y e) posibilidad de estudio en paciente portador de dispositivos ferromagnéticos.
La TC es la técnica de elección en TCE, lesiones óseas, seguimiento de drenajes y válvulas de derivación ventricular.
El angio-TC permite realizar estudios vasculares similares a los obtenidos por resonancia magnética (RM).
Si no hay contraindicación, en el estudio de un niño en coma se realizará con contraste. Resonancia magnética craneal. Las ventajas de la RM son: a) ausencia de radiación; b) imagen multiplanar y reconstrucciones volumétricas; c) posibilidad de estudios vasculares, y d) mejor resolución en troncoencéfalo, cerebelo y canal medular.
La RM es la técnica de elección en enfermedad metabólica y neurodegenerativa, enfermedad de la sustancia blanca, enfermedad del troncoencéfalo y cerebelo, enfermedad raquídea no ósea, enfermedad de pares craneales.
La angio-RM permite obtener estudios vasculares de calidad similar a la angiografía. Actualmente, está disponible la RM funcional (de difusión, espectroscópica), que permite realizar nuevas secuencias con posibilidad de valorar la perfusión cerebral, medir flujo y volumen sanguíneo local y determinar metabolitos.
Angiografía cerebral. Puede resultar muy útil en el caso de niños con accidentes vasculares cerebrales, ya sean isquémicos o hemorrágicos.
ElectroencefalogramaConsiste en realizar un seguimiento de la actividad eléctrica cerebral. se recoge mediante la colocación de electrodos en el cuero cabelludo, siguiendo el sistema Internacional 10–20. Puede realizarse un EEG convencional o un registro continuo.
El EEG es un conjunto de ondas que expresan la suma de los potenciales sinápticos y postsinápticos inhibidores y excitadores de las neuronas corticales.
En el análisis del EEG, debe valorarse: frecuencia de las ondas, voltaje de las ondas, reactividad ante estímulos, presencia de puntas-ondas, simetría de ambos hemisferios y presencia de artefactos.
En el niño en coma, los hallazgos del EEG pueden indicar posibilidades diagnósticas: actividad comicial, alteraciones focales que muestren lesión estructural, patrón brotesupresión en la encefalopatía difusa grave (secundaria a anoxia), etc. También permiten valorar su gravedad y evolución. El trazado electroencefalográfico es necesario para valorar el coma barbitúrico (patrón salvasupresión) y en el diagnóstico de muerte cerebral.
La administración de sedoanalgesia puede modificar el EEG24,25.
Potenciales evocados de troncoencéfalo sensitivos, auditivos o visualesLos potenciales evocados (PE) son la respuesta eléctrica generada por el troncoencéfalo frente a un estímulo sensorial en un nervio periférico (PE sensitivos), sonoro (PE auditivos) o visual (PE visuales). Permiten detectar la integridad funcional de las vías neuronales implicadas. Se recogen mediante electrodos colocados en el cuero cabelludo.
Se valora la latencia (tiempo de aparición de la onda tras el estímulo), la amplitud de la onda, la distancia entre las ondas y la simetría entre ambos lados.
No suelen afectarse por la sedoanalgesia, barbitúricos, alteraciones metabólicas o electrolíticas. Tienen valor pronóstico y en el seguimiento evolutivo del paciente neurocrítico24,25.
Ecografía Doppler cerebralSe trata de una técnica de seguimiento no invasiva de la hemodinamia cerebral, que informa del estado de la perfusión sanguínea local. Consiste en obtener la morfología de la curva y los valores numéricos de la velocidad de flujo (índice de pulsatilidad, velocidad media, velocidad sistólica máxima, velocidad telediastólica) en las arterias del polígono de Willis.
En la interpretación de los resultados, es importante tener en cuenta la edad y la situación fisiopatológica de cada paciente. En el niño en coma, la arteria cerebral media tiene especial interés, por aportar información sobre la perfusión cerebral global24,26,27.
Cribado metabólico en sangre y/o orinaEl cribado básico incluye equilibrio ácido-base, glucosa, función hepática, creatincinasa, amonio, lactato y piruvato. Según la sospecha diagnóstica, se solicitarán diversas pruebas que orienten hacia diversas enfermedades metabólicas, como cuerpos cetónicos, aminoacidemia, ácidos orgánicos, ácido orótico, carnitina total y libre, determinación de actividad enzimática mitocondrial en hígado/músculo/corazón, etc.
MonitorizaciónTodo niño en coma debe someterse a un seguimiento continuo de las constantes vitales. El seguimiento básico incluirá: temperatura, presión arterial, FC, ECG, diuresis (espontánea o por sondaje vesical), FR, saturación de hemoglobina, glucemia capilar.
Además, hay una serie de medidas destinadas al seguimiento neurocrítico del paciente, fundamentalmente en los casos en los que se necesita valorar la evolución del niño con alteraciones del grado de conciencia en el contexto de HTIC, como sucede en el caso de traumatismos craneales, meningoencefalitis o alteraciones metabólicas.
Seguimiento de la presión intracraneal. Presión de perfusión cerebralEl seguimiento de la presión intracraneal (PIC) es imprescindible y se llevará a cabo en todos los niños con TCE grave. Su cuantificación, aparte de ofrecer una valoración de la PIC, es fundamental para medir la presión de perfusión cerebral (PPC) que se define mediante la diferencia entre la presión arterial media (PAM) – la PIC, y para ofrecer las mejores perspectivas pronósticas debería ser mayor de 60mmHg en adolescentes, y mayor de 50mmHg en niños pequeños y lactantes.
Lectura rápida
Todo niño en coma debe someterse a un seguimiento continuo de las constantes vitales. El seguimiento básico incluirá: temperatura, presión arterial, FC, ECG, diuresis (espontánea o por sondaje vesical), FR, saturación de hemoglobina, glucemia capilar.
Además, hay una serie de medidas destinadas al seguimiento neurocrítico del paciente, fundamentalmente en los casos en los que se necesita valorar la evolución del niño con alteraciones del grado de conciencia en el contexto de HTIC.
Es primordial en pacientes con HTIC, fundamentalmente traumática o infecciosa, para evitar situaciones de isquemia, conocer si el flujo sanguíneo cerebral es el adecuado a sus necesidades metabólicas.
Uno de los métodos que ha adquirido más importancia en este sentido ha sido el análisis de la sangre venosa en el bulbo de la yugular interna, mediante su cateterización retrógrada, ya que prácticamente toda la sangre allí recogida procede del cerebro. Al medir la saturación sanguínea en esta zona estamos valorando la sangre de retorno cerebral y aproximándonos al consumo de oxígeno cerebral.
Presión tisular de O2Consiste en la introducción de un catéter (polarográfico tipo Clark) en el parénquima cerebral para medir la presión tisular de oxígeno, con el objetivo de detectar la presencia de isquemia cerebral. Es un método complementario de la saturación venosa en el bulbo de la yugular y no deben considerarse excluyentes.
Microdiálisis cerebralEs una técnica poco utilizada hasta el momento en el ámbito pediátrico, pero que puede ayudar en el diagnóstico y el seguimiento al valorar mediante una sonda la concentración de sustratos y metabolitos, como glucosa, ácido láctico y pirúvico; aminoácidos, como el glutamato, e indicadores de daño cerebral, como el glicerol en líquido extracelular cerebral18–22,28.