Puntos clave
El teratoma sacrococcígeo (TSC) aparece en 1 de cada 40.000 recién nacidos vivos. La historia natural de los TSC diagnosticados antes del nacimiento es diferente a la de los neonatales. La primera causa de mortalidad de TSC en el neonato es el crecimiento tumoral, lo que es poco frecuente in útero. La causa fundamental de mortalidad fetal por un TSC es la insuficiencia cardíaca por el robo sanguíneo en tumores muy vascularizados. El 15% de los TSC en fetos causan hidrops y, en estos casos, si no se realiza ningún tipo de tratamiento intrauterino la mortalidad es cercana al 100%.
El diagnóstico prenatal mediante ecografía del TSC se basa en la demostración de un flujo vascular particular o de la masa en sí. De hecho, el TSC puede ser observado incluso antes de las 14 semanas de gestación.
Los TSC en el feto pueden ser quísticos, sólidos o presentar ambas características y, en general, su aspecto es heterogéneo debido a la presencia de zonas de hemorragia, necrosis y calcificación. El diagnóstico diferencial incluye el mielomeningocele. En casos de tumores grandes y muy vascularizados, se ha descrito un incremento del flujo aórtico distal e incluso la presencia de vasos que salen directamente de la placenta hacia el tumor.
El TSC puede provocar una complicación materna particular, asociada también a la malformación adenomatoidea quística, que se denomina síndrome de espejo materno o síndrome de Ballantine. En este síndrome, la madre experimenta síntomas progresivos de preeclampsia, que incluyen vómitos, hipertensión, edema periférico, proteinuria y edema pulmonar, debido probablemente a la liberación de factores vasoactivos o a toxinas de células endoteliales procedentes de la placenta edematosa. En este caso, la resección de la masa podría revertir el hidrops pero no la enfermedad materna; la impresión de varios autores es que el tratamiento prenatal tiene pocas esperanzas de éxito si ya existe hidrops y placentomegalia. La técnica quirúrgica es semejante a la posnatal y se lleva a cabo mediante cirugía fetal abierta.
Inicialmente, Harrison describió un torniquete que, rodeando la base de la masa, trataba de impedir el robo de flujo sanguíneo y el crecimiento tumoral. Existía, sin embargo, el riesgo elevado de lesionar el recto y el complejo muscular, que generalmente se localizan en la base de la masa, y es necesario realizar cierta disección de estos elementos antes de colocar el torniquete. Este simple paso eliminaría en teoría el problema hemodinámico fetal, pero si no se reseca la masa, se abandonaría tejido necrótico intrauterino durante el resto de la gestación con un pronóstico incierto.
Se han descrito varios intentos fallidos de embolización, esclerosis o fulguración con láser de los vasos principales del tumor mediante abordaje fetoscópico o percutáneo guiado por ecografía.
Hay descritos pocos supervivientes a largo plazo en niños con tumores grandes muy vascularizados o en aquellos en los que se asocia hidrops.
Una de las mayores series publicadas describe 5 casos con TSC grandes con hidrops. Todos los casos fueron operados mediante cirugía fetal abierta, y a pesar del tratamiento tocolítico agresivo, presentaron parto pretérmino. Dos niños murieron, uno como consecuencia de una embolia gaseosa durante la cirugía de resección tumoral prenatal y el otro durante el parto1.
En conclusión, el tratamiento de elección del TSC con hidrops es la extirpación de la masa mediante cirugía fetal abierta; no hay series grandes y la mortalidad del procedimiento es elevada.
MielomeningoceleEl mielomeningocele (MMC) es un defecto generalmente lumbosacro que permite la exposición del canal neuronal al líquido amniótico. Uno de cada 2.000 recién nacidos vivos presentan MMC y el 80% de ellos necesita una derivación ventricular por hidrocefalia. La mayor parte de los niños con MMC pueden ser diagnosticados prenatalmente mediante determinación de alfafetoproteína en suero materno, mientras que la visualización ecográfica directa del MMC no suele realizarse hasta la semana 16 de gestación. Otras malformaciones observadas ecográficamente y asociadas al MMC son: malformación de Chiari tipo II, hidrocefalia, microcefalia y encefalocele.
Los niños con MMC se ven sometidos hasta su adolescencia a diversas intervenciones quirúrgicas para conseguir la continencia urinaria, y el seguimiento a largo plazo de este problema suele ser complejo y supone un reto para cualquier sistema de salud. El MMC, por lo tanto, puede no amenazar la vida del niño, pero se relaciona con frecuencia a secuelas neurológicas, urológicas, sexuales y óseas devastadoras, y esto trae consigo enormes costes personales, familiares, sanitarios y sociales.
La razón del planteamiento inicial de una intervención prenatal se basó en la observación de que los movimientos de las extremidades inferiores, presentes en las primeras semanas del embarazo, se van perdiendo de manera progresiva en los niños con MMC. Varios estudios experimentales han confirmado posteriormente este punto.
Algunos trabajos con animales han demostrado de manera sólida que la reparación intrauterina del MMC puede preservar la función de los nervios periféricos en las extremidades inferiores2. Aunque se asume que la médula espinal se encuentra intrínsecamente dañada en el MMC, estos trabajos sugieren que, al menos en parte, el daño neuronal se puede deber a la exposición medular al líquido amniótico y, en estadios avanzados, también a la orina y al meconio. De la misma manera, cubrir el defecto evitaría la pérdida de líquido cefalorraquídeo, reduciendo la frecuencia de malformaciones cerebrales y Chiari II e hidrocefalia, y reduciría así la necesidad posterior de colocar una derivación ventriculoperitoneal.
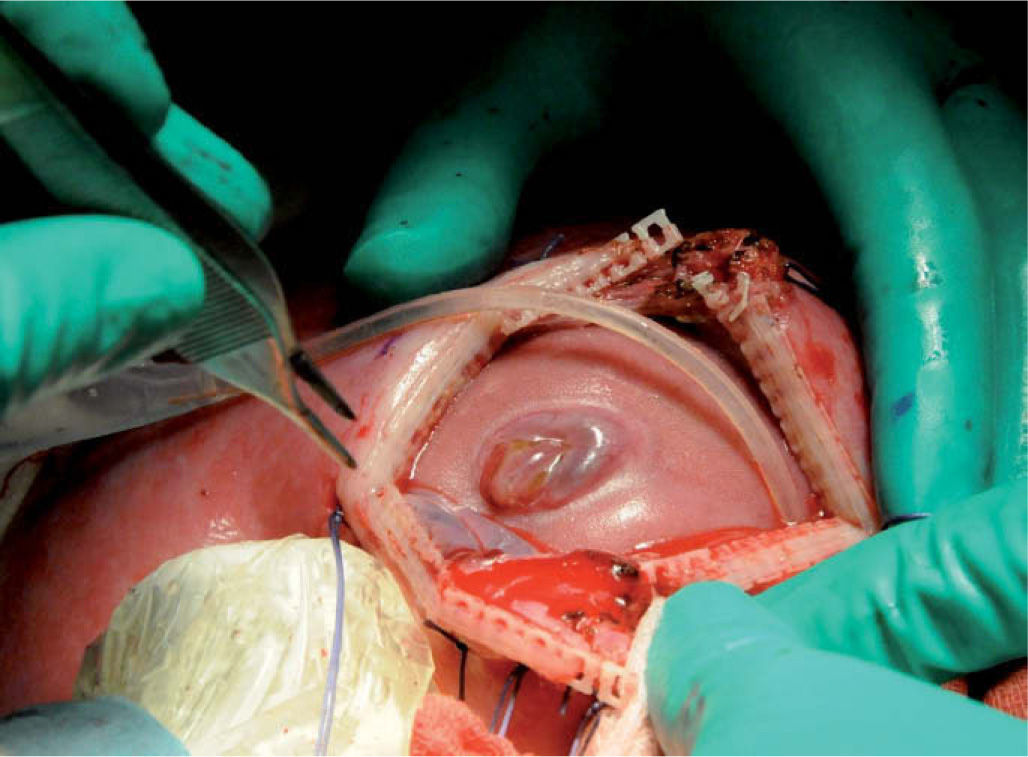
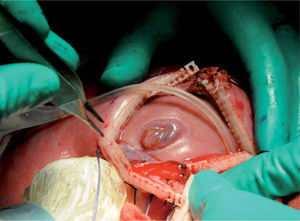
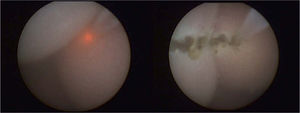
Desde 1997 se ha corregido prenatalmente el MMC en más de 200 fetos humanos mediante cirugía fetal abierta (fig. 1)3.
La evidencia clínica preliminar sugiere que este procedimiento reduce la necesidad de establecimiento de una derivación ventricular y restablece el cerebro y cerebelo a una configuración morfológica semejante a la normal. Sin embargo, estos estudios iniciales en seres humanos hicieron comparaciones con controles históricos y estudiaron únicamente la eficacia del procedimiento y no la seguridad del mismo.
El National Institute of Health (NIH) en EE.UU. ha puesto en marcha un estudio multicéntrico y aleatorizado cerrado a centros externos a los EE.UU. (Management of Mielomeningocele Study, MOMS). Este estudio trabajará sobre 200 pacientes con MMC, que serán tratados mediante cirugía fetal abierta en 100 casos, en 3 hospitales (Children's Hospital of Philadelphia, UCSF, y Universidad de Vanderbilt) y cirugía posnatal en los otros 100.
Los objetivos de este estudio son:
- —
Determinar si la reparación completa del MMC entre las semanas 19 y 26 de gestación mejora el resultado en cuanto a mortalidad y necesidad de una derivación ventricular antes del año de edad.
- —
Establecer si la reparación completa del MMC en ese período mejora la función cognitiva medida por la escala de desarrollo infantil de Bayley a los 30 meses de edad corregida.
Los criterios de inclusión generales son: feto menor de 26 semanas, cariotipo normal, movimientos de extremidades inferiores presentes y tamaño ventricular máximo de 17mm.
Los resultados preliminares tras 2 años se han publicado recientemente y describen la corrección intrauterina de la malformación de Chiari tipo II, así como la reducción al 43% de la necesidad a los 2 años de establecimiento de una derivación ventriculoperitoneal. También se ha descrito cierta mejoría cognitiva en algunos niños.
Los resultados urológicos de la corrección prenatal son escasos. Varios grupos han hecho seguimientos urodinámicos de grupos reducidos de pacientes y todos ellos coinciden en las pocas diferencias que existen entre el tratamiento prenatal y el posnatal. Sólo el grupo de Filadelfia ha descrito cierta mejoría en términos de continencia en el grupo de tratamiento prenatal.
Recientemente algunos trabajos sobre animales de experimentación han descrito resultados prometedores mediante la aplicación prenatal sobre el defecto de células madre4.
Síndrome de transfusión fetofetalEl síndrome de transfusión fetofetal (STFF) es la complicación más común en los embarazos gemelares monocoriales (entre el 5 y el 35% presenta STFF y representa el 17% de la mortalidad en embarazos gemelares).
Las anomalías asociadas son extremadamente raras, pero el STFF se asocia con un riesgo elevado de abortos espontáneos, daño cerebral, muerte perinatal y morbilidad en los supervivientes.
El pronóstico depende del momento de diagnóstico; los casos con diagnóstico previo a la semana 20, sin tratamiento intrauterino, tienen una mortalidad cercana al 100%.
Ecográficamente puede demostrarse un reparto desigual de los vasos placentarios. Los vasos dirigidos al gemelo pequeño suelen ser marginales o velamentosos y los que se dirigen al gemelo grande provienen del centro de la placenta. Entre los 2 gemelos se producen anastomosis vasculares en la superficie de la placenta con desviación del flujo sanguíneo de un gemelo a otro.
Por regla general, mediante ecografía puede observarse en el gemelo pequeño un oligohidramnios grave. El gemelo receptor, por otro lado, desarrolla polihidramnios y miocardiopatía por sobrecarga crónica de volumen.
La comunicación vascular puede observarse con frecuencia mediante eco-Doppler y se trata de vasos impares con flujo de donante a receptor.
El tratamiento es la coagulación fetoscópica mediante láser con indicaciones basadas en el oligohidramnios, la visualización de vejiga y alteraciones en el eco-Doppler. Hay evidencia de que la coagulación de los vasos entre ambos gemelos es superior al amniodrenaje aislado o la septostomía5. La coagulación incompleta de estas anastomosis puede asociarse a recidiva del cuadro y anemia fetal. Esta condición puramente obstétrica suele ser la indicación fetoscópica más frecuente y no debe ser en realidad considerada dentro del término "cirugía fetal" al ser un procedimiento sobre la placenta.
Obstrucción congénita de las vías aéreas altasLa causa de la obstrucción congénita de las vías aéreas altas (CHAOS) es generalmente una atresia de tráquea o laringe, o una compresión extrínseca por una gran masa cervical como un teratoma o un linfangioma. Los hallazgos ecográficos o mediante resonancia magnética (RM) consisten en pulmones distendidos, diafragmas desplazados hacia cavidad abdominal, hidrops por compresión mediastínica y polihidramnios por compresión esofágica.
Si no se desarrolla hidrops durante el embarazo el niño debe ser extraído asegurando la vía aérea mediante un procedimiento EXIT; durante este procedimiento y si el niño no puede ser intubado se tratará de extirpar la masa o se realizará una traqueostomía. El procedimiento EXIT en niños con masas cervicales sin hidrops proporciona un tiempo indispensable sin el cual en ocasiones no es posible asegurar la vía aérea. La ausencia de ventilación adecuada mayor a 5min, en niños con intubaciones difíciles por compresión traqueal tumoral, se asocia a lesiones neurológicas en el 100% de los casos.
El tratamiento del polihidramnios consiste en reposo, vaciamiento periódico y tratamiento médico. Si el polihidramnios persiste, la masa crece o aparece hidrops, será necesaria la extirpación de la masa o la realización de una traqueostomía prenatal, descrita recientemente y por primera vez, mediante abordaje fetoscópico con un único trocar, por el autor alemán Kohl.
Hay únicamente 3 casos conocidos de supervivencia después de un diagnóstico prenatal de CHAOS por masa cervical con hidrops y sin tratamiento prenatal.
Bridas o bandas amnióticasLas lesiones producidas por bridas amnióticas se observan en 1/1.200 recién nacidos vivos.
La etiopatogenia de las bandas es confusa. Probablemente haya varios tipos dentro de los cuales solamente serán susceptibles de recibir tratamiento prenatal aquellos cuya etiopatogenia se base en la compresión extrínseca sobre el feto. En este último caso, la rotura precoz del amnios produciría bandas mesodérmicas que comprimen el cuerpo del niño y causan dificultad en la vascularización de la zona afectada y dificultad para el libre movimiento de éste dentro de la cavidad amniótica. Estas bandas pueden dar lugar a amputaciones y deformidades posturales, que se han reproducido en animales de experimentación.
La gravedad de la lesión probablemente está relacionada con el momento de aparición de la banda aminótica; las bandas en el primer trimestre de gestación se relacionan con lesiones viscerales y craneales, mientras que en el segundo trimestre se asocian a defectos en las extremidades en forma de amputaciones y sindactilia.
Se han descrito resoluciones espontáneas, amputaciones progresivas del miembro documentadas ecográficamente y muerte fetal si está afectado el cordón.
Su etiopatogenia desconocida y la inexistencia de signos ecográficos sólidos que determinen su pronóstico hacen difícil establecer claramente las indicaciones. Éstas se basan en la presencia de linfedema o de fractura ósea o en la afectación del flujo distal recogido por Doppler.
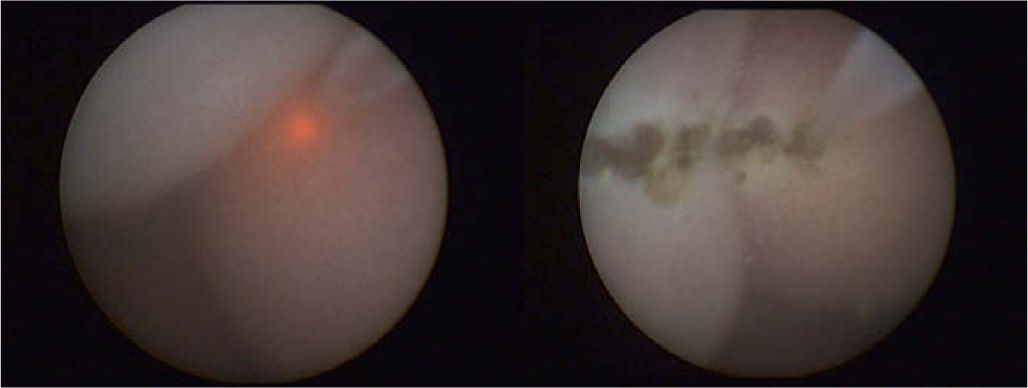
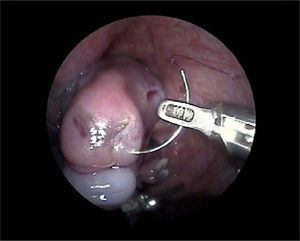
El tratamiento prenatal es semejante al de los procedimientos fetoscópicos usados en el tratamiento del STFF y consiste básicamente en el abordaje de la cavidad uterina mediante un trocar de 3mm y la sección de la brida mediante láser en un punto del miembro donde haya menor riesgo de lesionar las estructuras vasculares o nerviosas. Se han realizado varias descripciones con éxito basadas en esta técnica (grupo del Hospital Vall d'Hebron, Barcelona), tanto para rescatar la extremidad fetal como para proteger el cordón (fig. 2)6.
HidrocefaliaLa hidrocefalia se describe en 2,5 de cada 1.000 recién nacidos vivos y se asocia en el 30% a la malformación de Chiari tipo II y en el 10% a la malformación de Dandy Walker. Durante el embarazo, el límite superior del diámetro ventricular entre las semanas 15 y 35 es de 10mm; el pronóstico fetal y neonatal de esta malformación es particularmente difícil de predecir.
Harrison describió su modelo experimental de hidrocefalia en cordero y varios tipos de drenaje ventricular intrauterino mediante cirugía abierta (ventriculoamniótico, ventriculoauricular y ventriculopleural). Sus trabajos le permitieron describir la evolución de esta enfermedad en el animal, pero no fue capaz de describir cuáles de ellos se beneficiarían de la disposición de una derivación.
En el ser humano, se ha descrito el tratamiento fetal en casos puntuales mediante drenaje ventricular percutáneo y se dispone de referencias recientes sobre animales de experimentación7. No existe actualmente indicación del tratamiento prenatal de la hidrocefalia mediante drenaje continuo o seriado.
Malformaciones cardíacasÉste es un campo de gran interés que excede ampliamente los objetivos de este tercer capítulo de cirugía fetal.
Las indicaciones principales de cirugía fetal en malformaciones cardíacas son la atresia pulmonar con septo íntegro, la enfermedad obstructiva izquierda y el bloqueo cardíaco completo, y los procedimientos se basan generalmente en el abordaje percutáneo guiado por ecografía.
En casos de atresia pulmonar con septo íntegro en fetos hidrópicos se han descrito valvuloplastias de la pulmonar con resultados positivos. En la misma enfermedad se han realizado septostomías interauriculares con cierta mejoría en la función respiratoria perinatal.
En cuanto a la enfermedad obstructiva izquierda, Tierney ha descrito recientemente la serie de Boston compuesta por 26 fetos con mejoría en la función ventricular izquierda tras una valvuloplastia aórtica. En este mismo trabajo describió también cambios significativos en la función cardíaca pre y postintervención.
El bloqueo cardíaco completo puede beneficiarse del tratamiento intrauterino mediante la colocación intrauterina de marcapasos8.
Labio leporino y paladar hendidoLas primeras descripciones sobre la ausencia de cicatrices en heridas fetales realizadas durante el primer y segundo trimestre de gestación resultaban muy atractivas en el tratamiento de este tipo de malformación. Estos beneficios teóricos no se han probado; actualmente no existe justificación para los riesgos de la cirugía fetal y sólo el procedimiento EXIT se reserva para aquellas malformaciones maxilares en las que pueda ser difícil controlar la vía aérea en el período posnatal inmediato.
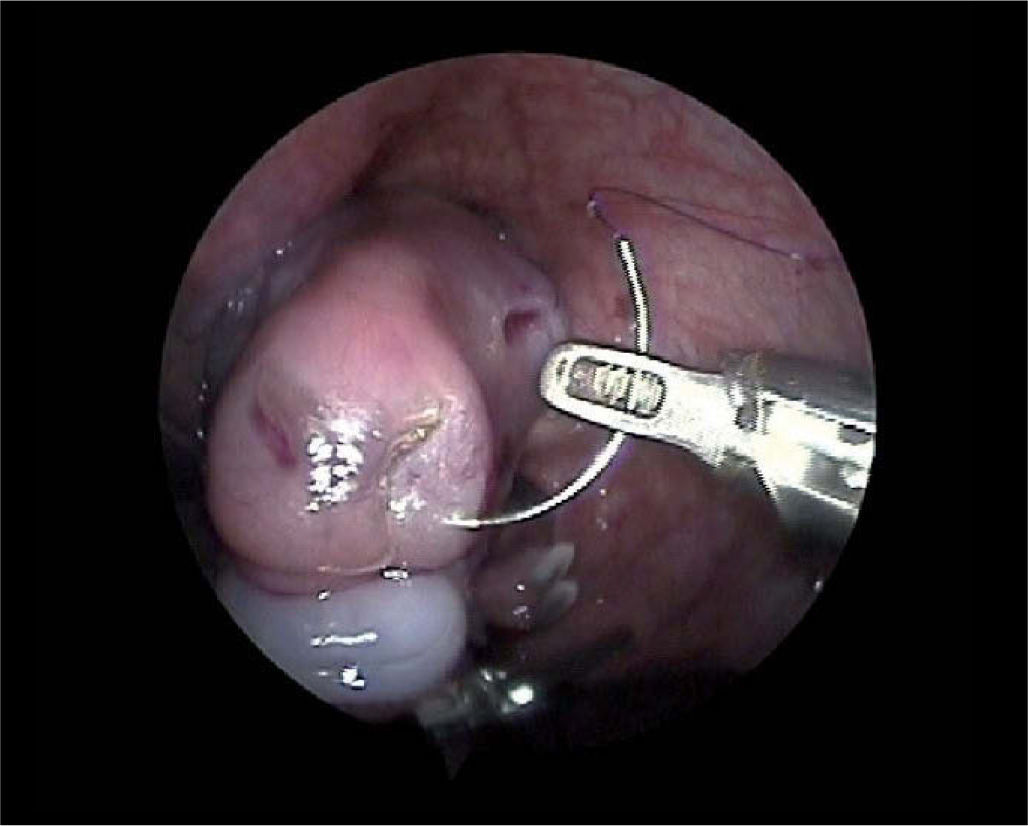
La observación de la cicatrización sin secuelas en fetos durante el período gestacional precoz mantiene sin embargo abiertas algunas líneas de investigación; estas líneas han descrito resultados con éxito en la cicatrización cutánea y prometedores en la corrección de los defectos óseos maxilares, haciendo especial énfasis en que el grado de mejoría depende de la precocidad la intervención. Existen referencias en este sentido de grupos nacionales y extranjeros9 (fig. 3).
GastrosquisisLos niños que nacen con gastrosquisis son intervenidos en el período neonatal inmediato generalmente con éxito. A pesar de esto, a menudo presentan alteraciones de la absorción de nutrientes, en la motilidad del intestino o en su longitud. En ocasiones el intestino de los niños con gastrosquisis presenta al nacimiento un aspecto edematoso y engrosado que puede deberse a dificultad de retorno venoso o linfático y a la exposición de éste al líquido amniótico, la orina y el meconio. Se ha intentado limitar este problema prenatalmente mediante cambios secuenciales del líquido amniótico y los resultados hasta ahora no son satisfactorios. Nuestra capacidad para identificar el daño intestinal fetal es limitada y es posible que la cantidad de líquido amniótico que se extrae sea insuficiente. Los hallazgos ecográficos prenatales de afectación intestinal, como sonolucencia (inflamación de la pared) y dilatación intestinal aparecen normalmente después de las 34 semanas de edad gestacional.
Peiró, del grupo del Hospital Vall d'Hebron, describió en 2005 que el adelantamiento del parto a la semana 34 permitía una reducción sencilla del contenido intestinal sin ampliar el defecto abdominal gracias a la ausencia de engrosamiento de la pared intestinal. Describió también una reducción significativa del tiempo de ingreso y menor dependencia de nutrición parenteral total10.