Editado por: Andrea Gallioli
Fundació Puigvert
Marco Moschini
San Raffaele Hospital
Última actualización: Junio 2025
Más datosHasta hace poco tiempo no existía una terapia adyuvante recomendada para pacientes con metástasis en los ganglios linfáticos (ypN+) después de la quimioterapia neoadyuvante (QNA) y la cistectomía radical (CR) para el cáncer de vejiga músculo-invasivo (CVMI). El objetivo del estudio fue describir los resultados oncológicos de los pacientes ypN+ tras QNA y CR para CVMI.
MétodosEste estudio retrospectivo colaborativo incluyó a 195 pacientes con enfermedad ypN+ después de QNA seguida de CR y disección bilateral de ganglios linfáticos pélvicos para el CVMI en 7 centros entre 2000 y 2019. Se recopilaron los datos demográficos y las características clínicas y patológicas de los pacientes. Se realizaron análisis de supervivencia con estimaciones de Kaplan-Meier y se generó un modelo de Cox.
ResultadosEn total, 120 (62%) pacientes fueron pN1, 51 (26%) pN2 y 24 (12%) pN3. Se realizó radioterapia adyuvante en 18 (9%), quimioterapia adyuvante en 40 (21%), y los 137 pacientes restantes (70%) fueron sometidos a observación. La mediana del tiempo de seguimiento fue de 51 meses (IC95%: 44-62). La mediana de la supervivencia libre de recurrencia, la supervivencia específica al cáncer y la supervivencia global (SG) fue de 18meses (IC95%: 16-21), 47 meses (IC95%: 31-70) y 28 meses (IC95%: 22-34), respectivamente. En el análisis multivariable, el sexo femenino (HR: 1,5; IC95%: 1,002-2,21; p=0,049) y los márgenes quirúrgicos positivos (HR: 1,6; IC95%: 1,06-2,38; p=0,026) fueron los únicos factores predictivos independientes de la SG. El tipo de tratamiento adyuvante no influyó en la SG (quimioterapia adyuvante, p=0,44; radioterapia adyuvante, p=0,40).
ConclusiónLos resultados de supervivencia de los pacientes con CVMI y afectación ganglionar residual tras la QNA y la CR son desfavorecedores. El sexo femenino y los márgenes positivos en la CR se asocian a un pronóstico peor. Estos resultados pueden ser útiles para el diseño de ensayos clínicos a futuro.
Until recently there was no recommended adjuvant therapy for patients with lymph nodes metastasis (ypN+) following neoadjuvant chemotherapy (NAC) and radical cystectomy (RC) for muscle-invasive bladder cancer (MIBC). The aim of the study was to describe the oncological outcomes of ypN+ patients following NAC and RC for MIBC.
MethodsThis collaborative retrospective study included 195 patients with ypN+ disease after NAC followed by RC and bilateral pelvic lymph node dissection for MIBC between 2000 and 2019 in seven centers. Patients’ demographics, clinical and pathological features were collected. Survival analyses were carried out with Kaplan-Meier estimates and a Cox model was generated.
ResultsA total of 120 patients (62%) were pN1, 51 pN2 (26%) and 24 pN3 (12%). Adjuvant radiation therapy was performed in 18 (9%), adjuvant chemotherapy in 40 (21%) and the remaining 137 (70%) patients were observed. The median follow-up time was 51 months (95%CI: 44-62). Median times for recurrence-free survival, cancer-specific survival and overall survival (OS) were 18 months (95%CI: 16-21), 47 months (95%CI: 31-70) and 28 months (95%CI: 22-34) respectively. On multivariable analysis, female gender (HR: 1.5, 95%CI: 1.002-2.21, P=.049) and positive surgical margins (HR: 1.6, 95%CI: 1.06-2.38, P=.026) were the only independent predictor of OS. The type of adjuvant therapy did not impact OS (adjuvant chemotherapy, P=.44; adjuvant radiotherapy, P=.40).
ConclusionMIBC patients with residual node positive disease following NAC and RC have poor survival outcomes. Females and patients with positive margin status at RC carry a poorer prognosis. These results may be beneficial for clinical trial design.
La quimioterapia neoadyuvante (QNA) seguida de cistectomía radical (CR) con linfadenectomía pélvica bilateral es el tratamiento recomendado para el cáncer de vejiga músculo-invasivo no metastásico (CVMI)1-3. Puede observarse una respuesta patológica completa (ypT0pN0) en hasta el 40% de los pacientes, dependiendo del régimen de quimioterapia utilizado y de la calidad de la resección4. Sin embargo, entre el 10 y el 20% de los pacientes presentarán enfermedad ganglionar residual (ypN+) tras la QNA y la CR4,5. Los resultados oncológicos de estos pacientes no se conocen bien, pero los resultados comunicados son desfavorables, con una mediana de supervivencia global (SG) generalmente inferior a los dos años6-10.
Por otra parte, no hay consenso en cuanto a la quimioterapia adicional para estos pacientes ypN+11. Una revisión sistemática y metaanálisis de los datos de participantes individuales en ensayos controlados aleatorizados demostraron un beneficio de la quimioterapia adyuvante (CA) basada en cisplatino en la SG, con una mejora absoluta de la supervivencia del 6% a los 5años12. Sin embargo, estos datos no pueden aplicarse a pacientes con ypN+ (tras QNA).
Adicionalmente, aunque el uso de radioterapia (RT) adyuvante puede mejorar la SG en el CVMI localmente avanzado (la QNA se utilizó en menos del 10% de la cohorte), el mayor estudio retrospectivo sobre RT adyuvante tras QNA y CR no halló una mejora de la SG13. Por lo tanto, ninguna de las directrices internacionales apoya el uso de quimio o radioterapia adyuvante tras el uso de terapia sistémica preoperatoria.
Hace poco, el ensayo CheckMate 274 comunicó un beneficio de no aparición de enfermedad con el uso del inhibidor nivolumab de la Proteína1 de muerte programada (PD-1) en pacientes con CVMI de alto riesgo (al menos pT3 o ypT2 o N+) tras una CR14. En este ensayo, solo el 43% de los pacientes recibieron QNA. Curiosamente, el análisis de subgrupos mostró que los pacientes con enfermedad cN+ y los que recibieron QNA favorecieron nivolumab en comparación con los pacientes con cN0 o sin QNA, respectivamente. Además, la Agencia Europea del Medicamento (EMA) ha aprobado el uso de nivolumab solo para pacientes con resultado positivo de PD-L1, por lo que un subgrupo significativo de pacientes no se vería beneficiado por dicha terapia.
Existe la necesidad de describir los resultados de los pacientes con ypN+, ya que hasta la fecha solo se dispone de series pequeñas. El objetivo de este estudio es describir los resultados oncológicos de los pacientes con ganglios positivos tras la QNA y la CR para el CVMI.
MétodoDiseño del estudioEn un grupo colaborativo, revisamos retrospectivamente todos los pacientes con CVMI sometidos a CR entre 2000 y 2019 en siete centros académicos de todo el mundo. Cada centro fue responsable de la aprobación del estudio, y se intercambiaron acuerdos de uso compartido de datos. Se fusionaron las bases de datos informatizadas para la gestión típica de los datos.
Selección de los pacientes y recogida de datosPara este análisis se incluyeron pacientes con CVMI sometidos a QNA seguida de CR con histopatología de invasión ganglionar del carcinoma urotelial (ypN+). Todos los pacientes recibieron QNA con un régimen basado en cisplatino o carboplatino. Se excluyeron los pacientes con enfermedad metastásica previa (cN3 y cM1) y los pacientes sin datos del seguimiento.
Se obtuvieron características demográficas básicas como la edad en el momento del diagnóstico, el sexo, el índice de masa corporal, los antecedentes de tabaquismo, la clasificación ASA, el índice de comorbilidad de Charlson, y el estadio clínico y ganglionar. También se recogieron los tipos de derivación urinaria, los estadios patológicos y ganglionares, el estado de los márgenes, el número de ganglios linfáticos extirpados, el número de ganglios linfáticos positivos y la presencia de carcinoma in situ (CIS) concomitante tras la CR. Se registró el tipo de terapia adyuvante (radioterapia o quimioterapia) y los demás pacientes fueron sometidos a observación. Los pacientes recibieron seguimiento de por vida según la modalidad de cada centro con imágenes transversales seriadas. También se recogieron los datos relativos al tratamiento administrado en el momento de la recurrencia.
ResultadosLa duración de la supervivencia libre de recurrencia (SLR) se definió como el tiempo transcurrido desde la cistectomía hasta la recurrencia local (lecho de la cistectomía, ganglios linfáticos pélvicos hasta la bifurcación aórtica o tejidos blandos) o distante; los pacientes sin recurrencia al final del estudio fueron censurados en el último control de seguimiento. Por lo tanto, la recurrencia se definió como cualquier recurrencia local o metástasis tras la CR. El tiempo total de seguimiento se definió como el periodo entre la CR y la última visita de seguimiento o la fecha de recurrencia o muerte. El carcinoma urotelial de novo en el tracto superior o la uretra no se consideró como recurrencia.
La supervivencia específica al cáncer (SEC) y la SG se definieron como el tiempo transcurrido desde la cistectomía hasta la muerte por cáncer de vejiga o por cualquier causa, respectivamente; los pacientes que estaban vivos al final del estudio fueron censurados en el último seguimiento.
Análisis estadísticoLas variables categóricas se expresaron mediante frecuencia y porcentaje; las variables continuas se expresaron mediante mediana y rango intercuartílico (RIC). Para el análisis de supervivencia, se censuró a los pacientes hasta la muerte o la recurrencia. Se utilizaron curvas de Kaplan-Meier para estimar la SLR, la SEC y la SG. Se realizaron comparaciones estratificadas con la prueba de log-rank. El efecto de las distintas variables sobre la SG se estimó mediante un modelo de regresión multivariable de Cox por pasos para la variable con un valor p<0,2 en el análisis univariante y con menos del 30% de valores no disponibles. Para profundizar en la evaluación del papel del tratamiento adyuvante, forzamos la variable correspondiente en el modelo final. Se realizaron modelos log-lineales para las variables cuantitativas y se verificaron los supuestos de riesgo proporcional para todas las variables. Todos los análisis estadísticos se realizaron con SAS 9.4 (SAS Institute; Cary, Carolina del Norte, EE.UU.). Todos los valores p<0,05 se consideraron estadísticamente significativos.
ResultadosCaracterísticas de los pacientesSe incluyeron 195 pacientes ypN+ en el análisis, 123 de los cuales eran varones (63%) y 64 mujeres (33%). Las características demográficas, clínicas y patológicas de los pacientes se resumen en la tabla 1. La mediana de edad en el momento de la cirugía fue de 65años (RIC: 59-71años).
Datos demográficos de los pacientes, características clínicas y patológicas
| Total | ||
|---|---|---|
| n o mediana | % o RIC | |
| n=195 | ||
| Sexo | ||
| Masculino | 123 | 63,1% |
| Femenino | 64 | 32,8% |
| Sin datos | 8 | 4,1% |
| Mediana de edad en el momento del diagnóstico | 65 | 59-71 |
| Estadio clínico del tumor | ||
| cT1 | 1 | 0,5% |
| cT2 | 121 | 62,1% |
| cT3 | 15 | 7,7% |
| cT4 | 10 | 5,1% |
| cTx | 48 | 24,6% |
| Estadio clínico ganglionar | ||
| cN0 | 71 | 36,4% |
| cN1 | 28 | 14,4% |
| cN2 | 23 | 7,8% |
| cNx | 73 | 37,4% |
| Régimen NAC | ||
| A base de cisplatino | 97 | 49,7% |
| A base de carboplatino | 53 | 27,2% |
| Sin datos | 45 | 23,1% |
| Número de ciclo NAC | ||
| 1 | 4 | 2,05% |
| 2 | 7 | 3,59% |
| 3 | 44 | 22,56% |
| 4 | 74 | 37,95% |
| >4 | 21 | 10,77% |
| Sin datos | 45 | 23,08% |
| Estadio patológico en el momento de la CR | ||
| ypT0 | 10 | 5,13% |
| ypT1 | 11 | 5,64% |
| ypT2 | 29 | 14,87% |
| ypT3 | 79 | 40,51% |
| ypT4 | 61 | 31,28% |
| ypTis | 5 | 2,56% |
| Sin datos | 0 | 0% |
| Estadio patológico ganglionar en el momento de la CR | ||
| pN1 | 120 | 61,5% |
| pN2 | 51 | 26,2% |
| pN3 | 24 | 12,3% |
| Estadio patológico de los márgenes en el momento de la CR | ||
| R0 | 140 | 71,8% |
| R1 | 51 | 26,2% |
| Mediana de ganglios linfáticos extirpados | 17 | 11-26 |
| Mediana de ganglios linfáticos positivos | 2 | 1-4 |
| Carcinoma in situ concomitante en el momento de la CR | ||
| No | 96 | 49,2% |
| Sí | 64 | 32,8% |
| Sin datos | 35 | 18,0% |
La estadificación ganglionar previa a la CR se distribuyó de la siguiente manera: 71 cN0 (36%), 28 cN1 (14%), 14 cN2 (7%), 9 cN3 (0,6%) y 73 datos ausentes (38%). Los regímenes de QNA fueron basados en cisplatino en 97 pacientes (50%), carboplatino en 53 (27,2%), y no se dispone de datos en 45 (23,1%). La mayoría de los pacientes se sometieron a una derivación urinaria por conducto ileal (62%).
Un total de 10 pacientes (5%) tenían ypT0 en la patología final, 16 (8%) tenían un CVNMI residual y 169 (87%) tenían CVMI residual. La mayoría de los pacientes fueron pN1 (n=120; 62%) con un número medio de ganglios linfáticos extirpados de 1711-26. Se identificaron márgenes positivos en 53 (27%). Dieciocho pacientes (9%) se sometieron a radioterapia adyuvante, 40 pacientes (21%) recibieron quimioterapia adyuvante, y los 137 pacientes restantes (70%) se sometieron observación (tabla 2).
Tratamiento postoperatorio de los pacientes y resultados oncológicos
| Total | ||
|---|---|---|
| N o mediana | % o RIC | |
| N=195 | ||
| Quimioterapia adyuvante | ||
| No | 154 | 79% |
| Sí | 41 | 21,0% |
| Número de ciclos de quimioterapia adyuvante | ||
| 4 | 1 | 2,4% |
| 5 | 2 | 4,9% |
| 6 | 19 | 46,3% |
| 7 | 2 | 4,9% |
| Radioterapia adyuvante | ||
| No | 147 | 90,8% |
| Sí | 18 | 9,2% |
| Recurrencia | ||
| No | 66 | 33,8% |
| Sí | 129 | 66,2% |
| Muerte específica por CV | ||
| No | 120 | 61,5% |
| Sí | 75 | 38,5% |
| Mortalidad global | ||
| No | 79 | 40,5% |
| Sí | 116 | 59,5% |
La mediana del tiempo de seguimiento de los pacientes censurados fue de 51 meses (IC95%: 44-62). Se produjeron recurrencias en 129 pacientes (66%), muertes específicas por cáncer en 75 (39%) y fallecimientos en 116 (60%). La mayoría de los pacientes (68%) recibieron quimioterapia en el momento de la recurrencia. Los resultados oncológicos de los pacientes se resumen en la tabla 2. Se produjo progresión sistémica en el 70% de los pacientes que presentaron recurrencia.
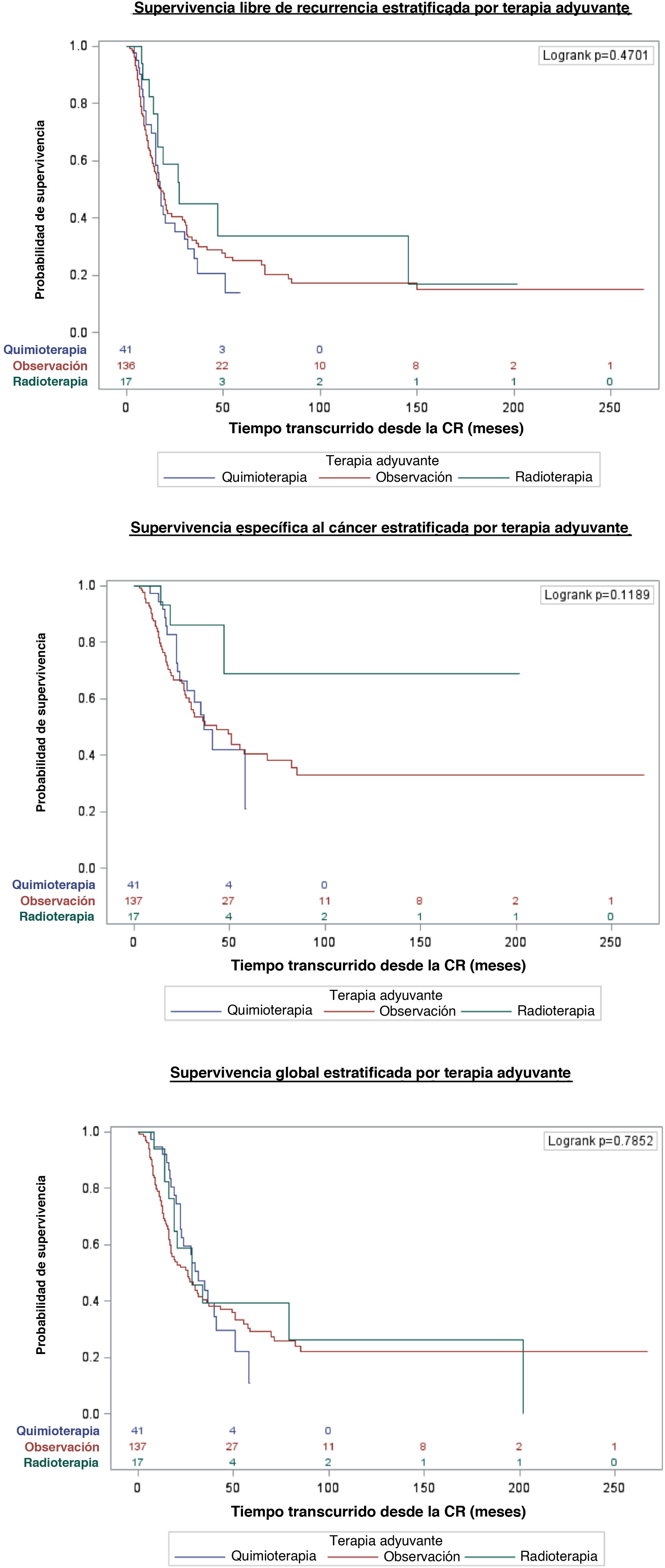
En la población general, la SLR a 1, 3 y 5años fue del 67% (IC95%: 59-73), 31% (IC95%: 24-39) y 24% (IC95%: 17-31), respectivamente. La SEC a 1, 3 y 5años fue del 89% (IC95%: 83-93), 56% (IC95%: 46-64) y 41% (IC95%: 31-50), respectivamente. La SG a 1, 3 y 5años fue del 82% (IC95%: 75-86), 40% (IC95%: 32-48) y 28% (IC95%: 20-36), respectivamente (tabla 3).
Estimación Kaplan Meier de la supervivencia libre de recurrencia (SLR), supervivencia específica al cáncer (SEC) y supervivencia global (SG) tras una mediana de seguimiento de 51 meses (IC95%: 44-62)
| SLR | SEC | SG | ||||
|---|---|---|---|---|---|---|
| Tiempo desde la CR | % | (IC 95%) | % | (IC 95%) | % | (IC 95%) |
| 12 | 66,8% | (59,3-73,1) | 89,1% | (83,4-92,9) | 81,5% | (75,0-86,4) |
| 24 | 41,1% | (33,5-48,6) | 68,2% | (59,8-75,2) | 54,1% | (46,1-61,4) |
| 36 | 31,1% | (23,9-38,5) | 55,6% | (46,4-63,7) | 40,2% | (32,4-47,9) |
| 48 | 27,7% | (20,8-35,1) | 49,8% | (40,3-58,5) | 36,2% | (28,5-43,9) |
| 60 | 23,9% | (17,1-31,3) | 40,9% | (31,0-50,6) | 27,8% | (20,3-35,8) |
| Mediana | 18 meses | (16-21) | 47 meses | (31-70) | 28 meses | (22-34) |
La mediana del tiempo transcurrido hasta la SLR, la SEC y la SG fue de 18meses (IC95%: 16-21), 47 meses (IC95%: 31-70) y 28meses (IC95%: 22-34), respectivamente. No se observaron diferencias de supervivencia entre los tipos de terapia adyuvante tras la QNA y la CR (fig. 1).
Curvas de Kaplan-Meier con supervivencia libre de recurrencia, supervivencia específica al cáncer y supervivencia global estratificadas por tipo de terapia adyuvante en pacientes con afectación ganglionar tras quimioterapia neoadyuvante y cistectomía radical para el cáncer de vejiga músculo-invasivo.
Se diseñó un modelo multivariante de Cox. El sexo femenino (HR: 1,5; IC95%: 1,002-2,21; p=0,049) y los márgenes positivos en el momento de la CR (HR: 1,6; IC95%: 1,06-2,38; p=0,026) fueron los únicos predictores independiente de supervivencia global (tabla 4). El tipo de terapia adyuvante no influyó en la SG: HR: 0,8, IC95%: 0,52-1,33, p=0,44 y HR: 0,8, IC95%: 0,41-1,34, p=0,4 para quimioterapia y radioterapia adyuvantes, respectivamente.
Supervivencia general. Análisis univariante y multivariante
| Análisis univariante | Análisis multivariante | |||||||
|---|---|---|---|---|---|---|---|---|
| HR | Intervalo de confianza al 95% | p | HR | Intervalo de confianza al 95% | p | |||
| Inferior | Superior | Inferior | Superior | |||||
| Género | ||||||||
| Masculino | Ref. | Ref. | ||||||
| Femenino | 1,5 | 1,02 | 2,24 | 0,039 | 1,49 | 1,00* | 2,21 | 0,049 |
| Edad en el momento del diagnóstico | 1,004 | 0,99 | 1,02 | 0,70 | ||||
| Régimen NAC | ||||||||
| A base de cisplatino | Ref. | Ref. | ||||||
| A base de carboplatino | 1,09 | 0,71 | 1,66 | 0,71 | − | − | − | − |
| Estadio patológico en el momento de la CR | ||||||||
| ypT0-T1 | Ref. | Ref. | ||||||
| ypT2 | 1,98 | 0,92 | 4,29 | 0,08 | − | − | − | − |
| ypT3 | 1,61 | 0,81 | 3,21 | 0,18 | − | − | − | − |
| ypT4 | 1,95 | 0,97 | 3,90 | 0,061 | − | − | − | − |
| ypTis | 1,50 | 0,41 | 5,45 | 0,54 | − | − | − | − |
| Estadio patológico ganglionar en el momento de la CR | ||||||||
| pN1 | Ref. | Ref. | ||||||
| pN2 | 0,99 | 0,64 | 1,51 | 0,94 | − | − | − | − |
| pN3 | 1,16 | 0,68 | 1,98 | 0,59 | − | − | − | − |
| Estadio patológico de los márgenes en el momento de la CR | ||||||||
| Negativo | Ref. | Ref. | ||||||
| Positivo | 1,66 | 1,13 | 2,43 | 0,01 | 1,59 | 1,06 | 2,38 | 0,026 |
| Número de ganglios linfáticos extirpados | 0,99 | 0,98 | 1,01 | 0,36 | − | − | − | − |
| Número de ganglios linfáticos positivos extirpados | 1,01 | 0,98 | 1,04 | 0,62 | − | − | − | − |
| Carcinoma concomitante in situ al momento de la CR | ||||||||
| No | Ref. | Ref. | ||||||
| Presente | 1,07 | 0,72 | 1,60 | 0,74 | − | − | − | − |
| Quimioterapia adyuvante | ||||||||
| No | Ref. | Ref. | ||||||
| Sí | 0,91 | 0,58 | 1,44 | 0,69 | − | − | − | − |
| Radioterapia adyuvante | ||||||||
| No | Ref. | Ref. | ||||||
| Sí | 0,97 | 0,54 | 1,74 | 0,91 | − | − | − | − |
| Terapia adyuvante | ||||||||
| Observación | Ref. | Ref. | ||||||
| Quimioterapia adyuvante | 0,88 | 0,56 | 1,40 | 0,59 | 0,83 | 0,52 | 1,33 | 0,44 |
| Radioterapia adyuvante | 0,85 | 0,46 | 1,56 | 0,60 | 0,77 | 0,41 | 1,43 | 0,40 |
Nuestro estudio demostró que los pacientes con enfermedad ganglionar residual tras QNA y CR tienen resultados de supervivencia desfavorables, con una mediana de tiempo hasta la recurrencia de 18meses y una mediana de tiempo hasta la muerte de 28meses. Ningún tratamiento adyuvante parece tener un efecto beneficioso sobre la SG. Las mujeres y los pacientes con márgenes positivos en las muestras de cistectomía tienen peor pronóstico.
Esta es la mayor cohorte publicada hasta la fecha sobre el estudio de pacientes ypN+. En otras cohortes de tamaño limitado, se han investigado los resultados de pacientes con hallazgos patológicos adversos después de QNA y CR5,9,10,15-18, pero hay menos informes centrados en pacientes ypN+. Kassouf et al.7 comunicaron una mediana de SLR de 6meses y una mediana de SG de 13meses con una mediana de seguimiento de 50meses en 37 pacientes. Curiosamente, encontraron en el análisis multivariante que el estado del margen quirúrgico, el sexo y la histología variante se asociaban significativamente con la SG, mientras que la histología variante y el uso de quimioterapia adyuvante se asociaban significativamente con la SLR. En nuestra cohorte, el estado del margen y el sexo también se asociaron significativamente con una peor SG en el análisis multivariante. Sin embargo, no encontramos ningún beneficio de la quimioterapia adyuvante en la SLR, la SEC o la SG. Además, no pudimos informar acerca de variantes histológicas, ya que nuestro estudio solo incluyó pacientes con carcinoma urotelial puro, lo que probablemente explique la diferencia con los resultados que publicamos aquí. Jeong et al.6 también informaron sobre esta población concreta con una mediana de seguimiento de 68meses, incluyendo a 53 pacientes. En su análisis, la mediana de la SLR fue de 8,5meses y la mediana de la SG de 16,2meses. Solo la edad tuvo un efecto significativo sobre la SG, y la quimioterapia adyuvante no mejoró la SLR ni la SG.
Es interesante señalar que algunos pacientes presentarán una respuesta diferenciada en la vejiga y en los ganglios. En nuestro estudio, y en las series publicadas6,7, una pequeña proporción de pacientes (5% en nuestra cohorte) presenta una respuesta completa en la vejiga (ypT0) pero sigue siendo ypN+. Esto pone de relieve el papel beneficioso de la disección de los ganglios linfáticos pélvicos en el momento de la CR. Aunque el ensayo aleatorizado controlado alemán LEA no demostró una ventaja significativa de la disección ganglionar ampliada sobre la limitada en la SLR, la SEC y la SG, es importante señalar que ninguno de los pacientes recibió QNA y, por lo tanto, los resultados de este ensayo no deben extrapolarse a esta población19. Los resultados del SWOG 1011 (NCT01224665) se comunicaron recientemente en congresos internacionales en los que se informaba de resultados similares, pero esperamos que la publicación principal se haga pronto. Sin embargo, dada la rareza de la enfermedad (ypN+), es poco probable que este ensayo pueda aclarar las dudas sobre el beneficio terapéutico de la extirpación ampliada de los ganglios linfáticos en esta subpoblación. La identificación de metástasis ganglionares es esencial, ya que estos pacientes albergan un mal pronóstico, independientemente del número y de la localización de los ganglios positivos. En nuestra serie, no encontramos diferencias de SG entre los pacientes ypN1, ypN2 o ypN3.
El papel de la RT adyuvante también es objeto de debate. Una revisión sistemática que evaluó la eficacia de la RT adyuvante para el CV no halló un beneficio claro para la SG20, aunque algunos análisis retrospectivos multicéntricos de puntuación de propensión han informado de un beneficio para la SG en pacientes pT4 o pN+21. Sin embargo, la extrapolación de este metaanálisis es difícil, ya que la mayoría de los estudios no investigaron específicamente a pacientes ypN+. Lewis et al.13 no encontraron diferencias en la SG al investigar el papel de la RT adyuvante utilizando la National Cancer Data Base para pacientes con carcinoma urotelial de vejiga pT3-4N0-3M0 que recibieron QNA y CR (n=1.646 pacientes). En un análisis de subgrupos, no se informaron diferencias en la SG con RT adyuvante para pacientes con enfermedad ypN2-N3 (16,6meses frente a 15,1meses, p=0,205), en consonancia con nuestros resultados. Además, en un ensayo de faseII en el que se evaluaron la toxicidad y la tasa de control local tras RT adyuvante después de CR (solo el 47% de los pacientes recibieron QNA y el 65% eran pN+), la SG a 2años fue del 52%22, equivalente a nuestros resultados (SG a 2años del 54%). Hay algunos estudios en curso sobre el tema23, como el Bladder-ART (GETUG-AFU 30, NCT03333356), el ensayo egipcio del NCI (NCT04740866) y el ensayo BART (NCT02951325).
Es interesante mencionar que un ensayo aleatorizado de fase2 investigó el papel de la quimioterapia adyuvante y la RT frente a quimioterapia adyuvante exclusivamente para el cáncer de vejiga localmente avanzado tras CR sin QNA24. Aunque los resultados a 2años y las tasas de riesgo relativo (HR) globales ajustadas apoyaron la quimioterapia combinada con RT frente a quimioterapia exclusiva en términos de SLR locorregional (96% frente al 69%; CRI: 0,08; IC95%: 0,02-0,39; p<0,01), este ensayo no pudo demostrar un beneficio para la SG del tratamiento adyuvante combinado (71% frente al 60%; CRI: 0,61; IC95%: 0,33-1,11; p=0,11). Podemos plantear la hipótesis de que la adición de quimioterapia o RT tras CR y QNA no será beneficiosa para los pacientes ypN+.
Se han llevado a cabo tres ensayos para investigar el papel del bloqueo de PD-1 o PD-L1 adyuvante. El ensayo Checkmate 274 aleatorizó a pacientes con CVMI de alto riesgo (al menos pT3 o ypT2 o N+) tras CR a un año de nivolumab (inhibidor de PD-1) adyuvante frente a placebo14. Este ensayo mostró una mejora de la supervivencia libre de enfermedad en la población por intención de tratar (HR: 0,70; IC95%: 0,54-0,89; p<0,001). Estos resultados han conducido a la aprobación de la FDA en 202125. En este ensayo solo se incluyeron pacientes con márgenes negativos, y solo el 43% de los pacientes recibieron QNA. Curiosamente, el análisis de subgrupos mostró que los pacientes con enfermedad N+ (CRI: 0,64; 0,48-0,85) y los que recibieron QNA (CRI: 0,52; 0,38-0,71) apoyaron el uso de nivolumab. Por el contrario, en el ensayo IMvigor010, en el que se aleatorizó a los pacientes para atezolizumab a 1año frente a observación, no se alcanzó el criterio de valoración primario de mejora de la supervivencia libre de enfermedad en la población por intención de tratar26. En el análisis de subgrupos, los pacientes con pN+ o los que recibieron QNA no se beneficiaron de atezolizumab. Los resultados del ensayo AMBASSADOR (NCT03244384) —en el que se aleatorizó a los pacientes a 1año de pembrolizumab adyuvante frente a observación— también son positivos, pero se espera su publicación. Ninguno de los dos ensayos reportados incluyó pacientes con márgenes positivos en la CR, mientras que en nuestro estudio el 27% de los pacientes incluidos tenían márgenes positivos. Esta población de muy alto riesgo debe ser investigada en ensayos clínicos, ya que presentan resultados oncológicos adversos y no son aptos para nivolumab adyuvante.
Nuestro estudio tiene varias limitaciones, además de su diseño retrospectivo. Se incluyó a un grupo heterogéneo de pacientes tratados en hospitales diferentes (según los protocolos locales) durante un periodo de tiempo relativamente largo. Aunque esta cohorte es la mayor publicada hasta la fecha, seguimos sin tener la potencia suficiente para identificar un beneficio de cualquier tratamiento adyuvante en este contexto. Además, el prolongado periodo de inclusión puede aportar heterogeneidad por el tipo de tratamiento recibido, incluido el tratamiento en el momento de la recurrencia, lo que podría repercutir en los análisis de supervivencia global. Además, una cuarta parte de los pacientes incluidos recibieron QNA basada en carboplatino, debido al deterioro de la función renal. Las normas actuales desaconsejan el uso de QNA basada en carboplatino. Por último, dado el número relativamente pequeño de pacientes que recibieron tratamiento adyuvante y la heterogeneidad de la cohorte, no pueden extraerse conclusiones sobre las estrategias de tratamiento adyuvante. Sin embargo, los resultados de nuestro estudio subrayan la necesidad de seguir investigando el uso del tratamiento adyuvante, y de seleccionar a los pacientes que puedan resultar más beneficiados.
ConclusiónLos pacientes con CVMI con enfermedad ganglionar residual tras QNA y CR tienen resultados de supervivencia desfavorables. El sexo femenino y los márgenes positivos en la CR se asocian a un peor pronóstico. Nuestros resultados pueden ser beneficiosos para ensayos clínicos, y para la selección de posibles estrategias de tratamiento adyuvante.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.