El tratamiento estándar del carcinoma de próstata hormonosensible metastásico (CPHSm) es en la actualidad una combinación de terapia de privación androgénica (TPA) más una terapia dirigida al receptor androgénico (abiraterona, apalutamida, enzalutamida o darolutamida) con o sin quimioterapia (docetaxel). La selección de pacientes adecuados para cada enfoque terapéutico se ha convertido en un factor determinante para garantizar la eficacia y minimizar los efectos secundarios. Este artículo combina la evidencia clínica reciente con la experiencia acumulada de expertos en oncología médica, oncología radioterápica y urología, para proporcionar una visión integral y recomendaciones terapéuticas para el manejo del CPHSm.
The standard treatment for metastatic hormone-sensitive prostate cancer (mHSPC) is now a combination of androgen deprivation therapy plus an androgen receptor-targeted therapy (abiraterone, apalutamide, enzalutamide or darolutamide), with or without chemotherapy (docetaxel). The selection of suitable patients for each therapeutic approach has become a determining factor to ensure efficacy and minimize side effects. This article combines recent clinical evidence with the accumulated experience of experts in medical oncology, radiation oncology and urology, to provide a comprehensive view and therapeutic recommendations for mHSPC.
El tratamiento del cáncer de próstata hormonosensible metastásico (CPHSm) consiste en un tratamiento de privación androgénica (TPA) más un fármaco dirigido a la vía del receptor androgénico (abiraterona, apalutamida, enzalutamida o darolutamida), pudiendo añadir docetaxel y/o radioterapia locorregional en pacientes seleccionados.
Los ensayos aleatorizados demuestran mejoras en la supervivencia global (SG) con el tratamiento doble (TPA más inhibidor de la vía del receptor androgénico [IRA]) y con el triple, sumando docetaxel, en el primer caso comparado con TPA y en el segundo contra un tratamiento de docetaxel+TPA1-7, pero no hay estudios comparativos de terapia triple frente a doble, por lo que la selección entre ambas ha de realizarse según características del paciente, y clínico-moleculares de la neoplasia.
Este artículo combina evidencia clínica y directrices terapéuticas con la opinión de expertos en oncología médica, radioterápica y urología, para proporcionar recomendaciones terapéuticas en CPHSm.
Papel del tratamiento local en el paciente con CPHSmDiferentes análisis de subgrupos en grandes ensayos aleatorizados y análisis retrospectivos sugieren que el tratamiento local del tumor primario en el contexto de enfermedad metastásica tendría un impacto en la supervivencia8-13, principalmente en aquellos pacientes catalogados como oligometastásicos.
Papel del tratamiento local del tumor primario en CPHSmEn el contexto de una enfermedad metastásica, el tratamiento local del tumor primario tiene una justificación biológica, por la disminución de la carga tumoral total y por inducción de una respuesta inmunogénica que libera sustancias que desencadenan efectos antitumorales sistémicos (efecto abscopal)14. Además, existe una justificación clínica, basada en series retrospectivas en las que se sugiere un efecto citorreductor con radioterapia que induciría el retraso de la terapia sistémica a través de la destrucción de subclones de células resistentes y reduciría, con un mejor control local, el desarrollo de sintomatología urinaria12,15 (tabla 1).
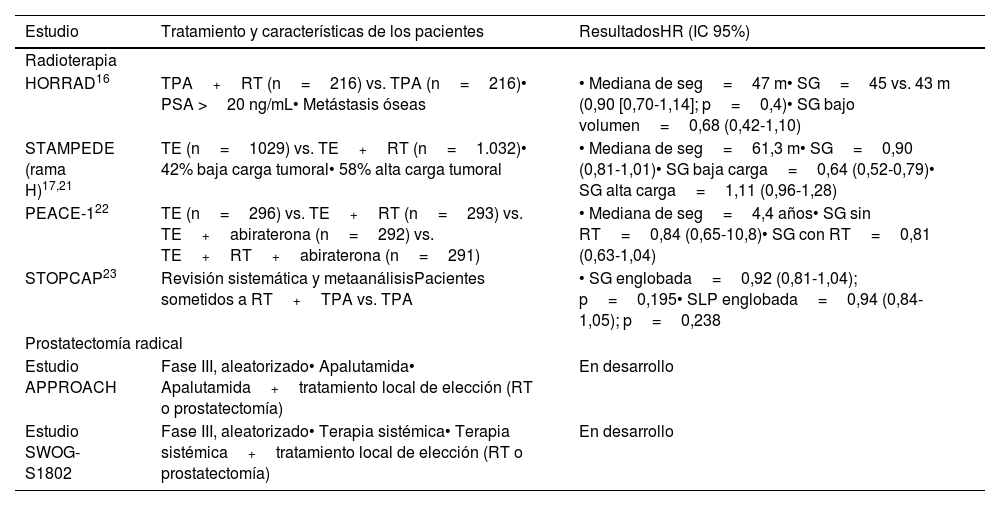
Evidencia sobre tratamiento local del tumor primario en el cáncer de próstata hormonosensible metastásico
| Estudio | Tratamiento y características de los pacientes | ResultadosHR (IC 95%) |
|---|---|---|
| Radioterapia | ||
| HORRAD16 | TPA+RT (n=216) vs. TPA (n=216)• PSA >20 ng/mL• Metástasis óseas | • Mediana de seg=47 m• SG=45 vs. 43 m (0,90 [0,70-1,14]; p=0,4)• SG bajo volumen=0,68 (0,42-1,10) |
| STAMPEDE (rama H)17,21 | TE (n=1029) vs. TE+RT (n=1.032)• 42% baja carga tumoral• 58% alta carga tumoral | • Mediana de seg=61,3 m• SG=0,90 (0,81-1,01)• SG baja carga=0,64 (0,52-0,79)• SG alta carga=1,11 (0,96-1,28) |
| PEACE-122 | TE (n=296) vs. TE+RT (n=293) vs. TE+abiraterona (n=292) vs. TE+RT+abiraterona (n=291) | • Mediana de seg=4,4 años• SG sin RT=0,84 (0,65-10,8)• SG con RT=0,81 (0,63-1,04) |
| STOPCAP23 | Revisión sistemática y metaanálisisPacientes sometidos a RT+TPA vs. TPA | • SG englobada=0,92 (0,81-1,04); p=0,195• SLP englobada=0,94 (0,84-1,05); p=0,238 |
| Prostatectomía radical | ||
| Estudio APPROACH | Fase III, aleatorizado• Apalutamida• Apalutamida+tratamiento local de elección (RT o prostatectomía) | En desarrollo |
| Estudio SWOG-S1802 | Fase III, aleatorizado• Terapia sistémica• Terapia sistémica+tratamiento local de elección (RT o prostatectomía) | En desarrollo |
HR: hazard ratio; IC: intervalo de confianza; m: meses; PSA: antígeno prostático específico; RT: radioterapia; SG: supervivencia global; SLP: supervivencia libre de progresión; TE: tratamiento estándar; TPA: terapia de privación androgénica.
El estudio HORRAD fue el primer ensayo clínico diseñado entre 2004 y 2014 que aleatorizó a 432 pacientes con CPHSm a TPA±radioterapia16. No observó diferencias en la SG, pero en el subgrupo de pacientes con bajo volumen (n=160, <5 metástasis), la radioterapia mostró una tendencia de mejora en la SG no estadísticamente significativa (hazard ratio [HR]: 0,68; intervalo de confianza [IC] 95%: 0,42-1,10)16.
En 2013-2016, el ensayo fase III STAMPEDE (rama H) aleatorizó a 2.061 pacientes con CPHSm de novo al estándar (TPA+docetaxel en un 18%) con o sin radioterapia externa en próstata17. La radioterapia mejoró la supervivencia libre de progresión (SLP) en comparación con el tratamiento estándar (HR: 0,76; IC 95%: 0,68-0,84; p <0,0001), pero no mejoró la SG (HR: 0,92; IC 95%: 0,80-1,06; p=0,266). Sin embargo, en un análisis preespecificado utilizando criterios CHAARTED para volumen tumoral (alto: ≥ metástasis óseas incluida ≥ 1 metástasis fuera de la columna vertebral o pelvis y/o metástasis viscerales; bajo: que no sea alto)18-20, en el grupo de pacientes con bajo volumen (n=819), la radioterapia mejoró la SG a tres años en comparación con el tratamiento estándar (81% vs. 73%; HR: 0,68; IC 95%: 0,52-0,90; p=0,007) y la SLP (50% vs. 33%; HR: 0,59; IC 95%: 0,49-0,72; p <0,0001), sin un aumento significativo de la toxicidad urinaria o intestinal. Los pacientes con alto volumen no se beneficiaron del tratamiento local17. Los resultados actualizados tras una mediana de seguimiento de 61,3 meses demostraron que la radioterapia prostática mantenía el beneficio en la SG en pacientes con un bajo volumen tumoral (HR: 0,64; IC 95%: 0,52-0,79; p <0,001), sin beneficio en pacientes con alto volumen (HR: 1,11; IC 95%: 0,96-1,28; p=0,164)21.
El estudio PEACE-1 es un ensayo fase III multicéntrico realizado en 2013-2018 en el que 1.173 pacientes con CPHSm de novo fueron aleatorizados (1:1:1:1) a tratamiento estándar (TPA±docetaxel), tratamiento estándar con radioterapia, tratamiento estándar con abiraterona, o estándar con radioterapia y abiraterona2. Los pacientes que recibieron radioterapia (tanto en población de bajo volumen tumoral como en la global) mostraron una disminución en el tiempo de aparición de eventos genitourinarios graves, independientemente de la terapia sistémica utilizada. Los resultados de un subanálisis con 505 pacientes comparativo de radioterapia en el subgrupo de bajo volumen tumoral han sido presentados en la American Society of Clinical Oncology (ASCO) 202322. Con una mediana de seguimiento de 73 meses, estos pacientes no mostraron un beneficio significativo en SG con la adición de radioterapia, pero sí una mejoría significativa en SLP radiológica, en el subgrupo de pacientes tratados con abiraterona (HR: 0,65; p=0,02). El tratamiento con radioterapia prolongó el intervalo libre de resistencia a castración, tanto en población de bajo volumen (mediana 3,4 vs. 2,5 años; HR: 0,74; IC 95%: 0,60-0,92; p=0,007), como en la global (2,5 vs. 1,9 años; HR: 0,79; IC 95%: 0,69-0,90; p=0,007). El uso de una dosis de radiación más alta justificaría las diferencias observadas en los resultados entre PEACE-1 y STAMPEDE (74 vs. 67Gy) y una terapia sistémica más eficaz.
La revisión sistemática y metaanálisis Systemic Treatment Options for Prostate Cancer (STOPCAP) (con 2.126 pacientes procedentes de HORRAD, STAMPEDE y PEACE-1) describió que la radioterapia prostática era más favorable ante una menor carga metastásica (< 5 vs. ≥ 5 metástasis; HR: 1,47; IC 95%: 1,11-1,94; p=0,007). Hubo una mejoría del 7% en la SG a tres años en pacientes con <5 metástasis23.
Recomendación de expertos: debería recomendarse la radioterapia prostática a pacientes con CPHSm y bajo volumen tumoral. El tratamiento en otros subgrupos debería individualizarse y justificarse basándose en el beneficio observado en la reducción de eventos locales.
Prostactectomía radicalNo hay datos de ensayos fase III que aclaren el papel de la prostatectomía en el CPHSm de novo. Teóricamente, la morbilidad asociada a la cirugía podría tener un efecto negativo sobre el sistema inmunológico y el control del cáncer. Las series publicadas hasta ahora, con número limitado de pacientes, concluyen que la prostatectomía proporciona beneficios en el control local, y SLP, siendo una técnica reproducible si se seleccionan adecuadamente los pacientes24.
Actualmente, hay dos estudios fase III en marcha: APPROACH (NCT05649943) y SWOG-S1802 (NCT03678025). El primero es un ensayo multicéntrico que reclutará a 566 pacientes con CPHS oligometastásico25. Después de seis meses de tratamiento con apalutamida, los pacientes serán aleatorizados (1:1) para continuar el tratamiento con apalutamida sola o más un tratamiento local (dependiendo del investigador, radioterapia frente a prostatectomía). El estudio SWOG-S1802 es un ensayo fase III aleatorizado que estudia la eficacia de la terapia sistémica estándar con o sin tratamiento definitivo (prostatectomía citorreductora o radioterapia) en pacientes con cáncer de próstata metastásico.
Papel del tratamiento local de la enfermedad oligometastásica en CPHSmClínicamente, se ha demostrado que la terapia dirigida a metástasis (TDM), comúnmente mediante radioterapia estereotáctica corporal (SBRT o SABR)26 mejora la SLP. La evidencia principal proviene de dos ensayos fase II (STOMP y ORIOLE) que aleatorizaron pacientes con enfermedad oligometastásica (1-3 lesiones) a TDM (SBRT en el 81% de los pacientes en el STOMP y el 100% en el ORIOLE) o a observación27-29. En ambos ensayos se observó que la TDM permitía retrasar el tiempo al inicio de la TPA (tabla 2). Los datos combinados mostraron que la TDM mejoraba la SLP (5,9 meses para el grupo de observación y 11,9 para el grupo con TDM; HR: 0,44; IC 95%: 0,29-0,66; p <0,001)30. No hubo diferencias significativas en la SLP radiográfica, tiempo hasta resistencia a castración o SG.
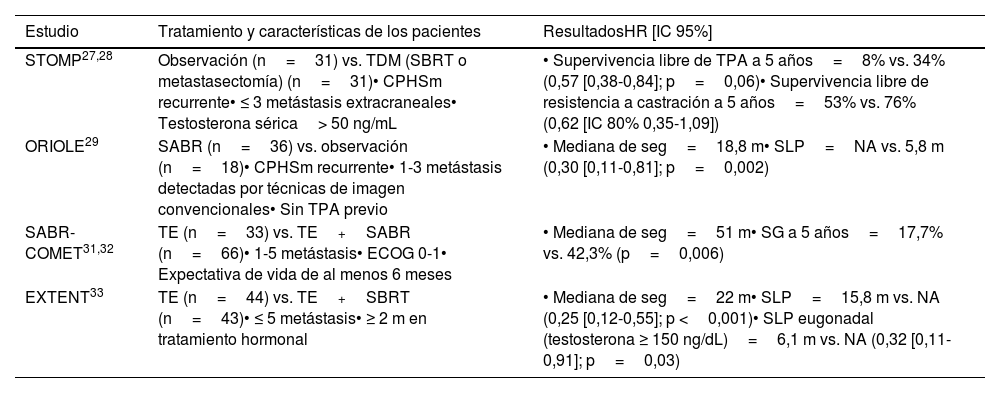
Evidencia sobre tratamiento local de las oligometástasis en el cáncer de próstata hormonosensible metastásico
| Estudio | Tratamiento y características de los pacientes | ResultadosHR [IC 95%] |
|---|---|---|
| STOMP27,28 | Observación (n=31) vs. TDM (SBRT o metastasectomía) (n=31)• CPHSm recurrente• ≤ 3 metástasis extracraneales• Testosterona sérica> 50 ng/mL | • Supervivencia libre de TPA a 5 años=8% vs. 34% (0,57 [0,38-0,84]; p=0,06)• Supervivencia libre de resistencia a castración a 5 años=53% vs. 76% (0,62 [IC 80% 0,35-1,09]) |
| ORIOLE29 | SABR (n=36) vs. observación (n=18)• CPHSm recurrente• 1-3 metástasis detectadas por técnicas de imagen convencionales• Sin TPA previo | • Mediana de seg=18,8 m• SLP=NA vs. 5,8 m (0,30 [0,11-0,81]; p=0,002) |
| SABR-COMET31,32 | TE (n=33) vs. TE+SABR (n=66)• 1-5 metástasis• ECOG 0-1• Expectativa de vida de al menos 6 meses | • Mediana de seg=51 m• SG a 5 años=17,7% vs. 42,3% (p=0,006) |
| EXTENT33 | TE (n=44) vs. TE+SBRT (n=43)• ≤ 5 metástasis• ≥ 2 m en tratamiento hormonal | • Mediana de seg=22 m• SLP=15,8 m vs. NA (0,25 [0,12-0,55]; p <0,001)• SLP eugonadal (testosterona ≥ 150 ng/dL)=6,1 m vs. NA (0,32 [0,11-0,91]; p=0,03) |
CPHSm: cáncer de próstata hormonosensible metastásico; HR: hazard ratio; IC: intervalo de confianza; m: meses; NA: no alcanzado; PSA: antígeno prostático específico; SABR: radioterapia estereotáctica corporal; SG: supervivencia global; SLP: supervivencia libre de progresión; TDM: terapia dirigida a las metástasis; TE: tratamiento estándar; TPA: terapia de privación androgénica.
El estudio fase II, abierto y aleatorizado multitumor, SABR-COMET (el 18% de pacientes tenían cáncer de próstata) evaluó el efecto de la SABR en enfermedad oligometastásica (1-5 metástasis)31,32. Los pacientes fueron aleatorizados (1:2) para recibir tratamiento estándar±SABR. Con una mediana de seguimiento de 51 meses, la tasa de SG a cinco años fue del 17,7% en el grupo control y del 42,3% en el grupo con SABR (p=0,006)32. El estudio fase II EXTENT también evidenció el beneficio de la TDM en CPHSm, que tras una mediana de seguimiento de 22 meses proporcionó una mejora significativa de la SLP33.
Actualmente, hay múltiples ensayos clínicos que evalúan el empleo de la SBRT sobre las oligometástasis en pacientes que reciben tratamiento estándar con nuevos antiandrógenos34-37, como el estudio español fase III START-MET (NCT05209243)38, que incluirá 266 pacientes con CPHSm, con enfermedad limitada (≤ 3 lesiones según tomografía computarizada (TC) y gammagrafía ósea y ≤ 5 lesiones según tomografía por emisión de positrones [PET]/TC-colina o antígeno prostático específico de membrana [PSMA]) en el diagnóstico o en un estadio oligorrecurrente, y serán aleatorizados (1:1) a tratamiento estándar+SBRT (para todas las lesiones) frente a tratamiento estándar.
Recomendación de expertos: en espera de resultados de ensayos aleatorizados, el tratamiento con TDM (y más específicamente SBRT) en enfermedad oligometastásica parece una opción a individualizar en pacientes bien informados y en el contexto de comités multidisciplinares.
Revisión de la actividad de los dobletesDoblete TPA+docetaxelDocetaxel mejora la supervivencia cuando se añade a TPA frente a monoterapia con TPA18,19,39-42. Aunque el estudio GETUG-AFU15 fue negativo en SG39,40, probablemente debido al mayor número de pacientes de bajo volumen, el estudio CHAARTED18,19 y la rama C del STAMPEDE41,42 fueron positivos para SG (tabla 3). Según CHAARTED, la mejoría fue más pronunciada en pacientes con alto volumen18,43. Sin embargo, en STAMPEDE el volumen de la enfermedad no influyó en el beneficio sobre la SG cuando se añadía docetaxel a la TPA41,42, probablemente porque el STAMPEDE incluyó más pacientes con bajo volumen que el CHAARTED (44% vs. 35%). Varios metaanálisis han demostrado que el beneficio del docetaxel es mayor en la enfermedad sincrónica y de alto volumen18,19,44.
Evidencia sobre el uso de dobletes en el cáncer de próstata hormonosensible metastásico
| Estudio | Tratamiento y características de los pacientes | ResultadosHR (IC95%) |
|---|---|---|
| TPA+docetaxel | ||
| GETUG-AFU1539,40 | TPA (orquiectomía o agonista de LHRH solo o en combinación con antiandrógenos no esteroideos)+docetaxel (n=192) vs. TPA (n=193)• Diagnóstico de CPHS con confirmación radiológica de metástasis• Karnofsky 70%• Esperanza de vida de al menos 3 meses• Se permitió tratamiento previo con TPA | • Mediana de seg=83,9 m• SG=62,1 vs. 48,6 m (0,88 [0,68-1,14]; p=0,3)• SG alta carga tumoral=39,8 vs. 35,1 m (0,78 [0,56-1,09]; p=0,14)• SG baja carga=NA vs. 83,4 m (1,02 [0,67-1,55]; p=0,9)• SG pacientes metastásicos en fase inicial=52,6 vs. 41,5 m (0,93 [0,69-1,25]; p=0,6) |
| CHAARTED18,19 | TPA+docetaxel (n=397) vs. TPA (n=393)• Diagnóstico de cáncer de próstata o niveles elevados de PSA• Evidencia radiológica de metástasis• Se permitió tratamiento previo con TPA• 73% sincrónicos• 65% alto volumen | • Mediana de seg=53,7 m• SG=57,6 vs. 47,2 m (0,72 [0,59-0,89]; p=0,0018)• SG alto volumen=51,2 vs. 34,4 m (0,63 [0,50-0,79]; p=0,001)• SG bajo volumen=1,04 (0,70-1,55); p=0,68 |
| STAMPEDE (rama C)41,42 | TPA+docetaxel (n=362) vs. TPA (n=724)• 61% con CPHSm• 58% sincrónicos• 56% alta carga tumoral | • Mediana de seg=78,2 m• SG docetaxel=59,1 m; 49% a 5 años• SG control=43,1 m; 37% a 5 años• 0,81 (0,69-0,95); p=0,003 |
| TPA+IRA | ||
| STAMPEDE (rama G)4,58 | Abiraterona+prednisolona+TPA (n=960) vs. TPA (n=957)• Recién diagnosticados de CPHSm, ganglios positivos• CPHSm localmente avanzado de alto riesgo (NOMO, ≥ 2 de las siguientes: T3 o T4, Gleason ≥ 8 y PSA ≥ 40 ng/mL)• Enfermedad recurrente tras terapia local con características de alto riesgo o metástasis• 49% sincrónicos• 52% alto riesgo | • Mediana seg=40 m• SG=0,61 (0,56-0,78); p <0,001 |
| LATITUDE3,45 | Abiraterona+prednisona+TPA (n=597) vs. TPA+placebo (n=602)• Recién diagnosticado CPHSm con ≥ 2 de los siguientes factores de alto riesgo: Gleason ≥ 8, ≥ 3 lesiones óseas, y metástasis visceral medible• 100% sincrónicos• 100% de alto riesgo | • Mediana seg=51,8 m• SG=53,3 vs. 36,5 m (0,66 [0,56-• 0,78]; p<0,0001)• SG alto riesgo/alto volumen=0,58 (0,41-0,83)• SG bajo riesgo/bajo volumen=0,69 (0,58-0,82) |
| ARCHES7,46 | Enzalutamida+TPA (n=574) vs. TPA+placebo (n=576)• Se permitió tratamiento previo con docetaxel o TPA• 63% alto volumen• 67% sincrónicos | • Mediana seg=44,6 m• SG=NA vs. NA (0,66 [0,53-0,81]; p <0,001)• SG alto riesgo/volumen=0,66 (0,52-0,83)• SG bajo riesgo/volumen=0,66 (0,43-1,02) |
| TITAN50,47 | Apalutamida+TPA (n=525) vs. TPA+placebo (n=527)• Se permitió tratamiento previo con docetaxel o TPA• 81% sincrónicos• 63% alto volumen | • Mediana seg=44 m• SG=NA vs. 52,2 m (0,65 [0,53-0,79]; p <0,0001)• SG alto riesgo/volumen=0,68 (0,50-0,92)• SG bajo riesgo/volumen=0,67 (0,34-1,32) |
| ENZAMET48,51 | Enzalutamida+supresión de testosterona (n=563) vs. supresión de testosterona+terapia antiandrógena no esteroidea (n=562)• Supresión de testosterona iniciada hasta 12 meses antes de la aleatorización• Se permitió la administración de docetaxel• 61% sincrónicos• 52% alto volumen | • Mediana seg=68 m• SG a 5 años=67% vs. 57% (0,7 [0,58-0,84]; p <0,0001) |
CPHSm: cáncer de próstata hormonosensible metastásico; HR: hazard ratio; IC: intervalo de confianza; IRA: inhibidores de la vía de los receptores androgénicos; LHRH: hormona liberadora de hormona luteinizante; m: meses; NA: no alcanzado; PSA: antígeno prostático específico; SG: supervivencia global; TPA: terapia de privación androgénica.
La rama G del estudio STAMPEDE comparó la combinación de abiraterona con prednisolona y TPA frente a TPA sola, mostrando una mejora en la SG a cinco años hasta del 60% vs. 41% en TPA4. De forma similar, en el ensayo LATITUDE, que incluyó solo pacientes con metástasis sincrónicas y de alto riesgo (definido como dos de tres de una puntuación de Gleason ≥ 8, ≥ 3 lesiones óseas y la presencia de metástasis viscerales), la mediana de SG fue de 53,3 meses en varones con CPHSm de novo de alto riesgo tratados con abiraterona y prednisona, frente a 36,5 meses en el grupo con TPA45. La apalutamida y enzalutamida también han confirmado el beneficio del doblete sobre monoterapia con TPA en términos de tiempo a resistencia a castración, SLP46 y SG47,48. La tabla 3 resume los estudios con la combinación de TPA con IRA frente a TPA sola.
Revisión de la evidencia de los tripletes: TPA+docetaxel+IRADos estudios fase III aleatorizados (PEACE-12 y ARASENS1,49) han demostrado la superioridad del triplete sobre el tratamiento doble de TPA+docetaxel (características de pacientes y resultados en la tabla 4). De ellos, ARASENS es el único diseñado desde el inicio para responder a si añadir un IRA mejora los resultados del doblete con docetaxel.
Evidencia sobre el uso de tripletes en el cáncer de próstata hormonosensible metastásico
| Estudio | Tratamiento y características de los pacientes | ResultadosHR (IC 95%) |
|---|---|---|
| ARASENS1,49 | Darolutamida+docetaxel+TPA (n=651) vs. TPA+docetaxel (n=655)• 100% sincrónicos• 77% alto volumen | • Mediana seg=43,7 m• SG=NR vs. 48.9 (HR 0,68; IC 95% 0,57-0,8; p <0,001)• SG alto volumen=0,69 (0,57-0,82)• SG bajo volumen=0,68 (0,41-1,13)• SG sincrónicos=0,71 (0,59-0,85)• SG metacrónicos=0,61 (0,35-1,05) |
| PEACE-12 | Abiraterona+prednisona+docetaxel+TPA (n=355) vs. TPA+docetaxel (n=355)• 100% sincrónicos• 64% alto volumen | • Mediana seg=45,6 m• SG=NA vs. 52,6 m (0,75 [0,59-0,95]; p=0,017)• SG alto volumen=0,72 (0,55-0,95)• SG bajo volumen=0,83 (0,5-1,39) |
HR: hazard ratio; IC: intervalo de confianza; m: meses; NA: no alcanzado; SG: supervivencia global; TPA: terapia de privación androgénica.
El estudio PEACE-1 tenía como objetivo inicial evaluar el papel del tratamiento local más la intensificación del tratamiento sistémico con abiraterona. Al extenderse el reclutamiento, el tratamiento estándar que inicialmente consistió solo en TPA, tras una modificación del protocolo fue TPA+docetaxel. La terapia triple mejoró la SG en comparación con docetaxel y TPA; con un beneficio mayor en pacientes con alto volumen2.
En un subanálisis del estudio PEACE-1 se evaluó el efecto del triplete en pacientes con ≥ 70 años en comparación con pacientes más jóvenes50. Los pacientes añosos tenían un peor estado funcional ECOG 1-2, y presentaban con más frecuencia hipertensión y diabetes mellitus tipo 2. Los resultados sugirieron que la población más mayor obtiene un menor beneficio en términos de SLP radiográfica y de SG, posiblemente debido a una mayor toxicidad que conduce a una interrupción más frecuente del fármaco, ya que en pacientes mayores lo suficientemente aptos como para recibir TPA+docetaxel, el beneficio de añadir abiraterona al tratamiento estándar fue comparable al obtenido en los más jóvenes50.
El único ensayo de registro publicado hasta ahora con un triplete es el ARASENS, que aleatorizó a 1.306 pacientes con CPHSm sincrónico y metacrónico (1:1) a TPA+docetaxel+darolutamida o placebo1,49. El triplete se asoció de nuevo a una mejora de la SG en el global y en todos los subgrupos de pacientes en comparación con el grupo control, pero fue superior en los pacientes con enfermedad sincrónica y alto volumen. Como dato adicional, la mayoría de los pacientes en este estudio recibieron terapias que prolongan la supervivencia a la progresión, lo que nuevamente confirma que un tratamiento secuencial es inferior a una intensificación de inicio. A largo plazo no se observó un efecto deletéreo en la calidad de vida de aquellos pacientes tratados con darolutamida ni efectos secundarios inesperados.
Recomendación de expertos: los pacientes candidatos a recibir docetaxel no deberían recibir solo un doblete con docetaxel. La combinación con darolutamida es la única disponible según ficha técnica, basada en un ensayo específico para demostrar superioridad sobre docetaxel. La combinación con abiraterona es una alternativa válida en aquellos pacientes en los que no pueda administrarse una terapia triple con darolutamida e individualizar según comorbilidades y potenciales toxicidades.
Revisión de la evidencia sobre comparaciones indirectas entre dobletes y tripletesEn los ensayos ARCHES, TITAN y ENZAMET se incluyeron un pequeño número de pacientes que recibieron terapia triple secuencial con docetaxel. En los dos primeros, docetaxel fue administrado a un 18% y 11%, respectivamente, y los análisis secundarios no encontraron un beneficio en la SG con el triplete, probablemente debido al bajo número de pacientes5,7,46,47. Sin embargo, en el estudio ENZAMET (el 45% de los pacientes recibieron triplete con docetaxel) los resultados sugirieron que el triplete aumentaba la SLP a expensas de una mayor toxicidad48,51.
Varias revisiones sistemáticas y metaanálisis han realizado comparaciones indirectas entre TPA+IRA+docetaxel frente a TPA+IRA52-57. En este sentido, en población general, la mayoría de análisis ha demostrado que la SLP y la SG fueron superiores con el triplete que con TPA+docetaxel5,7,46,47,53,54,56,57, sin embargo el triplete no es superior cuando se compara con TPA+IRA52,53,55,56. En cuanto al análisis de subgrupos, la SG fue superior con el triplete frente a TPA+docetaxel solo en pacientes de alto volumen y sincrónicos53,56. En pacientes de bajo volumen, el triplete no mostró un beneficio significativo en comparación con TPA+docetaxel, e incluso sería desfavorable en comparación con TPA+IRA57. Los resultados de toxicidad fueron muy variables de unos análisis a otros, desde no observar diferencias hasta un aumento de toxicidad grado 3 con los tripletes, especialmente la hipertensión arterial con abiraterona y darolutamida52,57.
Recomendación de expertos: para aquellos pacientes metastásicos de alto volumen tumoral, especialmente de novo y sin contraindicaciones para docetaxel, el tratamiento recomendado podría ser un triplete. Los pacientes no candidatos a un tratamiento con docetaxel deberían recibir un doblete de TPA+IRA. No se contempla un doblete con docetaxel. La terapia única con TPA debería limitarse a pacientes con importantes comorbilidades y que podrían no beneficiarse de una intensificación a medio plazo.
ConclusionesEl panorama terapéutico del CPHSm ha evolucionado rápidamente, dejando obsoleto el tratamiento de TPA sola y el de TPA+docetaxel. Los avances se resumen en la incorporación de la radioterapia local en la enfermedad metastásica, y en la evidencia de un efecto sinérgico de los diferentes tratamientos usados de forma concomitante. La elección de un triplete sobre un doblete con IRA no puede basarse en los resultados de un ensayo directo. Algunos criterios propuestos para tomar en consideración son la tolerancia a un tratamiento con docetaxel, el volumen de la enfermedad y la temporalidad en la forma de presentación metastásica. Si bien estos criterios son imperfectos, deberíamos buscar individualizaciones terapéuticas basadas en paneles génicos y biomarcadores.
FinanciaciónEste trabajo ha sido financiado por Bayer de acuerdo con las Guías de Buenas Prácticas de Publicación (GPP-2022).
Conflicto de interesesÁ. Borque-Fernando ha participado en sesiones de formación y ha recibido honorarios por asesoría de Asofarma, Astellas-Pharma, AstraZeneca, Bayer, GP Pharm, HealthMDx, Ipsen, Janssen, Lacer, MSD, Pharmalink y Recordati.
A. Zapatero ha recibido honorarios por ponencias, asesoría, investigación y otros apoyos no financieros de Astellas-Pharma y Janssen.
R. Manneh ha recibido honorarios por ponencias, asesorías e investigación de AstraZeneca, Amgen, Astellas-Pharma, Bayer, BMS, Eli Lilly, Ipsen, Jannsen, MSD, Merck Serono, Novartis, Pfizer, Roche y Tecnofarma.
T. Alonso-Gordoa ha recibido honorarios por ponencias, asesorías, investigación y otros apoyos no financieros de IPSEN, Eli Lilly, Adacap, Pfizer, Sanofi, EISAI, Bayer, Janssen, Astellas-Pharma, Novartis y MSD.
F. Couñago ha recibido honorarios de Janssen, Astellas, IPSEN, Recordati, Boston Scientific, AstraZeneca y Bayer por la participación en comités de expertos y conferencias impartidas.
M. Domínguez ha recibido honorarios de Janssen, Astellas, IPSEN, Bristol, AAA, Boston Scientific, Intuitive, AstraZeneca y Bayer por la participación en comités de expertos y conferencias impartidas.
M. López Valcárcel ha recibido honorarios por ponencias, asesorías, investigación y otros apoyos no financieros de Astellas-Pharma, Janssen, Bayer, Recordati y MSD.
Alfredo Rodríguez Antolín ha recibido honorarios por su participación en sesiones de formación y asesoría de Astellas-Pharma, AstraZeneca, Novartis, Bayer y Janssen.
N. Sala González: ha recibido becas de investigación, honorarios y otros apoyos no financieros de IPSEN Pfizer, Bayer, BMS y MSD.
N. Sanmamed ha recibido honorarios por asesoría de Astellas-Pharma.
P. Maroto ha recibido honorarios por ponencias, asesorías, y otros apoyos como ayudas logísticas de Astellas, Janssen, Bayer, MSD y Novartis.
AgradecimientosLos autores agradecen a Fernando Sánchez Barbero PhD, en nombre de Springer Healthcare, el soporte editorial y la ayuda en la redacción del manuscrito.