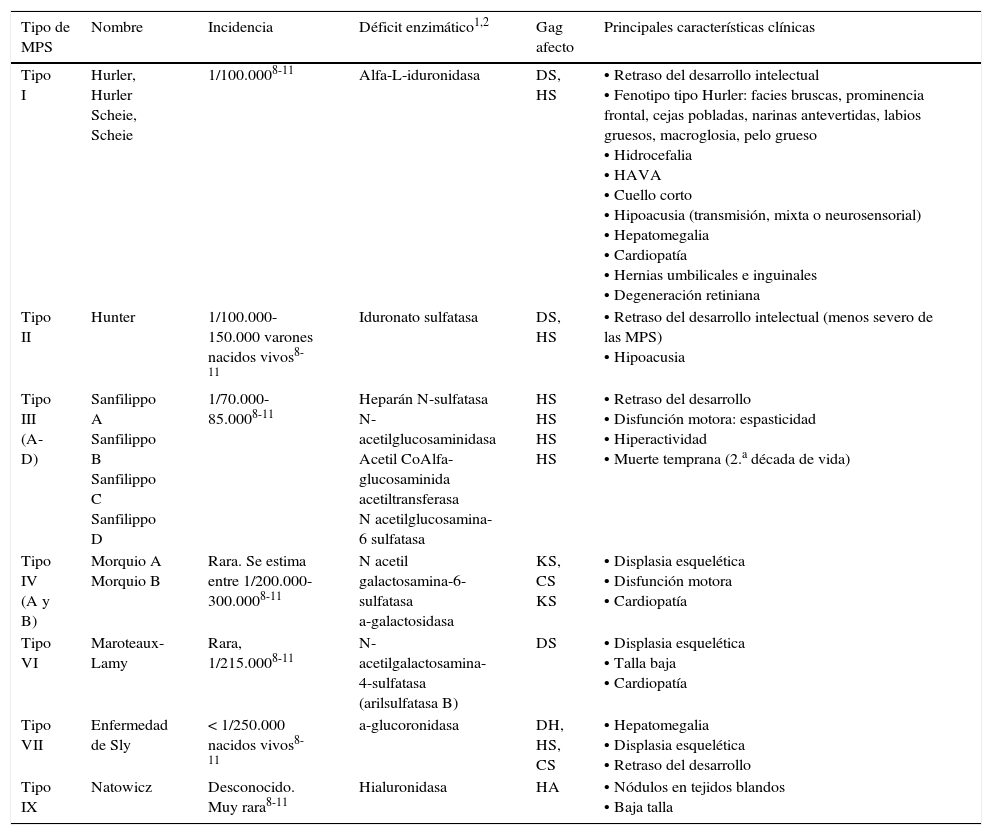
Revisión y descripción de la afectación otoaudiológica en el seguimiento de 23niños con diagnóstico de mucopolisacaridosis (MPS) tipoI, II, III y IV.
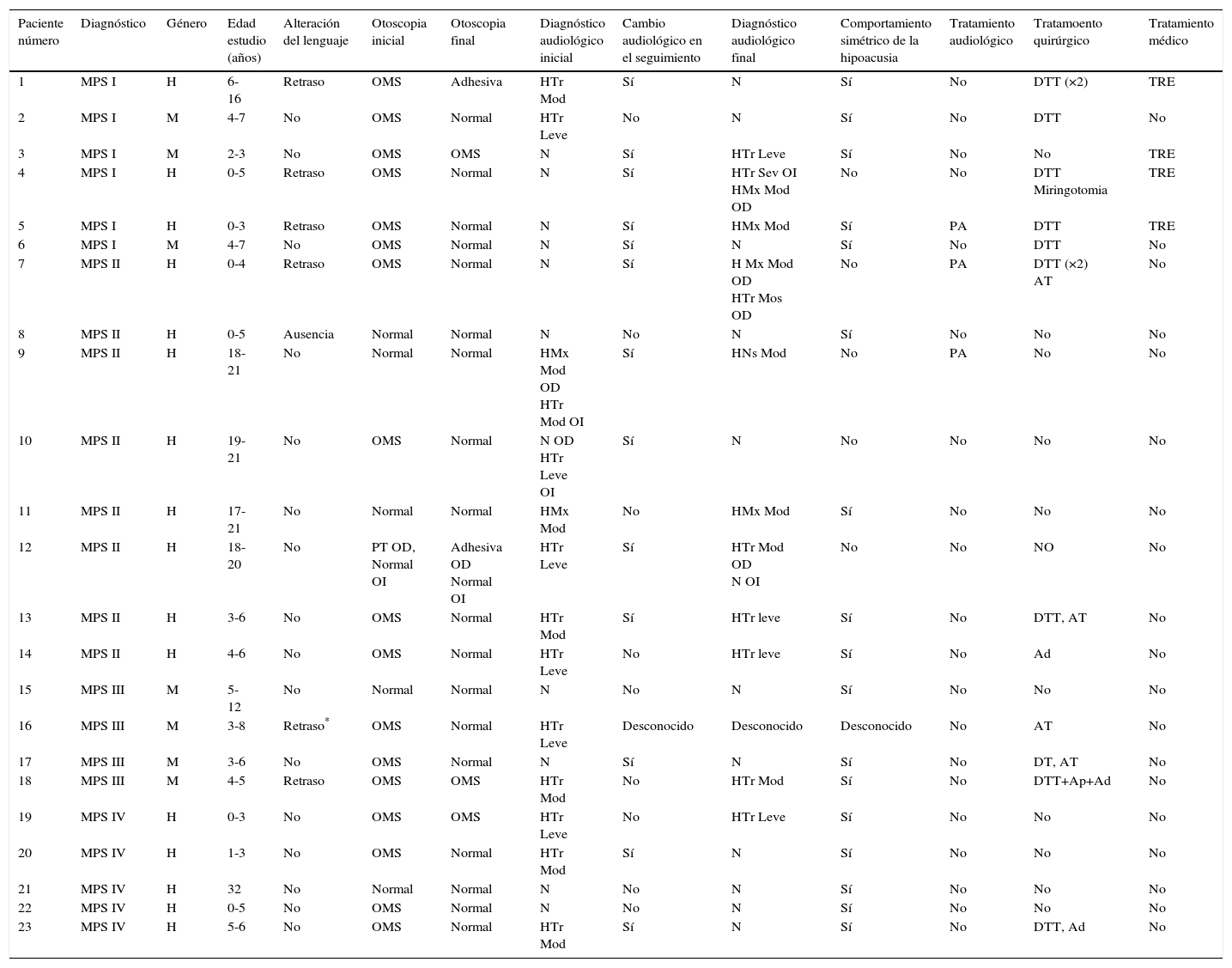
MétodosEstudio retrospectivo de los hallazgos clínicos, audiológicos y tratamiento (médico y/o quirúrgico) de 23niños con diagnóstico de MPS tipoI, II, III o IV en seguimiento en un hospital terciario entre 1997 y 2015.
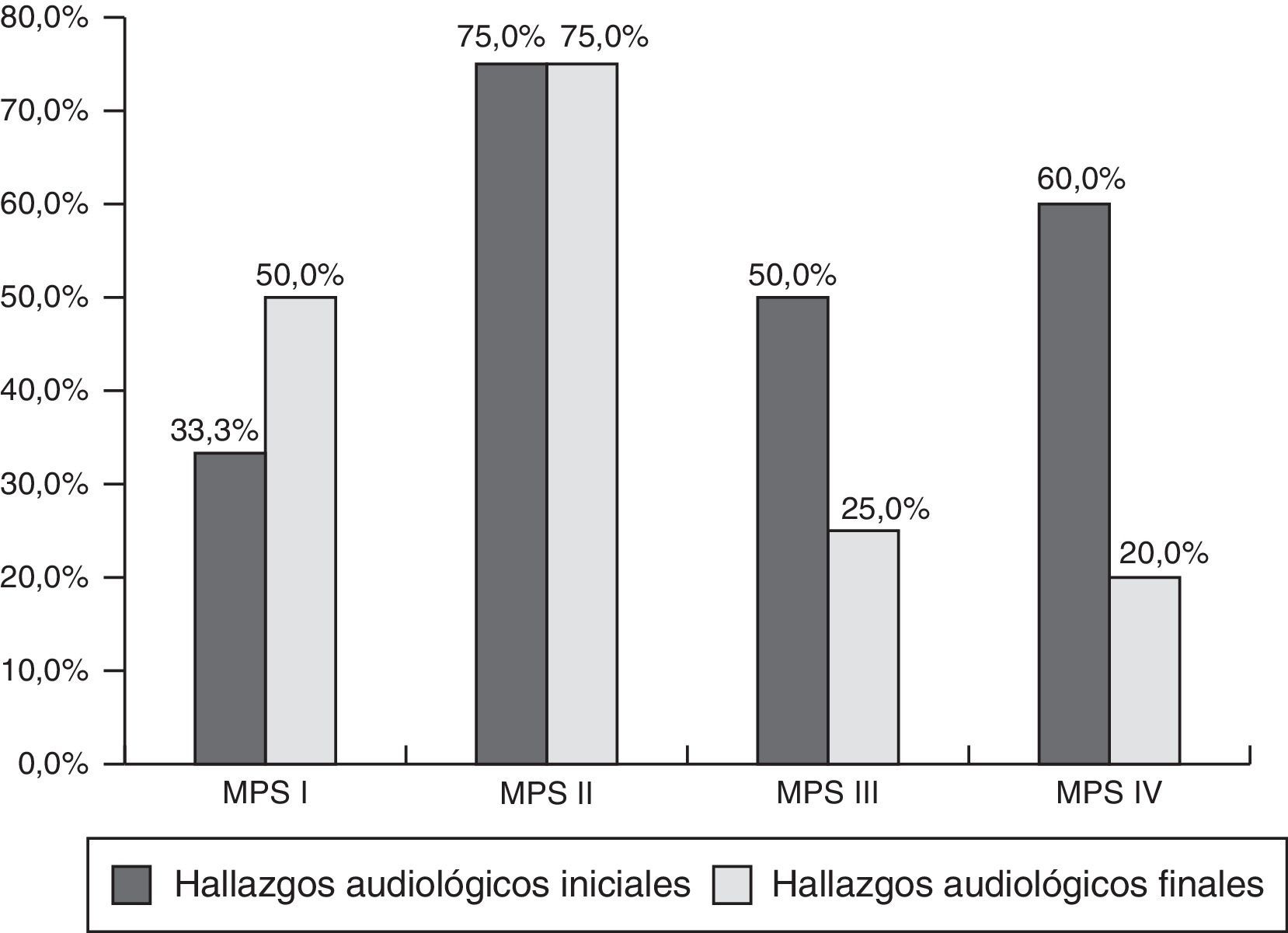
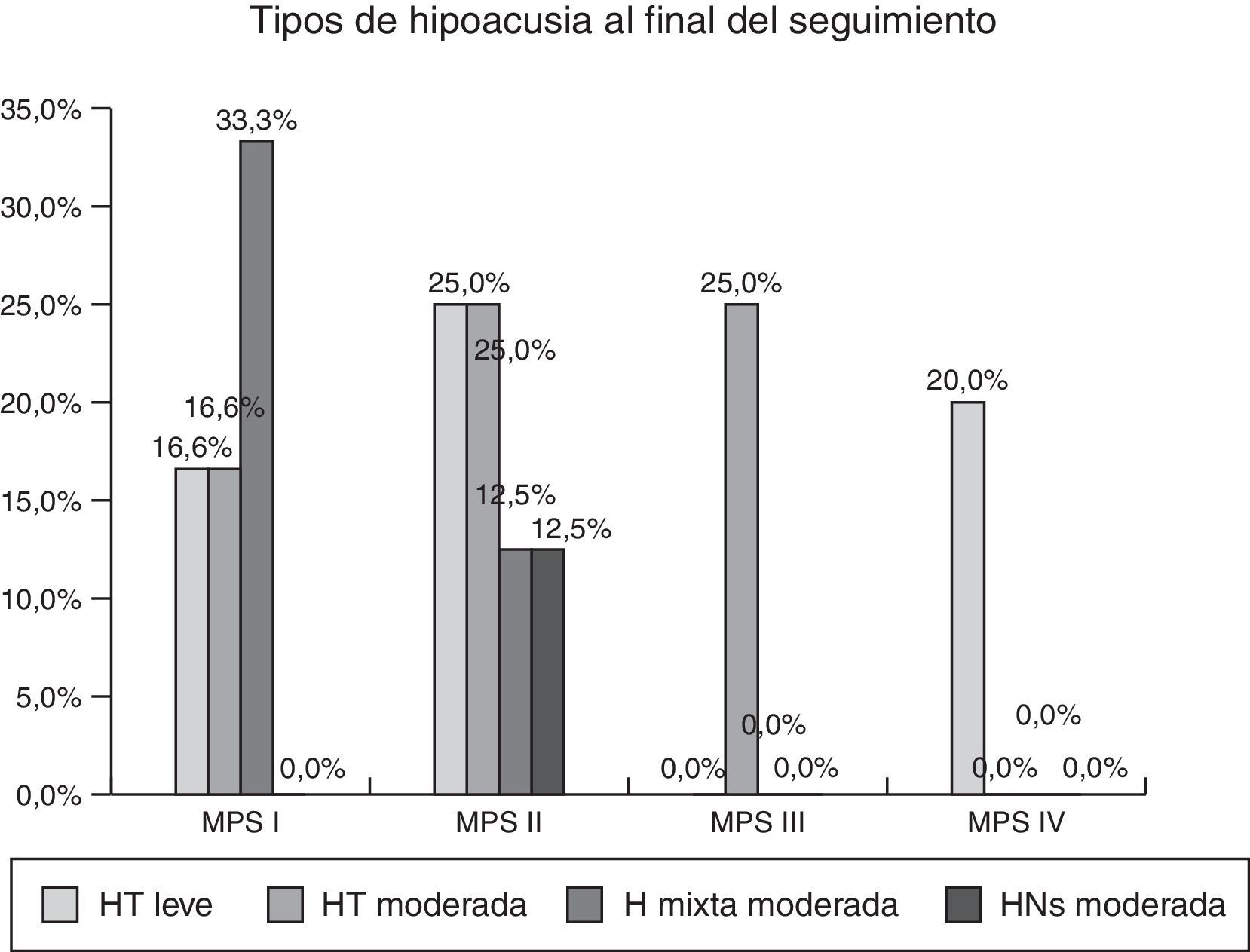
ResultadosSeis casos de MPSI, 8 de MPSII, 4 de MPSIII y 5 de MPSIV fueron revisados. Al inicio del seguimiento el 71,2% de los pacientes presentaban otitis media serosa (OMS) y el 54% de los casos presentaban algún tipo de hipoacusia. El comportamiento de la hipoacusia fue fluctuante en cada uno de los subgrupos de MPS, encontrando mayor afectación y variabilidad en los tiposI y II.
ConclusionesLos niños afectos de MPS tienen un alto riesgo de hipoacusia, siendo MPS tipoI y II los casos con mayor porcentaje de afectación audiológica y con un comportamiento menos homogéneo, mostrando un importante porcentaje de hipoacusias transmisivas que progresan a componentes mixtos o neurosensoriales. Se requiere un seguimiento periódico dada la importante repercusión de esta patología en la calidad de vida y en el desarrollo de estos pacientes.
The aim of our study is to reflect hearing impairment of 23children diagnosed with mucopolysaccharidosis (MPS) typeI, II, III and IV.
MethodsRetrospective study of the clinical, audiological and treatment (medical vs surgical) findings of 23children diagnosed with MPS typeI, II, III or IV followed at a Tertiary Referral Hospital between 1997 and 2015.
ResultsSix cases of MPSI, 8 of MPSII, 4 of MPSIII and 5 of MPSIV were reviewed. 71.2% of patients had secretory otitis media (SOM) and 54% of patients had some type of hearing loss (HL). The behaviour of hearing loss was variable in each of the subgroups of MPS, finding greater involvement and variability in typesI and II.
ConclusionsChildren with MPS have a high risk of hearing loss. A significant percentage of transmissive HL progressing to mixed or sensorineural HL was observed. This was more common in typesI and II. Periodic follow up of these patients is mandatory because of hearing impairment and consequences for their development and quality of life.