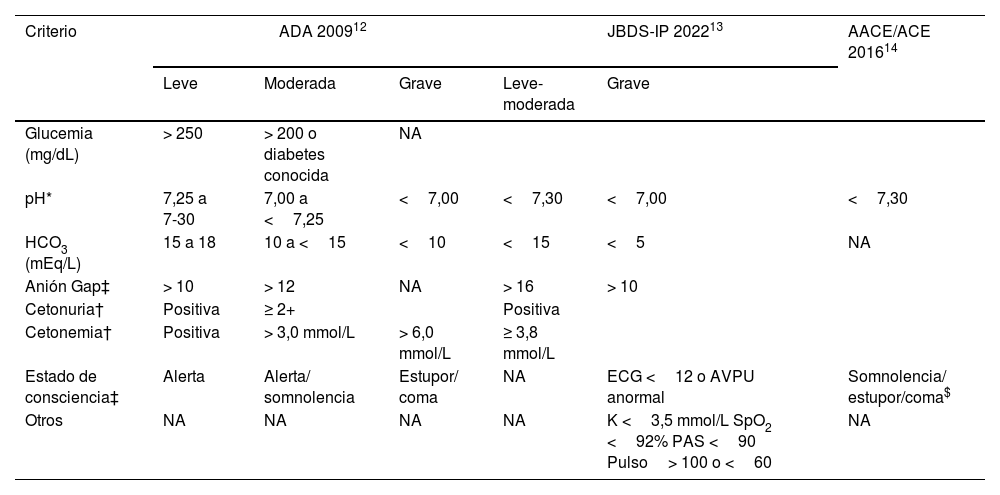
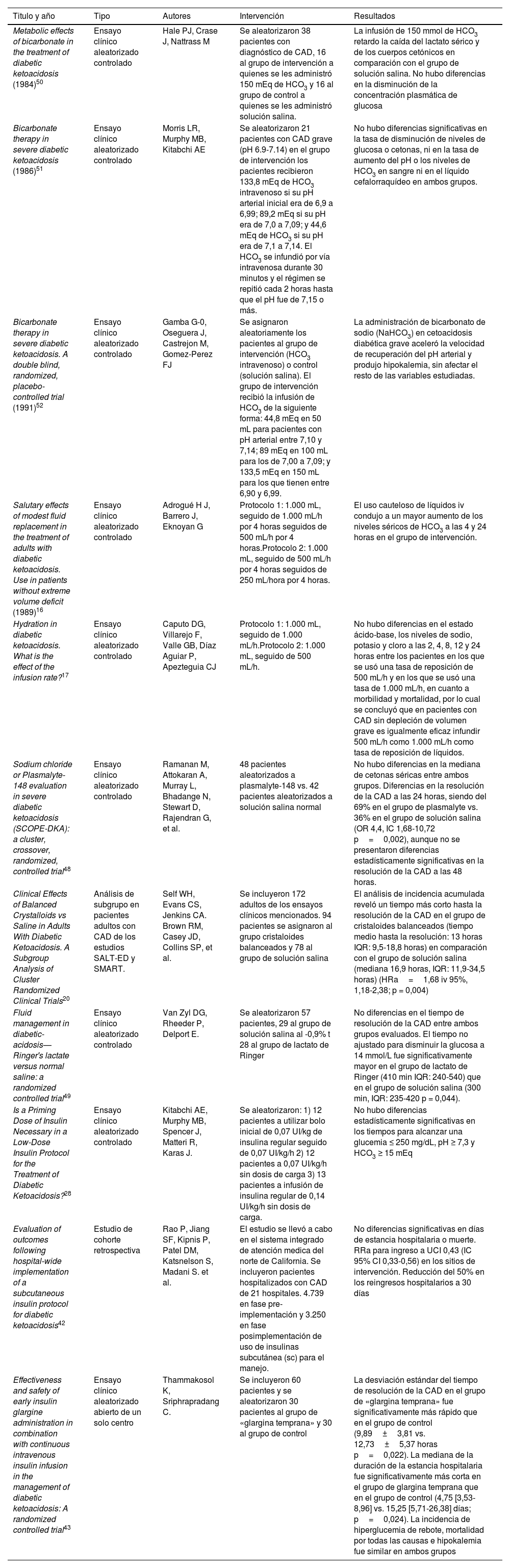
La diabetes mellitus es una de las condiciones crónicas no transmisibles más prevalentes a nivel mundial. Entre sus complicaciones agudas, la cetoacidosis diabética (CAD) es la emergencia más común. Para su diagnóstico es esencial conocer sus manifestaciones clínicas y criterios diagnósticos establecidos por las diferentes sociedades científicas. El tratamiento de la CAD se sustenta en tres pilares fundamentales, la administración temprana de líquidos, la insulinoterapia y la corrección de los trastornos electrolíticos. Sin embargo, en situaciones especiales las medidas anteriores se deben individualizar. Con un tratamiento adecuado y rápido, la tasa de supervivencia libre de morbilidad puede acercarse al 100%. En esta revisión, basados en un caso clínico, proporcionaremos información más reciente con referente al abordaje integral de la CAD en el paciente crítico.
Diabetes mellitus is one of the most prevalent non-communicable chronic conditions worldwide. Among its acute complications, diabetic ketoacidosis (DKA) is the most common emergency. For its diagnosis, it is essential to know the most common clinical manifestations and diagnostic criteria established by different scientific societies. The treatment of DKA is based on three key elements, early fluid administration, insulin therapy and correction of electrolyte disorders. However, in special situations the above measures must be individualized. With appropriate and prompt treatment, the morbidity-free survival rate can reach up to 100%. In this review, based on a clinical case, we will provide more recent information regarding the comprehensive approach to DKA in critically ill patients.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí