Los pacientes con lupus eritematoso sistémico (LES) tienen un riesgo aumentado de padecer infecciones tanto adquiridas en la comunidad como asociadas con el cuidado de la salud. Las infecciones bacterianas son las más frecuentes y graves durante la hospitalización de estos pacientes.
ObjetivoDesarrollar y validar internamente un modelo de predicción clínica de pronóstico del riesgo de infección bacteriana adquirida en el hospital en pacientes con LES, usando datos clínicos y de laboratorio obtenidos durante las primeras horas de hospitalización.
MétodosSe analizó una cohorte retrospectiva de pacientes con LES mayores de 16 años, hospitalizados por motivos diferentes a infección bacteriana en 2 hospitales de alta complejidad de Medellín entre 2011 y 2016. Se compararon las características de los pacientes que desarrollaron el desenlace de infección bacteriana entre el día 3 y el día 15 de hospitalización con aquellos que no lo presentaron. Las variables significativas en el análisis bivariado fueron consideradas para la construcción del modelo por medio de regresión logística multivariada.
ResultadosSe incluyeron 765 episodios, de los cuales 98 (12,8%) presentaron el desenlace de interés. Se consideraron 35 predictores candidatos. Las variables incorporadas en el modelo final fueron: edad, recuento de neutrófilos, puntaje de actividad lúpica SLEDAI, uso de sonda vesical, uso de catéter venoso central en las primeras 72h, dosis de glucocorticoides en el mes previo y el uso de un antimalárico en los 3 meses previos. La capacidad de discriminación del modelo fue aceptable a buena (AUC-ROC 0,74; IC 95% 0,69-0,80). La prueba de bondad de ajuste de Hosmer-Lemeshow (p=0,637) evidenció una adecuada calibración.
ConclusiónDesarrollamos un modelo de predicción clínica de pronóstico del riesgo de infección bacteriana nosocomial en pacientes con LES. El modelo desarrollado está compuesto por variables clínicas y de laboratorio simples disponibles en el momento del ingreso al hospital. Se requieren estudios de validación externa y de impacto clínico antes de su implementación rutinaria.
Patients with systemic lupus erythematosus (SLE) have an increased risk of developing community-acquired infections, as well as those associated with health care. Bacterial infections are the most common and serious while these patients are in hospital.
ObjectiveTo develop, and internally validate, a clinical prediction model for the prognosis of the risk of hospital-acquired bacterial infection in SLE patients using clinical and laboratory data obtained during the first hours of hospital admission.
MethodsAn analysis was performed on retrospective cohort of patients with SLE older than 16 years and admitted for reasons other than bacterial infection in 2 highly complex hospitals in Medellín between 2011 and 2016. The characteristics of the patients who developed a bacterial infection were compared between day 3 and day 15 of hospital admission with those who did not develop one. The significant variables in the bivariate analysis were used for the construction of the model using multivariate logistic regression.
ResultsA total of 765 episodes were included, of which 98 (12.8%) presented the outcome of interest. Thirty-five candidate predictors were considered. The variables incorporated in the final model were: age, neutrophil count, SLEDAI lupus activity score, use of a bladder catheter, use of a central venous catheter in the first 72h, glucocorticoid doses in the previous month, and use of an antimalarial drug in the 3 previous months. The discrimination capacity of the model was acceptable to good (AUC-ROC 0.74; 95% CI 0.69-0.80). The Hosmer-Lemeshow goodness of fit test (P=.637) suggested adequate calibration.
ConclusionA clinical prediction model of prognostic risk of nosocomial bacterial infection in patients with SLE has been developed. This model is made up of simple clinical and laboratory variables available at the time of hospital admission. External validation and clinical impact studies are required before routine implementation.
Durante el curso de la enfermedad, hasta la mitad de los pacientes con lupus eritematoso sistémico (LES) desarrollarán al menos una infección1. Las infecciones en pacientes con LES representan entre el 11 y el 23% de los motivos de hospitalización2 y entre el 3,6 y el 67% de todas las muertes en pacientes con esta enfermedad3. Las infecciones pueden ser de muchas clases y ocurrir en cualquier contexto clínico. Dentro de las infecciones adquiridas en el hospital sobresalen las bacterianas por su mayor frecuencia y gravedad. Tales infecciones se asocian con un aumento de los días de estancia hospitalaria, un retraso en el inicio o la continuación del tratamiento inmunosupresor, el ingreso a cuidados intensivos, un incremento de los costos sanitarios y un aumento de la mortalidad4,5.
Se han reportado diferentes factores de riesgo asociados con infección en pacientes con LES. Dentro de ellos se encuentran la actividad de la enfermedad6; el compromiso de órganos o de sistemas individuales, especialmente la nefritis lúpica, el compromiso pulmonar y la actividad en el sistema nervioso central7; la leucopenia, la linfopenia y la neutropenia8; los títulos elevados de anti-ADN y los niveles bajos de las fracciones C3 y C4 del complemento9; el uso de esteroides crónicos10; el uso de pulsos de metilprednisolona para el tratamiento de las exacerbaciones11; el uso de ciclofosfamida, empleada para el tratamiento de manifestaciones graves como las clases proliferativas de la nefritis lúpica y el compromiso del sistema nervioso central12, entre otros.
A pesar de la frecuencia y la gravedad de las infecciones en LES y del reconocimiento de diferentes factores de riesgo asociados con estas, las recomendaciones preventivas siguen siendo muy limitadas13. Para el estudio y la implementación de medidas preventivas se requiere idealmente la estratificación adecuada del riesgo individual de infección en contextos clínicos bien delimitados. Dicha cuantificación del riesgo individual de infección debería basarse en modelos predictivos, por medio de una aproximación multivariada al problema, y no mediante la simple identificación de factores de riesgo aislados14. Se encontraron 2 modelos de predicción del pronóstico de infección en pacientes con LES.
Yuhara et al.15 desarrollaron un modelo para estimar el riesgo de infección mayor, definida como aquella que requiriera el uso de un antimicrobiano intravenoso a los 6 meses del inicio de la terapia con glucocorticoides. Solo hubo 17 eventos de infección, dentro de los cuales se incluyeron también hongos y micobacterias. Tejera Segura et al. publicaron un modelo predictivo de infección mayor futura en pacientes con LES. La validación externa se hizo por medio de un diseño de casos y controles. No es claro el horizonte temporal de la predicción16. No se encontró ningún modelo para estimar el riesgo de infección bacteriana nosocomial y poder así evaluar e implementar estrategias preventivas o terapéuticas específicas y personalizadas.
El objetivo de nuestro trabajo fue desarrollar y validar internamente un modelo de predicción clínica de pronóstico del riesgo de infección bacteriana intrahospitalaria, en pacientes con LES mayores de 16 años hospitalizados por motivos diferentes a una infección, basado en los datos clínicos y de laboratorio disponibles durante las primeras horas del ingreso al hospital.
Pacientes y métodosDiseñoEstudio de cohorte retrospectiva para el desarrollo y la validación interna de un modelo predictivo de pronóstico del riesgo de infección bacteriana intrahospitalaria en pacientes con LES.
ParticipantesPacientes de cualquier sexo con diagnóstico de LES, con una edad mayor o igual a 16 años, atendidos entre enero de 2006 y diciembre de 2016 en el Hospital Universitario de San Vicente Fundación y el Hospital Pablo Tobón Uribe de la ciudad de Medellín, Colombia, que cumplieron con los siguientes criterios de inclusión: hospitalización por motivo diferente a infección, ausencia de diagnóstico de infección a las 48h de ingreso, ausencia de tratamiento antibiótico en las primeras 48h de ingreso, duración de la hospitalización mayor de 72h. Para el diagnóstico de LES se usaron los criterios de clasificación del Colegio Americano de Reumatología de 1982 actualizados en 199717,18. No hubo criterios de exclusión.
DesenlaceLa variable de desenlace fue el diagnóstico de infección bacteriana adquirida entre el día 3 y el día 15 de hospitalización, definida como aquella infección confirmada por cualquier aislamiento microbiológico bacteriano o en ausencia de este que haya sido diagnosticada por los médicos tratantes con base en síntomas, signos, laboratorios o imágenes; que hubiera requerido el uso de uno o más antibióticos intravenosos y que hubiera sido diagnosticada 48h después del ingreso hospitalario en, ausencia de sospecha de que se estuviera incubando durante este lapso.
PredictoresLas variables independientes fueron los predictores potenciales de infección intrahospitalaria y se seleccionaron luego de revisar exhaustivamente la literatura científica. Los datos de cada paciente se tomaron de los registros clínicos de las primeras 72h de hospitalización.
El cálculo del tamaño de la muestra se basó en los reportes publicados de la frecuencia de infecciones bacterianas de los 2 centros hospitalarios incluidos6,19. Se calculó que habría unas 1.200 hospitalizaciones de pacientes con LES durante los 10 años de observación en las instituciones incluidas, de los cuales en un 50% de las veces se hubiera administrado ciclofosfamida o iniciado mofetil micofenolato, y que de estos, un 20% hubiese presentado infección bacteriana nosocomial durante los 15 días siguientes. Se estimó que se contaría con 600 episodios hospitalarios elegibles y 120 infecciones bacterianas nosocomiales, lo que habría de permitir que se consideraran al menos 12 variables predictoras.
Plan de análisisLas variables cuantitativas se presentan como promedios o medianas, con su respectiva medida de dispersión, y las variables cualitativas como número absoluto y porcentaje del total. La asociación entre las diferentes variables independientes y el desenlace principal se evaluó mediante la prueba t de Student o la U de Mann-Whitney según la distribución de las variables cuantitativas, y mediante la Chi cuadrado o la prueba exacta de Fisher para las variables categóricas.
Las variables cuantitativas fueron ingresadas al modelo en forma continua, sin realizar dicotomización ni transformaciones matemáticas. No se planeó la imputación de datos, por lo cual solo se hicieron análisis de casos completos. Se realizaron inicialmente análisis de regresión logística bivariados con cada una de las variables independientes definidas previamente. Se verificaron los supuestos necesarios para la regresión logística. Se exploró la capacidad de discriminación de cada una de las variables de predicción candidatas y se consideraron para el modelo final aquellas con un valor de p en el estadístico de Wald<0,25, con datos ausentes≤20%, que exhibieran un comportamiento monótono y no presentaran alta colinealidad entre ellas.
Posteriormente, se incluyeron todas las variables candidatas propuestas en un modelo de regresión logística multivariado. Para esta selección se hicieron múltiples comparaciones manuales de las propiedades de discriminación y calibración usando las curvas ROC y las pruebas de bondad de ajuste de Hosmer-Lemeshow, respectivamente. Siempre se usaron como guía criterios estadísticos, junto con el criterio clínico y el principio de parsimonia durante la selección del mejor modelo.
Por último, se realizó la validación interna del modelo final por medio del método de remuestreo (bootstrapping). A este último fin se efectuaron 200 repeticiones sin reemplazo y se analizó la estabilidad de las variables finalmente incluidas. Para todos los análisis se utilizó el programa estadístico Stata 12.
El protocolo del estudio fue aprobado por el Comité de Ética de la Investigación del Hospital Universitario de San Vicente Fundación y por el Comité de Investigaciones y Ética en Investigaciones del Hospital Pablo Tobón Uribe. Por el carácter retrospectivo de la investigación, esta se calificó de riesgo mínimo. Debido a ello no se consideró necesaria la obtención de consentimiento informado. Durante todas las fases de este proyecto se cumplió con las buenas prácticas clínicas vigentes para realizar investigación clínica. Los datos se mantendrán anónimos y siempre se protegerá la confidencialidad de la información de cada participante.
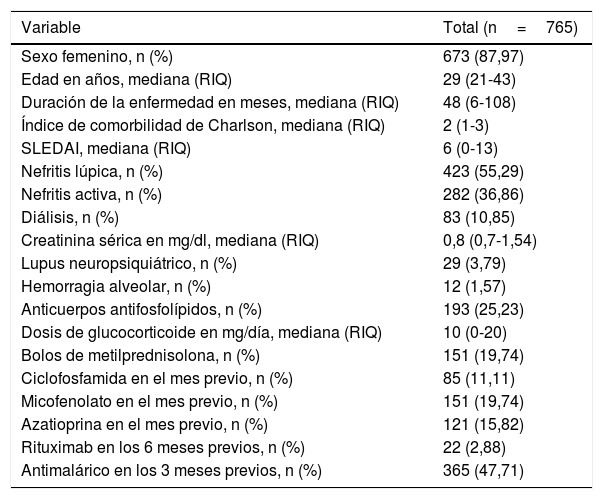
ResultadosSe revisaron 2.802 episodios de hospitalización de pacientes con diagnóstico de egreso de LES que tuvieron una estancia mayor de 72h. De estos, se incluyeron 765 episodios, de los cuales un 12,8% (n=98) presentaron el desenlace de interés. Las características demográficas y clínicas de los pacientes incluidos se muestran en la tabla 1.
Características demográficas y clínicas de la población incluida
| Variable | Total (n=765) |
|---|---|
| Sexo femenino, n (%) | 673 (87,97) |
| Edad en años, mediana (RIQ) | 29 (21-43) |
| Duración de la enfermedad en meses, mediana (RIQ) | 48 (6-108) |
| Índice de comorbilidad de Charlson, mediana (RIQ) | 2 (1-3) |
| SLEDAI, mediana (RIQ) | 6 (0-13) |
| Nefritis lúpica, n (%) | 423 (55,29) |
| Nefritis activa, n (%) | 282 (36,86) |
| Diálisis, n (%) | 83 (10,85) |
| Creatinina sérica en mg/dl, mediana (RIQ) | 0,8 (0,7-1,54) |
| Lupus neuropsiquiátrico, n (%) | 29 (3,79) |
| Hemorragia alveolar, n (%) | 12 (1,57) |
| Anticuerpos antifosfolípidos, n (%) | 193 (25,23) |
| Dosis de glucocorticoide en mg/día, mediana (RIQ) | 10 (0-20) |
| Bolos de metilprednisolona, n (%) | 151 (19,74) |
| Ciclofosfamida en el mes previo, n (%) | 85 (11,11) |
| Micofenolato en el mes previo, n (%) | 151 (19,74) |
| Azatioprina en el mes previo, n (%) | 121 (15,82) |
| Rituximab en los 6 meses previos, n (%) | 22 (2,88) |
| Antimalárico en los 3 meses previos, n (%) | 365 (47,71) |
RIQ: rango intercuartílico.
Las infecciones más frecuentemente adquiridas en el hospital fueron: bacteriemia (27 casos), infección del tracto urinario (25 casos), infecciones de tejidos blandos (19 casos) y neumonía (15 casos). Se logró aislamiento microbiológico en el 67% de las infecciones diagnosticadas. Los microorganismos más frecuentes fueron: Escherichia coli, Staphylococcus aureus y Klebsiella spp. El germen más frecuente en los casos de bacteriemia fue S. aureus (40,7%).
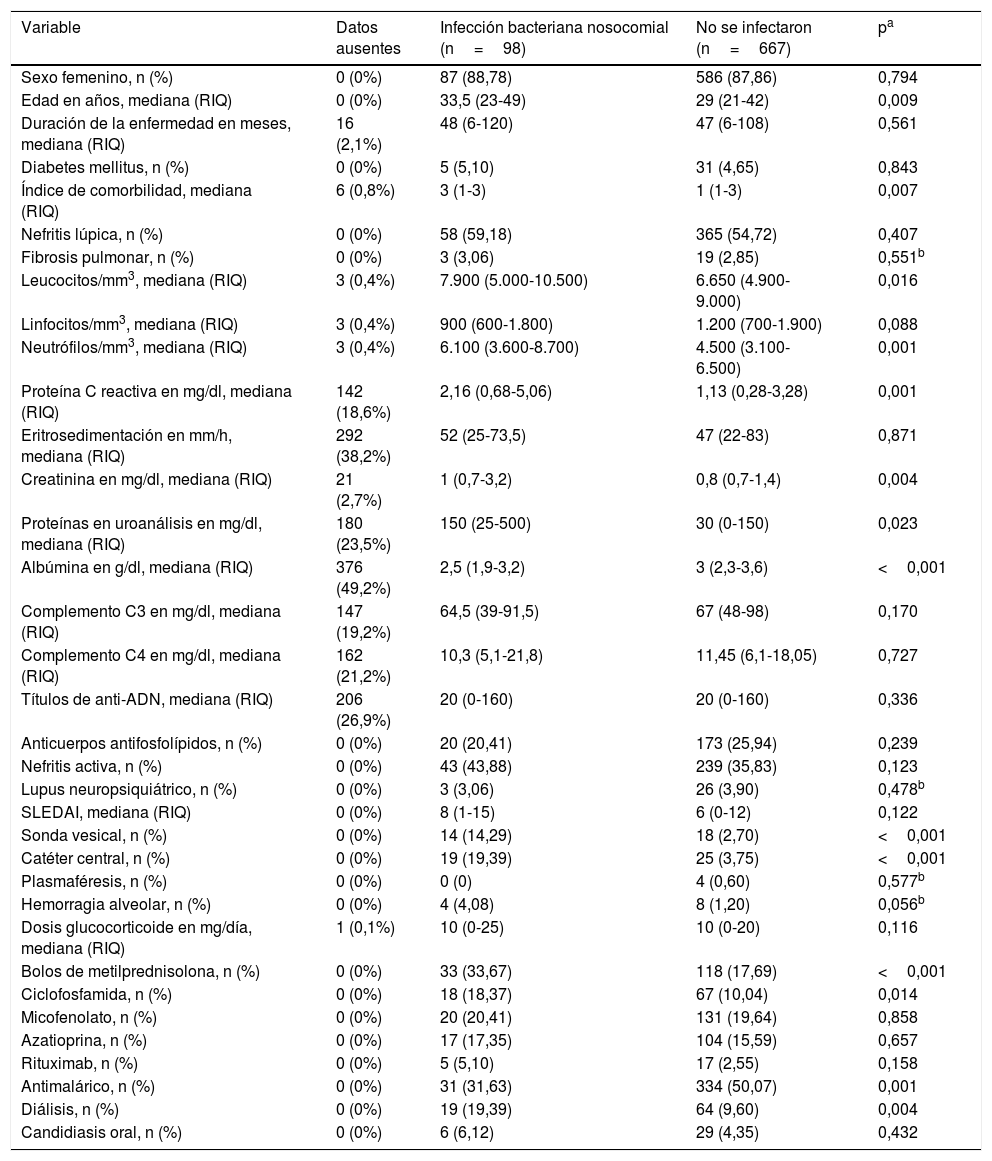
En la tabla 2 se muestra el análisis bivariado inicial comparando entre aquellos que presentaron el desenlace y los que no lo presentaron. Los pacientes que se infectaron durante la hospitalización mostraron diferencias significativas en las siguientes variables medidas al ingreso: edad, índice de comorbilidad de Charlson, leucocitos, neutrófilos, proteína C reactiva (PCR), creatinina, proteinuria en muestra aislada, necesidad de diálisis, albúmina, uso de catéter venoso central, uso de sonda vesical, uso de antimalárico, bolos de metilprednisolona y uso de ciclofosfamida.
Análisis bivariado de acuerdo con el desarrollo de la infección bacteriana nosocomial
| Variable | Datos ausentes | Infección bacteriana nosocomial (n=98) | No se infectaron (n=667) | pa |
|---|---|---|---|---|
| Sexo femenino, n (%) | 0 (0%) | 87 (88,78) | 586 (87,86) | 0,794 |
| Edad en años, mediana (RIQ) | 0 (0%) | 33,5 (23-49) | 29 (21-42) | 0,009 |
| Duración de la enfermedad en meses, mediana (RIQ) | 16 (2,1%) | 48 (6-120) | 47 (6-108) | 0,561 |
| Diabetes mellitus, n (%) | 0 (0%) | 5 (5,10) | 31 (4,65) | 0,843 |
| Índice de comorbilidad, mediana (RIQ) | 6 (0,8%) | 3 (1-3) | 1 (1-3) | 0,007 |
| Nefritis lúpica, n (%) | 0 (0%) | 58 (59,18) | 365 (54,72) | 0,407 |
| Fibrosis pulmonar, n (%) | 0 (0%) | 3 (3,06) | 19 (2,85) | 0,551b |
| Leucocitos/mm3, mediana (RIQ) | 3 (0,4%) | 7.900 (5.000-10.500) | 6.650 (4.900-9.000) | 0,016 |
| Linfocitos/mm3, mediana (RIQ) | 3 (0,4%) | 900 (600-1.800) | 1.200 (700-1.900) | 0,088 |
| Neutrófilos/mm3, mediana (RIQ) | 3 (0,4%) | 6.100 (3.600-8.700) | 4.500 (3.100-6.500) | 0,001 |
| Proteína C reactiva en mg/dl, mediana (RIQ) | 142 (18,6%) | 2,16 (0,68-5,06) | 1,13 (0,28-3,28) | 0,001 |
| Eritrosedimentación en mm/h, mediana (RIQ) | 292 (38,2%) | 52 (25-73,5) | 47 (22-83) | 0,871 |
| Creatinina en mg/dl, mediana (RIQ) | 21 (2,7%) | 1 (0,7-3,2) | 0,8 (0,7-1,4) | 0,004 |
| Proteínas en uroanálisis en mg/dl, mediana (RIQ) | 180 (23,5%) | 150 (25-500) | 30 (0-150) | 0,023 |
| Albúmina en g/dl, mediana (RIQ) | 376 (49,2%) | 2,5 (1,9-3,2) | 3 (2,3-3,6) | <0,001 |
| Complemento C3 en mg/dl, mediana (RIQ) | 147 (19,2%) | 64,5 (39-91,5) | 67 (48-98) | 0,170 |
| Complemento C4 en mg/dl, mediana (RIQ) | 162 (21,2%) | 10,3 (5,1-21,8) | 11,45 (6,1-18,05) | 0,727 |
| Títulos de anti-ADN, mediana (RIQ) | 206 (26,9%) | 20 (0-160) | 20 (0-160) | 0,336 |
| Anticuerpos antifosfolípidos, n (%) | 0 (0%) | 20 (20,41) | 173 (25,94) | 0,239 |
| Nefritis activa, n (%) | 0 (0%) | 43 (43,88) | 239 (35,83) | 0,123 |
| Lupus neuropsiquiátrico, n (%) | 0 (0%) | 3 (3,06) | 26 (3,90) | 0,478b |
| SLEDAI, mediana (RIQ) | 0 (0%) | 8 (1-15) | 6 (0-12) | 0,122 |
| Sonda vesical, n (%) | 0 (0%) | 14 (14,29) | 18 (2,70) | <0,001 |
| Catéter central, n (%) | 0 (0%) | 19 (19,39) | 25 (3,75) | <0,001 |
| Plasmaféresis, n (%) | 0 (0%) | 0 (0) | 4 (0,60) | 0,577b |
| Hemorragia alveolar, n (%) | 0 (0%) | 4 (4,08) | 8 (1,20) | 0,056b |
| Dosis glucocorticoide en mg/día, mediana (RIQ) | 1 (0,1%) | 10 (0-25) | 10 (0-20) | 0,116 |
| Bolos de metilprednisolona, n (%) | 0 (0%) | 33 (33,67) | 118 (17,69) | <0,001 |
| Ciclofosfamida, n (%) | 0 (0%) | 18 (18,37) | 67 (10,04) | 0,014 |
| Micofenolato, n (%) | 0 (0%) | 20 (20,41) | 131 (19,64) | 0,858 |
| Azatioprina, n (%) | 0 (0%) | 17 (17,35) | 104 (15,59) | 0,657 |
| Rituximab, n (%) | 0 (0%) | 5 (5,10) | 17 (2,55) | 0,158 |
| Antimalárico, n (%) | 0 (0%) | 31 (31,63) | 334 (50,07) | 0,001 |
| Diálisis, n (%) | 0 (0%) | 19 (19,39) | 64 (9,60) | 0,004 |
| Candidiasis oral, n (%) | 0 (0%) | 6 (6,12) | 29 (4,35) | 0,432 |
RIQ: rango intercuartílico.
Para el análisis de regresión logística multivariado se excluyeron las siguientes variables por porcentaje de datos ausentes mayor del 20%: eritrosedimentación, proteinuria en muestra aislada, albúmina sérica, complemento C4 y anti-ADN. De estas, mostraron una diferencia significativa la proteinuria en muestra aislada y la albúmina. La variable comorbilidad no mostró monotonía, por lo que fue excluida.
Por medio de una matriz de correlaciones se sospechó alta colinealidad entre las variables leucocitos y neutrófilos (0,89) y entre las variables C3 y SLEDAI (−0,55). Se decidió excluir la variable leucocitos (porque la variable neutrófilos podría aportar más información independiente de la variable linfocitos) y complemento C3 (por una mayor cantidad de datos ausentes). Se incluyeron entonces en el modelo completo inicial las variables: edad, linfocitos, neutrófilos, PCR, creatinina, nefritis activa, SLEDAI, uso de sonda vesical, uso de catéter venoso central, hemorragia alveolar, dosis diaria de prednisolona, pulsos de metilprednisolona, ciclofosfamida, uso de antimalárico y diálisis. Las variables creatinina, nefritis activa y diálisis pueden estar fuertemente correlacionadas, por lo cual se dejó solamente la variable diálisis por presentar un menor número de datos ausentes.
El análisis de casos completos con la variable PCR solo permitiría incluir 604 observaciones de 765 totales; se decidió, por tanto, eliminar dicha variable para aprovechar mejor la información disponible. En busca del modelo más parsimonioso se eliminó paso a paso, con base en la significación estadística y el rendimiento observado, las variables hemorragia alveolar, ciclofosfamida, linfocitos, rituximab, diálisis y pulsos de glucocorticoides. El análisis de casos completos final incluyó 762 de 765 episodios.
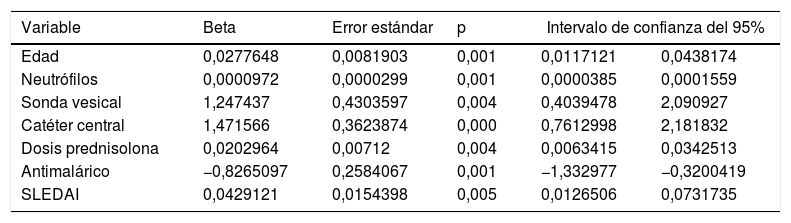
El modelo final incluyó los siguientes predictores: edad, neutrófilos, SLEDAI, uso de sonda vesical, uso de catéter venoso central, dosis de glucocorticoides en el mes previo a la hospitalización y el uso de un antimalárico en los 3 meses previos al ingreso. La tabla 3 muestra los coeficientes de cada predictor con su respectivo error estándar. El área bajo la curva ROC del modelo final fue de 0,74 (IC 95% 0,69-0,80). La prueba de bondad de ajuste de Hosmer-Lemeshow evidenció una adecuada calibración (p=0,637). Con un punto de corte de 0,16 se obtiene el mejor balance entre sensibilidad (55,1) y especificidad (82,5). Por medio de un remuestreo se realizó una validación interna del modelo, en la cual se observó estabilidad en todos los coeficientes estimados.
Variables incluidas en el modelo predictivo final
| Variable | Beta | Error estándar | p | Intervalo de confianza del 95% | |
|---|---|---|---|---|---|
| Edad | 0,0277648 | 0,0081903 | 0,001 | 0,0117121 | 0,0438174 |
| Neutrófilos | 0,0000972 | 0,0000299 | 0,001 | 0,0000385 | 0,0001559 |
| Sonda vesical | 1,247437 | 0,4303597 | 0,004 | 0,4039478 | 2,090927 |
| Catéter central | 1,471566 | 0,3623874 | 0,000 | 0,7612998 | 2,181832 |
| Dosis prednisolona | 0,0202964 | 0,00712 | 0,004 | 0,0063415 | 0,0342513 |
| Antimalárico | −0,8265097 | 0,2584067 | 0,001 | −1,332977 | −0,3200419 |
| SLEDAI | 0,0429121 | 0,0154398 | 0,005 | 0,0126506 | 0,0731735 |
Se construyó un modelo de pronóstico para la predicción del riesgo de adquirir una infección bacteriana nosocomial para pacientes lúpicos que se hospitalizan por causas diferentes a infección. Las variables incluidas fueron: edad, neutrófilos, SLEDAI, uso de sonda vesical, uso de catéter venoso central, dosis de glucocorticoides en el mes previo a la hospitalización y uso de un antimalárico en los 3 meses previos al ingreso.
Este modelo predictivo está compuesto por variables clínicas y de laboratorio simples y fáciles de medir en las primeras horas de hospitalización. El área bajo la curva ROC de 0,74 indica una capacidad de discriminación de aceptable a buena. La variable dependiente se restringió a las infecciones bacterianas porque son las más frecuentes y graves. Estas infecciones se asocian con una estancia más prolongada, un mayor ingreso a cuidados intensivos y una menor tasa de supervivencia4,5.
Adicionalmente, las infecciones nosocomiales causadas por otros microorganismos probablemente tengan factores de riesgo/predictores diferentes que podrían generar confusión y reducir la aplicabilidad clínica si se usara un desenlace mixto. No se incluyeron infecciones diagnosticadas después del día 14 de hospitalización debido a que posiblemente no estarían influidas por algunas de las variables medidas cerca de la fecha de ingreso, momento que consideramos idóneo para establecer el riesgo de desarrollar el desenlace.
En una búsqueda sistemática de la literatura no se encontraron modelos de predicción específicos de infección bacteriana nosocomial en pacientes con LES, pero otros autores han construido modelos predictivos de infección para estos pacientes usando diferentes definiciones, poblaciones y metodologías: Yuhara et al. diseñaron un modelo para predecir infección mayor de cualquier etiología dentro de los 6 meses a partir del inicio de la terapia con glucocorticoides para el tratamiento de un episodio de actividad lúpica que requiriera hospitalización. Los predictores finales fueron: nivel de albúmina sérica, nivel de creatinina sérica y uso de prednisolona a una dosis≥60mg/día sin uso de pulsos de metilprednisolona15.
Tejera Segura et al. desarrollaron un modelo de predicción de infección mayor en LES, a partir de la cohorte española RELESSER-T, al cual denominaron SLESIS (SLE severe infection score) y que incluyó una edad mayor de 46 años, etnia latinoamericana, dosis de prednisolona>10mg/día, sexo masculino, hospitalización previa por LES, índice de gravedad de Katz y antecedente de infección en cualquier momento. Dicho modelo fue sometido a validación externa en una cohorte independiente y el área ROC fue de 0,66 (IC 95% 0,56-0,71)16. Los horizontes temporales de predicción a largo plazo y los desenlaces compuestos utilizados en estos 2 modelos limitan su probable aplicación clínica.
La infección bacteriana nosocomial más frecuente en nuestro estudio fue la bacteriemia. Marcos et al. describieron 48 episodios de bacteriemia en 38 pacientes con LES atendidos en el Hospital Clínic de Barcelona; el 41% de los eventos fueron nosocomiales, siendo S. aureus el aislamiento más común, y el 55% tenía un catéter venoso central presente20. La bacteriemia fue la cuarta infección grave más frecuente y la principal causa de muerte por infección en el registro español RELESSER-T5. Rua-Figueroa et al. realizaron un estudio de casos y controles anidado en esa cohorte para describir las características de la bacteriemia; los gérmenes más usuales fueron E. coli (29,8%), S. aureus (16,7%) y Salmonella spp. (10,5%); el 24,6% tenía un catéter venoso central insertado, el 35,1% de los eventos fueron nosocomiales y en el análisis bivariado los antimaláricos fueron protectores para el desarrollo de infecciones bacterianas adquiridas en el hospital21.
Al igual que en nuestro estudio, Rúa-Figueroa et al. identificaron la edad al diagnóstico como un factor de riesgo independiente asociado con infección, lo que evidencia que el lupus ejerce tal vez más impacto sobre el sistema inmune con el aumento de la edad5. A su vez, Mok et al. indicaron que la edad es un factor importante que afecta las manifestaciones clínicas y el pronóstico del LES; la infección es una causa mayor de mortalidad en el LES de inicio tardío22,23.
Aunque en nuestro estudio la inserción de una línea venosa central y una sonda vesical en las primeras 72h de estancia fue factor predictor de infección bacteriana nosocomial, otros estudios no han reportado estas variables como significativas en sus análisis multivariados6,20,21,24–29; sin embargo, es bastante reconocido que constituyen un factor de riesgo para infecciones del torrente sanguíneo30.
Los glucocorticoides son un factor de riesgo para infección en LES, consistentemente reportado en múltiples estudios, asociación que depende de la dosis y el tiempo de uso9,27,31–38. Pocos estudios han caracterizado la relación específica entre infección adquirida en el hospital y el uso de glucocorticoides antes de la hospitalización; en algunos se reportó que se comportaba como un factor de riesgo en el análisis multivariado15,26,27,39, pero no en otros6,25,29.
En nuestro estudio, un mayor conteo de neutrófilos en las primeras horas de hospitalización se asoció con infección bacteriana nosocomial. El hallazgo de neutrofilia en pacientes con LES suele orientar más hacia una infección ya presente o hacia un efecto transitorio producido por los glucocorticoides40,41. Una posible explicación para nuestro hallazgo podría ser que el grupo con el desenlace de infección bacteriana mayor intrahospitalaria requirió el uso de mayores dosis de glucocorticoides, incluidos pulsos de metilprednisolona y aumento de la dosis ambulatoria previa, debido a que la enfermedad tenía una mayor actividad, como lo refleja el SLEDAI más alto y la necesidad de ingreso hospitalario por actividad lúpica en la mitad de los pacientes.
Otra posibilidad podría ser que el mayor conteo de neutrófilos refleje actividad de la enfermedad42. Alternativamente, este mayor conteo de neutrófilos podría indicar que la infección estaba incubándose en esas primeras horas de la estancia sin ser diagnosticada todavía, pero la sospecha de este último escenario era uno de los criterios de exclusión del estudio.
Así mismo, se encontró que un mayor puntaje SLEDAI confería un mayor riesgo de presentar infección bacteriana nosocomial, posiblemente como reflejo de un LES más grave, y la consecuente necesidad de emplear un tratamiento inmunosupresor más intenso. Esta asociación concuerda con lo informado en otras investigaciones, en las que se identificaron factores de riesgo para infecciones adquiridas en el hospital en pacientes con LES43. Ramírez Gómez et al. hallaron que una mediana más alta de SLEDAI al ingreso en el hospital se asoció con un mayor riesgo de infección nosocomial (OR 4,43; IC 95% 1,16-16,8; p=0,03)6. Navarro-Zarza et al. encontraron que un puntaje Mex-SLEDAI≥6 fue un factor de riesgo para infección en pacientes ambulatorios y hospitalizados29. En el estudio de Duffy et al. un puntaje>8 fue la variable más sensible y específica para predecir infección en pacientes con LES hospitalizados25.
El aparente efecto protector de los antimaláricos en el desarrollo de infecciones ha sido reportado por varios autores. Ruiz-Irastorza et al., por ejemplo, encontraron, en su estudio de casos y controles anidado en la cohorte Lupus-Cruces, que el tratamiento con antimaláricos se asociaba con un riesgo 16 veces menor de sufrir una infección grave (OR 0,06; IC 95% 0,02-0,18)7. Sisó et al. analizaron la influencia del uso de cloroquina o hidroxicloroquina antes del diagnóstico de nefritis lúpica en una cohorte de 204 pacientes durante un seguimiento promedio de 148 meses. Los expuestos a estos medicamentos tuvieron menos infecciones (11 vs. 29%; p=0,006)44. Feldman et al., en su robusta cohorte con usuarios de Medicaid, reportaron que el uso basal de hidroxicloroquina se asoció con un menor riesgo de una primera infección grave (HR 0,73; IC 95% 0,68-0,77)31.
Nuestro estudio tiene varias limitaciones. Por su carácter retrospectivo, los datos de algunas variables independientes estuvieron ausentes en más del 20% de los episodios, incluyendo algunas significativas en el análisis bivariado como la albúmina, reportada como predictor de infección en algunos estudios y cuya capacidad de predicción de infección nosocomial sería interesante de analizar en un diseño prospectivo. El número de desenlaces obtenidos fue pequeño y no se alcanzó la relación ideal de una variable independiente por al menos cada 10 desenlaces45. No se excluyeron los episodios en los que las infecciones virales, fúngicas o parasitarias eran el motivo de hospitalización (4,83%), debido a que el objetivo era predecir infección nosocomial de etiología bacteriana; sin embargo, es posible que estas infecciones hayan afectado algunas variables independientes, como los recuentos total y diferencial de leucocitos y los valores de VSG y PCR.
El modelo de predicción clínica desarrollado y validado internamente requiere al menos un estudio de validación externa antes de considerar la evaluación de su probable impacto clínico por medio de estudios controlados. Dentro de las aplicaciones clínicas que podría tener este modelo estarían implementar y evaluar intervenciones encaminadas a disminuir el riesgo de infección de estos pacientes por medio de un seguimiento más estrecho, el ajuste de la inmunosupresión, el aislamiento preventivo y el uso de antimicrobianos profilácticos, entre otras.
ConclusionesSe construyó un modelo de predicción clínica de pronóstico del riesgo de infección bacteriana nosocomial para pacientes con LES hospitalizados. El modelo desarrollado está compuesto por variables clínicas y de laboratorio simples, disponibles en el momento del ingreso al hospital. El modelo propuesto estima el riesgo de un desenlace grave, claramente definido y que ocurre dentro de un horizonte temporal a corto plazo, lo que le confiere un alto potencial de utilidad clínica. Se requieren estudios de validación externa y de impacto clínico antes de su implementación rutinaria.
FinanciaciónEl presente trabajo recibió apoyo financiero de la Asociación Colombiana de Reumatología.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores expresan su inmensa gratitud al Comité de Ética de la Investigación del Hospital Universitario San Vicente Fundación y al Comité de Investigaciones y Ética en Investigaciones del Hospital Pablo Tobón Uribe, de la ciudad de Medellín.