La oxigenoterapia continua domiciliara (OCD) es el primer tratamiento que ha demostrado aumentar la supervivencia de los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) e hipoxemia crónica, junto con el abandono del consumo de tabaco.
ObjetivoConocer la supervivencia de una cohorte de pacientes con EPOC en OCD y analizar las principales causas y factores de riesgo que pueden relacionarse con su mortalidad.
MétodosEstudio prospectivo de una cohorte de pacientes EPOC en OCD. Se han recogido numerosas variables, además de la situación vital y causas de la muerte al final del seguimiento.
ResultadosSe han incluido 409 pacientes EPOC en OCD (85,6% varones; edad media: 71,27 ± 9,74 años). La media de seguimiento en OCD fue de 5,86 ± 3,24 años y la mediana de supervivencia de 6 años (IC95%: 5,47-6,53). La mortalidad al final del seguimiento fue de un 75,8%, siendo la principal causa de muerte de origen respiratorio (36,9%). Una mayor supervivencia se relacionó de manera significativa con una menor edad, cumplimiento correcto OCD, ausencia de exacerbaciones el año previo, empleo de anticolinérgico de larga duración (LAMA), menor severidad de la EPOC, presencia de síndrome apnea-hipopnea del sueño/síndrome hipoventilación-obesidad (SAHS/SHO), ausencia de neoplasias, cardiopatía, enfermedad cerebrovascular y renal.
ConclusionesLa supervivencia de los pacientes EPOC en OCD fue muy prolongada. Las principales causas de mortalidad han sido de origen respiratorio (36,9%). Fueron predictores independientes de mortalidad la edad, la presencia de exacerbaciones el año previo, el diagnóstico previo de cáncer, la presencia de enfermedad cerebrovascular y renal.
Continuous home oxygen therapy (CHOT), along with smoking cessation, is the first treatment that has been shown to increase the survival of patients with chronic obstructive pulmonary disease (COPD) and chronic hypoxemia.
ObjectiveTo determine survival in a cohort of COPD patients receiving CHOT and to analyze the main causes and risk factors associated with their mortality.
MethodsProspective study of a cohort of COPD patients receiving CHOT. Numerous variables, including survival and cause of death at the end of follow-up, were collected.
ResultsA total of 409 COPD patients receiving CHOT were included (85.6% men; mean age: 71.27 ± 9.74 years). Mean time of CHOT follow-up was 5.86 ± 3.24 years and median survival was 6 years (95% CI: 5.47-6.53). Mortality at the end of follow-up was 75.8%, the leading cause of death being respiratory (36.9%). Longer survival was significantly associated with lower age, correct CHOT compliance, absence of exacerbations in the previous year, use of long-acting anticholinergics (LAMA), less severe COPD, presence of sleep apnea-hypopnea syndrome/obesity hypoventilation syndrome (SAHS/SHO), absence of malignant disease, heart disease, cerebrovascular disease, and kidney disease.
ConclusionsThe survival of COPD patients receiving CHOT was very long. The main causes of mortality were respiratory (36.9%). Independent predictors of mortality were age, presence of exacerbations in the previous year, previous diagnosis of cancer, and presence of cerebrovascular and renal disease.
La OCD es uno de los tratamientos más importante en el manejo de la enfermedad respiratoria crónica evolucionada1. Está indicada en pacientes con EPOC e insuficiencia respiratoria2; continuando vigentes las recomendaciones establecidas en dos ensayos clínicos publicados hace más de 30 años3,4. Los pacientes con EPOC e hipoxemia crónica presentan una elevada morbi-mortalidad, siendo la oxigenoterapia la única medida que ha demostrado aumentar su supervivencia junto con el abandono del consumo de tabaco2.
Nuestro objetivo ha sido analizar la supervivencia en el momento de finalización del estudio de una cohorte de pacientes con EPOC que reciben OCD, y valorar cuales han sido las causas de muerte y los factores de riesgo que pueden influir en su supervivencia.
MétodosDiseño del estudioSe ha realizado un estudio prospectivo, en el que se han incluido a todos los pacientes con EPOC que recibían OCD en el momento de inicio del estudio, estableciéndose éste con fecha del 1 de octubre de 2010. Es importante reseñar que la fecha de inicio de la oxigenoterapia difiere del momento de registro de los pacientes en el estudio. Los pacientes provienen de un listado proporcionado por la empresa suministradora de la oxigenoterapia y los datos se han obtenido mediante la revisión de informes clínicos procedentes de los servicios que hayan pautado esta terapia.
La prescripción de oxigenoterapia se ha considerado correcta si cumplían las indicaciones de OCD establecidas según las recomendaciones SEPAR1; y la cumplimentación se ha catalogado correcta si empleaban esta terapia un mínimo de 16h al día, mediante la información proporcionada en los informes clínicos. El cumplimiento del tratamiento broncodilatador se ha considerado correcto si realizaban la técnica inhalatoria de forma adecuada y seguían la pauta establecida según la información aportada en las historias clínicas. La severidad de la EPOC se ha evaluado en función de las guías clínicas disponibles en el momento de finalizar el estudio (GOLD 20135 y GesEPOC 20126), reevaluando la gravedad que presentaba cada paciente sin registrar directamente la que figuraba en los documentos clínicos.
Se han incluido aquellos pacientes con diagnóstico de EPOC definido por una relación volumen espiratorio máximo en el primer segundo/capacidad vital forzada (FEV1/FVC) postbroncodilatación menor del 70%, en tratamiento activo con OCD en el momento de inicio del estudio y en situación de insuficiencia respiratoria (PaO2 menor de 55mmHg) o hipoxemia moderada (PaO2 ≥ de 55mmHg) con datos de insuficiencia cardiaca o cor pulmonale asociado, excluyendo a los pacientes que no presentaban estas características. Se recogió el consumo de tabaco de cada uno de los pacientes con diagnóstico correcto de EPOC, sin establecer un punto de corte fijo para incluirlos en el estudio.
Todos los pacientes han sido seguidos hasta el 4 de octubre de 2016, fecha establecida previamente como final del estudio, evaluando su situación vital, como vivo o fallecido. En el caso de haber fallecido se ha registrado fecha y causa de la muerte procedente de la revisión de la historia clínica. Cada 3 meses se ha valorado si han presentado exacerbaciones y el número de las mismas, así como si han sido tratadas de forma ambulatoria o han precisado hospitalización, el tratamiento broncodilatador que realizaban y si habían desarrollado una neoplasia.
Los pacientes firmaron el consentimiento informado y el protocolo fue aprobado por el Comité de Ensayos Clínicos del hospital.
Análisis estadísticoAnálisis descriptivo de las variables incluidas, tanto cualitativas (frecuencias absolutas y porcentajes) como cuantitativas (medias y desviación estándar). La supervivencia se analizó con el método de Kaplan y Meier (mediana de supervivencia e intervalo de confianza al 95% (IC95%)). Las variables predictoras de eventos se evaluaron mediante un análisis multivariante utilizando el modelo de riesgos proporcionales de Cox, para determinar qué variables fueron predictoras independientes de mortalidad (hazard ratio (HR) e IC95%).
Se consideró que había diferencias estadísticamente significativas cuando el valor de p asociado era menor de 0,05. Para el análisis estadístico se empleó el Statistical Package for the Social Science (SPSS, Chicago, IL, USA), versión 24.0 para Windows.
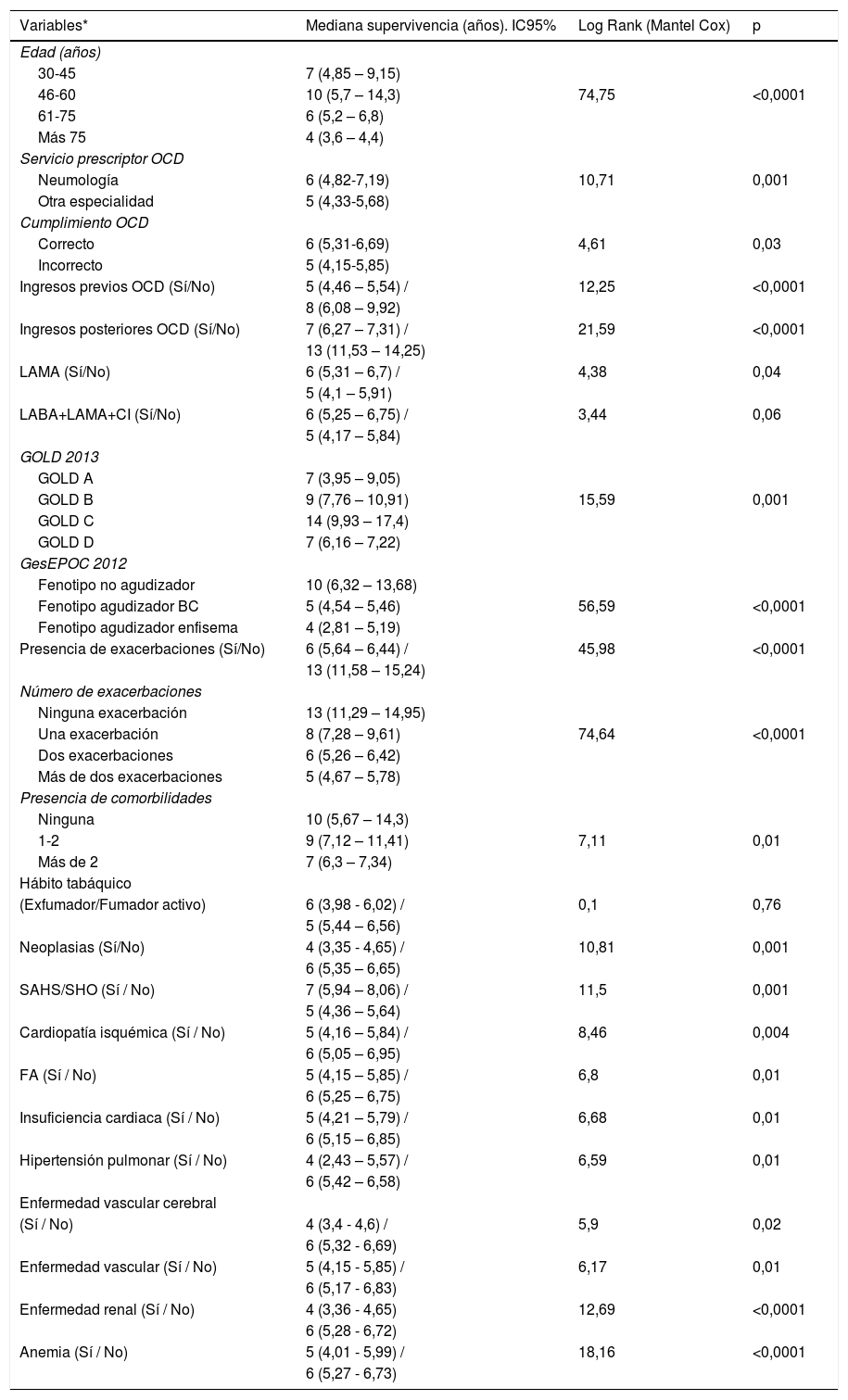
ResultadosEn el momento de comienzo del estudio 893 pacientes estaban en tratamiento con OCD, independientemente del motivo de inicio, siendo finalmente incluidos 409 pacientes con EPOC que cumplían los criterios de inclusión mencionados anteriormente. El 85,6% eran varones, con una edad media de 71,27 ± 9,74 años. La indicación y cumplimentación de la oxigenoterapia se consideró correcta en el 87,8% y en el 80,9% respectivamente. Las principales causas de error fueron el empleo de dicha terapia menos de 16h al día (16,4%). La tabla 1 recoge las características de la población estudiada.
Características de la población estudiada (I)
| Variables* | n (%) |
|---|---|
| Género | |
| Hombre / Mujer | 350 (85,6) / 59 (14,4) |
| Edad (años) | 71,27 ± 9,74 |
| Servicio prescriptor | |
| Neumología | |
| Consultas externas | 105 (25,7) |
| Hospitalización | 74 (18,1) |
| Medicina Interna | 2 (0,5) |
| Consultas externas | 225 (55) |
| Hospitalización | |
| 3 (0,7) | |
| Atención primaria | |
| Tratamiento BD | |
| Monoterapia | |
| LAMA | 40 (9,8) |
| Doble terapia | |
| LABA+CI | 28 (6,8) |
| LABA+LAMA | 0 (0) |
| Triple terapia | |
| LABA+LAMA+CI | 310 (75,8) |
| LABA+SAMA+CI | 31 (7,6) |
| Roflumilast | 8 (2) |
| Comorbilidades | |
| HTA | 251 (61,4) |
| DM | 150 (36,7) |
| DLP | 159 (38,9) |
| Cardiopatía isquémica | 164 (40,1) |
| FA | 116 (28,4) |
| Insuficiencia cardiaca | 111 (27,1) |
| Neoplasia | 96 (23,5) |
| SAHS/SHO | 117 (28,6) |
| Bronquiectasias | 29 (7,1) |
| Hipertensión pulmonar | 52 (12,7) |
| Anemia | 47 (11,5) |
| Enfermedad vascular cerebral | 96 (23,5) |
| Enfermedad psiquiátrica | 60 (14,7) |
| Enfermedad ósea | 84 (20,5) |
| Grado disnea mMRC | |
| Grado 1 | 7 (1,7) |
| Grado 2 | 176 (43) |
| Grado 3 | 178 (43,5) |
| Grado 4 | 48 (11,7) |
BD: broncodilatadores, LAMA: anticolinérgico de larga duración, LABA: β-2 adrenérgico de larga duración, CI: corticoide inhalado, SAMA: anticolinérgico de corta duración, HTA: hipertensión arterial, DM: diabetes mellitus, DLP: dislipemia, FA: fibrilación auricular, SAHS/SHO: síndrome de apnea-hipopnea del sueño/ síndrome hipoventilación obesidad, disnea mMRC: escala de disnea modificada de la Medical Research Council.
En el 91,2% precisaron ingreso hospitalario previo al inicio de la OCD, con una media de ingresos previos de 2,7 ± 2,9; observándose la misma tendencia tras el inicio de esta terapia (reingreso: 95,8%).
El tratamiento broncodilatador empleado se muestra en la tabla 1. De forma simultánea a la oxigenoterapia, el 6,8% precisó asociar la Bi-level positive airway pressure (BIPAP) como soporte ventilatorio y el 17,1% la continuous positive airway pressure (CPAP).
El 81,7% eran exfumadores y el 18,3% fumadores activos con un índice de consumo acumulado de tabaco (ICAT) medio de 46,2 ± 37,5 paquetes/año. El 98,8% presentaban comorbilidades asociadas además de la EPOC. De ellos, el 93,4% tenían más de 2 comorbilidades (tabla 1). El 23,5% habían sido diagnosticados de neoplasias (7,6% de origen pulmonar y 15,9% de origen extrapulmonar). El 11% tenían un diagnóstico de cáncer previo al inicio de la oxigenoterapia, observándose que el 12,5% lo desarrolló a lo largo del seguimiento, y concretamente en el 4,9% fue un cáncer de pulmón (CP).
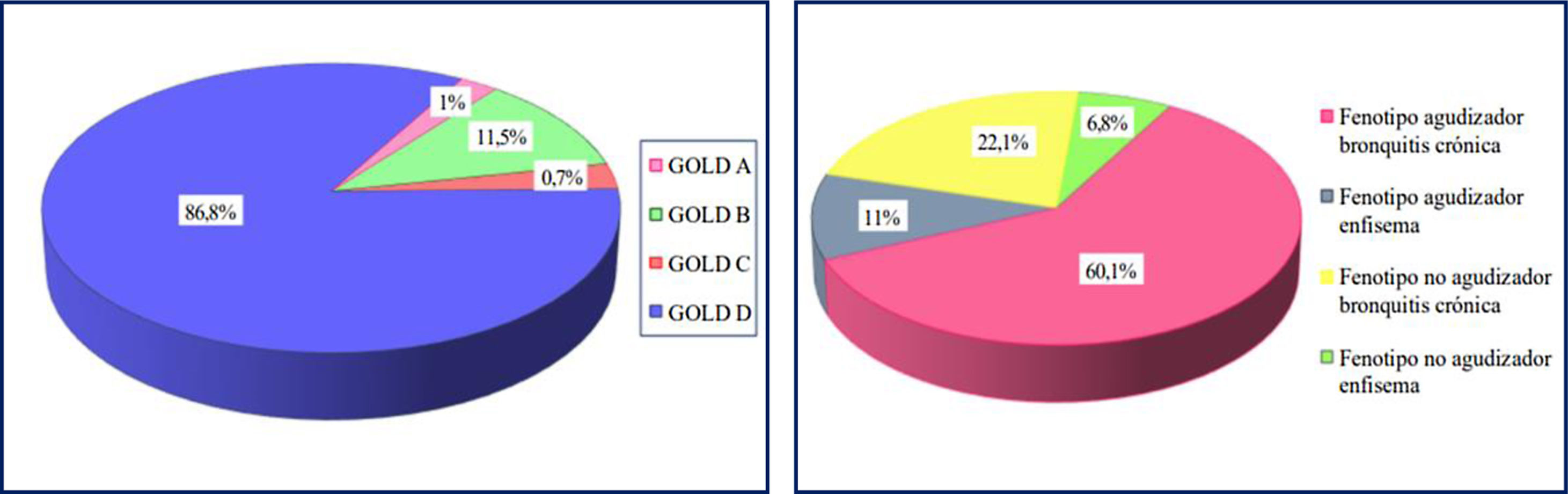
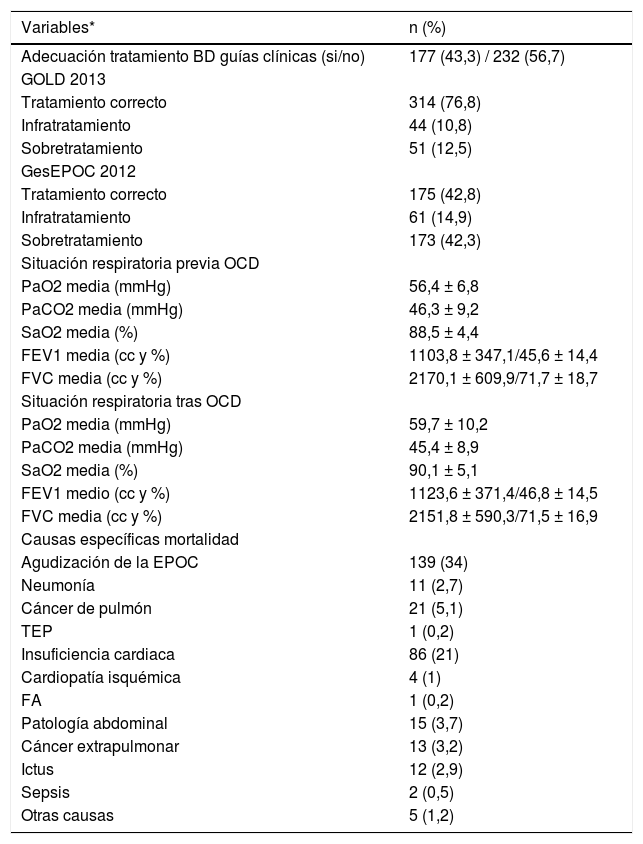
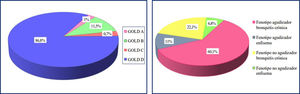
La mayoría de los pacientes fueron clasificados en los grupos de más gravedad según GOLD y en el fenotipo agudizador bronquitis crónica según GesEPOC (fig. 1).
En el 56,7% de los casos no se consideró adecuado el tratamiento broncodilatador empleado en función de la severidad de la EPOC; encontrando datos contradictorios según las guías analizadas (tabla 2).
Características de la población estudiada (II)
| Variables* | n (%) |
|---|---|
| Adecuación tratamiento BD guías clínicas (si/no) | 177 (43,3) / 232 (56,7) |
| GOLD 2013 | |
| Tratamiento correcto | 314 (76,8) |
| Infratratamiento | 44 (10,8) |
| Sobretratamiento | 51 (12,5) |
| GesEPOC 2012 | |
| Tratamiento correcto | 175 (42,8) |
| Infratratamiento | 61 (14,9) |
| Sobretratamiento | 173 (42,3) |
| Situación respiratoria previa OCD | |
| PaO2 media (mmHg) | 56,4 ± 6,8 |
| PaCO2 media (mmHg) | 46,3 ± 9,2 |
| SaO2 media (%) | 88,5 ± 4,4 |
| FEV1 media (cc y %) | 1103,8 ± 347,1/45,6 ± 14,4 |
| FVC media (cc y %) | 2170,1 ± 609,9/71,7 ± 18,7 |
| Situación respiratoria tras OCD | |
| PaO2 media (mmHg) | 59,7 ± 10,2 |
| PaCO2 media (mmHg) | 45,4 ± 8,9 |
| SaO2 media (%) | 90,1 ± 5,1 |
| FEV1 medio (cc y %) | 1123,6 ± 371,4/46,8 ± 14,5 |
| FVC media (cc y %) | 2151,8 ± 590,3/71,5 ± 16,9 |
| Causas específicas mortalidad | |
| Agudización de la EPOC | 139 (34) |
| Neumonía | 11 (2,7) |
| Cáncer de pulmón | 21 (5,1) |
| TEP | 1 (0,2) |
| Insuficiencia cardiaca | 86 (21) |
| Cardiopatía isquémica | 4 (1) |
| FA | 1 (0,2) |
| Patología abdominal | 15 (3,7) |
| Cáncer extrapulmonar | 13 (3,2) |
| Ictus | 12 (2,9) |
| Sepsis | 2 (0,5) |
| Otras causas | 5 (1,2) |
BD: broncodilatador, OCD: oxigenoterapia continua domiciliara, PaO2: presión arterial de oxígeno, mmHg: milímetros de mercurio, PaCO2: presión arterial de dióxido de carbono, SaO2: saturación arterial de oxígeno, FEV1: volumen espiratorio máximo en el primer segundo, cc: centímetros cúbicos, FVC: capacidad vital forzada, EPOC: enfermedad pulmonar obstructiva crónica, TEP tromboembolismo pulmonar, FA: fibrilación auricular.
El 87,3% presentó exacerbaciones durante el año previo. De forma desglosada, el 16,6% tuvo una exacerbación, el 37,9% dos exacerbaciones y el 32,8% más de dos.
La situación respiratoria previa y posterior al inicio de la oxigenoterapia fue similar, tanto desde el punto de vista gasométrico como funcional, a pesar del empleo de OCD durante al menos un año (tabla 2).
El tiempo medio de seguimiento en oxigenoterapia fue de 5,86 ± 3,24 años con una mediana de supervivencia de 6 años (IC95%: 5,47-6,53). La mortalidad al final del seguimiento fue del 75,8%, siendo el 36,9% de causa respiratoria, el 22,2% de causa cardiológica, el 8,4% de causa neoplásica y el 8,3% por otros procesos (tabla 2).
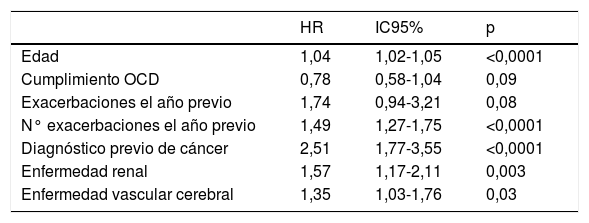
La supervivencia al año, a los 3 años, a los 5 años y a los 10 años fue del 92,9, 75,1, 52,6 y 20,4% respectivamente. La tabla 3 recoge el análisis de supervivencia. Una mayor supervivencia se relacionó de forma significativa con una menor edad (p<0,0001), la prescripción de OCD por parte de Neumología (p=0,001), el cumplimiento correcto de la OCD (p=0,03), un menor número de ingresos hospitalarios previos (p<0,0001) y posteriores al inicio de esta terapia (p<0,0001) y la ausencia de comorbilidades (p=0,01). No encontramos diferencias en cuanto a la cumplimentación de los broncodilatadores (p=0,77); sin embargo, la supervivencia fue más elevada en los pacientes que tomaban LAMA (p=0,04) y la combinación LAMA+LABA+CI (p=0,06), aunque tan sólo obtuvimos diferencias significativas en el caso de la monoterapia.
Análisis de supervivencia
| Variables* | Mediana supervivencia (años). IC95% | Log Rank (Mantel Cox) | p |
|---|---|---|---|
| Edad (años) | |||
| 30-45 | 7 (4,85 – 9,15) | ||
| 46-60 | 10 (5,7 – 14,3) | 74,75 | <0,0001 |
| 61-75 | 6 (5,2 – 6,8) | ||
| Más 75 | 4 (3,6 – 4,4) | ||
| Servicio prescriptor OCD | |||
| Neumología | 6 (4,82-7,19) | 10,71 | 0,001 |
| Otra especialidad | 5 (4,33-5,68) | ||
| Cumplimiento OCD | |||
| Correcto | 6 (5,31-6,69) | 4,61 | 0,03 |
| Incorrecto | 5 (4,15-5,85) | ||
| Ingresos previos OCD (Sí/No) | 5 (4,46 – 5,54) / | 12,25 | <0,0001 |
| 8 (6,08 – 9,92) | |||
| Ingresos posteriores OCD (Sí/No) | 7 (6,27 – 7,31) / | 21,59 | <0,0001 |
| 13 (11,53 – 14,25) | |||
| LAMA (Sí/No) | 6 (5,31 – 6,7) / | 4,38 | 0,04 |
| 5 (4,1 – 5,91) | |||
| LABA+LAMA+CI (Sí/No) | 6 (5,25 – 6,75) / | 3,44 | 0,06 |
| 5 (4,17 – 5,84) | |||
| GOLD 2013 | |||
| GOLD A | 7 (3,95 – 9,05) | ||
| GOLD B | 9 (7,76 – 10,91) | 15,59 | 0,001 |
| GOLD C | 14 (9,93 – 17,4) | ||
| GOLD D | 7 (6,16 – 7,22) | ||
| GesEPOC 2012 | |||
| Fenotipo no agudizador | 10 (6,32 – 13,68) | ||
| Fenotipo agudizador BC | 5 (4,54 – 5,46) | 56,59 | <0,0001 |
| Fenotipo agudizador enfisema | 4 (2,81 – 5,19) | ||
| Presencia de exacerbaciones (Sí/No) | 6 (5,64 – 6,44) / | 45,98 | <0,0001 |
| 13 (11,58 – 15,24) | |||
| Número de exacerbaciones | |||
| Ninguna exacerbación | 13 (11,29 – 14,95) | ||
| Una exacerbación | 8 (7,28 – 9,61) | 74,64 | <0,0001 |
| Dos exacerbaciones | 6 (5,26 – 6,42) | ||
| Más de dos exacerbaciones | 5 (4,67 – 5,78) | ||
| Presencia de comorbilidades | |||
| Ninguna | 10 (5,67 – 14,3) | ||
| 1-2 | 9 (7,12 – 11,41) | 7,11 | 0,01 |
| Más de 2 | 7 (6,3 – 7,34) | ||
| Hábito tabáquico | |||
| (Exfumador/Fumador activo) | 6 (3,98 - 6,02) / | 0,1 | 0,76 |
| 5 (5,44 – 6,56) | |||
| Neoplasias (Sí/No) | 4 (3,35 - 4,65) / | 10,81 | 0,001 |
| 6 (5,35 – 6,65) | |||
| SAHS/SHO (Sí / No) | 7 (5,94 – 8,06) / | 11,5 | 0,001 |
| 5 (4,36 – 5,64) | |||
| Cardiopatía isquémica (Sí / No) | 5 (4,16 – 5,84) / | 8,46 | 0,004 |
| 6 (5,05 – 6,95) | |||
| FA (Sí / No) | 5 (4,15 – 5,85) / | 6,8 | 0,01 |
| 6 (5,25 – 6,75) | |||
| Insuficiencia cardiaca (Sí / No) | 5 (4,21 – 5,79) / | 6,68 | 0,01 |
| 6 (5,15 – 6,85) | |||
| Hipertensión pulmonar (Sí / No) | 4 (2,43 – 5,57) / | 6,59 | 0,01 |
| 6 (5,42 – 6,58) | |||
| Enfermedad vascular cerebral | |||
| (Sí / No) | 4 (3,4 - 4,6) / | 5,9 | 0,02 |
| 6 (5,32 - 6,69) | |||
| Enfermedad vascular (Sí / No) | 5 (4,15 - 5,85) / | 6,17 | 0,01 |
| 6 (5,17 - 6,83) | |||
| Enfermedad renal (Sí / No) | 4 (3,36 - 4,65) | 12,69 | <0,0001 |
| 6 (5,28 - 6,72) | |||
| Anemia (Sí / No) | 5 (4,01 - 5,99) / | 18,16 | <0,0001 |
| 6 (5,27 - 6,73) |
OCD: oxigenoterapia continua domiciliaria, LAMA: anticolinérgico de larga duración, LABA: β-2 adrenérgico de larga duración, SAHS/SHO: síndrome apnea-hipopnea del sueño / síndrome hipoventilación obesidad, FA: fibrilación auricular.
La supervivencia se asoció de forma significativa con el nivel de gravedad de la EPOC según GOLD 2013 (p=0,001) y GesEPOC 2012 (p<0,0001), existiendo una menor supervivencia en los pacientes GOLD D, así como en el fenotipo agudizador enfisema y bronquitis crónica.
La presencia de exacerbaciones se relacionó con la supervivencia (p<0,0001), siendo mayor en aquellos pacientes que no habían presentado agudizaciones durante el año previo (p<0,0001).
La supervivencia se asoció con la ausencia de neoplasias (p=0,001), la presencia de SAHS/SHO (p=0,001), la ausencia de cardiopatía isquémica (p=0,004), FA (p=0,01), insuficiencia cardiaca (p=0,01), enfermedad vascular cerebral (p=0,02), enfermedad vascular (p=0,01), enfermedad renal (p<0,0001) y con la ausencia de anemia (p<0,0001).
El modelo multivariante estableció que la edad (HR: 1,04; IC95%: 1,02-1,05), el número de exacerbaciones durante el año previo (HR: 1,49; IC95%: 1,27-1,75), el diagnóstico previo de cáncer (HR: 2,51; IC95%: 1,77-3,55), la presencia de enfermedad renal (HR: 1,57; IC95%: 1,17-2,11) y de enfermedad vascular cerebral (HR: 1,35; IC95%: 1,03-1,76) se asociaron de forma independiente con una mayor mortalidad (tabla 4).
Factores asociadas con la mortalidad. Modelo multivariante*
| HR | IC95% | p | |
|---|---|---|---|
| Edad | 1,04 | 1,02-1,05 | <0,0001 |
| Cumplimiento OCD | 0,78 | 0,58-1,04 | 0,09 |
| Exacerbaciones el año previo | 1,74 | 0,94-3,21 | 0,08 |
| N° exacerbaciones el año previo | 1,49 | 1,27-1,75 | <0,0001 |
| Diagnóstico previo de cáncer | 2,51 | 1,77-3,55 | <0,0001 |
| Enfermedad renal | 1,57 | 1,17-2,11 | 0,003 |
| Enfermedad vascular cerebral | 1,35 | 1,03-1,76 | 0,03 |
OCD: oxigenoterapia continúa domiciliaria.
* Análisis multivariante con Regresión de Cox.
El mal pronóstico que presentan los pacientes con EPOC que precisan oxigenoterapia, sugiere la influencia de otros factores de origen no respiratorio en su supervivencia7.
La edad y el sexo son similares a los datos encontrados en el estudio de Rizzi et al8 y en The Long-Term Oxygen Treatment Trial Research Group9, en los que la mayoría son varones (78 y 72%), aunque con una edad inferior a nuestros pacientes (68 ± 10 y 68,3 ± 7,5 años). Sin embargo, últimamente se ha observado un incremento en el número de mujeres con EPOC que necesitan oxigenoterapia, presentando incluso una mortalidad más elevada10.
La adherencia al tratamiento es indispensable, ya que el incumplimiento de al menos el 80% del tiempo prescrito puede reducir los beneficios de esta terapia. En contraposición con otros estudios11, en nuestro caso encontramos resultados muy positivos, ya que tan sólo se ha catalogado como incorrecto el cumplimiento de la OCD en el 19,1%.
Entre el 38% y el 77% de los pacientes con EPOC son fumadores12, observando datos semejantes a nuestra cohorte. El hábito tabáquico no se ha relacionado con la supervivencia (p=0,76), sin embargo, al evaluar cada uno de los grupos (fumadores activos vs exfumadores), la mortalidad ha sido mayor en los fumadores activos (76,3% vs 73,3%), pero sin encontrar diferencias significativas (p=0,34), probablemente relacionado con el pequeño tamaño que conforman el grupo de los fumadores activos. En la actualidad no se disponen de estudios randomizados que evalúen el impacto de la OCD en función del consumo de tabaco en términos de supervivencia. En general, existen estudios poblacionales que analizan la prevalencia de tabaquismo y la dependencia por la nicotina12, o bien la influencia del consumo de tabaco en el cumplimiento de la oxigenoterapia como es el caso del estudio de Barrueco-Otero et al.13. Este estudio muestra un incumplimiento de un 26% cuando se emplean cuestionarios, incrementándose hasta un 62,13% en el caso de utilizar métodos directos consistentes en medir los niveles de monóxido de carbono (CO) en aire espirado13. Estos hallazgos concuerdan con nuestra serie, ya que obtenemos una baja tasa de incumplimiento (19,1%), lo cual está claramente relacionado con la forma en la que se ha recogido dicha variable, resaltando de nuevo que los fumadores activos tienen un grado mayor de incumplimiento en comparación con los exfumadores (36,8% vs 15,5%; p<0,0001).
La presencia de comorbilidades es deletérea para el pronóstico de estos pacientes. Se estima que más del 80% tienen al menos una comorbilidad asociada14, al igual que en nuestra serie. En el trabajo de Marti et al observamos resultados similares, aunque en este caso la insuficiencia cardiaca (13%), la diabetes mellitus (9%), la cardiopatía isquémica (7%) y la enfermedad digestiva (7%)15 son las más frecuentes. Tales discrepancias pueden deberse al infradiagnóstico e infratratamiento de las comorbilidades, como ocurre con las enfermedades cardiovasculares.
La presencia de neoplasias influye de forma negativa en el pronóstico de los pacientes con EPOC16. El CP es una causa importante de mortalidad en la EPOC, oscilando entre el 7% y el 38% según las series16. Estos datos concuerdan con nuestros resultados, siendo mayor la mortalidad en los pacientes con CP (90,3% vs 74,6%; p=0,03).
Los pacientes con EPOC y SAHS/SHO tienen peor pronóstico que los pacientes con EPOC y SAHS/SHO por separado17. En contraposición con estos datos, en nuestro caso hemos observado una supervivencia más elevada en aquellos que presentan ambas comorbilidades asociadas (tabla 3), considerando que dicho hallazgo puede ser consecuencia del efecto beneficioso de la oxigenoterapia en las desaturaciones nocturnas.
El tratamiento broncodilatador empleado y su correcta cumplimentación influyen tanto en el adecuado control de la EPOC como en el pronóstico, encontrando resultados similares al estudio de Marti et al15 y al de Tkacova et al18. Sin embargo, ninguno de ellos aporta datos relacionados con la influencia del tratamiento broncodilatador en la supervivencia.
Disponemos de estudios similares que analizan la gravedad de la EPOC y la tendencia en la mortalidad según las guías clínicas19,20, sin embargo, no hay datos de series tan largas ni estudios en los que se analice la supervivencia de estos pacientes en función de la severidad. Coincidimos con el estudio de Miravitlles et al21, en cuanto a la gravedad de la EPOC según GOLD 2013; sin embargo, difieren al evaluar la GesEPOC 2012, sin lograr identificar, en nuestro caso, ningún fenotipo mixto asma-EPOC. Uno de los posibles motivos por los que creemos que existen tales diferencias, es la avanzada enfermedad que presentan nuestros pacientes.
Las exacerbaciones en la EPOC y la necesidad de ingreso hospitalario son considerados factores independientes de mortalidad22. En el estudio de Soler-Cataluña et al tan sólo el 11,8% tenía 3 o más exacerbaciones, resaltando que el 53,6% no presentó ninguna23, datos claramente contrarios a nuestra cohorte. La supervivencia se ha asociado con la presencia de exacerbaciones, siendo mayor en el grupo que no presentaron agudizaciones durante el año previo, al igual que ocurre en el estudio de Soler-Cataluña et al23.
En comparación con las series descritas, nuestra cohorte presenta mejor función pulmonar, destacando el estudio de Manresa et al en el que existe mayor grado de obstrucción (FEV1 medio: 24%)24.
En general, la supervivencia está claramente disminuida en los pacientes con EPOC en relación con la población general. La mortalidad global a los 4-7 años oscila entre el 30-48%, dependiendo sobre todo de la gravedad de la enfermedad en el momento del diagnóstico, siendo la evolución de la propia enfermedad la principal causa de muerte22. En nuestro caso, se ha obtenido un descenso progresivo de la misma a lo largo del seguimiento, ya que al año fue de un 92,9% y a los 10 años de un 20,4%. Encontramos resultados similares a los descritos, aunque es difícil comparar supervivencias a los 5 y 10 años, ya que en la mayoría de las series el seguimiento es menor. Resaltar que ninguno de los estudios mencionados incluye a pacientes que se encuentren recibiendo OCD, factor a considerar, ya que, al tener una enfermedad de base en fase más avanzada, puede ser una de los motivos por los que encontramos una mortalidad más elevada.
En el estudio de Ekström et al existe un tiempo medio de seguimiento de 1,71 años, claramente inferior a nuestra cohorte. Sin embargo, las principales causas de mortalidad han sido superponibles, siendo las de origen respiratorio (71%) y cardiológico (16%) las más frecuentes, seguidas de las neoplasias (7,6%)25. Lo mismo ocurre al compararlo con el estudio de Ringbaek et al26 y con el de Moreno et al27.
En el estudio de Soler-Cataluña et al se observa que un mayor número de exacerbaciones graves (HR: 4,13; p=0,003), la edad y la PaCO2 pueden ser considerados predictores independientes de mortalidad23. Igualmente, en nuestra serie el número de exacerbaciones ha sido considerado como predictor independiente de una mayor mortalidad (HR: 1,49; p<0,0001).
La tabla 4 muestra el análisis multivariante siendo nuestros resultados similares a los observados en las cohortes reportadas de Marti et al15, Moreno et al27 y Soler-Cataluña et al23, entre otros, siempre reseñando que, excepto el estudio realizado por Marti et al15, la mayoría de las publicaciones disponibles y referidas con anterioridad no aportan datos concretos acerca del subgrupo de pacientes con oxigenoterapia.
La principal limitación de nuestro trabajo es el origen monocéntrico de los pacientes, lo cual puede conllevar ciertos sesgos en las características basales y en el manejo habitual de los mismos. De igual forma, los datos procedentes de la revisión de informes clínicos pueden influir en la veracidad de los mismos por pérdida de información relevante que no haya sido registrada.
En conclusión, la supervivencia de los pacientes con EPOC en oxigenoterapia domiciliaria es prolongada, siendo la principal causa de muerte de origen respiratorio (36,9%); destacando que, la presencia de exacerbaciones durante el año previo influye de forma ominosa en el pronóstico de los mismos.
Conflicto de interesesLos autores declaran no tener ningún tipo de conflicto de intereses.