La vía inhalatoria es la de elección en el tratamiento de la infección bronquial crónica. Con esta forma de administrar los antibióticos se reducen el volumen y la purulencia del esputo, el número y la gravedad de las agudizaciones, y se enlentece la pérdida de función pulmonar, con menores efectos secundarios que si se utilizasen por vía sistémica. Existen dos tipos de antibióticos inhalados: nebulizados (si el antibiótico se presenta en suspensión o solución) y en polvo seco. Los antibióticos en polvo seco presentan una eficacia y una seguridad similares a las de las formulaciones nebulizadas, aunque suelen producir más tos, que en algunos casos obliga a la suspensión del tratamiento. Tienen la ventaja añadida de tener dispositivos con un tamaño reducido, el menor tiempo de limpieza, la reducción del tiempo de inhalación —lo que facilita la adhesión al tratamiento— y una menor contaminación del dispositivo comparados con los nebulizadores. Actualmente hay cuatro antibióticos en solución comercializados (tobramicina, colistina, aztreonam y levofloxacino) y dos en polvo seco (tobramicina y colistina). En diferentes fases de desarrollo clínico se encuentran cuatro formulaciones de antibióticos, dos en solución (ciprofloxacino y amikacina —formulaciones liposomales—) y otros dos en polvo seco (ciprofloxacino y vancomicina). En un futuro próximo dispondremos de otros antibióticos en polvo seco, lo que permitirá su utilización tanto en pacientes con fibrosis quística como en pacientes con bronquiectasias no secundarias a ella.
Inhalation is the route of choice in the treatment of chronic bronchial infection. Administering antibiotics in this way reduces sputum volume and purulence and the number and severity of exacerbations, and slows lung function decline, while producing fewer side effects than the systemic route. There are two types of inhaled antibiotics, nebulized (if the antibiotic is presented in suspension or solution) and dry powder. The efficacy and safety of dry powder antibiotics are similar to nebulized formulations, but they often produce more cough, leading in some cases to discontinuation of treatment. Additional advantages include presentation in small devices, shorter cleaning time, reduced inhalation time — facilitating therapeutic adherence — and less contamination of the device compared to nebulizers. Currently, 4 antibiotics are available in solution (tobramycin, colistin, aztreonam, and levofloxacin) and 2 in dry powder (tobramycin and colistin). Four formulations of antibiotics are currently in clinical development, 2 in solution (liposomal formulations of ciprofloxacin and amikacin) and 2 in dry powder (ciprofloxacin and vancomycin). In the near future, other dry powder antibiotics suitable for use in both patients with cystic fibrosis (CF) and in patients with non-CF bronchiectasis will become available.
Las bronquiectasias (BQ) son el estadio final del daño pulmonar causado por muchas enfermedades. En esta patología, la infección bronquial crónica (IBC), causada por microorganismos potencialmente patógenos (MPP) (bacterias principalmente), desencadena un proceso inflamatorio crónico perpetuando el círculo infección-inflamación. Las infecciones son la mayor causa de morbimortalidad en los pacientes con BQ, ya sean estas debidas a fibrosis quística (FQ) o a otras etiologías.
El tratamiento de la IBC se basa en el uso de antibióticos de mantenimiento, durante meses o años, principalmente por vía inhalada1,2. Esta vía de administración alcanza mayores concentraciones en el árbol bronquial, con una efectividad mayor y menores efectos secundarios que la vía sistémica3,4. Con esta terapia se reducen el volumen y la purulencia del esputo, el número y la gravedad de las agudizaciones, y se enlentece la pérdida de función pulmonar5,6.
Los principales MPP más frecuentes en BQ son Haemophilus influenzae no tipificable (11,8% según el Registro Español de Bronquiectasias), Pseudomonas aeruginosa (20,5%), Moraxella catharralis, Staphylococcus aureus (tanto sensible como resistente a meticilina [SARM]), Escherichia coli, Achromobacter xylosoxidans y Stenotrophomonas maltophilia7. De todos ellos, P.aeruginosa es el que se aísla con más frecuencia en FQ y el que se asocia a una mayor morbimortalidad, tanto en FQ como en BQ de otras etiologías8,9. De ahí que los ensayos con antibióticos inhalados se hayan centrado principalmente en este microorganismo.
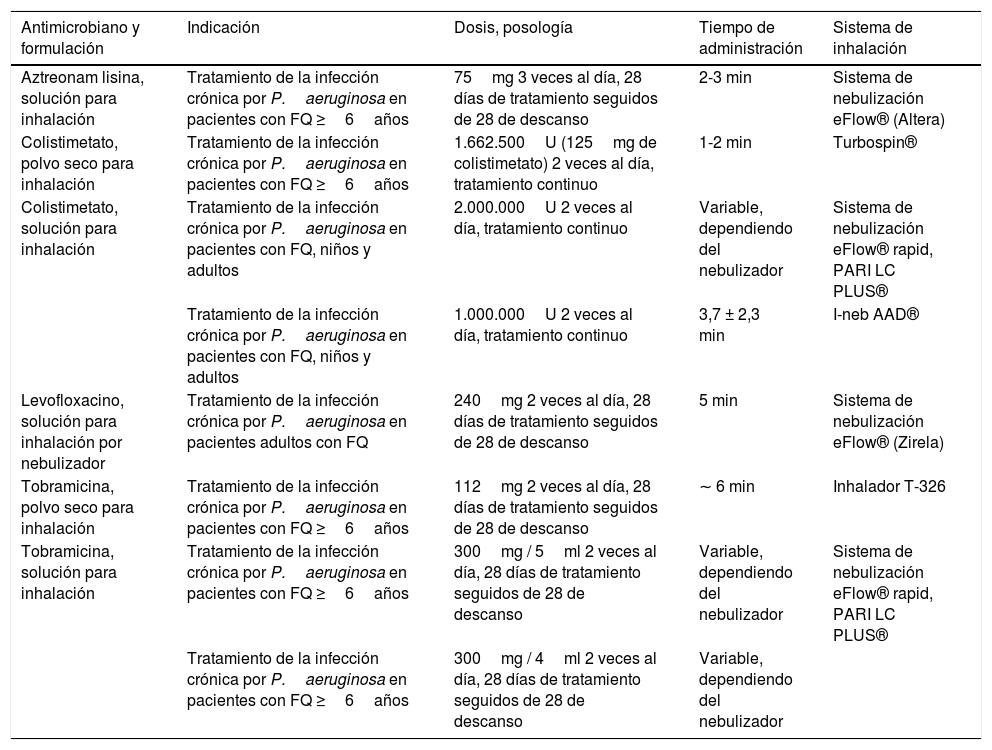
Las primeras investigaciones con antibióticos inhalados datan de los años cuarenta, empleando formulaciones intravenosas líquidas nebulizadas. Su eficacia se ha demostrado tanto en pacientes con IBC9-11 como en FQ12. Tras décadas en desuso, en los años ochenta se retomó esta vía de administración de antibióticos, pero solo en pacientes con FQ13. Veinte años después salió al mercado la primera formulación de antibiótico nebulizado específica para inhalación14,15. Posteriormente se han incorporado al arsenal terapéutico los antibióticos inhalados en polvo seco16. Actualmente, de los antibióticos específicos para inhalación comercializados, cuatro se presentan en solución (tobramicina, colistina, aztreonam y levofloxacino [LF]) y dos en polvo seco (tobramicina y colistina) (tabla 1). En los últimos años se han desarrollado nuevas formulaciones de antibióticos específicas para inhalación. Dentro del grupo de las fluoroquinolonas, además del LF en solución (AeroquinTM, Quinsair®) se han realizado estudios con ciprofloxacino liposomal (PulmaquinTM y LipoquinTM) y en polvo seco. Entre los aminoglucósidos destaca la amikacina liposomal (Arikace™, Insmed Incorporated). También hay una formulación de vancomicina inhalada en polvo seco (Aerovanc™) para pacientes con FQ e infección por SARM. Novedades relevantes, en diferentes fases de estudio, son las combinaciones de dos antibióticos como fosfomicina/tobramicina o fosfomicina/amikacina y las formulaciones con macrólidos. En la tabla 2 se muestran los principales estudios, aún no publicados, en diferentes fases de desarrollo, que emplean antibióticos por vía inhalada.
Antimicrobianos específicos para inhalación comercializados en la actualidad
| Antimicrobiano y formulación | Indicación | Dosis, posología | Tiempo de administración | Sistema de inhalación |
|---|---|---|---|---|
| Aztreonam lisina, solución para inhalación | Tratamiento de la infección crónica por P.aeruginosa en pacientes con FQ ≥6años | 75mg 3 veces al día, 28 días de tratamiento seguidos de 28 de descanso | 2-3 min | Sistema de nebulización eFlow® (Altera) |
| Colistimetato, polvo seco para inhalación | Tratamiento de la infección crónica por P.aeruginosa en pacientes con FQ ≥6años | 1.662.500U (125mg de colistimetato) 2 veces al día, tratamiento continuo | 1-2 min | Turbospin® |
| Colistimetato, solución para inhalación | Tratamiento de la infección crónica por P.aeruginosa en pacientes con FQ, niños y adultos | 2.000.000U 2 veces al día, tratamiento continuo | Variable, dependiendo del nebulizador | Sistema de nebulización eFlow® rapid, PARI LC PLUS® |
| Tratamiento de la infección crónica por P.aeruginosa en pacientes con FQ, niños y adultos | 1.000.000U 2 veces al día, tratamiento continuo | 3,7 ± 2,3 min | I-neb AAD® | |
| Levofloxacino, solución para inhalación por nebulizador | Tratamiento de la infección crónica por P.aeruginosa en pacientes adultos con FQ | 240mg 2 veces al día, 28 días de tratamiento seguidos de 28 de descanso | 5 min | Sistema de nebulización eFlow® (Zirela) |
| Tobramicina, polvo seco para inhalación | Tratamiento de la infección crónica por P.aeruginosa en pacientes con FQ ≥6años | 112mg 2 veces al día, 28 días de tratamiento seguidos de 28 de descanso | ∼ 6 min | Inhalador T-326 |
| Tobramicina, solución para inhalación | Tratamiento de la infección crónica por P.aeruginosa en pacientes con FQ ≥6años | 300mg / 5ml 2 veces al día, 28 días de tratamiento seguidos de 28 de descanso | Variable, dependiendo del nebulizador | Sistema de nebulización eFlow® rapid, PARI LC PLUS® |
| Tratamiento de la infección crónica por P.aeruginosa en pacientes con FQ ≥6años | 300mg / 4ml 2 veces al día, 28 días de tratamiento seguidos de 28 de descanso | Variable, dependiendo del nebulizador |
FQ: fibrosis quística.
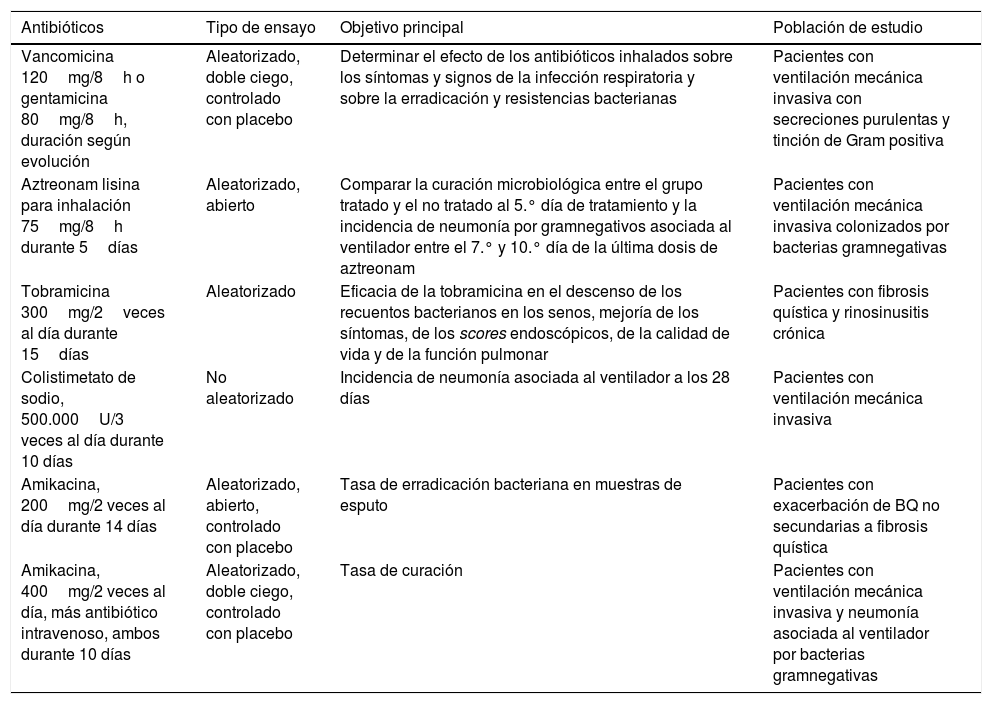
Nuevos estudios con antibióticos inhalados (no publicados)
| Antibióticos | Tipo de ensayo | Objetivo principal | Población de estudio |
|---|---|---|---|
| Vancomicina 120mg/8h o gentamicina 80mg/8h, duración según evolución | Aleatorizado, doble ciego, controlado con placebo | Determinar el efecto de los antibióticos inhalados sobre los síntomas y signos de la infección respiratoria y sobre la erradicación y resistencias bacterianas | Pacientes con ventilación mecánica invasiva con secreciones purulentas y tinción de Gram positiva |
| Aztreonam lisina para inhalación 75mg/8h durante 5días | Aleatorizado, abierto | Comparar la curación microbiológica entre el grupo tratado y el no tratado al 5.° día de tratamiento y la incidencia de neumonía por gramnegativos asociada al ventilador entre el 7.° y 10.° día de la última dosis de aztreonam | Pacientes con ventilación mecánica invasiva colonizados por bacterias gramnegativas |
| Tobramicina 300mg/2veces al día durante 15días | Aleatorizado | Eficacia de la tobramicina en el descenso de los recuentos bacterianos en los senos, mejoría de los síntomas, de los scores endoscópicos, de la calidad de vida y de la función pulmonar | Pacientes con fibrosis quística y rinosinusitis crónica |
| Colistimetato de sodio, 500.000U/3 veces al día durante 10 días | No aleatorizado | Incidencia de neumonía asociada al ventilador a los 28 días | Pacientes con ventilación mecánica invasiva |
| Amikacina, 200mg/2 veces al día durante 14 días | Aleatorizado, abierto, controlado con placebo | Tasa de erradicación bacteriana en muestras de esputo | Pacientes con exacerbación de BQ no secundarias a fibrosis quística |
| Amikacina, 400mg/2 veces al día, más antibiótico intravenoso, ambos durante 10 días | Aleatorizado, doble ciego, controlado con placebo | Tasa de curación | Pacientes con ventilación mecánica invasiva y neumonía asociada al ventilador por bacterias gramnegativas |
Datos obtenidos de https://clinicaltrials.gov/ con fecha del 07/05/2020.
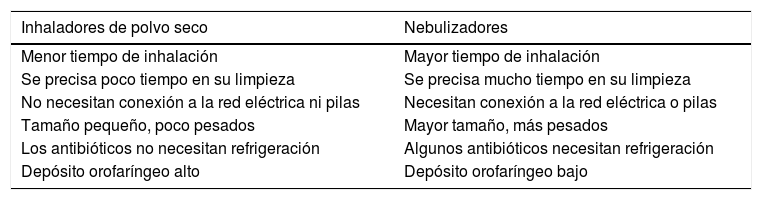
La indicación formal de todos ellos (excepto para vancomicina) es para pacientes con FQ e IBC por P.aeruginosa. Los antibióticos inhalados en polvo seco han demostrado una eficacia y una seguridad similares a las de las formulaciones nebulizadas, con ventajas adicionales comparados con los que se emplean con nebulizadores (tabla 3).
Ventajas e inconvenientes de los antibióticos de polvo seco frente a los antibióticos nebulizados
| Inhaladores de polvo seco | Nebulizadores |
|---|---|
| Menor tiempo de inhalación | Mayor tiempo de inhalación |
| Se precisa poco tiempo en su limpieza | Se precisa mucho tiempo en su limpieza |
| No necesitan conexión a la red eléctrica ni pilas | Necesitan conexión a la red eléctrica o pilas |
| Tamaño pequeño, poco pesados | Mayor tamaño, más pesados |
| Los antibióticos no necesitan refrigeración | Algunos antibióticos necesitan refrigeración |
| Depósito orofaríngeo alto | Depósito orofaríngeo bajo |
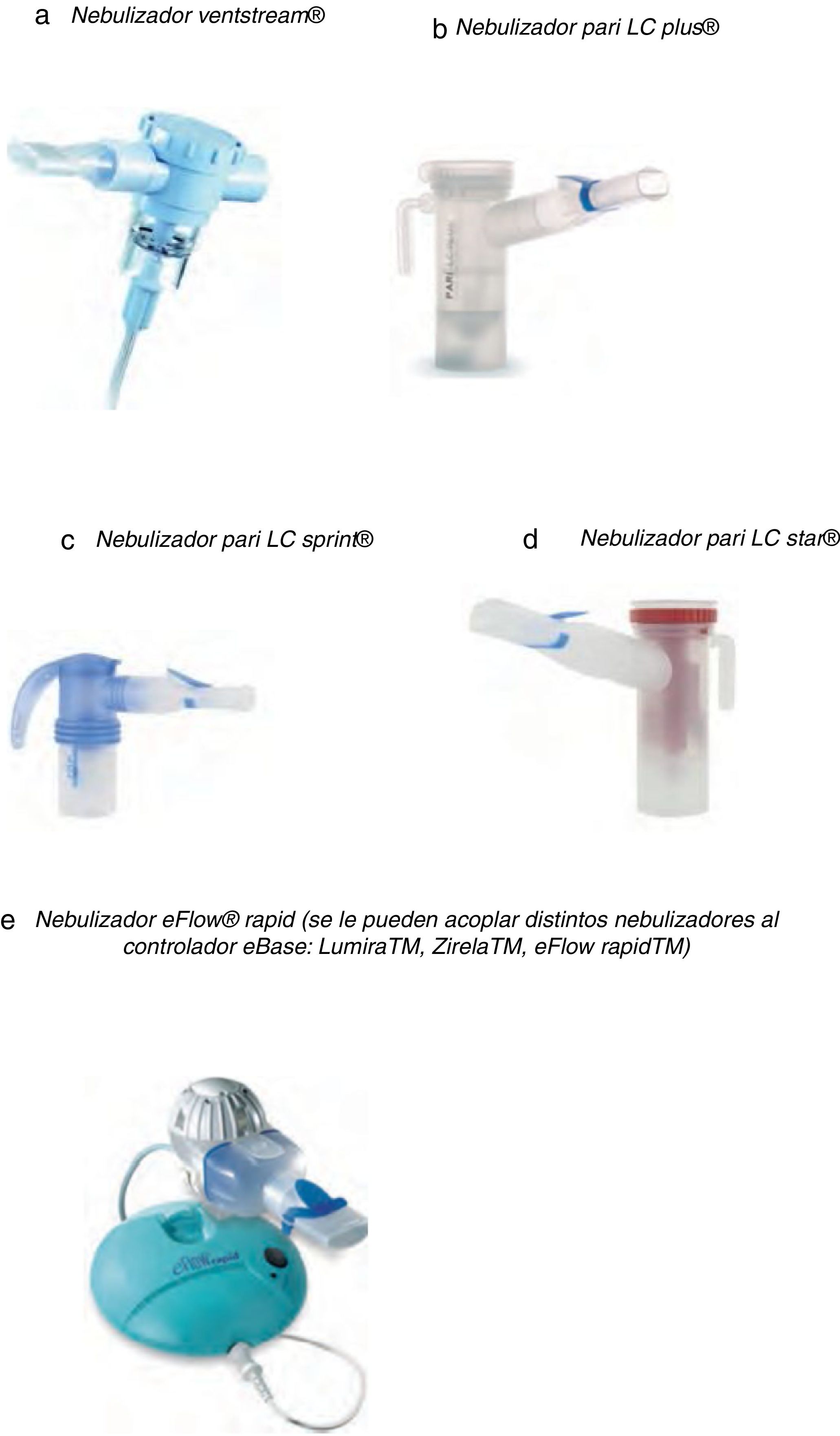
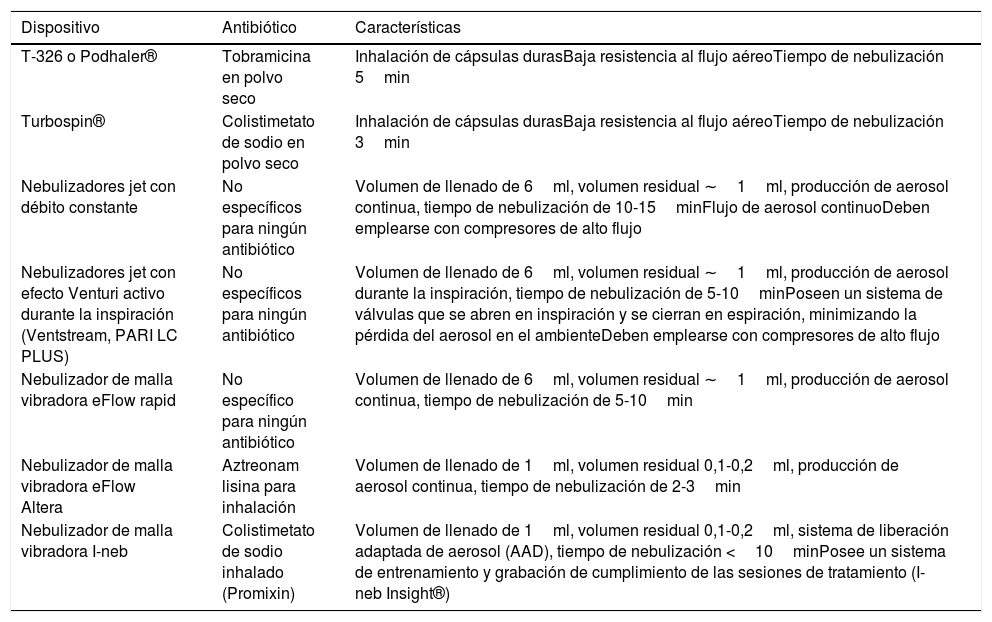
Los aparatos de inhalación de antibióticos son de dos tipos: nebulizadores, en los que el fármaco se encuentra en suspensión o solución acuosa y se atomiza en gotas pequeñas susceptibles de ser inhaladas, e inhaladores de polvo seco, que contienen el principio activo en forma de polvo17. Incluso con el nebulizador más eficaz solo un pequeño porcentaje del fármaco se deposita en las vías aéreas18,19. Una parte del fármaco permanece en la cámara y no se nebuliza, es el llamado volumen residual. Por ello, para nebulizadores con un volumen residual de 1ml, como tienen la mayoría de los nebulizadores jet, se recomienda un volumen de solución de 4 a 5ml20. Volúmenes menores suponen un aumento en la viscosidad de la solución que comporta una mayor dificultad en su nebulización. Volúmenes mayores no mejoran mucho el rendimiento y prolongan el tiempo de nebulización21, lo que disminuye la adherencia al tratamiento. En la tabla 4 se muestran las características de los inhaladores y nebulizadores que se emplean más frecuentemente para antibióticos.
Características principales de diferentes tipos de nebulizadores e inhaladores que se emplean con antibióticos inhalados
| Dispositivo | Antibiótico | Características |
|---|---|---|
| T-326 o Podhaler® | Tobramicina en polvo seco | Inhalación de cápsulas durasBaja resistencia al flujo aéreoTiempo de nebulización 5min |
| Turbospin® | Colistimetato de sodio en polvo seco | Inhalación de cápsulas durasBaja resistencia al flujo aéreoTiempo de nebulización 3min |
| Nebulizadores jet con débito constante | No específicos para ningún antibiótico | Volumen de llenado de 6ml, volumen residual ∼1ml, producción de aerosol continua, tiempo de nebulización de 10-15minFlujo de aerosol continuoDeben emplearse con compresores de alto flujo |
| Nebulizadores jet con efecto Venturi activo durante la inspiración (Ventstream, PARI LC PLUS) | No específicos para ningún antibiótico | Volumen de llenado de 6ml, volumen residual ∼1ml, producción de aerosol durante la inspiración, tiempo de nebulización de 5-10minPoseen un sistema de válvulas que se abren en inspiración y se cierran en espiración, minimizando la pérdida del aerosol en el ambienteDeben emplearse con compresores de alto flujo |
| Nebulizador de malla vibradora eFlow rapid | No específico para ningún antibiótico | Volumen de llenado de 6ml, volumen residual ∼1ml, producción de aerosol continua, tiempo de nebulización de 5-10min |
| Nebulizador de malla vibradora eFlow Altera | Aztreonam lisina para inhalación | Volumen de llenado de 1ml, volumen residual 0,1-0,2ml, producción de aerosol continua, tiempo de nebulización de 2-3min |
| Nebulizador de malla vibradora I-neb | Colistimetato de sodio inhalado (Promixin) | Volumen de llenado de 1ml, volumen residual 0,1-0,2ml, sistema de liberación adaptada de aerosol (AAD), tiempo de nebulización <10minPosee un sistema de entrenamiento y grabación de cumplimiento de las sesiones de tratamiento (I-neb Insight®) |
En los últimos años se ha añadido surfactante a las soluciones para nebulización, lo que permite mejorar el depósito pulmonar y la eficacia antimicrobiana22. Las formulaciones liposomales y encapsuladas tienen unas partículas de liberación controlada y mantenida que mejoran la penetración en las biopelículas23,24, tal y como ocurre con las nanopartículas.
Tobramicina en polvo secoEn los años ochenta se comenzaron a emplear formulaciones intravenosas de tobramicina por vía inhalada en pacientes con FQ. Posteriormente se desarrolló una formulación específica para inhalación en solución (TNS, TOBI, Novartis Pharmaceuticals) indicada en el tratamiento de mantenimiento de las infecciones pulmonares crónicas por P.aeruginosa en pacientes con FQ a partir de los 6años de edad14. Más recientemente se comercializó la tobramicina en polvo seco (TIP TOBI Podhaler, Novartis Pharmaceuticals).
La tobramicina en polvo seco está indicada en el tratamiento de mantenimiento de la IBC debida a P.aeruginosa en pacientes con FQ a partir de los 6años de edad25. La dosis recomendada es de 112mg de tobramicina (4cápsulas de 28mg cada una), en ciclos alternos de 28días con medicación seguidos de 28días sin tratamiento (ciclos on-off). Las dos dosis deben inhalarse en un intervalo lo más próximo posible a 12h y no inferior a 6h. Para su inhalación se utiliza el dispositivo T-326 (Novartis Pharmaceuticals).
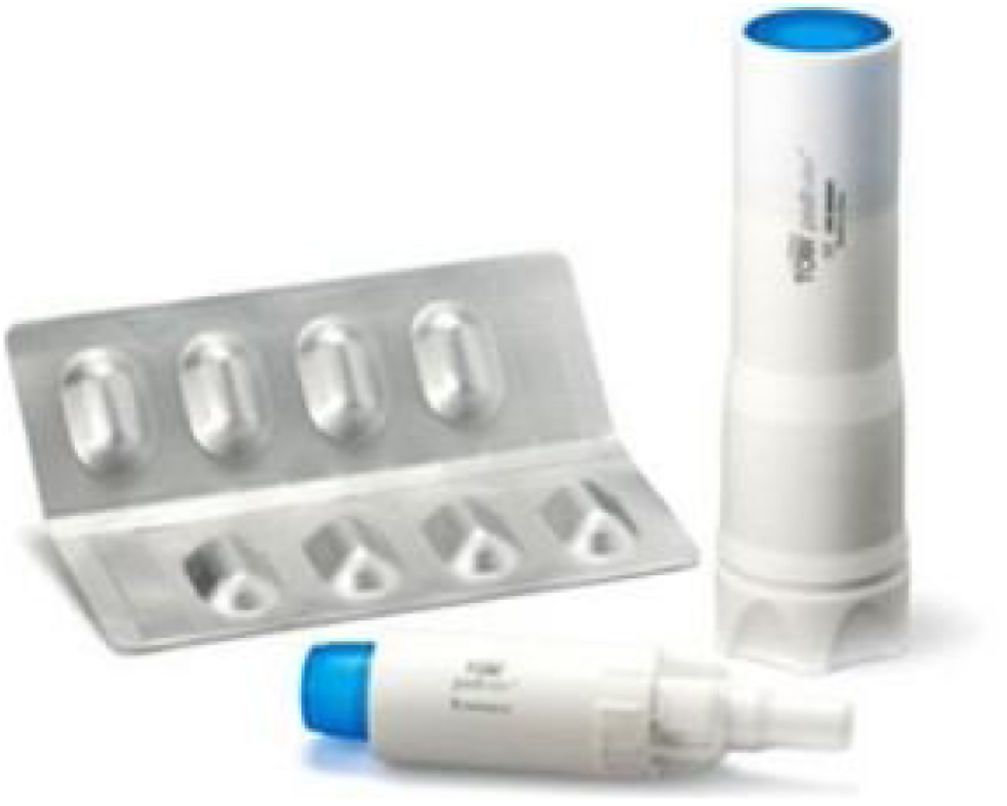
Las Cystic Fibrosis Pulmonary Guidelines la recomiendan con alto grado de evidencia en pacientes con FQ e IBC por P.aeruginosa y afectación pulmonar de moderada a grave26. Las European Consensus Guidelines recomiendan, en la infección crónica por P.aeruginosa, TNS en ciclos de tratamiento y descanso o colistimetato de sodio de manera continua27. Las European Cystic Fibrosis Society Standards of Care añaden que TIP ha demostrado eficacia similar a TNS25 y permite acortar el tiempo de tratamiento con mejoría de la adherencia de los pacientes11. Emplea la tecnología de PulmoSphere (Novartis Pharmaceuticals) y el inhalador T-326 (fig. 1). Esta tecnología genera partículas de tamaño uniforme, esféricas y porosas, de un diámetro inferior a 4μm. Debido a que el dispositivo presenta baja resistencia a la inhalación, la dosis del antibiótico liberada depende muy poco del flujo inspiratorio del paciente, lo que reduce la variabilidad en la liberación de las dosis28.
Farmacocinética y tiempo de administraciónLa farmacocinética de TIP se evaluó en varios estudios. La inhalación de 112mg de tobramicina proporcionó una exposición sistémica similar a 300mg/5ml de TNS con el nebulizador PARI LC PLUS11. Las concentraciones séricas de TIP se analizaron en los ensayos EVOLVE, EDIT y EAGER. No hubo evidencia de acumulación sistémica de tobramicina tras varios ciclos de TIP29.
En un estudio en faseI en pacientes con FQ se reportó un tiempo medio de administración de 4,9min con TIP™, frente a los 15,8min de TNS empleando el nebulizador jet PARI LC PLUS, sin incluir el tiempo empleado en la desinfección y limpieza del mismo16. Similarmente, en un estudio multicéntrico, aleatorizado, abierto y en faseIII (EAGER) el tiempo medio de administración también fue significativamente menor con TIP que con TNS (5,6 vs. 19,7min), excluyendo también el tiempo de limpieza del nebulizador28.
Estudios de evaluación clínica en fase IIITIP se evaluó en dos estudios controlados con placebo, ambos en pacientes con FQ29,30. En EVOLVE, TIP mostró un aumento significativo del flujo espiratorio forzado en el primer segundo (FEV1% del predicho) vs. placebo en el día 28 del ciclo1, manteniéndose esta eficacia durante todo el estudio. Además, TIP redujo las hospitalizaciones y el empleo de antibióticos antipseudomónicos con respecto a placebo29. En ambos estudios se redujo de manera significativa la concentración de P.aeruginosa en esputo en el grupo de tratamiento comparado con el que recibió placebo.
El efecto adverso más frecuente fue la tos. Sin embargo, esta fue poco intensa y habitualmente cedía con el tiempo, por lo que no obligó a suspender el tratamiento29,30. Otros efectos secundarios habituales fueron afonía, disfonía y disgeusia, que pueden deberse a la liberación de elevadas concentraciones de polvo seco o a la irritación de la faringe por el depósito de tobramicina. Las medidas que se recomiendan para minimizar la tos postinhalación son beber agua entre las inhalaciones, hacer inhalaciones menos profundas, mejorar la técnica inhalatoria e inclinar la cabeza ligeramente hacia atrás durante la inhalación.
Evidencia en la vida realSe han llevado a cabo varios estudios para evaluar si los datos respecto a la eficacia y la facilidad de uso del dispositivo de inhalación objetivados en los estudios en faseIII pueden trasladarse a la vida real31-33. En los mismos se demuestra que la eficacia y la seguridad de TIP se mantienen a largo plazo, mostrando los pacientes una mayor adherencia al tratamiento con TIP que con TNS34,35, lo que puede conllevar una disminución del número de ciclos de antibióticos intravenosos que precisaron los pacientes con TIP respecto a los que recibieron TNS36.
Estudios en pacientes con bronquiectasias no secundarias a fibrosis quísticaEn un estudio piloto llevado a cabo con ocho pacientes con BQ no secundarias a FQ se evaluó la tolerabilidad local y la farmacocinética de TIP. Se objetivó buena tolerancia al tratamiento. La tos solo se reportó una vez y se alcanzaron dosis séricas de tobramicina similares a las alcanzadas por TNS36.
A pesar de la falta de estudios realizados en BQ no secundarias a FQ, algunas normativas recomiendan la tobramicina en polvo seco en el tratamiento de la IBC por P.aeruginosa debido a la eficacia y seguridad que ha mostrado en la FQ1.
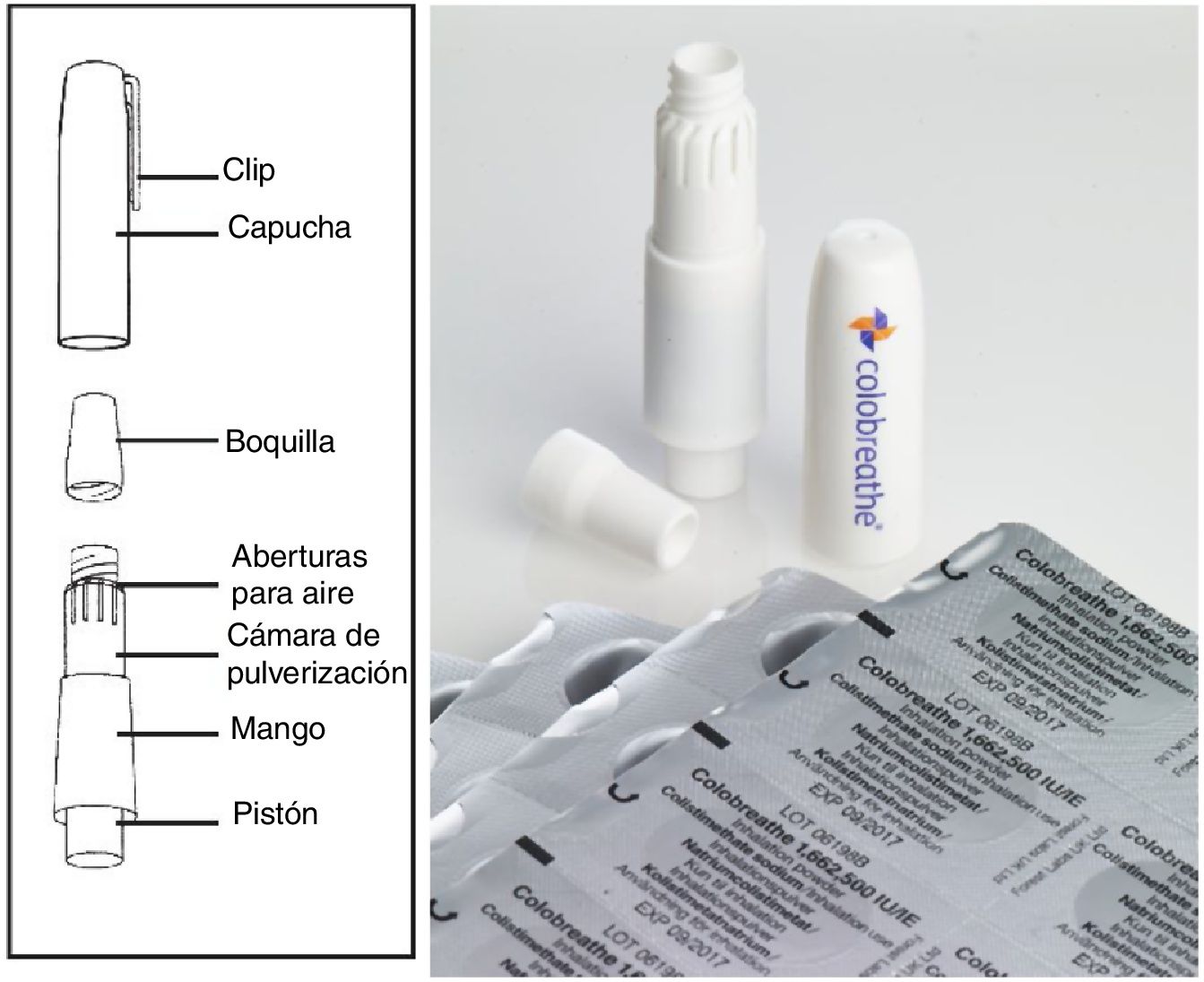
Colistimetato de sodio en polvo secoEl colistimetato de sodio en polvo seco (Colobreathe, Laboratorios TEVA) está indicado en el tratamiento de mantenimiento de la IBC debida a P.aeruginosa en adultos y niños con FQ a partir de los 6años de edad37. La dosis recomendada es de una cápsula (125mg de colistimetato de sodio, equivalentes a 1.662.500UI) administrada de manera continua, sin ciclos de descanso, dos veces al día, con un intervalo de dosis que debe ser lo más cercano posible a 12h. El dispositivo que se utiliza para su inhalación es el Turbospin Dry Power Inhaler (Laboratorios TEVA).
El Turbospin (fig. 2) es un inhalador de polvo seco impulsado por el flujo inspiratorio. Produce, como TIP, un mayor depósito orofaríngeo, por lo que ocasiona mayores efectos locales (en especial irritación faríngea, sabor desagradable, disfonía y tos). Estos suelen desaparecer al cabo de unos días de tratamiento, sin que suela ser necesario suspender este37. La técnica de inhalación es muy semejante a la de otros inhaladores de polvo seco, como TIP. Se precisa un flujo inspiratorio mínimo de 30l/min.
Farmacocinética y tiempo de administraciónLa absorción sistémica se analizó en un estudio de dosis múltiples abierto, realizado en pacientes con FQ e IBC por P.aeruginosa. La máxima concentración (Cmax) plasmática para colistimetato se alcanzó entre media hora y una hora postinhalación y estuvo significativamente por encima de la concentración de antimicrobiano que inhibe al 90% de las cepas bacterianas (CMI90) frente a P.aeruginosa. Los niveles plasmáticos de colistina fueron unas 500 veces menores que los niveles que se alcanzan tras una infusión intravenosa de colistimetato de sodio, lo que confirma el bajo riesgo de toxicidad sistémica y de interacción con otros fármacos. Su tiempo de administración es aproximadamente de 1min37.
Estudios de evaluación clínica en fase IIIEn el ensayo FREEDOM, en faseIII, se comparó colistimetato de sodio en polvo seco, 125mg dos veces al día, sin periodos de descanso, con el inhalador Turbospin, con TNS (300mg/5ml dos veces al día, en tres ciclos on-off) con el nebulizador PARI LC PLUS, durante 24semanas32. Se llevó a cabo en pacientes con FQ≥6años, con IBC por P.aeruginosa y con un FEV1 comprendido entre el 25% y el 75% del predicho. El colistimetato de sodio en polvo seco no fue inferior a TNS en la variable principal (la media del cambio del FEV1 —% del predicho— a las 24semanas de tratamiento). La proporción de pacientes con al menos una agudización a las 24semanas fue del 31,1% en el grupo de colistimetato de sodio y del 26,1% en el grupo de TNS. En ninguno de los dos grupos hubo diferencias en la calidad de vida entre el inicio del estudio y la semana24. Los efectos adversos relacionados con el tratamiento fueron más frecuentes con colistimetato, pero generalmente resultaron leves. Un mayor número de pacientes encontró más fácil de usar el dispositivo Turbospin que el nebulizador PARI LC PLUS. No se detectaron problemas significativos de resistencias a colistimetato.
Hasta la fecha no se han publicado ensayos clínicos que estudien la eficacia y la seguridad del colistimetato de sodio en BQ no secundarias a FQ. Sin embargo, tal y como ocurre con TIP, está recomendada por la normativa de la Sociedad Española de Patología Respiratoria en el tratamiento de la IBC por P.aeruginosa debido a la eficacia y la seguridad demostradas en FQ1.
Vancomicina en polvo secoLa prevalencia de SARM ha aumentado mucho en la última década en pacientes con FQ, sobre todo en Estados Unidos. Por ello se está desarrollando una preparación de vancomicina en polvo seco (Aerovanc).
En un estudio en faseI realizado en voluntarios sanos y en pacientes con FQ, Aerovanc se toleró bien y consiguió altos niveles de vancomicina en el esputo38. Recientemente se ha realizado un ensayo de faseII (resultados todavía no publicados) para evaluar la eficacia, la seguridad y la farmacocinética de Aerovanc en pacientes con FQ e infección crónica por SARM con dos cohortes de tratamiento, cada una con 40pacientes. Los pacientes se aleatorizaron para inhalar dos cápsulas de 32mg de Aerovanc o de placebo dos veces al día durante 28días. El ensayo alcanzó su objetivo primario de lograr una disminución de las unidades formadoras de colonias de SARM en el tracto respiratorio. Se toleró bien y no se seleccionaron otros MPP. Todo ello sugiere que Aerovanc puede ser una opción terapéutica viable para la infección por SARM en FQ. Debido a estos buenos resultados está en desarrollo un estudio en faseIII multicéntrico y aleatorizado también en pacientes con FQ e IBC por SARM.
Hasta la fecha no hay estudios con Aerovanc en pacientes con BQ no secundarias a FQ.
Ciprofloxacino inhaladoExisten dos formulaciones de ciprofloxacino para inhalación: la formulación en polvo seco y la liposomal. La presentación en polvo seco emplea la tecnología de PulmoSphere (Novartis Pharma AG, Basilea, Suiza) por medio del inhalador T-326 (fig. 1). La dosis del polvo seco es de 32,5mg cada 12h alternando ciclos de 28días de tratamiento con 28días de descanso (on-off).
Las formulaciones de ciprofloxacino liposomal (Lipoquin Aradigm Corp., CA, EE.UU.) y ciprofloxacino de liberación dual con combinación de formulación liposomal y libre (Pulmaquin Aradigm Corp., CA, EE.UU.) se administran una vez al día. El ciprofloxacino liposomal Pulmaquin (150mg en 3ml) se administra con un nebulizador tipo jet (fig. 3).
La Food and Drug Administration ha reconocido el ciprofloxacino inhalado como tratamiento huérfano para pacientes con FQ y BQ no secundarias a FQ con IBC por MPP sensibles al fármaco.
Farmacocinética y tiempo de administraciónEn un ensayo en faseI en pacientes con FQ se demuestra que ciprofloxacino en polvo seco se tolera bien, con una exposición sistémica mínima, y alcanza concentraciones en esputo más de 100 veces la CIM39.
Estudios gammagráficos con ciprofloxacino en polvo seco han demostrado un depósito pulmonar del 51-53% en voluntarios sanos, del 53% en BQ no secundarias a FQ y del 51% en EPOC. La exposición sistémica ha sido baja y no ha habido episodios de broncoespasmo ni cambios en la función pulmonar40.
Por otra parte, estudios in vitro demostraron que ciprofloxacino liposomal era capaz de penetrar en las biopelículas de P.aeruginosa con 99% de reducción en la viabilidad a concentración de 1μm/ml41 y el dispositivo en polvo seco T-326 necesita flujos inspiratorios mínimos de 45l/min y una capacidad de 1,3l42.
El tiempo de administración es de aproximadamente 15min con la formulación liposomal y menos de 5min con el polvo seco.
Estudios en fase IIUn ensayo clínico en faseII realizado en 124 pacientes con BQ no secundarias a FQ con infección bronquial tanto por P.aeruginosa como por otros MPP durante 28días y con seguimiento a 56días con la presentación en polvo seco (DPI 32,5mg cada 12h) observó una disminución significativa de la carga bacteriana en el día 28 comparado con placebo (62 log10 CFU.g-1 vs. −0,27 log10 CFU.g-1; p<0,001) y en la tasa de erradicación de MPP (35% vs. 8%; p=0,001). Sin embargo, no hubo diferencias en el tiempo transcurrido hasta la primera agudización, ni en el número total de agudizaciones, en la función pulmonar ni en la calidad de vida. Tampoco hubo efectos secundarios importantes43,44.
El estudio ORBIT-2, realizado con la formulación liposomal dual de ciprofloxacino (150mg 3ml +libre 60mg 3ml en 3 ciclos de 28 días en ciclos on-off) en 42 pacientes con BQ no secundarias a FQ e IBC por P.aeruginosa durante 24semanas, también ha constatado una disminución de la carga bacteriana (−4,2 log10 CFU/g vs. −0,08 placebo; p=0,002) al final del primer ciclo. El tiempo hasta la primera agudización fue de 134días vs. 58días (p=0,057) y la tasa de agudizaciones fue del 40% vs. 77% (p=0,027). Sin embargo, no encontraron mejoría del FEV1, del test de marcha, ni en la calidad de vida medida por el cuestionario de St. George's. La tolerancia del fármaco fue adecuada, sin que se produjera selección de cepas resistentes a ciprofloxacino o se detectara la aparición de patógenos emergentes45.
Estudios de evolución clínica en fase IIIEn el análisis conjunto de los estudios ORBIT-3 y 4 con ciprofloxacino para inhalación en formulación dual (liposomal 150mg 3ml +libre 60mg 3ml; Aradigm Corporation, Hayward, CA, EE.UU.) en ciclos de 28días on-off durante 48semanas en 582 pacientes con BQ no secundarias a FQ se observó disminución de carga bacteriana, aumento del tiempo hasta la primera agudización (2meses grupo ciprofloxacino vs. placebo) y una reducción de agudizaciones del 27% (RR: 0,73; p<0,001) comparado con placebo46.
El RESPIRE-1, en el que participaron 416 pacientes con una duración de 48semanas, comparó la presentación en polvo seco (DPI 32,5mg c/12h) en ciclos on-off de 14días frente a 28días, observando tanto aumento del tiempo hasta la primera agudización (336días vs. 186días; HR 0,53; p=0,005) como una reducción de agudizaciones de un 39% (RR: 0,61; p=0,0061) para los ciclos de 14días on-off pero no para los de 28días47.
Sorprendentemente, el estudio RESPIRE-2, realizado en 521 pacientes durante 48semanas utilizando ciprofloxacino en polvo seco (DPI 32,5 cada 12h en ciclos de 14 o 28días on-off), no mostró diferencias significativas ni en el tiempo hasta la primera agudización ni en el número de agudizaciones48.
Un metaanálisis reciente49 de todos los ensayos controlados aleatorizados con ciprofloxacino inhalado (2 estudios en faseII y 4 estudios en faseIII), que incluía 1.685 pacientes (1.094 ciprofloxacino inhalado y 591 placebo), concluye que existe un beneficio clínico en términos de reducción de agudizaciones en pacientes con BQ no secundarias a FQ.
Por otra parte, VanDevanter et al.50, tras analizar los aspectos microbiológicos de los estudios en faseIII con ciprofloxacino concluyen que la reducción media de densidad P.aeruginosa era consistente a lo largo de 48semanas y se asociaba con menor riesgo de agudizaciones. Se observó un aumento de CIM de ciprofloxacino a P.aeruginosa pero no hubo cambio en la sensibilidad a otros antimicrobianos o emergencia de bacterias oportunistas.
Las discrepancias observadas entre estudios pueden explicarse por las distintas etiologías de las BQ, proporción variable de MPP distintos a P.aeruginosa, procedencia de países con culturas y sistemas sanitarios heterogéneos, tiempo y proporción variable de pacientes con macrólidos, ausencia de métodos precisos de medición de la adherencia al tratamiento, distintas definiciones de agudización, el número diferente de agudizaciones previas entre estudios y resultados diferentes de los ciclos on-off de 14días con respecto a 28días. Cabe destacar que en los estudios ORBIT-3 y 4 aproximadamente 1/3 de pacientes tenían MPP distintos a P.aeruginosa y en un alto porcentaje la etiología de las BQ era asma o EPOC.
Estudios en pacientes con bronquiectasias no secundarias a fibrosis quísticaLos estudios faseII yIII mencionados se han realizado en pacientes con BQ no secundarias a FQ.
Levofloxacino inhaladoEl LF es una fluoroquinolona de tercera generación que cuenta con un amplio espectro de actividad frente a bacterias grampositivas y gramnegativas (incluyendo P.aeruginosa)51. Posee mejor actividad contra microorganismos grampositivos que ciprofloxacino52.
La presentación que se ha formulado para inhalación es una solución en aerosol, sin conservantes y ligeramente hiperosmótica (350-500mOsm). Cada ampolla contiene 240mg de LF. Se ha comercializado en Europa como Quinsair®. Está indicado para el tratamiento de las infecciones pulmonares crónicas causadas por P.aeruginosa en pacientes adultos con FQ53,54.
La dosis recomendada es de 240mg (una ampolla) en ciclos alternos de 28días on-off, administrados mediante inhalación dos veces al día (separadas en lo posible 12h). Se recomienda la utilización de un broncodilatador de acción corta al menos 15min antes de la siguiente dosis. Se administra con un nebulizador Zirela específico para Quinsair conectado con un Controlador eBase PARI eFlow.
Farmacocinética y tiempo de administraciónLos parámetros farmacocinéticos se caracterizaron en ensayos clínicos faseI con pacientes con FQ48 y en modelos de ratón con infección crónica por P.aeruginosa55.
La concentración plasmática máxima de LF inhalado se alcanza alrededor de 0,5-1h después de la dosis. La inhalación de la dosis de 240mg dos veces al día da lugar a una exposición sistémica un 50% inferior a la observada tras la administración sistémica de dosis comparables.
Un estudio in vitro de la actividad antibacteriana de varios antibióticos inhalados (LF, ciprofloxacino, tobramicina, amikacina y aztreonam) reveló que LF fue el antibiótico más potente contra biopelículas de P.aeruginosa, Burkholderia cepacia, Stenotrophomonas maltophilia, Achromobacter xylosoxidans y S.aureus56. Las formulaciones en polvo seco presentan propiedades aerodinámicas satisfactorias, por lo que podrían ser una alternativa prometedora a la solución de LF para inhalación57.
Estudios microbiológicos in vitro indican que la actividad en esputo para P.aeruginosa solo se obtendría cuando los valores de CIM son ≤0,2mg/l para ciprofloxacino y ≤0,5mg/l para LF58. Con el LF se ha demostrado en un modelo de ratón con infección crónica en la vía aérea que la reducción de P.aeruginosa es proporcional a la dosis, constatándose que dosis de 15, 30 y 60mg/kg de peso reducen los recuentos bacterianos (expresado en UFC/ml) 0,07, 0,62 y 1,25 veces, respectivamente59. No obstante, la correlación con las bacterias que crecen en biopelículas requiere fAUC/CMI superiores a 384 para producir un efecto bactericida y lograr disminuir la selección de mutantes resistentes, situación que solo es posible con una administración de este antibiótico por vía inhalada. El tiempo de administración es aproximadamente de 5min.
Estudios de evolución clínica en fase IIIUn estudio aleatorizado frente a placebo, con diferentes dosis de LF, administrado por medio de eFlow rapid (PARI Pharma GmbH, Stamberg, Alemania), demostró su efectividad en pacientes con FQ tratados previamente con solución de tobramicina para inhalación (TIS). Los autores concluyen que la dosis de 240mg/12h durante 28días reduce significativamente el recuento de P.aeruginosa en esputo, el consumo de antibióticos, mejora el FEV1 y muestra una tendencia hacia la mejoría de los síntomas al final de los 28días de tratamiento60.
En un ensayo clínico en faseIII, multicéntrico, doble ciego, aleatorizado, se comparó LF con TIS (3ciclos de 28días on/off de 240mg/12h de LF nebulizado frente a 300mg de TIS) en 208 pacientes ≥12años con FQ e IBC por P.aeruginosa procedentes de 125 centros (EE.UU., Europa, Israel). LF demuestra no inferioridad en FEV1 en los primeros 28días frente a TIS. No hubo diferencias significativas hasta la primera agudización entre los dos grupos, pero sí una mejoría significativa en la calidad de vida y una reducción significativa en las hospitalizaciones en el brazo de LF. Los autores concluyen que LF inhalado es tan seguro y eficaz como TIS, y ofrece una alternativa para su uso en el tratamiento de pacientes con FQ e infección crónica por P.aeruginosa61. En el curso del estudio la proporción de sujetos que experimentaron un aumento de 4veces en la CMI de LF para P.aeruginosa era similar en los dos grupos de tratamiento (21% para LF vs. 17% para TIS; p=0,5). Otro ensayo controlado con placebo, aleatorizado, realizado en 330 pacientes con FQ pertenecientes a 97 centros (EE.UU., Canadá, Australia, Nueva Zelanda, Israel) a los que se les administró LF 240mg con eFlow cada 12h en ciclos de 28días mostró eficacia en aumento del tiempo hasta la primera agudización62.
Las reacciones adversas más frecuentes fueron tos/tos productiva (54%), disgeusia (30%) y fatiga/astenia (25%). No es necesario ajustar la dosis en pacientes con insuficiencia renal leve a moderada ni en insuficiencia hepática. No se recomienda el uso de Quinsair en pacientes con insuficiencia renal grave.
En los ensayos clínicos se incluyeron tanto adolescentes con FQ (≥12 a <18años) como niños (≥6años) y no se observaron diferencias clínicamente significativas en el perfil de seguridad en estos subgrupos de la población pediátrica en comparación con los adultos. Sin embargo, se han observado dos casos de artralgias en niños y faltan los datos de seguridad a largo plazo, especialmente considerando los efectos sobre los cartílagos observados en animales, por lo que no se recomienda su uso en menores de 18años (Ficha técnica Quinsair).
En resumen, LF inhalado constituye otra opción de tratamiento de la IBC por P.aeruginosa en pacientes adultos con FQ y permite desarrollar nuevas pautas de tratamiento, rotando los antibióticos, disminuyendo con ello las resistencias a P.aeruginosa, enlenteciendo el declive de la función pulmonar, disminuyendo las agudizaciones y mejorando la calidad de vida de los pacientes.
Estudios en pacientes con bronquiectasias no secundarias a fibrosis quísticaHasta la fecha no se han publicado ensayos clínicos que estudien la eficacia y la seguridad del LF inhalado en BQ no secundarias a FQ. Sin embargo, está recomendado por la normativa de la Sociedad Española de Patología Respiratoria en el tratamiento de la IBC por P.aeruginosa debido a la eficacia y a la seguridad demostradas en FQ1.
Amikacina liposomalExiste una formulación liposomal de amikacina (Arikace; Transave Inc., Monmouth Junction, NJ, EE.UU.) que consigue concentraciones de fármaco en los pulmones más prolongadas. Hay un interés creciente por explorar el papel de este fármaco en la IBC por P.aeruginosa en FQ63 y en el tratamiento de la infección pulmonar refractaria por micobacterias no tuberculosas (MNT)64-69. Factores como la dosificación una vez al día y una buena penetración en moco y biopelícula hacen de esta formulación una opción terapéutica prometedora.
Arikace emplea una formulación lipídica de amikacina que contiene 590mg y se administra una vez al día mediante nebulizador Pari eFlow® (Lamira Nebulizer System, PARI Respiratory Equipment, Inc.) durante 10-14min.
Farmacocinética y tiempo de administraciónEl desarrollo de formulaciones liposomales para inhalación permite una absorción más lenta una vez que alcanzan la vía aérea, a diferencia de los antimicrobianos hidrosolubles (la mayoría de los que se utilizan para inhalación).
Estudios in vitro han verificado que los liposomas penetran bien en las biopelículas tanto de P.aeruginosa como de MNT70,71 y que los factores de virulencia secretados por P.aeruginosa facilitan la liberación de amikacina de los mismos. Además, los liposomas liberan las partículas de antibiótico lentamente, lo que prolonga el tiempo en que aquel está en contacto con los patógenos y permite alargar el intervalo de administración65. Varios estudios han analizado la farmacocinética en MNT72-75.
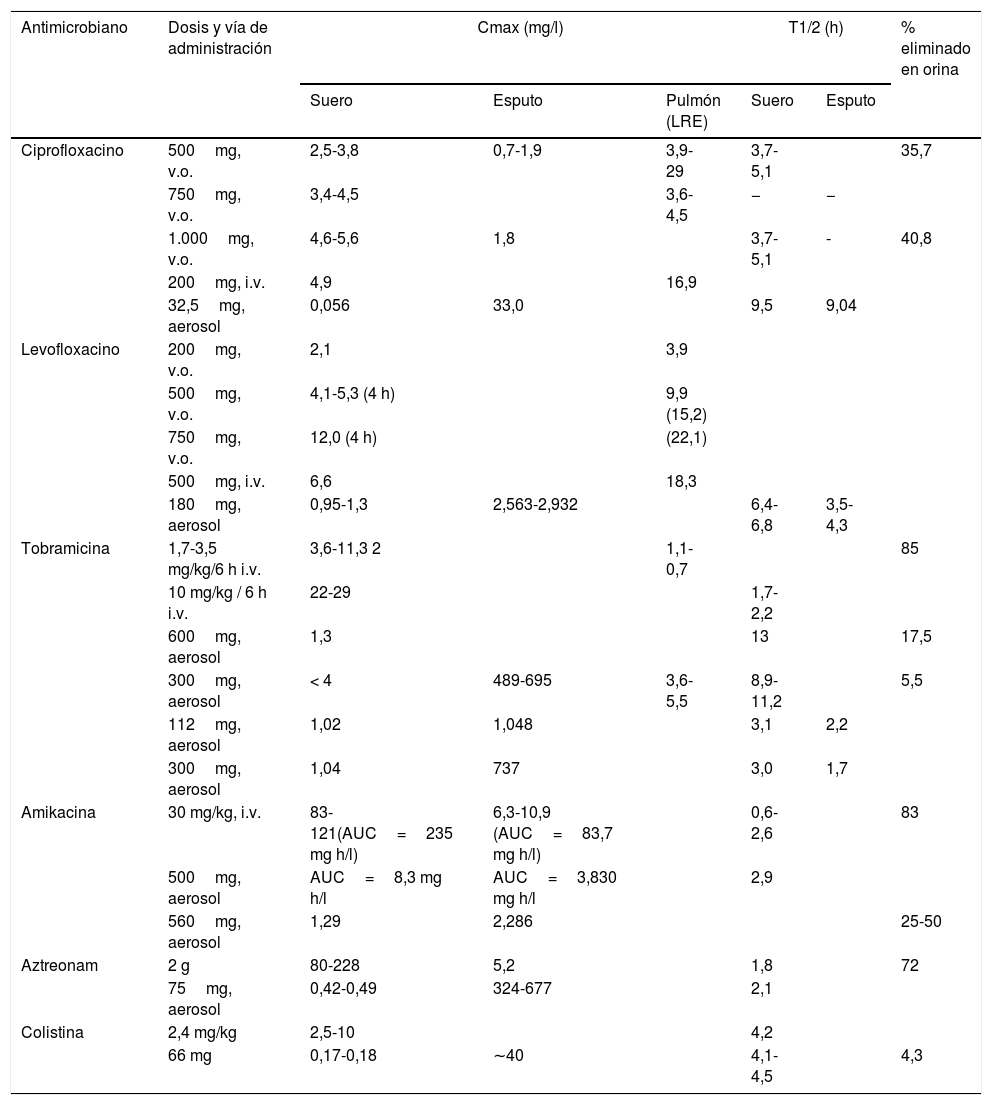
En la tabla 5 pueden observarse los valores de diferentes parámetros farmacocinéticos que se alcanzan cuando el antimicrobiano se administra por diferentes vías.
Valores de diferentes parámetros farmacocinéticos que se alcanzan cuando el antimicrobiano se administra por diferentes vías
| Antimicrobiano | Dosis y vía de administración | Cmax (mg/l) | T1/2 (h) | % eliminado en orina | |||
|---|---|---|---|---|---|---|---|
| Suero | Esputo | Pulmón (LRE) | Suero | Esputo | |||
| Ciprofloxacino | 500mg, v.o. | 2,5-3,8 | 0,7-1,9 | 3,9-29 | 3,7-5,1 | 35,7 | |
| 750mg, v.o. | 3,4-4,5 | 3,6-4,5 | − | − | |||
| 1.000mg, v.o. | 4,6-5,6 | 1,8 | 3,7-5,1 | - | 40,8 | ||
| 200mg, i.v. | 4,9 | 16,9 | |||||
| 32,5mg, aerosol | 0,056 | 33,0 | 9,5 | 9,04 | |||
| Levofloxacino | 200mg, v.o. | 2,1 | 3,9 | ||||
| 500mg, v.o. | 4,1-5,3 (4 h) | 9,9 (15,2) | |||||
| 750mg, v.o. | 12,0 (4 h) | (22,1) | |||||
| 500mg, i.v. | 6,6 | 18,3 | |||||
| 180mg, aerosol | 0,95-1,3 | 2,563-2,932 | 6,4-6,8 | 3,5-4,3 | |||
| Tobramicina | 1,7-3,5 mg/kg/6 h i.v. | 3,6-11,3 2 | 1,1-0,7 | 85 | |||
| 10 mg/kg / 6 h i.v. | 22-29 | 1,7-2,2 | |||||
| 600mg, aerosol | 1,3 | 13 | 17,5 | ||||
| 300mg, aerosol | < 4 | 489-695 | 3,6-5,5 | 8,9-11,2 | 5,5 | ||
| 112mg, aerosol | 1,02 | 1,048 | 3,1 | 2,2 | |||
| 300mg, aerosol | 1,04 | 737 | 3,0 | 1,7 | |||
| Amikacina | 30 mg/kg, i.v. | 83-121(AUC=235 mg h/l) | 6,3-10,9 (AUC=83,7 mg h/l) | 0,6-2,6 | 83 | ||
| 500mg, aerosol | AUC=8,3 mg h/l | AUC=3,830 mg h/l | 2,9 | ||||
| 560mg, aerosol | 1,29 | 2,286 | 25-50 | ||||
| Aztreonam | 2 g | 80-228 | 5,2 | 1,8 | 72 | ||
| 75mg, aerosol | 0,42-0,49 | 324-677 | 2,1 | ||||
| Colistina | 2,4 mg/kg | 2,5-10 | 4,2 | ||||
| 66 mg | 0,17-0,18 | ∼40 | 4,1-4,5 | 4,3 | |||
i.v.: vía intravenosa; v.o.: vía oral.
Fuente: datos tomados de Dalhoff58.
La amikacina liposomal nebulizada una vez al día ha demostrado ser tan eficaz como la tobramicina libre 2veces al día en un modelo de ratón con infección crónica por P.aeruginosa71, y comparado con salino, la amikacina liposomal disminuye significativamente las unidades formadores de colonias de P.aeruginosa (p=0,002).
Un estudio en faseII en pacientes con FQ con infección crónica por P.aeruginosa ha analizado la eficacia y la seguridad de 28días de tratamiento con Arikace63. Se han incluido 105 pacientes en un estudio doble ciego, controlado con placebo, aleatorizado a distintas dosis de amikacina liposomal (70, 140, 280 y 560mg; n=7, 5, 21 y 36pacientes) o placebo (n=36). Las variables primarias fueron seguridad y tolerancia. Las variables secundarias incluyeron FEV1, densidad de P.aeruginosa en esputo y calidad de vida medida por el cuestionario CFQ-R. Los efectos secundarios fueron similares a placebo. El cambio en FEV1 era mayor en el grupo de 560mg de amikacina liposomal en el día 28 (p=0,033) y en el día 56 (28días postratamiento (p=0,003) vs. placebo. La carga bacteriana de P.aeruginosa disminuía >1log en el grupo de 560mg vs. placebo (días 14, 28 y 35; p=0,021). El dominio respiratorio del CFQ-R alcanzaba la mínima diferencia clínicamente importante (MDCI) en 67% de sujetos con Arikace vs. 36% de placebo (p=0,006), y se correlacionaba con mejoría del FEV1 en los días 14, 28 y 42 (p<0,05). Una extensión abierta de 56días de seguimiento confirmaba mejoría de la función pulmonar y densidad de P.aeruginosa (n=49). Por tanto, Arikace una vez al día demostraba tolerancia, seguridad, y eficacia en pacientes con FQ e infección crónica por P.aeruginosa.
Estudios de evolución clínica en fase IIILos estudios de amikacina liposomal inhalada en comparación con TIS en pacientes con FQ, con infección por P.aeruginosa, revelaron un aumento comparable en el FEV1 al final de tres ciclos de tratamiento63. Además, la amikacina liposomal tiene otras aplicaciones potenciales en el tratamiento de las infecciones pulmonares por MNT difíciles de tratar65,69.
Eficacia en vida realSe han publicado casos clínicos de pacientes con enfermedad refractaria por MNT64-67.
Estudios en pacientes con bronquiectasias no secundarias a fibrosis quísticaNo existen estudios hasta el momento en BQ no FQ.
FosfomicinaLa fosfomicina es un antibiótico bactericida por su capacidad para interferir con la síntesis de constituyentes de la pared celular bacteriana (peptidoglicano) aumentando su permeabilidad para otros compuestos antibacterianos. Tiene actividad frente a bacterias grampositivas y gramnegativas (incluyendo P.aeruginosa, Acinetobacter baumannii o Burkholderia). Además, inhibe la formación de biopelículas de cepas de Escherichia coli o P.aeruginosa76. Se están estudiando dos combinaciones con fosfomicina vía inhalada para la infección por P.aeruginosa en pacientes con FQ (fosfomicina 300mg con amikacina 120mg y con tobramicina 160/40mg cada 12h o 80/20mg cada 12h).
La combinación de fosfomicina y amikacina en estudios in vitro ha demostrado la disminución de la CIM respecto a cada antibiótico por separado77,78. En un ensayo clínico faseI que evaluó la tolerancia y la seguridad tras la nebulización mediante eFlow de la combinación en pacientes con infecciones del tracto respiratorio inferior asociadas a ventilador79, se observó una alta concentración de ambos antibióticos en los aspirados traqueales de los 9pacientes estudiados y sin efectos adversos relevantes. Esta combinación aún no se ha evaluado en estudios clínicos en pacientes con FQ, pero la evidencia disponible sugiere que puede tener un papel relevante.
En los estudios preclínicos realizados in vitro y en modelos animales la combinación de fosfomicina/tobramicina ha demostrado una CMI menor que cada uno de los componentes de manera aislada para el tratamiento de P.aeruginosa y de S.aureus80. En estudios de sinergia no se demostró antagonismo entre constituyentes y sí un efecto bactericida concentración-dependiente. Un ensayo en faseII evaluó el papel de la combinación fosfomicina/tobramicina en pacientes que estaban recibiendo aztreonam inhalado y observó que las mejorías clínicas en síntomas, función pulmonar, parámetros microbiológicos y de calidad de vida conseguidas por aztreonam se mantuvieron cuando se cambió a la combinación fosfomicina/tobramicina utilizando tanto dosis altas (160/40mg/12h) como dosis bajas (80/20mg/12h)81.
Formulaciones intravenosas de antibióticos empleadas por vía inhaladaEl empleo de formulaciones intravenosas de antibióticos por vía inhalada para el tratamiento de enfermedades que cursan con una IBC data de finales de los años cuarenta11. A partir de los años ochenta se generalizó su uso, sobre todo en Europa, en pacientes con FQ82, debido, principalmente a los trabajos de Hodson et al.83 y a la notable mejora de la eficacia de los sistemas de nebulización. Se utilizaron aminoglucósidos, betalactámicos y polimixinas, en base a pequeños estudios19,84. Con la aparición de las preparaciones específicas para nebulización14 se fueron empleando cada vez menos las formulaciones intravenosas por vía nebulizada. Exceptuando algunos casos puntuales85, tanto las formulaciones intravenosas empleadas por vía inhalada como las soluciones de antibióticos específicas para inhalación se han dirigido para tratar la IBC por P.aeruginosa en pacientes con FQ.
La elección de la posología de las formulaciones intravenosas empleadas por vía inhalada ha sido totalmente empírica. Habitualmente las dosis empleadas han sido las mismas que las utilizadas por vía parenteral13,84, sin estudios previos que avalaran su seguridad y determinaran la cantidad de fármaco que se depositaba en las vías aéreas inferiores. El problema de estos estudios radica en que es difícil extraer conclusiones de los mismos con alto grado de evidencia, ya que tienen diseños diferentes, no controlados, incluyen pocos pacientes, con edades, patologías y afectación pulmonar muy variadas. Además emplean antibióticos distintos y nebulizadores de eficiencia muy dispar84-86. A pesar de todas estas limitaciones, en la mayoría de los estudios este tipo de formulaciones empleadas por vía inhalada se han mostrado seguras y eficaces.
Estas formulaciones suelen reconstituirse preferentemente con solución salina fisiológica y, menos frecuentemente, con agua destilada, según el tipo de antibiótico y la osmolaridad de la solución, de tal manera que sean lo más isotónicas posible, esto es, lo más parecidas a los valores fisiológicos (300-400mOsm/kg y pH de 7±0,5)87 para evitar un efecto broncoconstrictor88. Como norma general se debe priorizar el uso de las formulaciones específicas para inhalación sobre las formulaciones intravenosas de antibióticos por vía inhalada1, ya que las específicas están refrendadas por ensayos clínicos bien diseñados y probablemente se toleran mejor que las intravenosas89. Sin embargo, el coste de las formulaciones específicas es muy superior al de las formulaciones intravenosas, por lo que deben considerarse en algunos casos.
Las formulaciones intravenosas empleadas más habitualmente han sido tobramicina y gentamicina, tanto en FQ13,83,90-92 como en BQ de otras etiologías93-95. Tobramicina, en pacientes con BQ no secundarias a FQ, redujo el número de hospitalizaciones y días de ingreso hospitalario, sin cambios en la función pulmonar. Los efectos adversos fueron frecuentes pero en general leves, siendo el más relevante la broncoconstricción93,94. Las dosis empleadas han variado en los estudios, entre 100mg/12h y 300mg/12h. Gentamicina, también en este grupo de pacientes, ha demostrado su eficacia y seguridad a dosis de 80mg, dos veces al día, dispensada por un nebulizador jet, en un estudio de un año de duración del tratamiento con 3meses más de seguimiento, aleatorizado con placebo. Cabe destacar que en este estudio los pacientes estaban crónicamente infectados por cualquier microorganismo patógeno, no solo por P.aeruginosa95. En el grupo tratado con gentamicina se redujo el recuento de MPP en esputo, la purulencia del mismo y la inflamación sistémica y de las vías aéreas95,96. Los pacientes presentaron significativamente menos exacerbaciones y aumentó el intervalo de tiempo libre hasta la primera agudización, con mejoría en la calidad de vida. No se observaron diferencias en los parámetros espirométricos. Este trabajo refuerza la idea de que los tratamientos deben ser continuados, sin periodos de descanso, ya que al final del periodo de descanso se constató que los valores de las variables analizadas habían vuelto a sus valores pretratamiento.
No hay estudios publicados con amikacina en pacientes con IBC por Pseudomonas ni en FQ ni en BQ de otras etiologías. El único estudio publicado es sobre agudizaciones en FQ. Los autores concluyen que emplear amikacina inhalada añadida a amikacina y ceftazidima intravenosas en pacientes que presentan una exacerbación no aporta ningún beneficio clínico97. Algunas publicaciones basadas en pocos casos clínicos sugieren que la amikacina en aerosol puede ser eficaz como adyuvante al tratamiento estándar en pacientes con BQ que padecen enfermedad pulmonar por MNT68,98.
En pacientes con FQ también se han utilizado β-lactámicos, tales como carbenicilina13,83, cefaloridina99 y ampicilina100,101 en diferentes pautas, y en algunos casos en combinaciones con otros antibióticos por vía parenteral. En general, tal y como se ha comentado con los aminoglucósidos, muestran una disminución del número de agudizaciones con mínimos efectos secundarios.
En BQ no secundarias a FQ se han publicado varios trabajos con esta clase de antibióticos. Ya en los años cincuenta, Farber y Ross11 publicaron un estudio no aleatorizado en 300 pacientes con diversas patologías respiratorias, demostrando la eficacia y la seguridad de la penicilina y de la estreptomicina nebulizadas. Años más tarde, Stockley y Hill emplearon amoxicilina inhalada a dosis de 500mg, dos veces al día durante 4meses en pacientes con esputo purulento y diferentes MPP tras fracasar el tratamiento con amoxicilina oral. Objetivaron una disminución del volumen y de la purulencia del esputo, de la elastasa neutrofílica y un aumento del flujo espiratorio máximo sin efectos secundarios85,102. Currie et al.103 compararon el tratamiento con amoxicilina nebulizada frente a la oral durante 6meses en 10pacientes colonizados por diferentes MPP. No observaron ninguna diferencia entre las dos terapias, pero en ambas disminuyó la carga bacteriana al mes del tratamiento.
En otro estudio, El-Din et al.104 compararon en 40 pacientes, la mayoría de ellos con BQ, un tratamiento sistémico añadido o no a un antibiótico en aerosol, en el que se incluyó ceftazidima. Se observó una disminución del volumen de esputo superior cuando se asociaron ambas terapias. Orriols et al.93 compararon, en pacientes con BQ e infección por P.aeruginosa, una combinación de tobramicina y ceftazidima nebulizadas frente a un tratamiento sintomático (sin antibióticos inhalados). Observaron una disminución del número de hospitalizaciones y días de ingreso hospitalario en el grupo tratado con antibióticos nebulizados, sin objetivar diferencias en la función pulmonar.
Aunque la normativa de la Sociedad Española de Patología Respiratoria recomienda el uso de la formulación intravenosa de vancomicina para tratar la IBC por Staphylococcus aureus resistente a la meticilina en pacientes con BQ1, no hay trabajos publicados sobre el uso de la misma en este tipo de pacientes. La recomendación se hace en base a su empleo en pacientes con FQ105,106.
La tabla 6 presenta un resumen de los nuevos antibióticos inhalados y de los dispositivos utilizados para su inhalación. En la tabla 7 se muestran los estudios más relevantes con antibióticos inhalados, aún no publicados, en distintas fases de desarrollo clínico.
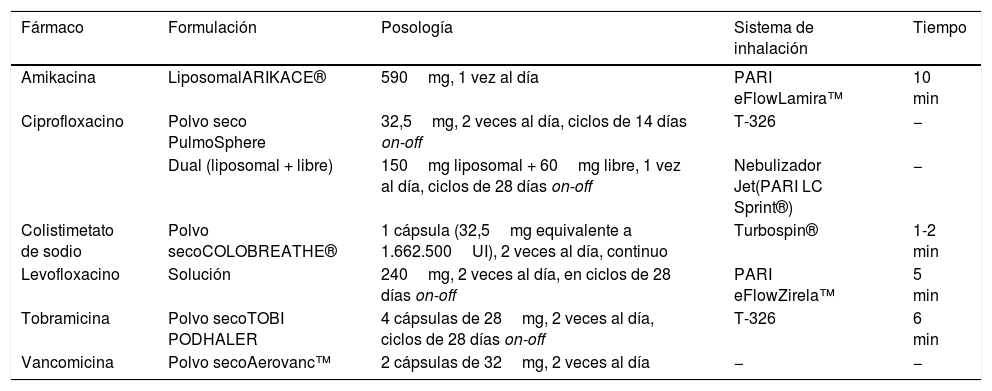
Antimicrobianos para inhalación en polvo seco y nuevas formulaciones
| Fármaco | Formulación | Posología | Sistema de inhalación | Tiempo |
|---|---|---|---|---|
| Amikacina | LiposomalARIKACE® | 590mg, 1 vez al día | PARI eFlowLamira™ | 10 min |
| Ciprofloxacino | Polvo seco PulmoSphere | 32,5mg, 2 veces al día, ciclos de 14 días on-off | T-326 | − |
| Dual (liposomal + libre) | 150mg liposomal + 60mg libre, 1 vez al día, ciclos de 28 días on-off | Nebulizador Jet(PARI LC Sprint®) | − | |
| Colistimetato de sodio | Polvo secoCOLOBREATHE® | 1 cápsula (32,5mg equivalente a 1.662.500UI), 2 veces al día, continuo | Turbospin® | 1-2 min |
| Levofloxacino | Solución | 240mg, 2 veces al día, en ciclos de 28 días on-off | PARI eFlowZirela™ | 5 min |
| Tobramicina | Polvo secoTOBI PODHALER | 4 cápsulas de 28mg, 2 veces al día, ciclos de 28 días on-off | T-326 | 6 min |
| Vancomicina | Polvo secoAerovanc™ | 2 cápsulas de 32mg, 2 veces al día | − | − |
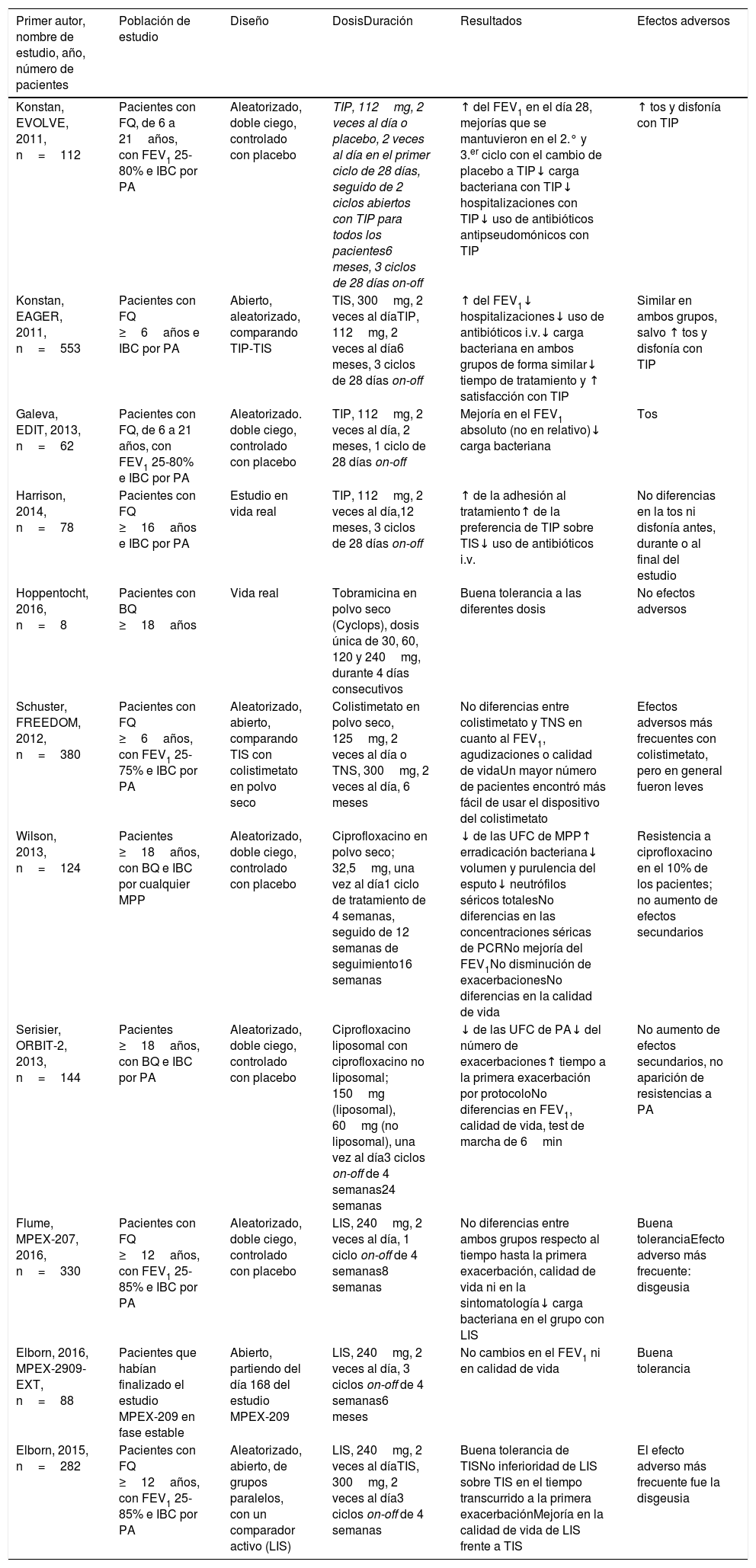
Estudios más relevantes publicados con antibióticos específicos para inhalación
| Primer autor, nombre de estudio, año, número de pacientes | Población de estudio | Diseño | DosisDuración | Resultados | Efectos adversos |
|---|---|---|---|---|---|
| Konstan, EVOLVE, 2011, n=112 | Pacientes con FQ, de 6 a 21años, con FEV1 25-80% e IBC por PA | Aleatorizado, doble ciego, controlado con placebo | TIP, 112mg, 2 veces al día o placebo, 2 veces al día en el primer ciclo de 28 días, seguido de 2 ciclos abiertos con TIP para todos los pacientes6 meses, 3 ciclos de 28 días on-off | ↑ del FEV1 en el día 28, mejorías que se mantuvieron en el 2.° y 3.er ciclo con el cambio de placebo a TIP↓ carga bacteriana con TIP↓ hospitalizaciones con TIP↓ uso de antibióticos antipseudomónicos con TIP | ↑ tos y disfonía con TIP |
| Konstan, EAGER, 2011, n=553 | Pacientes con FQ ≥6años e IBC por PA | Abierto, aleatorizado, comparando TIP-TIS | TIS, 300mg, 2 veces al díaTIP, 112mg, 2 veces al día6 meses, 3 ciclos de 28 días on-off | ↑ del FEV1↓ hospitalizaciones↓ uso de antibióticos i.v.↓ carga bacteriana en ambos grupos de forma similar↓ tiempo de tratamiento y ↑ satisfacción con TIP | Similar en ambos grupos, salvo ↑ tos y disfonía con TIP |
| Galeva, EDIT, 2013, n=62 | Pacientes con FQ, de 6 a 21 años, con FEV1 25-80% e IBC por PA | Aleatorizado. doble ciego, controlado con placebo | TIP, 112mg, 2 veces al día, 2 meses, 1 ciclo de 28 días on-off | Mejoría en el FEV1 absoluto (no en relativo)↓ carga bacteriana | Tos |
| Harrison, 2014, n=78 | Pacientes con FQ ≥16años e IBC por PA | Estudio en vida real | TIP, 112mg, 2 veces al día,12 meses, 3 ciclos de 28 días on-off | ↑ de la adhesión al tratamiento↑ de la preferencia de TIP sobre TIS↓ uso de antibióticos i.v. | No diferencias en la tos ni disfonía antes, durante o al final del estudio |
| Hoppentocht, 2016, n=8 | Pacientes con BQ ≥18años | Vida real | Tobramicina en polvo seco (Cyclops), dosis única de 30, 60, 120 y 240mg, durante 4 días consecutivos | Buena tolerancia a las diferentes dosis | No efectos adversos |
| Schuster, FREEDOM, 2012, n=380 | Pacientes con FQ ≥6años, con FEV1 25-75% e IBC por PA | Aleatorizado, abierto, comparando TIS con colistimetato en polvo seco | Colistimetato en polvo seco, 125mg, 2 veces al día o TNS, 300mg, 2 veces al día, 6 meses | No diferencias entre colistimetato y TNS en cuanto al FEV1, agudizaciones o calidad de vidaUn mayor número de pacientes encontró más fácil de usar el dispositivo del colistimetato | Efectos adversos más frecuentes con colistimetato, pero en general fueron leves |
| Wilson, 2013, n=124 | Pacientes ≥18años, con BQ e IBC por cualquier MPP | Aleatorizado, doble ciego, controlado con placebo | Ciprofloxacino en polvo seco; 32,5mg, una vez al día1 ciclo de tratamiento de 4 semanas, seguido de 12 semanas de seguimiento16 semanas | ↓ de las UFC de MPP↑ erradicación bacteriana↓ volumen y purulencia del esputo↓ neutrófilos séricos totalesNo diferencias en las concentraciones séricas de PCRNo mejoría del FEV1No disminución de exacerbacionesNo diferencias en la calidad de vida | Resistencia a ciprofloxacino en el 10% de los pacientes; no aumento de efectos secundarios |
| Serisier, ORBIT-2, 2013, n=144 | Pacientes ≥18años, con BQ e IBC por PA | Aleatorizado, doble ciego, controlado con placebo | Ciprofloxacino liposomal con ciprofloxacino no liposomal; 150mg (liposomal), 60mg (no liposomal), una vez al día3 ciclos on-off de 4 semanas24 semanas | ↓ de las UFC de PA↓ del número de exacerbaciones↑ tiempo a la primera exacerbación por protocoloNo diferencias en FEV1, calidad de vida, test de marcha de 6min | No aumento de efectos secundarios, no aparición de resistencias a PA |
| Flume, MPEX-207, 2016, n=330 | Pacientes con FQ ≥12años, con FEV1 25-85% e IBC por PA | Aleatorizado, doble ciego, controlado con placebo | LIS, 240mg, 2 veces al día, 1 ciclo on-off de 4 semanas8 semanas | No diferencias entre ambos grupos respecto al tiempo hasta la primera exacerbación, calidad de vida ni en la sintomatología↓ carga bacteriana en el grupo con LIS | Buena toleranciaEfecto adverso más frecuente: disgeusia |
| Elborn, 2016, MPEX-2909-EXT, n=88 | Pacientes que habían finalizado el estudio MPEX-209 en fase estable | Abierto, partiendo del día 168 del estudio MPEX-209 | LIS, 240mg, 2 veces al día, 3 ciclos on-off de 4 semanas6 meses | No cambios en el FEV1 ni en calidad de vida | Buena tolerancia |
| Elborn, 2015, n=282 | Pacientes con FQ ≥12años, con FEV1 25-85% e IBC por PA | Aleatorizado, abierto, de grupos paralelos, con un comparador activo (LIS) | LIS, 240mg, 2 veces al díaTIS, 300mg, 2 veces al día3 ciclos on-off de 4 semanas | Buena tolerancia de TISNo inferioridad de LIS sobre TIS en el tiempo transcurrido a la primera exacerbaciónMejoría en la calidad de vida de LIS frente a TIS | El efecto adverso más frecuente fue la disgeusia |
BQ: bronquiectasias no secundarias a fibrosis quística; FEV1: volumen espiratorio forzado en el primer segundo; FQ: fibrosis quística; IBC: infección bronquial crónica; i.v.: intravenoso; LIS: levofloxacino solución para inhalación; MPP: microrganismos potencialmente patógenos; on-off: ciclos de 28días de tratamiento seguidos de 28días de descanso; PA: Pseudomonas aeruginosa; PCR: proteínaC reactiva; TIP: tobramicina en polvo seco; TIS: solución de tobramicina para inhalación; UFC: unidades formadoras de colonias.
La vía inhalatoria es la de elección en el tratamiento de la IBC. Con esta forma de administrar los antibióticos se reducen el volumen y la purulencia del esputo, el número y la gravedad de las agudizaciones y se enlentece la pérdida de función pulmonar, con menores efectos secundarios que si se utilizasen por vía sistémica. Existen dos tipos de antibióticos inhalados: nebulizados (si el antibiótico se presenta en suspensión o solución) y en polvo seco. Los antibióticos en polvo seco presentan una eficacia y una seguridad similares a las de las formulaciones nebulizadas, aunque suelen producir más tos, que en algunos casos obliga a la suspensión del tratamiento. Tienen la ventaja añadida de tener dispositivos con un tamaño reducido, el menor tiempo de limpieza, la reducción del tiempo de inhalación —lo que facilita la adhesión al tratamiento— y una menor contaminación del dispositivo comparados con los nebulizadores. Diferentes estudios en faseIII y estudios en la vida real han demostrado su eficacia en pacientes con IBC. Actualmente hay cuatro antibióticos en solución comercializados (tobramicina, colistina, aztreonam y levofloxacino) y dos en polvo seco (tobramicina y colistina). En diferentes fases de desarrollo clínico se encuentran tres formulaciones de antibióticos: dos en solución (ciprofloxacino y amikacina —formulaciones liposomales—) y otros dos en polvo seco (ciprofloxacino y vancomicina). En un futuro próximo dispondremos de otros antibióticos en polvo seco, lo que permitirá su utilización en pacientes con FQ y BQ no secundarias a FQ.
FinanciaciónFinanciado por Teva.
Conflicto de interesesL. Máiz ha participado en comités de expertos y actividades de formación promovidas y financiadas por Gilead, Praxis, Teva, Pari, Chiesi.
M. Blanco-Aparicio ha participado en comités de expertos y actividades de formación promovidas y financiadas por Gilead, Praxis, Teva, Pari, Chiesi.





![[vs1] Nebulizadores tipo jet (a-d) para administración de antibióticos inhalados y nebulizador de malla (e). [vs1] Nebulizadores tipo jet (a-d) para administración de antibióticos inhalados y nebulizador de malla (e).](https://static.elsevier.es/multimedia/26596636/0000000200000003/v1_202009220715/S2659663620300382/v1_202009220715/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)

