El derrame pleural (DP) maligno se asocia a un mal pronóstico, pero la mortalidad de los pacientes con derrames no malignos no ha sido suficientemente estudiada. Nuestro objetivo fue describir la evolución clínica y explorar los factores asociados con la mortalidad por todas las causas a 1, 5 y 10 años de los pacientes que desarrollan un DP.
MétodosEstudio observacional retrospectivo de los pacientes intervenidos mediante toracocentesis diagnóstica durante el decenio 2008-2017 en un servicio de neumología. Se evaluaron variables demográficas, bioquímicas, anatomopatológicas y evolutivas. La etiología de los derrames se determinó mediante criterios estandarizados.
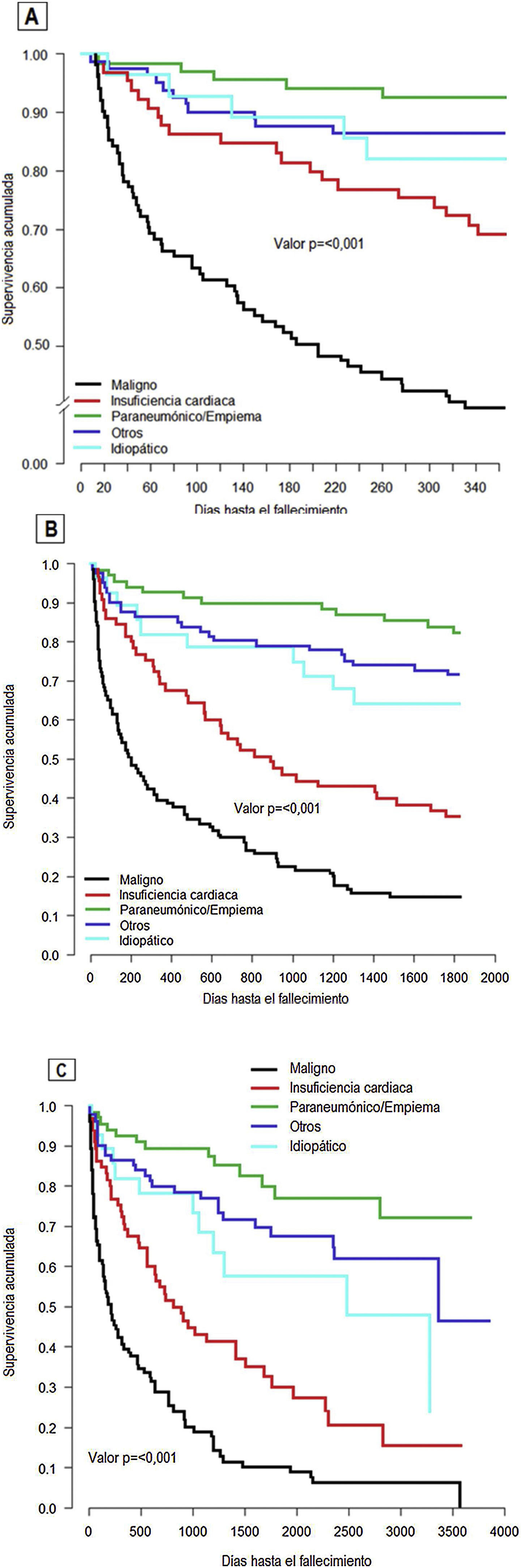
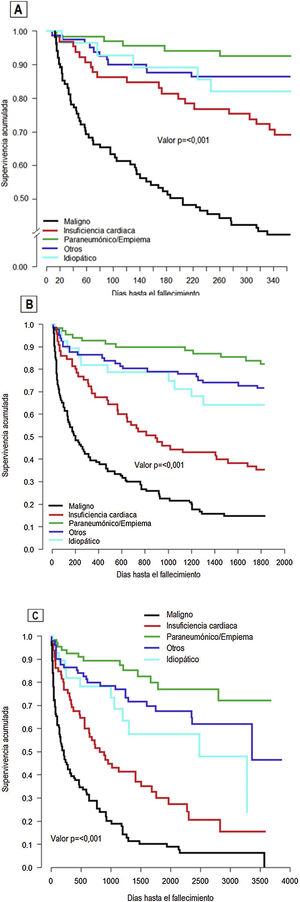
ResultadosSe estudió a 358 pacientes con líquido pleural analizado; el 69,2% de los cuales eran varones con una edad media de 68,9 años (DE 15,1). Predominaron los derrames malignos (29,4%), paraneumónicos (19,8%) y secundarios a insuficiencia cardiaca (18,9%). Los pacientes con derrame maligno y por insuficiencia cardiaca tuvieron tasas de mortalidad a un año del 60,0% y 30,8%, respectivamente y del 85% y 64,7% a 5 años. El sexo masculino (hazard ratio [HR] 1,46; IC 95%: 1,03-2,07), la citología positiva para malignidad (HR 1,66; IC 95%: 1,03-2,68) y la recidiva del derrame (HR 1,61; IC 95%: 1,17-2,21) se asociaron a un peor pronóstico y a mortalidad a 5 años.
ConclusionesLos pacientes intervenidos mediante toracentesis por derrame tienen una alta mortalidad a corto y largo plazo. En nuestros pacientes hospitalizados con DP, los factores asociados con mayor mortalidad a 1 y 5 años fueron la edad, el sexo masculino, la recidiva del DP y la coexistencia de neoplasia maligna.
Occurrence of malignant pleural effusion (PE) is known to be associated with a poor prognosis, but the mortality of patients with non-malignant effusions has not been sufficiently studied. Our objective was to describe the clinical course and explore risk factors associated with all-cause mortality at 1, 5 and 10 years in patients who develop a PE.
MethodsRetrospective observational study of patients undergoing diagnostic thoracentesis during the decade 2008-2017 in a pulmonology service. Demographic, biochemical, pathological and evolutionary variables were evaluated. The etiology of the effusions was determined using standardized criteria.
ResultsPleural fluid samples from 358 patients with a mean age of 68.9 years (SD 15.1 years), 69.2% males, were analyzed. Malignant (29.4%), parapneumonic (19.8%) and secondary to heart failure (18.9%) effusions predominated. Patients with malignant and heart failure related PE had 1-year mortality rates of 60.0% and 30.8%, respectively, and 85% and 64.7% at 5 years. Male gender (hazard ratio [HR] 1.46; 95% CI: 1.03-2.07), positive cytology for malignancy (HR 1.66; 95% CI: 1.03-2.68) and effusion recurrence (HR 1.61; 95% CI: 1.17-2.21) were associated with a worse prognosis and 5-year mortality.
ConclusionsPatients undergoing thoracentesis for effusion have a high short and long-term mortality. In our series of hospitalized patients with PE, the factors associated with higher mortality at 1 and 5 years were age, male sex, recurrence of PE, and coexistence of malignancy.
Los derrames pleurales (DP) son un problema médico común con más de 50 causas reconocidas, que incluyen enfermedades subyacentes de la pleura o del pulmón, afecciones sistémicas, disfunción de órganos y el uso de fármacos1. Se diagnostican anualmente en más de 1,5 millones de personas en EE. UU.2 y provocan al menos 173.000 toracocentesis cada año en ese país3. Otros autores informan de una prevalencia del DP ligeramente superior a 400/100.000 habitantes4. Las causas más comunes de DP son la insuficiencia cardiaca, la infección pleural y la malignidad5. Aunque los derrames malignos se asocian con una alta mortalidad, hay poca literatura sobre la mortalidad de los pacientes con derrame no maligno. El objetivo de esta investigación fue describir la evolución clínica y explorar los factores asociados con la mortalidad a 1, 5 y 10 años en pacientes con DP de diversas etiologías.
MétodosEste estudio de cohorte observacional retrospectivo se realizó en el Hospital Universitario de Cruces (País Vasco), un hospital académico de atención terciaria con 858 camas, y fue aprobado por su Comité Ético de Investigación Clínica (CEIC, E20/06).
Se incluyó a aquellos pacientes ≥18 años hospitalizados con DP no diagnosticado, a los que se les realizó una toracocentesis entre enero del 2008 y diciembre del 2017. Se excluyó a los pacientes sin un diagnóstico definitivo o sin los estudios radiológicos, del líquido pleural o seguimiento clínico suficientes, para establecer un diagnóstico final del DP o su inclusión como DP idiopático.
Se recogieron variables demográficas (sexo y edad), clínicas (antecedentes de cáncer, cardiopatía, hepatopatía, insuficiencia renal crónica, enfermedad reumática, neumonía, tromboembolia pulmonar o injuria cardiaca reciente; tabaquismo, exposición previa al amianto y mortalidad durante la fase de seguimiento), analíticas (concentraciones séricas de proteínas y lactato deshidrogenasa [LDH]; recuento de hematíes y leucocitos, porcentaje de neutrófilos y linfocitos, y concentraciones de glucosa, LDH, proteínas, adenosina desaminasa [ADA], pH y citología en el líquido pleural [LP]), microbiológicas (tinciones de auramina o Ziehl-Neelsen, cultivos en medios sólidos y líquidos, y técnicas de PCR, en muestras de LP si había sospecha de un origen infeccioso del DP), radiológicas (tamaño, localización unilateral o bilateral del DP). La tomografía computarizada, la ecocardiografía, la biopsia pleural guiada y la toracoscopia se realizaron según las indicaciones clínicas. Cada paciente fue incluido una única vez, independientemente del número de toracocentesis realizadas durante su evolución. Se utilizaron los criterios clásicos de Light para su clasificación como trasudado vs. exudado6. La etiología clínica de los DP fue determinada por un neumólogo y un asistente de investigación, según criterios estandarizados7-9. La mortalidad se evaluó a 1, 5 y 10 años.
Análisis estadísticoLas variables categóricas se expresaron como porcentaje y se calcularon las diferencias mediante la prueba de χ cuadrado. Las variables continuas se expresaron como media (desviación estándar) o mediana (rango intercuartil), dependiendo de si seguía una distribución normal o no. Se calcularon las diferencias mediante la prueba t de Student en caso de seguir una distribución normal o la prueba U de Mann-Whitney, en caso contrario. Se utilizaron modelos de regresión de Cox para analizar la mortalidad total, a 1, 5 y 10 años. En los modelos se incluyeron las variables que alcanzaban la significación estadística en el análisis univariado. Se calcularon las curvas de supervivencia de Kaplan-Meier y se compararon mediante la prueba logrank. Todos los análisis fueron realizados con el programa estadístico R (versión 3.6.2) (R: A language and environment for statistical computing. R Foundation for Statistical Computing, Viena, Austria. URL https://www.R-project.org/).
ResultadosSe identificó a un total de 504 pacientes durante el período de estudio y se incluyó a 358 pacientes en el análisis. Se excluyó a 146 participantes por múltiples razones, incluidos datos clínicos incompletos, LP insuficiente para su análisis y pérdida al seguimiento. Las características clínicas de los pacientes se presentan en la tabla 1.
Características demográficas y clínicas de la cohorte (N=358
| Características | Resultado |
|---|---|
| Edad, media (DE) | 68,9 (15,1) |
| Varones n (%) | 248 (69,2) |
| Factores de riesgo n (%) | |
| Tabaquismo | 217 (60,6) |
| Exposición al amianto | 51 (14,2) |
| Enfermedad maligna | 85 (23,7) |
| Cardiopatía | 165 (46,1) |
| Hepatopatía | 31 (8,6) |
| Insuficiencia renal crónica | 59 (16,4) |
| Neumonía | 48 (13,4) |
| Antecedente de enfermedad reumática | 23 (6,4) |
| Tromboembolia pulmonar | 9 (2,5) |
| Positnjuria cardiaca | 10 (2,8) |
| Características del derrame y líquido pleural n (%) | |
| Bilaterales | 78 (21, 8) |
| Unilaterales | 280 (78,2) |
| Exudados | 282 (78,7) |
| Trasudados | 76 (21,3) |
| Predominio linfocitario | 221 (61,8) |
| ADA ≥ 35U/l | 35 (10,8) |
| Citología positiva malignidad | 27 (7,5) |
| Aislamiento microbiológico | 10 (2,8) |
| Datos clínicos de interés n (%) | |
| TAC realizada | 281 (78,5) |
| Pleuroscopia con biopsia | 62 (17,3) |
| Días de ingreso hospitalario, media (DE) | 9,4 (8,9) |
| Recidiva de DP | 154 (43,0) |
Se presentan los valores absolutos y entre paréntesis los relativos de las diferentes características de la cohorte estudiada, excepto en la variable edad y duración del ingreso, donde se muestra la media y, entre paréntesis, la desviación estándar.
ADA: adenosina desaminasa; DE: desviación estándar; DP: derrame pleural; TAC: tomografía axial computarizada.
La cohorte estudiada tenía una edad media de 68,9 años (DE 15,1), con un predominio de varones (69,2%), fumadores (62,0%), coexistencia de cardiopatía (46,1%) y de neoplasia (23,7%). Los derrames unilaterales presentaron un predominio respecto a los bilaterales, que únicamente se objetivaron en el 21,7% de los pacientes. Existía una superioridad de los exudados frente a los trasudados (81,0% y 19,0%, respectivamente). Más de la mitad de los derrames mostraron una preponderancia linfocitaria (61,8%). Solo el 7,5% de las citologías fueron positivas para malignidad. El 34,9% de los pacientes precisó una toracocentesis evacuadora o drenaje como medida terapéutica inmediata. Además, en el 17,3% de estos derrames se realizó una pleuroscopia con biopsia pleural encaminada a filiar su etiología. La estancia media del ingreso hospitalario de los pacientes con DP fue de 9,4 días. La recidiva del DP se produjo en el 43% de la cohorte, con un predominio en los pacientes fallecidos durante el evolutivo de su enfermedad (55,6 vs. 27,7%; p<0,001). Las características demográficas y clínicas en función del diagnóstico etiológico se muestran en la tabla 2. El diagnóstico más frecuente fue el derrame neoplásico, seguido del paraneumónico o empiema y del secundario a insuficiencia cardiaca. Además, la categoría diagnóstica «otros» supuso un 23,6% de los derrames totales (tabla 3).
Características según la etiología de los derrames pleurales
| Diagnóstico | TotalN (%) | Edadmedia (DE) | VaronesN (%) | ExudadoN (%) | BilateralN (%) |
|---|---|---|---|---|---|
| DP maligno | 101 (29,4) | 69,1 (12,8) | 66 (65,3) | 97 (96,1) | 8 (7,9) |
| Otros | 81 (23,6) | 65,4 (16,9) | 56 (69,1) | 65 (80,2) | 14 (17,3) |
| Paraneumónicoo empiema | 68 (19,8) | 63 (16,9) | 50 (73,5) | 64 (94,1) | 9 (13,2) |
| DP por IC | 65 (18,9) | 78 (9,5) | 47 (72,3) | 25 (38,4) | 33 (50,8) |
| Idiopático | 28 (8,1) | 69,1 (15,4) | 20 (71,4) | 22 (78,6) | 12 (42,9) |
Cada categoría diagnóstica se presenta ordenada en función de la frecuencia de presentación, con el valor absoluto y, entre paréntesis, el relativo. Se han excluido aquellos DP que quedaron sin filiar por no completar el protocolo diagnóstico (15 en total).
DE: desviación estándar. DP: derrame pleural. IC: insuficiencia cardiaca.
Etiología de los DP con la categoría diagnóstica «otros» (N=81)
| Diagnóstico | N (%) |
|---|---|
| Benigno del asbesto | 14 (4,1) |
| Tuberculoso | 12 (3,5) |
| Postinjuria cardiaca | 10 (2,9) |
| Insuficiencia renal | 8 (2,2) |
| Postraumático | 8 (2,2) |
| Tromboembolia pulmonar | 4 (1,1) |
| Posquirúrgico | 4 (1,1) |
| Pleuropericarditis vírica | 4 (1,1) |
| Pleuritis inflamatoria | 4 (1,1) |
| Insuficiencia hepática | 3 (0,8) |
| Pulmón atrapado | 3 (0,8) |
| Neumotórax | 1 (0,2) |
| Colitis ulcerosa | 1 (0,2) |
| Secundario a tratamiento con dasatinib | 1 (0,2) |
| Atelectasia | 1 (0,2) |
| Bronquiolitis obliterante con neumonía organizada | 1 (0,2) |
| Enfermedad granulomatosa | 1 (0,2) |
| Secundario a tumor fibroso pleural | 1 (0,2) |
Cada categoría diagnóstica se presenta ordenada en función de la frecuencia de presentación, con el valor absoluto y, entre paréntesis, el relativo.
DP: derrame pleural.
Los derrames malignos representaron en nuestra cohorte la categoría diagnóstica predominante: el 29,4% del total. Mostraban un DP unilateral (92,1%), exudado (96,1%) con predominio linfocitario (79,0%). En el 57,4% de estos pacientes el derrame recidivó.
La segunda categoría diagnóstica fueron los derrames paraneumónicos o empiemas, el 19,8% del total. El 21,4% de estos derrames presentaron un valor ADA elevado y en el 9,3% se aisló algún microorganismo en el cultivo.
Los derrames secundarios a insuficiencia cardiaca fueron la tercera categoría diagnóstica más frecuente: el 18,9% del total de pacientes. Constituía el grupo con una edad media más avanzada (78 años). Casi un tercio de estos pacientes (29,2%) precisó drenaje del LP.
Los derrames idiopáticos suponían el 8,1% del total de pacientes con el protocolo diagnóstico completado. En más de un tercio de los pacientes se realizó una pleuroscopia (35,7%) para tratar de filiar la etiología del derrame.
Mortalidad de los pacientes con derrame pleuralComo se muestra en el análisis univariante (tabla 4), existía una relación estadísticamente significativa entre la edad y la mortalidad de los pacientes con DP: la edad media de los pacientes fallecidos era de 74,4 años, 12 años más que la edad media de los no fallecidos (p<0,001). También evidenciamos una mayor mortalidad de aquellos pacientes con exposición al amianto (p=0,045), con enfermedad neoplásica (p<0,001), cardiopatía (p=0,001) o insuficiencia renal (p=0,039). Comprobamos una mayor mortalidad en los pacientes con derrames predominantemente linfocitarios (p<0,001) y con una citología en LP positiva para malignidad (p<0,001). Constatamos una mortalidad significativamente más elevada en aquellos pacientes que precisaron drenaje durante el ingreso (p=0,004) o una pleuroscopia con toma de biopsia (p<0,001). Cabe resaltar que los fallecidos tuvieron ingresos hospitalarios más prolongados, con una media de 10,5 vs. 8,1 días de los supervivientes (p=0,008). También confirmamos una mayor mortalidad en aquellos pacientes en los que el derrame recidivó (p<0,001).
Características de los pacientes según estatus vital
| Característica | Total | Fallecidos | No fallecidos | p | N |
|---|---|---|---|---|---|
| N=358 | N=196 | N=162 | |||
| Edad, media (DE)a | 68,9 (15,1) | 74,4 (11,4) | 62,2 (16,3) | <0,001 | 358 |
| Sexo, N (%) | 0,075 | 358 | |||
| Mujer | 110 (30,7) | 52 (26,5) | 58 (35,8) | ||
| Varón | 248 (69,3) | 144 (73,5) | 104 (64,2) | ||
| Tabaquismo, N (%) | 217 (62,0) | 126 (66,7) | 91 (56,5) | 0,066 | 350 |
| Exposición al amianto, N (%)a | 51 (52,0) | 32 (62,8) | 19 (37,2) | 0,045 | 98 |
| Enfermedad neoplásica, N (%)a | 85 (23,7) | 61 (31,1) | 24 (14,8) | <0,001 | 358 |
| Cardiopatía, N (%)a | 165 (46,1) | 107 (54,6) | 58 (35,8) | 0,001 | 358 |
| Hepatopatía, N (%) | 31 (8,6) | 18 (9,1) | 13 (8,0) | 0,842 | 358 |
| Insuficiencia renal crónica, N (%)a | 59 (16,5) | 40 (20,4) | 19 (11,7) | 0,039 | 358 |
| Neumonía, N (%)a | 48 (13,4) | 12 (6,1) | 36 (22,2) | <0,001 | 358 |
| Enfermedad reumática, N (%) | 23 (6,4) | 11 (5,6) | 12 (7,4) | 0,636 | 358 |
| Tromboembolia pulmonar, N (%) | 9 (2,5) | 3 (1,5) | 6 (3,7) | 0,318 | 358 |
| Posinjuria cardiaca, N (%)a | 10 (2,8) | 1 (0,5) | 9 (5,5) | 0,011 | 358 |
| Características de DP y líquido pleural, N (%) | |||||
| Unilateral/bilateral | 0,644 | 358 | |||
| Bilateral | 78 (21,8) | 45 (23,0) | 33 (20,4) | ||
| Unilateral | 280 (78,2) | 151 (77,0) | 129 (79,6) | ||
| Clasificación según criterios de Light | 0,023 | 348 | |||
| Exudadoa | 282 (81,0) | 146 (76,4) | 136 (86,6) | ||
| Trasudadoa | 66 (19,0) | 45 (23,6) | 21 (13,4) | ||
| Predominio celular neutrófilosa | 68 (22,4) | 19 (11,9) | 49 (34,0) | <0,001 | 304 |
| Predominio celular linfocitosa | 188 (61,8) | 116 (72,5) | 72 (50,0) | <0,001 | 304 |
| ADA elevado | 35 (10,8) | 15 (8,5) | 20 (13,5) | 0,207 | 324 |
| Citología positiva malignidada | 27 (7,8) | 25 (13,0) | 2 (1,3) | <0,001 | 343 |
| Análisis microbiológico positivo | 10 (2,9) | 4 (2,1) | 6 (3,8) | 0,528 | 342 |
| Drenaje LPa | 125 (34,9) | 82 (41,8) | 43 (26,5) | 0,004 | 358 |
| Pleuroscopia-biopsia pleurala | 62 (17,3) | 47 (24,0) | 15 (9,2) | <0,001 | 358 |
| Días de ingreso hospitalario, media (DE)a | 9,4 (8,9) | 10,5 (11,2) | 8,1 (4,8) | 0,008 | 358 |
| Recidiva DPa | 154 (43,0) | 109 (55,6) | 45 (27,7) | <0,001 | 358 |
| Diagnóstico DPa | <0,001 | 343 | |||
| Maligno | 101 (29,4) | 90 (48,1) | 11 (7,0) | ||
| Otros diagnósticos | 81 (23,6) | 26 (13,9) | 55 (35,3) | ||
| Paraneumónico/empiema | 68 (19,8) | 13 (6,9) | 55 (35,3) | ||
| Insuficiencia cardiaca | 65 (18,9) | 46 (24,6) | 19 (12,2) | ||
| Idiopático | 28 (8,1) | 12 (6,4) | 16 (10,3) |
Se muestra el valor absoluto y, entre paréntesis, la proporción de los pacientes que fallecieron con cada característica y los que no lo hicieron, excepto para las variables edad y duración del ingreso, donde se muestran la media y desviaciones estándar.
ADA: adenosina desaminasa; DP: derrame pleural; LP: líquido pleural; N: número de pacientes en los que se dispone del dato.
La mortalidad global de la cohorte fue del 29,6% (106 de 358 pacientes) a un año; del 50,5% (181 de 358 pacientes) a los 5 años y del 54,7% (196 de 358 pacientes) a los 10 años.
Los factores asociados a la mortalidad a 1 y 5 años por cualquier causa en nuestra cohorte se presentan en la tabla 5, junto con los hazard ratio, que estiman el riesgo relativo de muerte en el tiempo de seguimiento entre los pacientes con una característica determinada y los que no la tienen. A medida que aumenta la edad, la mortalidad aumenta tanto a un año (hazard ratio [HR]=1,03; IC 95%: 1,01-1,05) como a 5 años (HR=1,05; IC 95%: 1,03-1,06). Además, los pacientes con ingresos hospitalarios más prolongados tienen mayor mortalidad (HR=1,04; IC 95%: 1,03-1,06). El sexo masculino (HR=1,46; IC 95%: 1,03-2,07), la citología positiva para malignidad (HR=1,66; IC 95%: 1,03-2,68) y la recidiva del derrame (HR=1,61; IC 95%: 1,17-2,21) se asocian con un peor pronóstico y mayor mortalidad a 5 años.
Factores asociados a la mortalidad global a 1 y 5 años Mortalidad a 1 año Mortalidad a 5 años
| Variables | HR | IC 95% | Valor p | HR | IC 95% | Valor p | |
|---|---|---|---|---|---|---|---|
| Edad | 1,03 | (1,01; 1,05) | <0,001 | 1,05 | (1,03; 1,06) | <0,001 | |
| Sexo: hombres | 1,24 | (0,8; 1,93) | 0,331 | 1,46 | (1,03; 2,07) | 0,034 | |
| Duración ingreso | 1,04 | (1,03; 1,06) | <0,001 | 1,04 | (1,03; 1,06) | <0,001 | |
| Insuficiencia cardiaca | 0,19 | (0,11; 0,32) | <0,001 | 0,38 | (0,25; 0,57) | <0,001 | |
| Paraneumónico/Empiema | 0,07 | (0,03; 0,20) | <0,001 | 0,11 | (0,05; 0,21) | <0,001 | |
| Otros DP | 0,12 | (0,06; 0,23) | <0,001 | 0,2 | (0,12; 0,33) | <0,001 | |
| Idiopático | 0,17 | (0,07; 0,42) | <0,001 | 0,22 | (0,11; 0,44) | <0,001 | |
| Neumonía | 0,28 | (0,08; 0,91) | 0,035 | - | - | - | |
| Pleuroscopia | 0,41 | (0,25; 0,69) | <0,001 | - | - | - | |
| Citología positiva para malignidad | - | - | - | 1,66 | (1,03; 2,68) | 0,038 | |
| Recidiva DP | - | - | - | 1,61 | (1,17; 2,21) | 0,003 |
En el modelo de regresión de Cox para analizar la mortalidad se incluyeron las siguientes variables: edad, sexo, cáncer, cardiopatía, neumonía, citología positiva para malignidad, drenaje de LP, pleuroscopia-biopsia pleural, duración de la hospitalización, recidiva de DP, diagnóstico final y clasificación según los criterios de Light. Se presentan solo aquellas variables que se asociaron significativamente con la mortalidad global al año y 5 años tras el DP.
DP: derrame pleural; IC: intervalos de confianza; HR: hazard ratio.
Por último, cabe destacar que hubo diferencias significativas (p<0,001) en la supervivencia de los pacientes con DP en función de su diagnóstico, como se aprecia en la figura 1. A un año (fig 1A), se percibe una rápida disminución de la supervivencia de los derrames malignos, que fue del 40% al año de seguimiento. Los derrames no malignos trazaron curvas de supervivencia superpuestas en el rango 80-100%, exceptuando los derrames por insuficiencia cardiaca, que mostraron peor supervivencia a un año, del 69,2%. Esta tendencia se ve reflejada en las figs. 1B y C que muestran la supervivencia a 5 y 10 años, respectivamente. Hay que destacar la supervivencia de los derrames de origen maligno, que a 5 años era del 15% y del 0% a 10 años, y los de causa cardiaca, del 35,3% a 5 años y del 20% a 10 años. El resto de las etiologías mostraron una mayor supervivencia a los 5 y 10 años de seguimiento.
DiscusiónEs conocido que la mortalidad a corto plazo asociada a los DP es muy marcada en el caso de los derrames malignos. Sin embargo, los datos de supervivencia de los derrames de otras etiologías a corto y largo plazo son escasos. Este estudio evalúa la mortalidad a corto, medio y largo plazo en pacientes que han sido tratados mediante toracocentesis y cuyo derrame se atribuye a una variedad de etiologías.
La mortalidad a corto plazo en nuestros pacientes tratados mediante toracocentesis por DP es alta, con un 22,9% de los pacientes fallecidos dentro de los 6 primeros meses de seguimiento, debido, fundamentalmente, a los DP malignos y a los secundarios a insuficiencia cardiaca. Reconocer que el derrame se asocia con una alta mortalidad puede impulsar un tratamiento más agresivo de la enfermedad que provoca su manifestación.
Se sabe que la diseminación de células malignas al espacio pleural es un marcador de malignidad avanzada. La supervivencia de los pacientes con derrame maligno difiere según el tipo de tumor primario, y la supervivencia más corta se asocia con el cáncer de pulmón10. Numerosos estudios, incluido este, demuestran que el derrame maligno se asocia con malos resultados11,12. En nuestro estudio, la mayor mortalidad asociada a DP se observó en pacientes con malignidad subyacente. En nuestro país, en el estudio de Porcel et al.13, en el que se analizaron más de 3.000 toracocentesis consecutivas, concluyeron que la causa más frecuente de DP era de origen maligno, el 27% del total. Coinciden con otro trabajo previo realizado en Madrid en un servicio de neumología por Villena et al.14 en el que la malignidad (36,4%) también fue la causa más frecuente de DP. Ambos están en consonancia con los resultados de nuestra investigación, en el que la etiología neoplásica fue la primera causa de DP (29,4%).
Arnold et al.15 evidencian en su estudio que la sensibilidad de la citología para el diagnóstico de derrame maligno es variable según el tipo de cáncer primario, con una sensibilidad global del 46%, mayor que la sensibilidad de la citología, según los datos de nuestra muestra (26,7%). Esta diferencia notoria de la sensibilidad con respecto a la encontrada en nuestro estudio puede deberse a diversas causas. Pensamos que una causa sustancial ha podido ser la escasa cantidad de LP remitida para el análisis citológico, aproximadamente unos 10ml. Hoy sabemos de la importancia de enviar al laboratorio una muestra idónea, que se estipula entre 40-50ml16. También ha podido contribuir a esta baja sensibilidad la falta de realización sistemática de técnicas de inmunohistoquímica del LP. Por otro lado, Heffner et al.17 muestran que generalmente un DP de origen maligno se correlaciona con un estado avanzado de enfermedad neoplásica, con menor supervivencia que aquellos que no presentan derrame, e indica que el paciente fallecerá en los próximos 3-12 meses, con una mediana de supervivencia global de 124 días. Los resultados de nuestro estudio están en línea con estas investigaciones, con una mediana de supervivencia global de 140 días.
En nuestro estudio los DP de causa infecciosa fueron los segundos en frecuencia (19,8%), dato similar al reportado por Porcel et al.13. Estos autores comunican un 30% de cultivos bacteriológicos del LP en los que se aisló algún microorganismo, de los que los más frecuentes fueron Streptococcus spp. (25,5%); en contraposición con nuestro estudio, en el que únicamente en el 9,3% se aisló algún microorganismo: el 50% Streptococcus spp. y el otro 50%, Staphylococcus spp. El DP en el contexto de una infección pulmonar es común, ocurre hasta en el 9% de los pacientes con neumonía, y es un signo de mal pronóstico, particularmente si el derrame es de gran tamaño, bilateral o asociado con empiema18,19. Walker et al.20 evidenciaron en su estudio una mortalidad a un año del 19% en derrames infecciosos, similar a otros proyectos de referencia. DeBiasi et al.21, sin embargo, describen el 11% de mortalidad a un mes y el 26% a un año. Además, señalan que estos valores son variables, con una tasa del 1,3-4% en pacientes con DP por neumonía comunitaria y cifras del 41-50% en pacientes ingresados en unidades de cuidados intensivos o con neumonías nosocomiales. En nuestro estudio, sin embargo, resultó ser la categoría diagnóstica con menor mortalidad: apenas del 7,3% a un año. El manejo apropiado de estos derrames incluye la identificación temprana del empiema a través de toracocentesis, tratamiento con antibióticos adecuados, drenaje con sonda torácica y cirugía cuando esté indicado.
En la literatura médica existe disparidad respecto de las tasas de mortalidad de los DP secundarios a insuficiencia cardiaca; desde cifras de mortalidad del 10-16% a un año de seguimiento22,23 y valores del 33% en aquellos pacientes hospitalizados por insuficiencia cardiaca24, hasta cifras de mortalidad del 50% a un año que encuentran en su estudio Walker et al.20, similar a la tasa de mortalidad de los pacientes con fallo cardiaco descompensado que ingresan en las unidades de coronarias o de cuidados intensivos y significativamente mayor que la tasa de mortalidad que refieren DeBiasi et al.21 En nuestro estudio, la tasa de mortalidad de los pacientes con insuficiencia cardiaca que precisaron de toracocentesis fue del 30,8% a un año, del 64,7% a los 5 años y del 80% a los 10 años. Creemos que el DP debido a dicha insuficiencia debe considerarse como una prueba más de la descompensación aguda y, con el fin de prevenir el reingreso y la muerte, hay que abogar por un tratamiento más intensivo.
Los DP idiopáticos, en un estudio de Porcel et al.13, constituyeron el 3% de su serie. Sin embargo, en el trabajo de Villena et al.14, se muestra una proporción del 11,9% de derrames idiopáticos, una cifra más cercana a los resultados de nuestra investigación, el 8,1% del total. Respecto de su pronóstico, estudios clásicos como el de Ferrer et al.25 señalaban que bajo los derrames idiopáticos se ocultaba una causa benigna y que, además, este grupo de derrames se comportaba como el grupo general de DP no malignos, con una elevada supervivencia. En otros trabajos más recientes, como el de Reuter et al.26, se evidencian unos resultados menos optimistas, con una mortalidad de los DP idiopáticos a un año del 29,2% y a 3 años del 50,6%. En nuestro estudio, la mortalidad de estos derrames fue notablemente menor que lo reportado por Reuter et al., del 17,8% a un año, el 28,5% a 3 años y del 35,7% a los 5 años.
Nuestro estudio es una cohorte bien caracterizada de pacientes de un servicio médico tratados mediante toracocentesis, que evalúa la mortalidad de los DP debidos a diferentes etiologías durante un decenio de seguimiento. Aporta información pronóstica que puede tener una aplicabilidad general en la población médica hospitalaria más amplia. Las limitaciones de este trabajo incluyen que se realizó en un único hospital académico y, debido a que esta cohorte se limita a pacientes tratados mediante toracocentesis, no podemos aportar información sobre la mortalidad de los pacientes con DP sin toracocentesis. A la luz de los conocimientos actuales, una limitación importante de nuestro estudio fue la escasez de LP remitido para su análisis citológico, 10ml, lo que ha podido repercutir en la baja sensibilidad de la citología. Hoy sabemos que una muestra de entre 40-50ml de LP es la adecuada para obtener una rentabilidad idónea en la investigación de los derrames malignos16.
El DP sirve como indicador de enfermedad y está influido por muchos factores. En este sentido, la enfermedad pleural sirve como un marcador de enfermedad grave. Dado el grado de mortalidad observado en los pacientes con DP, el requisito de hacer una toracocentesis con fines diagnósticos o terapéuticos debe señalarnos que el proceso está avanzado y que es primordial dirigir la terapia máxima a la etiología subyacente.
En conclusión, los pacientes que precisan una toracocentesis como tratamiento para el DP se encuentran en todos los ámbitos de la medicina. Además del derrame maligno, los derrames debidos a diferentes etiologías benignas tienen una mortalidad considerable. Los derrames más prevalentes en nuestra serie fueron los malignos, los paraneumónicos y los secundarios a insuficiencia cardiaca. Los factores asociados con una mayor mortalidad en nuestra cohorte de DP fueron la edad avanzada, el sexo masculino, la recidiva del DP y la coexistencia de enfermedad neoplásica. Los médicos que atiendan a pacientes con DP deben ser conscientes de su mayor riesgo de mortalidad, lo que justifica un manejo intensivo de la etiología subyacente.
Contribuciones de los autoresConcepción, diseño y redacción del manuscrito: F. Baranda e I. Hernández.
Recogida y análisis de datos: I. Hernández, J. Solorzano, I. González, A. Rezola.
Interpretación de los datos: F. Baranda, I. Hernández, J. I. Pijoan.
Análisis e interpretación estadística: J. I. Pijoan, S. Pérez.
Revisión crítica del manuscrito: A. Gómez, B. Gómez, M. Iriberri.
Aprobación de la versión final del manuscrito: todos los autores.
Consentimiento informadoLos autores confirman que se ha obtenido el consentimiento por escrito de todos los pacientes.
FinanciaciónLos autores declaran que no recibieron financiación para la publicación de este manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.