En las últimas décadas estamos asistiendo a un progresivo cambio en el panorama epidemiológico de las bronquiectasias (BQ), pasando de ser una enfermedad «huérfana» a ser una patología que está siendo objeto de investigación en diversos ámbitos. A ello han contribuido un mejor diagnóstico a través de la tomografía computarizada torácica de alta resolución, pero también una mayor conciencia de la comunidad médica sobre la enfermedad, debido a la identificación de diversas enfermedades muy prevalentes como posible causa de BQ y al desarrollo de nuevos tratamientos, como los antibióticos inhalados. Aunque su prevalencia real se desconoce, han aumentado los estudios de base poblacional que permiten asegurar que su prevalencia no es despreciable, como no lo son el elevado número de ingresos hospitalarios que condicionan, así como la mortalidad asociada a ellos. El aumento de publicaciones a nivel mundial posibilita hacer análisis sobre la variabilidad geográfica de esta enfermedad, tanto en lo que se refiere a su prevalencia como a las diferentes causas que la producen, muy variables en función de la población estudiada. El manejo de los pacientes con BQ supone un elevado gasto sanitario cuyo impacto exacto está aún por determinar, aunque los estudios realizados muestran que es equiparable o incluso superior al de otras enfermedades respiratorias crónicas.
In recent decades, we have seen the epidemiological landscape of bronchiectasis change from being an ‘orphan’ disease to a disease that is being investigated in various fields. This phenomenon is due not only to better diagnosis using high-resolution chest computed tomography, but also to a greater awareness of the disease among the medical community following the identification of several very prevalent diseases as possible causes of bronchiectasis and the development of new treatments, such as inhaled antibiotics. Although its real prevalence is unknown, the growing availability of population-based studies assures us that it is far from negligible: this disease leads to high numbers of hospital admissions and associated deaths. The increase in publications worldwide has facilitated the analysis of the geographical variability of this disease, both in terms of prevalence and causes, which vary widely depending on the population studied. The management of patients with bronchiectasis is costly, and while the exact impact on the healthcare budget remains to be determined, studies show that it is comparable or even higher than that of other chronic respiratory diseases.
Las bronquiectasias (BQ) fueron descritas por primera vez por Laënnec en 18191. Son una enfermedad pulmonar crónica que se caracteriza por presentar dilatación permanente e irreversible de la vía aérea inferior, infecciones recurrentes e inflamación bronquial persistente. La interacción entre exacerbaciones, infección e inflamación crónica provocan un círculo vicioso que da lugar a la destrucción del bronquio y del parénquima pulmonar2. Llegaron a convertirse, a mediados del sigloxx, en una enfermedad de frecuente diagnóstico, habitualmente mediante el uso de la broncografía. Posteriormente, con las mejoras sociosanitarias de los países desarrollados, se redujeron drásticamente su incidencia y su prevalencia, lo que, unido a la ausencia de tratamientos, hizo que las BQ perdieran notoriedad. Sin embargo, en los últimos años ha resurgido el interés por esta enfermedad debido a la mayor capacidad diagnóstica actual, a la creciente identificación de enfermedades asociadas a BQ (asma, enfermedad pulmonar obstructiva crónica [EPOC], enfermedades autoinmunes, etc.) y al desarrollo de nuevos tratamientos. Ello ha contribuido a un aumento del número de casos diagnosticados, si bien con una notable variabilidad geográfica, en función de determinados factores.
A todo ello se suma la constatación de que las BQ se asocian a un importante y, probablemente, creciente coste sanitario, lo que requerirá que en los próximos años se lleven a cabo estudios farmacoeconómicos y se desarrollen estrategias sociosanitarias encaminadas a optimizar el manejo de los pacientes.
Prevalencia de las bronquiectasiasEn la era pre-antibiótica, las BQ representaban una enfermedad que afectaba predominantemente a población joven y su incidencia era similar a la de la tuberculosis, estimándose en 100/100.000 habitantes en el Reino Unido3. Las mejoras sanitarias de la segunda mitad del sigloxx contribuyeron a que se redujeran los pacientes que desarrollaban esta dolencia. Entre estas mejoras destacan: las campañas de vacunación infantil frente a determinadas infecciones potencialmente generadoras de BQ (sarampión, tosferina, etc.); la reducción de los casos de tuberculosis; el desarrollo y el uso precoz de antibióticos de amplio espectro para el tratamiento de las infecciones broncopulmonares; la mejora en las condiciones de higiene de las ciudades y pueblos, y las mejoras en la cadena alimentaria y en la nutrición de la población4-6. Por ello, las BQ perdieron trascendencia científica y llegaron a ser consideradas una enfermedad «huérfana»5, esto es, una afección rara, con un bajo índice de sospecha clínica, por lo que con frecuencia se etiquetaba erróneamente a estos pacientes con expectoración crónica como afectos de EPOC, sin haber llevado a cabo una adecuada valoración radiológica que permitiera descartar la existencia de BQ.
En la actualidad, sobre todo en los países más desarrollados, asistimos a un notable aumento del número de casos de pacientes diagnosticados de BQ, a lo que han contribuido diversos factores: la creciente longevidad de la población, la cronicidad de las enfermedades potencialmente generadoras de BQ, la reaparición de la tuberculosis, pero sobre todo el uso de la tomografía computarizada de alta resolución (TCAR) torácica6,7, ya que permite detectar BQ que con otro tipo de estudios de imagen no podrían ser identificadas8. También han contribuido a este incremento la constatación de que muchos pacientes con otras enfermedades pulmonares (EPOC, asma) o sistémicas (conectivopatías, enfermedad inflamatoria intestinal) presentan BQ en la TCAR torácica. Muchos clínicos son actualmente más conscientes de esta posibilidad y solicitan TCAR a pacientes con estas patologías, en busca de BQ.
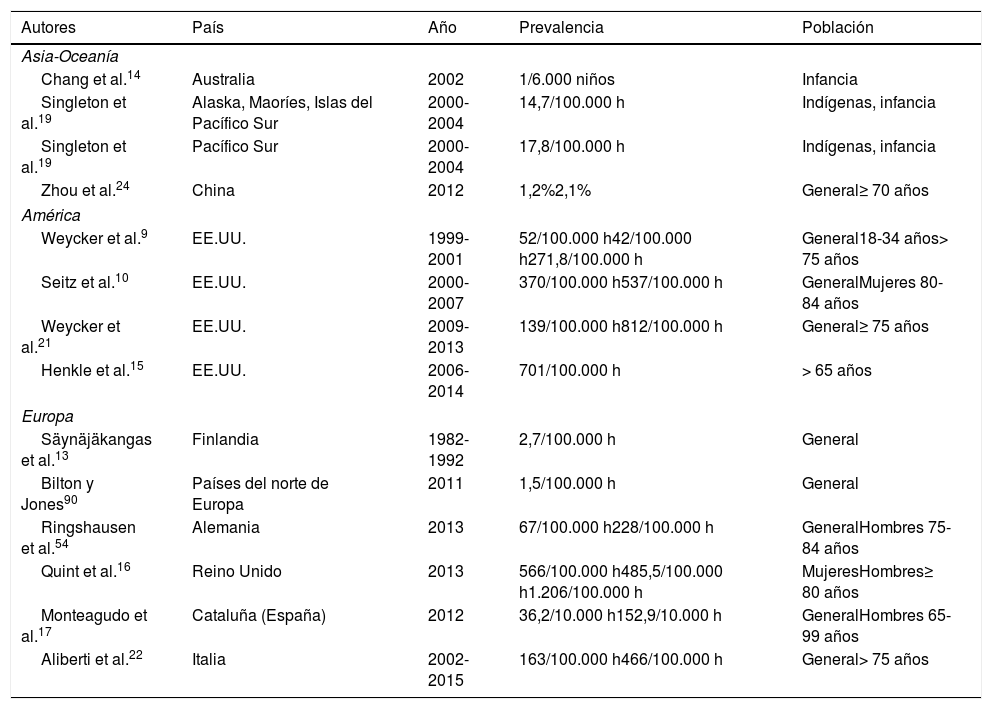
A pesar de todo ello, la prevalencia real de las BQ se desconoce, y es difícil de establecer, ya que pueden ser producidas por muchas y diferentes etiologías que pueden variar de un país a otro y de un periodo histórico a otro. También han variado las técnicas empleadas para diagnosticarlas y definirlas. Los datos disponibles sobre la prevalencia de BQ son escasos, y es posible que la infraestimen. Hay pocos estudios de base poblacional, y los que se han llevado a cabo utilizan muy diferentes metodologías9-11. La tabla 1 muestra la prevalencia de BQ en las series publicadas más destacadas de la literatura.
Prevalencias publicadas sobre bronquiectasias
| Autores | País | Año | Prevalencia | Población |
|---|---|---|---|---|
| Asia-Oceanía | ||||
| Chang et al.14 | Australia | 2002 | 1/6.000 niños | Infancia |
| Singleton et al.19 | Alaska, Maoríes, Islas del Pacífico Sur | 2000-2004 | 14,7/100.000 h | Indígenas, infancia |
| Singleton et al.19 | Pacífico Sur | 2000-2004 | 17,8/100.000 h | Indígenas, infancia |
| Zhou et al.24 | China | 2012 | 1,2%2,1% | General≥ 70 años |
| América | ||||
| Weycker et al.9 | EE.UU. | 1999-2001 | 52/100.000 h42/100.000 h271,8/100.000 h | General18-34 años> 75 años |
| Seitz et al.10 | EE.UU. | 2000-2007 | 370/100.000 h537/100.000 h | GeneralMujeres 80-84 años |
| Weycker et al.21 | EE.UU. | 2009-2013 | 139/100.000 h812/100.000 h | General≥ 75 años |
| Henkle et al.15 | EE.UU. | 2006-2014 | 701/100.000 h | > 65 años |
| Europa | ||||
| Säynäjäkangas et al.13 | Finlandia | 1982-1992 | 2,7/100.000 h | General |
| Bilton y Jones90 | Países del norte de Europa | 2011 | 1,5/100.000 h | General |
| Ringshausen et al.54 | Alemania | 2013 | 67/100.000 h228/100.000 h | GeneralHombres 75-84 años |
| Quint et al.16 | Reino Unido | 2013 | 566/100.000 h485,5/100.000 h1.206/100.000 h | MujeresHombres≥ 80 años |
| Monteagudo et al.17 | Cataluña (España) | 2012 | 36,2/10.000 h152,9/10.000 h | GeneralHombres 65-99 años |
| Aliberti et al.22 | Italia | 2002-2015 | 163/100.000 h466/100.000 h | General> 75 años |
La mayoría de estudios revelan que las BQ son más frecuentes en mujeres (63-68%)6,12, aunque se ha visto que la prevalencia aumenta en ambos sexos con la edad6. Los primeros trabajos que abordaron este tema a finales del siglo pasado estimaron prevalencias de BQ muy bajas, ya que eran estudios referidos a bases de datos de altas hospitalarias13 o a población infantil14, no a población general. No fue hasta comienzos de la década de los 2000 que Weycker et al.9 publicaron un estudio de base poblacional en el que detectaron un notable aumento de la prevalencia, de hasta 271 casos por 100.000 habitantes en población mayor de 75años. Diversos estudios más recientes, en diferentes países, han encontrado de forma consistente una prevalencia mucho más elevada, que llegó hasta los 701 o incluso 1.206 casos por 100.000 habitantes en Estados Unidos y el Reino Unido, respectivamente15,16. En España no existe un estudio a nivel nacional, aunque sí se publicó recientemente un análisis de la base de datos de Atención Primaria del Servicio Catalán de Salud (5,7 millones de asegurados), en el que la prevalencia global de BQ fue de 36,2 casos por cada 10.000 afiliados, llegando a 152,9/10.000 en pacientes de sexo masculino mayores de 65años17.
Por tanto, con los datos de que disponemos actualmente existe suficiente evidencia para desterrar definitivamente de las BQ la etiqueta de enfermedad «huérfana», término que designa a las entidades que afectan a menos de 5personas por 10.000 habitantes18. Tiene una identidad propia dentro de las enfermedades respiratorias crónicas, como la tienen la EPOC y el asma.
Diferencias geográficas en la prevalencia de las bronquiectasiasLa mayor variación epidemiológica se conoce al estudiar las BQ en las tribus indígenas de Australia, Nueva Zelanda, Canadá y Alaska19,20. Así, por ejemplo, los niños indígenas de ciertas comunidades, incluidas las de países desarrollados, tienen una prevalencia mayor, como por ejemplo en Alaska, donde llega a 14-20/1.000 habitantes (mayor que la media del resto de Estados Unidos)21. En estas poblaciones indígenas varios factores van a contribuir a las etiologías más frecuentes, como son los niveles socioeconómicos más bajos, la predisposición genética y las infecciones pulmonares graves padecidas en los primeros años de vida2,4. Las causas más frecuentes de BQ en estas poblaciones van desde las formas idiopáticas entre la población infantil de los indígenas neozelandeses hasta el predominio infeccioso en Alaska.
En los países europeos la incidencia y la prevalencia de las BQ están incrementándose desde el inicio del nuevo siglo, asociadas a mayor mortalidad16,22. En Estados Unidos se ha visto que existe un incremento anual de 8,7% en la prevalencia de las BQ23. Desconocemos la prevalencia en el resto de países americanos, sobre todo de Sudamérica, Canadá y Caribe. Los trabajos en Asia todavía son escasos. En un estudio de Corea del Sur, con un número significativo de casos, la prevalencia se estimó alrededor del 9%11. En un estudio realizado en China, sobre 10.811 personas se detectó una prevalencia de BQ ya diagnosticadas del 1,2% en población general, que aumentaba hasta el 2,1% en población ≥65años24. Sin embargo, este porcentaje incluyó solo a los individuos diagnosticados de BQ, por lo que es probable que el número de pacientes con BQ no diagnosticadas, y por tanto la prevalencia real de BQ en China, sea muy superior25.
Etiologías de las bronquiectasiasComo hemos comentado, asistimos en la actualidad a un aumento del número de diagnósticos de BQ, especialmente en los extremos de edad: menores de 5años y mayores de 75años2. Las etiologías de las BQ en cada uno de estos dos extremos varían, de forma que en los menores de 5años predominan las inmunodeficiencias, malformaciones congénitas y discinesia ciliar primaria26,27, mientras que en la edad adulta predominan las causas infecciosas28.
La generalización de campañas de vacunación y el desarrollo de nuevos antibióticos han modificado la epidemiología y la etiología de las BQ en las últimas décadas. Así, a pesar de que la etiología postinfecciosa sigue siendo la causa identificada más típica, muestra una frecuencia decreciente si se comparan los datos actuales con los de la era preantibiótica29. Por el contrario, aumenta la frecuencia de otras etiologías, como el asma, la EPOC y algunas enfermedades sistémicas.
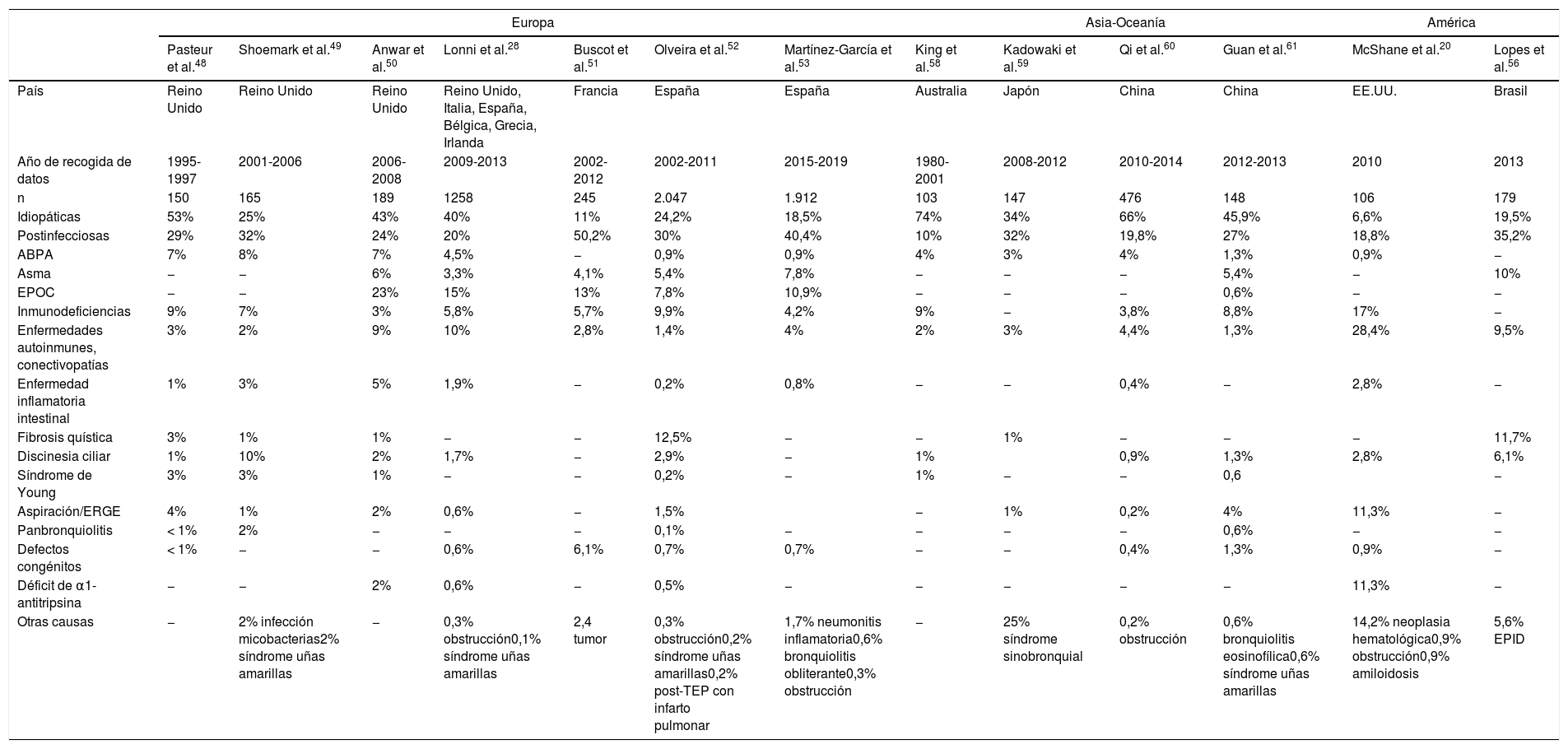
La tabla 2 muestra las causas de BQ más frecuentemente detectadas en las series publicadas en los últimos 20años. Como se puede apreciar, hay una gran variabilidad en los porcentajes de las etiologías descritas, lo que responde a diferencias metodológicas, de tamaño muestral, e incluso geográficas, entre los diferentes estudios. Los llevados a cabo en un único hospital, sobre todo si se trata de centros de referencia de determinadas enfermedades, tienen el sesgo de que sobrevaloran la frecuencia de estas etiologías. Los estudios multicéntricos, y especialmente los registros nacionales o internacionales, pueden minimizar este riesgo, siempre que participe en ellos un número suficiente de centros.
Comparativa de etiologías de bronquiectasias
| Europa | Asia-Oceanía | América | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pasteur et al.48 | Shoemark et al.49 | Anwar et al.50 | Lonni et al.28 | Buscot et al.51 | Olveira et al.52 | Martínez-García et al.53 | King et al.58 | Kadowaki et al.59 | Qi et al.60 | Guan et al.61 | McShane et al.20 | Lopes et al.56 | |
| País | Reino Unido | Reino Unido | Reino Unido | Reino Unido, Italia, España, Bélgica, Grecia, Irlanda | Francia | España | España | Australia | Japón | China | China | EE.UU. | Brasil |
| Año de recogida de datos | 1995-1997 | 2001-2006 | 2006-2008 | 2009-2013 | 2002-2012 | 2002-2011 | 2015-2019 | 1980-2001 | 2008-2012 | 2010-2014 | 2012-2013 | 2010 | 2013 |
| n | 150 | 165 | 189 | 1258 | 245 | 2.047 | 1.912 | 103 | 147 | 476 | 148 | 106 | 179 |
| Idiopáticas | 53% | 25% | 43% | 40% | 11% | 24,2% | 18,5% | 74% | 34% | 66% | 45,9% | 6,6% | 19,5% |
| Postinfecciosas | 29% | 32% | 24% | 20% | 50,2% | 30% | 40,4% | 10% | 32% | 19,8% | 27% | 18,8% | 35,2% |
| ABPA | 7% | 8% | 7% | 4,5% | − | 0,9% | 0,9% | 4% | 3% | 4% | 1,3% | 0,9% | − |
| Asma | − | − | 6% | 3,3% | 4,1% | 5,4% | 7,8% | − | − | − | 5,4% | − | 10% |
| EPOC | − | − | 23% | 15% | 13% | 7,8% | 10,9% | − | − | − | 0,6% | − | − |
| Inmunodeficiencias | 9% | 7% | 3% | 5,8% | 5,7% | 9,9% | 4,2% | 9% | − | 3,8% | 8,8% | 17% | − |
| Enfermedades autoinmunes, conectivopatías | 3% | 2% | 9% | 10% | 2,8% | 1,4% | 4% | 2% | 3% | 4,4% | 1,3% | 28,4% | 9,5% |
| Enfermedad inflamatoria intestinal | 1% | 3% | 5% | 1,9% | − | 0,2% | 0,8% | − | − | 0,4% | − | 2,8% | − |
| Fibrosis quística | 3% | 1% | 1% | − | − | 12,5% | − | − | 1% | − | − | − | 11,7% |
| Discinesia ciliar | 1% | 10% | 2% | 1,7% | − | 2,9% | − | 1% | 0,9% | 1,3% | 2,8% | 6,1% | |
| Síndrome de Young | 3% | 3% | 1% | − | − | 0,2% | − | 1% | − | − | 0,6 | − | |
| Aspiración/ERGE | 4% | 1% | 2% | 0,6% | − | 1,5% | − | 1% | 0,2% | 4% | 11,3% | − | |
| Panbronquiolitis | < 1% | 2% | − | − | − | 0,1% | − | − | − | − | 0,6% | − | − |
| Defectos congénitos | < 1% | − | − | 0,6% | 6,1% | 0,7% | 0,7% | − | − | 0,4% | 1,3% | 0,9% | − |
| Déficit de α1-antitripsina | − | − | 2% | 0,6% | − | 0,5% | − | − | − | − | − | 11,3% | − |
| Otras causas | − | 2% infección micobacterias2% síndrome uñas amarillas | − | 0,3% obstrucción0,1% síndrome uñas amarillas | 2,4 tumor | 0,3% obstrucción0,2% síndrome uñas amarillas0,2% post-TEP con infarto pulmonar | 1,7% neumonitis inflamatoria0,6% bronquiolitis obliterante0,3% obstrucción | − | 25% síndrome sinobronquial | 0,2% obstrucción | 0,6% bronquiolitis eosinofílica0,6% síndrome uñas amarillas | 14,2% neoplasia hematológica0,9% obstrucción0,9% amiloidosis | 5,6% EPID |
ABPA: aspergilosis broncopulmonar alérgica; AR: artritis reumatoide; EPID: enfermedad pulmonar intersticial difusa; EPOC: enfermedad pulmonar obstructiva crónica; ERGE: enfermedad por reflujo gastroesofágico; n: número de pacientes estudiados.
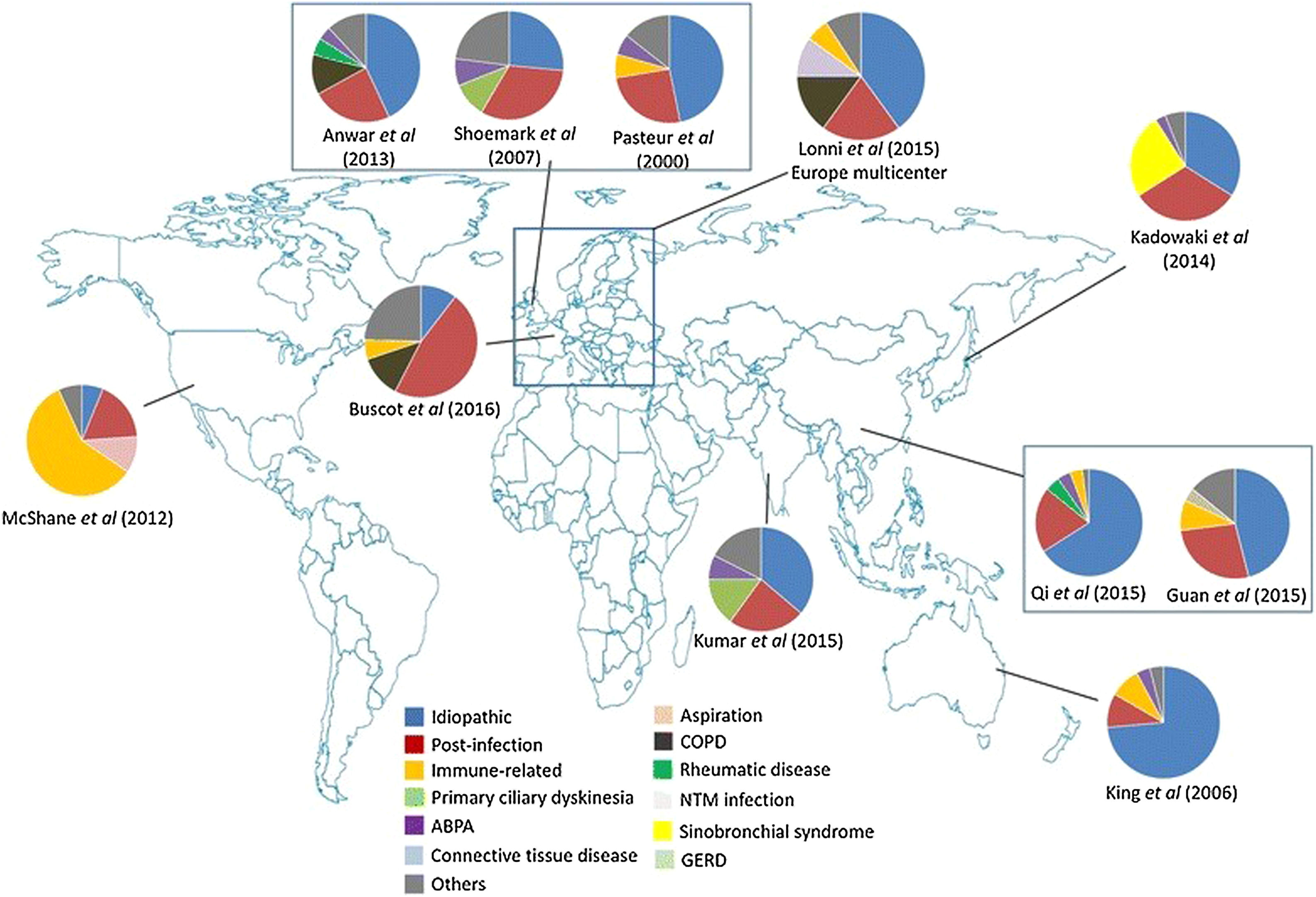
En la mayoría de series siguen apareciendo como los dos grupos más frecuentes las BQ idiopáticas y las postinfecciosas (en conjunto, por encima del 50% de casos), salvo en un estudio hecho en Estados Unidos20, en el que no llegan al 25% de los casos. En lo que respecta a las denominadas BQ idiopáticas, debemos asumir que en la mayoría de casos se trata de pacientes en los que no se ha llevado a cabo un estudio etiológico exhaustivo, que debería incluir una adecuada anamnesis y las exploraciones complementarias dirigidas a descartar las causas más frecuentes, con implicaciones terapéuticas (inmunodeficiencias, aspergilosis broncopulmonar alérgica [ABPA]) o de consejo genético (fibrosis quística, discinesia ciliar). El diagnóstico etiológico constituye uno de los retos más importantes para poder entender la patogenia de las BQ y adecuar el manejo específico de los pacientes que las padecen30.
En la última década se han llevado a cabo diversos estudios y revisiones acerca de la relación entre la EPOC y las BQ31-33. Se trata de dos patologías prevalentes, especialmente en edades más avanzadas, que cuando coexisten en un determinado paciente condicionan más síntomas, exacerbaciones, deterioro funcional e, incluso, mayor mortalidad que cuando se dan por separado34-37. En estos casos mixtos el diagnóstico de BQ es fácil de establecer mediante TCAR torácica7, pero resulta más difícil asegurar el diagnóstico de EPOC, ya que la obstrucción crónica al flujo aéreo es común a ambas enfermedades. Es, por tanto, probable que haya pacientes que han sido fumadores que presenten BQ y que tan solo estén diagnosticados de EPOC34, lo que puede comportar un incorrecto manejo por parte de los médicos responsables. La prevalencia de BQ aumenta con la gravedad de la EPOC, superando el 50% en EPOC moderada o grave36. Un reciente estudio ha demostrado, por primera vez, que la evolución natural de la EPOC puede asociarse a la aparición de BQ. En una cohorte de 201 pacientes con EPOC moderada-grave seguidos durante más de 8años se evidenció la aparición de nuevas BQ o la evolución de BQ ya preexistentes en el 36% de los casos. La presencia de expectoración purulenta crónica, el número de aislamientos de microorganismos potencialmente patógenos en esputo y el número de hospitalizaciones por exacerbación de EPOC fueron factores de riesgo independientes, prevenibles y tratables de progresión de las BQ en estos pacientes38.
Otra relación que se está estudiando en los últimos años es la que existe entre las BQ y el asma39. Ya era conocida la presencia de BQ en el 25% de autopsias de pacientes asmáticos desde los años sesenta40, aunque esta circunstancia no se confirmó hasta años más tarde, cuando un estudio detectó BQ en el 24% de pacientes con asma grave a los que se les practicó una TC torácica41. Series posteriores han descrito una prevalencia muy variable de BQ en pacientes con asma persistente grave42-44. Un reciente estudio nacional, en una cohorte de 398 pacientes con asma no controlada, mostró una prevalencia de BQ del 28,4%, que llegó al 33,6% en aquellos con asma grave45. La asociación de ambas enfermedades puede condicionar la presencia de infección bronquial crónica y un asma de mayor gravedad y peor control. Por ello, debe llevarse a cabo una TCAR torácica en pacientes con asma grave que presenten expectoración crónica y exacerbaciones frecuentes, para poder identificar eventuales BQ. En este caso, deben recibir tratamiento para ambas enfermedades, tanto farmacológico (es una de las escasas indicaciones para el uso de corticosteroides inhalados en pacientes con BQ)46 como fisioterapia respiratoria, para promover el drenaje y la expectoración efectiva47.
Variaciones geográficas en la etiología de las bronquiectasiasCausa de bronquiectasias en EuropaComo hemos dicho anteriormente, en la mayoría de series de Europa las más frecuentes son las BQ de causa desconocida y postinfecciosa28,48-54. En los últimos trabajos se ha evidenciado que cada vez con mayor frecuencia se identifican el asma, la EPOC, las inmunodeficiencias o las enfermedades del tejido conectivo como causa de BQ.
Causas de bronquiectasias en AméricaA diferencia de los países europeos, en Estados Unidos predominan todos los procesos de base inmune (enfermedades autoinmunes, inmunodeficiencias y patologías hematológicas, incluyendo la enfermedad del injerto contra huésped)20. La diferencia étnica es uno de los factores que más se asocia con la etiología; así, en pacientes afroamericanos predominan las colagenopatías, especialmente la artritis reumatoide, mientras que en los americanos de origen europeo son más frecuentes las enfermedades hematológicas, y en ellos, además, la prevalencia es más alta que en otras etnias convivientes en América.
Por su parte, en Canadá la etiología es bastante incierta, salvo en los niños indígenas55. En los países latinoamericanos las etiologías predominantes se encuentran en el campo de las infecciones y van a depender de los avances epidemiológicos: mientras que en algunos países predomina la tuberculosis, ya que es una enfermedad endémica, en aquellos en los que la población tiene difícil acceso a la vacunación infantil destacan el sarampión o la tosferina56,57.
Causa de bronquiectasias en Asia y en regiones del PacíficoLa prevalencia es mayormente desconocida, debido a la escasez de estudios de base poblacional. Sin embargo, en las series analizadas, tanto en Oceanía58 como en Asia (India, China y Tailandia)59-61 la principal etiología suele ser la postinfecciosa, seguida por las BQ de causa desconocida. Cabe destacar que en algunos casos se han descrito notables retrasos diagnósticos2. En Japón se ha demostrado una clara asociación sino-bronquial en estos pacientes62.
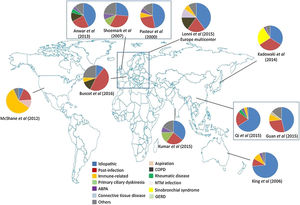
Estas diferencias geográficas podrían deberse a varias razones. En países en vías de desarrollo siguen teniendo gran relevancia las BQ postinfecciosas, sobre todo las postuberculosas y las secundarias a infecciones de la infancia, como tosferina o sarampión56,63. A esto se añade cierta predisposición genética en algunas etnias. Por su lado, en los países desarrollados ha disminuido la frecuencia de las BQ postinfecciosas y han aumentado la de etiologías que requieren un estudio diagnóstico más completo, como las conectivopatías, la enfermedad inflamatoria intestinal, etc. Todo queda recogido en la tabla 2 y en la figura 1.
Etiología y variabilidad geográfica de las bronquiectasias. Fuente: tomado de Chandrasekaran et al.2.
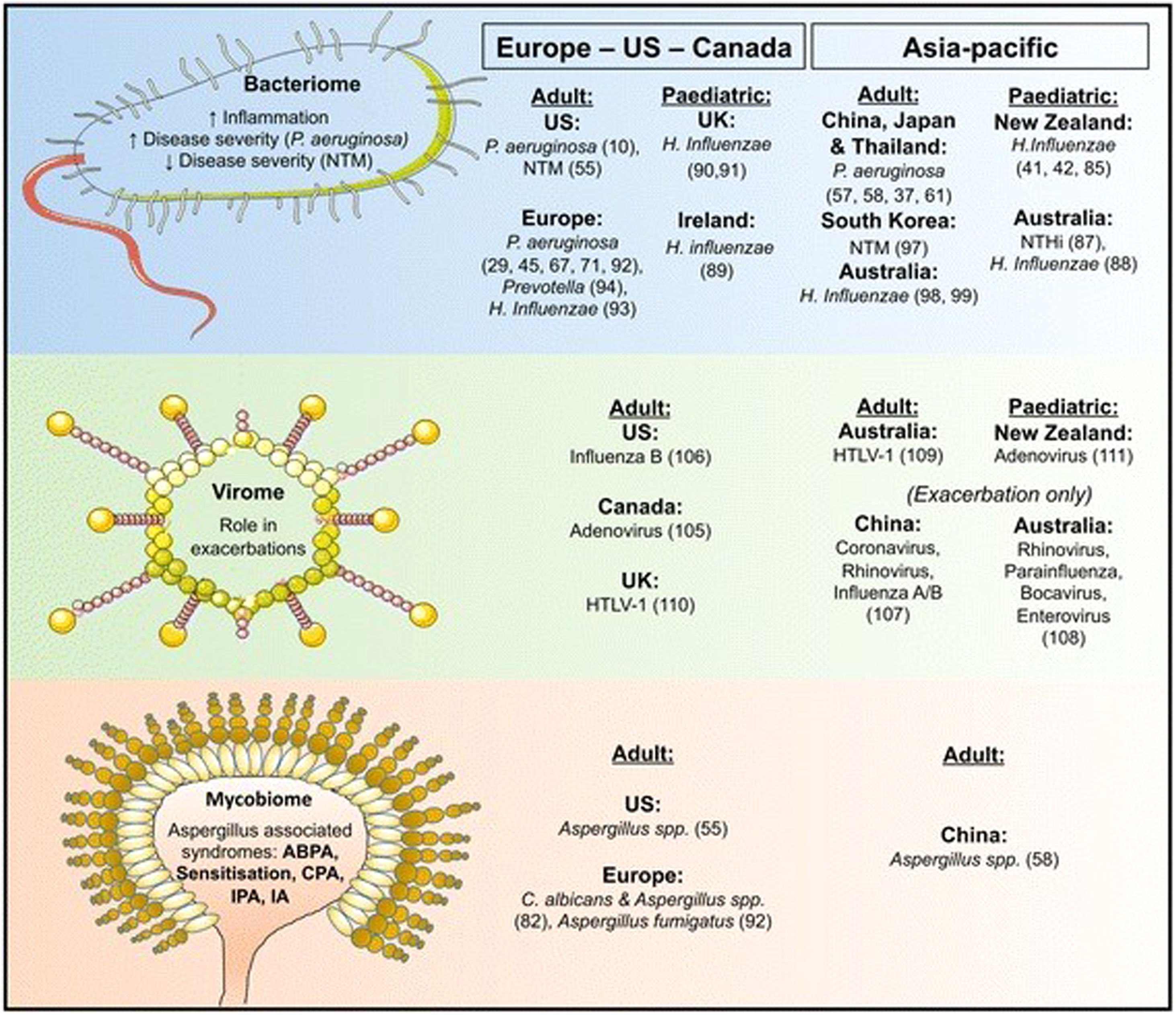
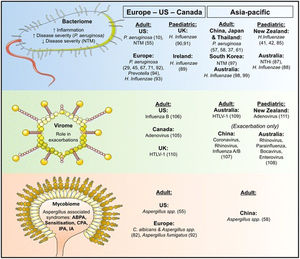
Sea cual sea la zona geográfica, Pseudomonas aeruginosa y Haemophilis influenzae son los microrganismos que con más frecuencia nos encontramos en las vías aéreas de los pacientes con BQ, aunque la primera es la que se relaciona con un peor pronóstico2 (fig. 2).
Variaciones geográficas de la microbiología encontrada en las vías aéreas de los pacientes con bronquiectasias.
Fuente: tomado de Chandrasekaran et al.2.
En diversos estudios se ha comprobado que en los países europeos existe una relación entre los microrganismos de la vía aérea y las exacerbaciones, de forma que una mayor densidad de P.aeruginosa y/o H.influenzae en las vías respiratorias, así como un patrón microbiológico específico, se asociaban con un mayor número de exacerbaciones64.
En los países americanos, la colonización por P.aeruginosa predomina entre americanos de origen hispano, seguido por los de origen europeo y finalmente los afroamericanos. Según el registro americano, las micobacterias no tuberculosas representan el 54% de los microorganismos aislados de las vías aéreas de pacientes con BQ, y la frecuencia de enfermedad asociada a las mismas es superior a la descrita en otras zonas geográficas65.
Sin embargo, en los países asiáticos los microrganismos más frecuentes en las series publicadas son P.aeruginosa y H.influenzae, y la frecuencia de aislamientos de micobacterias no tuberculosas es muy baja2.
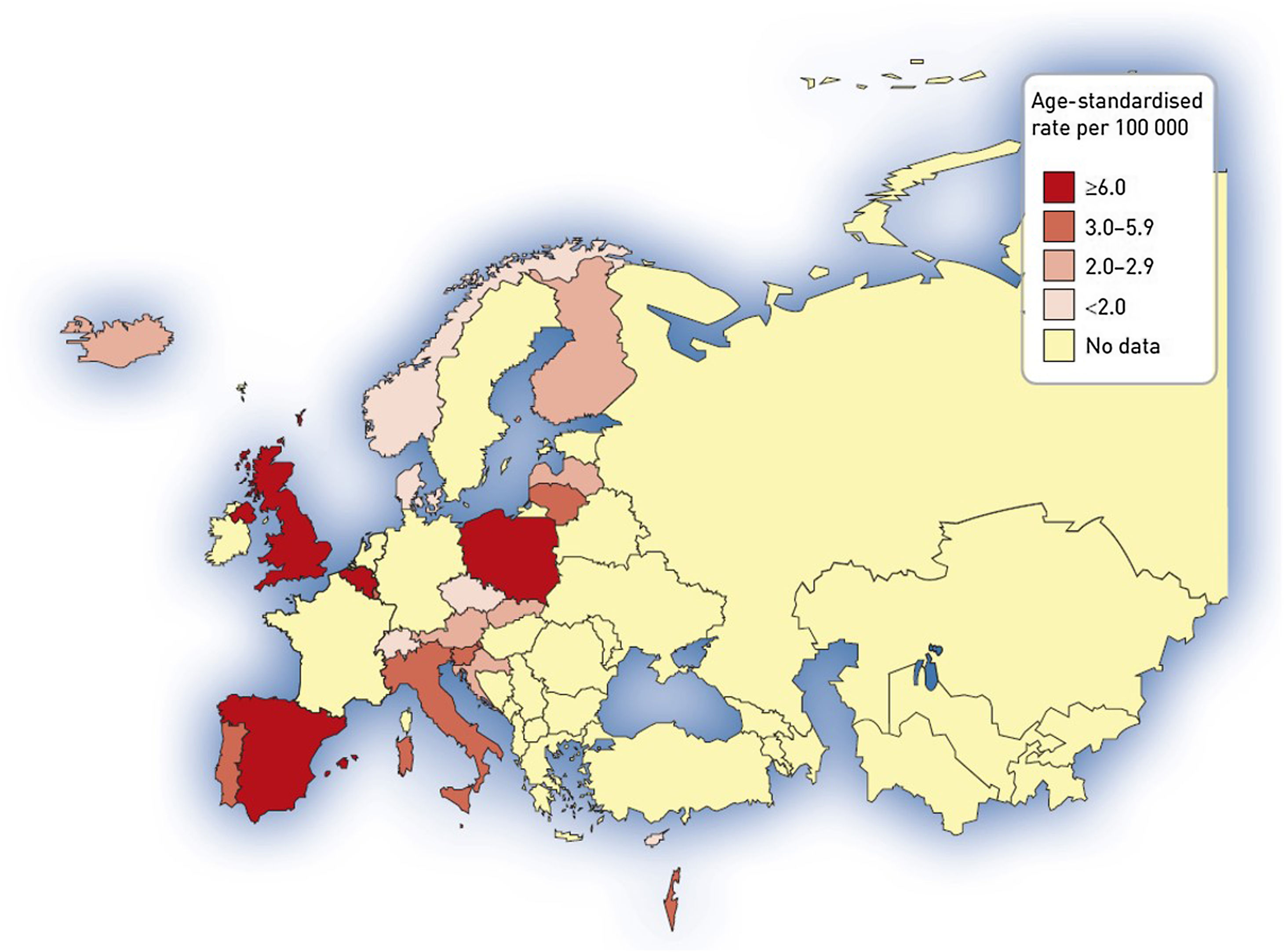
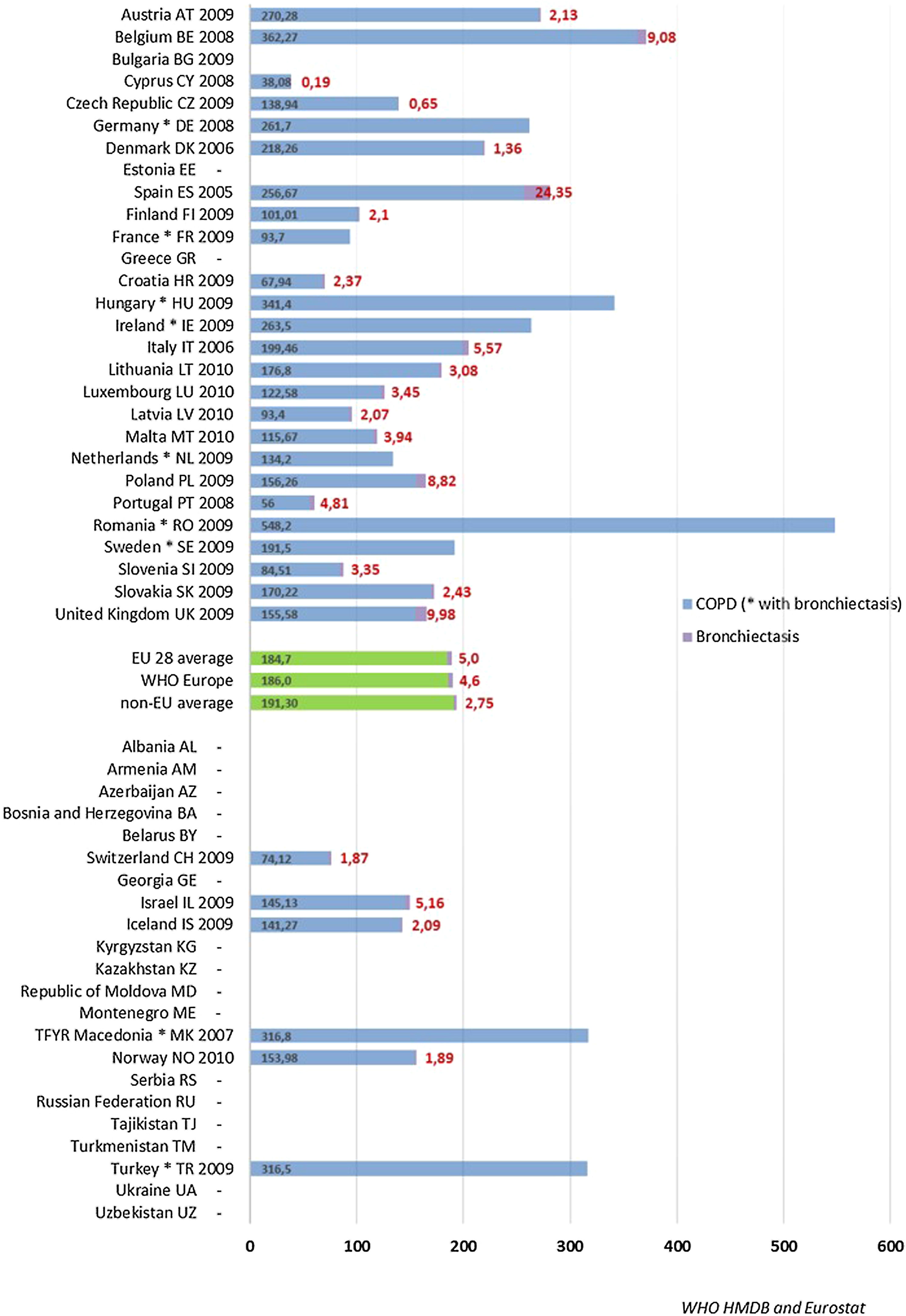
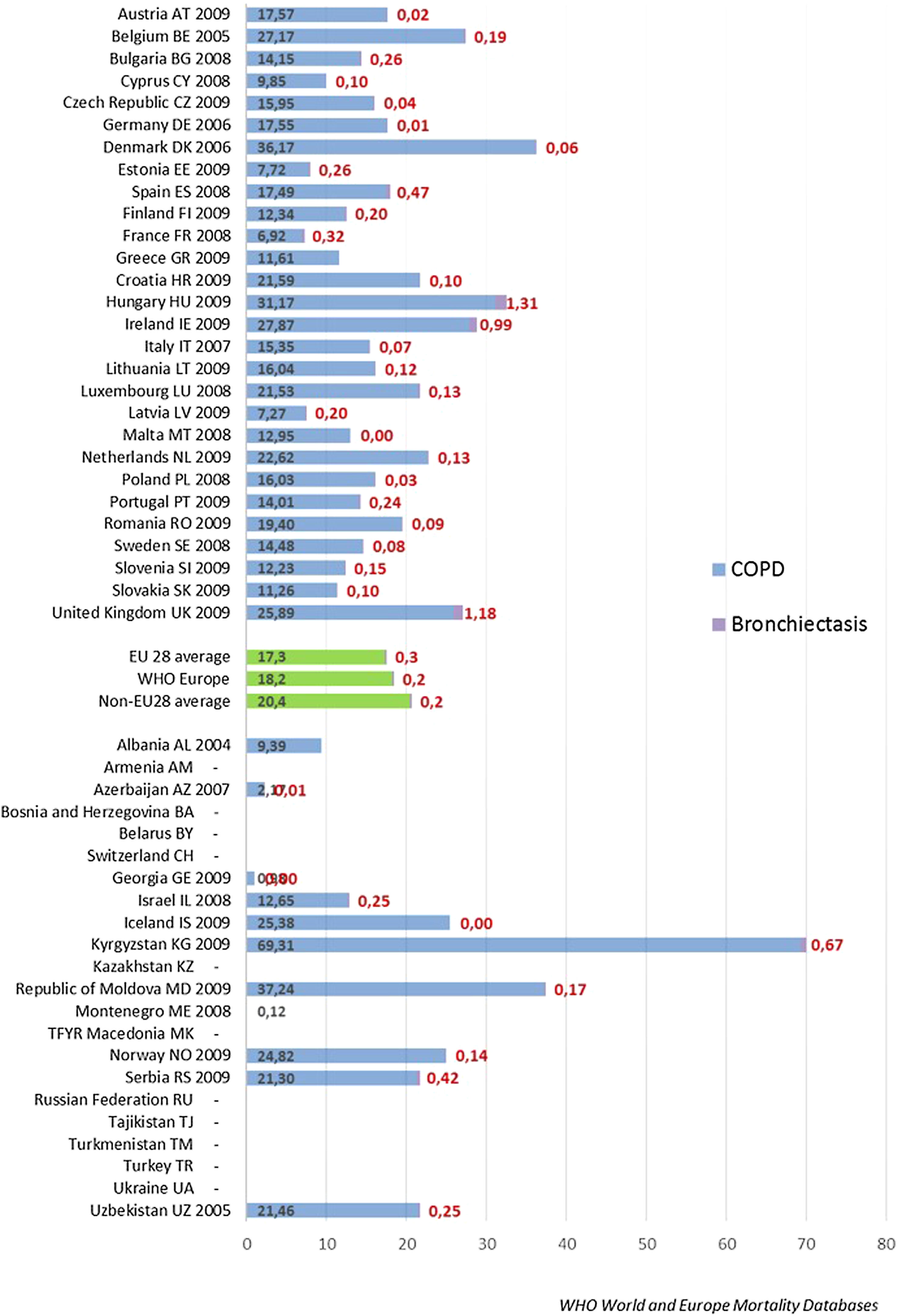
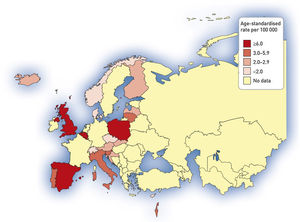
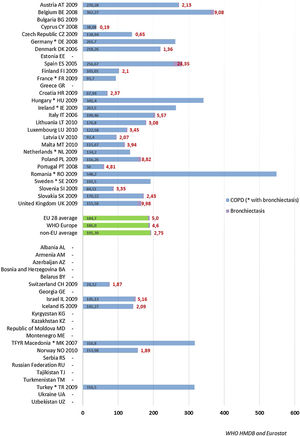
Tasa de ingresos hospitalarios y tasa de mortalidad por bronquiectasiasEl aumento de prevalencia de las BQ se ve reflejado en un aumento progresivo en diversos países del número de altas hospitalarias en las que se incluyen códigos diagnósticos de BQ, y que pone de manifiesto el impacto económico de la enfermedad en los sistemas sanitarios, cuyo alcance aún está por determinar66,67. En el año 1992, en Finlandia se registraron 87 ingresos por esta causa por cada millón de habitantes, aunque 20años antes el número de hospitalizaciones era mayor (143/1.000.000 habitantes)13. Estudios más recientes muestran tasas anuales de ingreso por BQ de 16,5/100.000 habitantes66 en Estados Unidos y de 9,4/100.000 habitantes en Alemania67. En estos estudios se evidenció, además, un incremento progresivo de dichas tasas de aproximadamente un 2% anual. Un estudio llevado a cabo en España sobre la base de datos del Conjunto Mínimo Básico de Datos entre 2004 y 2013 obtuvo datos muy similares: mostró una tasa anual de ingresos por BQ de 16,5/100.000 habitantes, con un incremento significativo de la misma durante los años analizados68. Las figuras 3 y 4 muestran las tasas de ingreso y alta hospitalaria por EPOC y por BQ en diversos países de Europa, respectivamente.
Tasa de ingreso hospitalario por bronquiectasias (tasa estandarizada por edad por 100.000 habitantes). Datos de la Base de datos de morbilidad hospitalaria de la Organización Mundial de la Salud, actualización de octubre de 2011, y Eurostat, actualización de marzo de 2012. No se muestran datos para los siguientes países donde las bronquiectasias se informan en combinación con la enfermedad pulmonar obstructiva crónica: Alemania, Francia, Hungría, Irlanda, Macedonia, Países Bajos, Rumania, Suecia y Turquía.
Tasas de alta hospitalaria por EPOC y bronquiectasias. Base de datos de morbilidad hospitalaria de la OMS y Eurostat.
Tasa de hospitalización anual estandarizada por edad por 100.000 habitantes.
* Indica países que suministran datos de Eurostat que solo están disponibles para EPOC y bronquiectasias combinadas.
La causa de muerte más frecuente en los pacientes con BQ son las exacerbaciones respiratorias, y hay diversas variables clínicas que han sido identificadas como factores de mal pronóstico, incluyendo los debidos a la evolución final de las patologías que originan las BQ (inmunodeficiencias, enfermedades sistémicas, EPOC, etc.). Dado que ninguna de estas variables puede determinar el pronóstico de la enfermedad, se han desarrollado escalas multidimensionales, como e-FACED69 y BSI70, que permiten determinar la gravedad de las BQ, dado que tienen valor pronóstico. Entre las variables que se recogen en estas escalas de gravedad destacan la edad, el FEV1, la presencia de exacerbaciones previas, la extensión radiológica de las BQ, la infección bronquial crónica por P.aeruginosa o el grado de disnea.
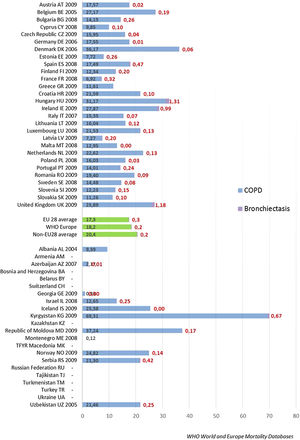
Diversos estudios han analizado la mortalidad de pacientes con BQ durante seguimientos de aproximadamente 5años en diferentes países. Las tasas de mortalidad han resultado similares: 20,4% en Bélgica71, 12,4% en una cohorte de cuatro países europeos72, 14,6% en cohortes históricas de tres países sudamericanos73 y 13,5% en un estudio chino74. La figura 5 muestra las tasas de mortalidad por EPOC y BQ en diversos países de Europa.
Impacto económico de las bronquiectasias no debidas a fibrosis quísticaLa evolución de los pacientes con BQ se caracteriza por la presencia de exacerbaciones infecciosas, que son más frecuentes en los casos de mayor gravedad, como aquellos con infección bronquial crónica por P.aeruginosa o un FEV1<50%. Estos pacientes requieren más tandas de antibiótico, más visitas a urgencias, más ingresos hospitalarios y, en algunos casos, tratamiento antibiótico inhalado75-77. Los gastos directos del manejo de los pacientes con BQ se deben a la suma de los costes de las exacerbaciones (fármacos, visitas a urgencias e ingresos hospitalarios), del tratamiento farmacológico, del tratamiento no farmacológico (fisioterapia respiratoria, oxigenoterapia, equipos de nebulización) y de las exploraciones complementarias78,79. A esto se deberían añadir, además, los costes indirectos que debe afrontar el paciente, su familia o el estado, derivados de los días de baja laboral del paciente y/o de su cuidador.
Desde comienzos del actual siglo se han publicado en Estados Unidos y en Europa diversos estudios que han analizado el coste asociado a las BQ, pero no hay publicaciones similares de otros continentes. Así, en estudios llevados a cabo en Estados Unidos se detectó un sobrecoste anual de los pacientes con BQ respecto a controles sin BQ (5.681$ por paciente)9, ya desde el primer año tras su diagnóstico (2.319$ por paciente), debido fundamentalmente al coste de los tratamientos farmacológicos, exploraciones complementarias, visitas programadas y de urgencias80. La colonización crónica por P.aeruginosa también fue un factor que aumentaba el coste sanitario total desde el momento de su detección (un 87% en comparación con los pacientes sin colonización)81.
En Europa también se han publicado en los últimos años varios trabajos sobre el gasto sanitario anual de los pacientes con BQ y los factores asociados al mismo. Un estudio en seis hospitales españoles analizó el coste anual del tratamiento de 456 pacientes con BQ82, apreciando un gasto anual medio de 4.671,9€ por paciente, que aumentaba con la gravedad de la enfermedad medida por el índice FACED83. En los pacientes con BQ más graves las exacerbaciones y el tratamiento antibiótico inhalado supusieron el 60% del coste total. El gasto sanitario fue especialmente elevado en tres subgrupos de pacientes: aquellos con BQ asociadas a EPOC, los más exacerbadores y los que presentaban colonización bronquial crónica por P.aeruginosa. En un estudio llevado a cabo en Alemania a partir de una amplia base de datos poblacional se compararon los gastos de los pacientes con BQ en relación a tres controles pareados durante tres años84. El total de gasto directo durante ese período por paciente con BQ fue de 18.634,57€, un 30% mayor que para cada control pareado. Los costes de hospitalización supusieron el 35% del total y el gasto en antibióticos fue casi cinco veces mayor que en los controles.
En lo que respecta al coste de los ingresos hospitalarios, Seitz et al.66 calcularon que, en Estados Unidos, en el año 2010, el coste medio del ingreso hospitalario por exacerbación de las BQ era de 7.827$/paciente. En este estudio, al igual que en el estudio alemán84, el coste medio del ingreso se estimó a partir del análisis de grandes bases de datos administrativas. En el primer estudio español el coste de la hospitalización se obtuvo a partir de los datos calculados por las autoridades sanitarias mediante el uso de gastos globales por grupos diagnósticos relacionados. Por ello, para conocer el coste real de una hospitalización por exacerbación por BQ en España se llevó a cabo un estudio en 29 hospitales, analizando los datos directamente de los episodios de hospitalización de 222 pacientes. El coste medio del ingreso obtenido fue de 5.284,7€, la mayoría correspondientes a la sala de hospitalización (86,9%) y, particularmente, a los costes estructurales de los hospitales. La infección bronquial crónica por P.aeruginosa, los días de hospitalización y la finalización del tratamiento con hospitalización domiciliaria fueron factores asociados independientemente con un mayor coste85.
A pesar de que en estos estudios hay una notable disparidad en la metodología empleada y en las tarifas de los diferentes sistemas sanitarios, demuestran que las BQ condicionan un elevado gasto sanitario, ya desde el momento de su diagnóstico. Dado el progresivo aumento de prevalencia de esta patología, así como del número de hospitalizaciones por exacerbación de BQ, sobre todo en población de mayor edad, se hace necesario desarrollar estrategias que permitan optimizar su manejo. Entre ellas deberían valorarse las siguientes: controlar los casos más graves en unidades especializadas de BQ, con la finalidad de armonizar el tratamiento bajo criterios clínicos, pero también de coste-eficacia; mejorar la educación sanitaria y promover el autocuidado de los pacientes86; realizar un control clínico centrado en el paciente, no en la enfermedad87; ofrecer alternativas a la visita a urgencias en caso de exacerbación, como pueden ser los hospitales de día88 o los tratamientos intravenosos domiciliarios89. En cualquier caso, hay que facilitar el contacto del paciente con el equipo médico encargado de su tratamiento, lo que permitiría realizar una valoración precoz en caso de agudización e intentar evitar ingresos hospitalarios innecesarios, asociados a elevados costes y a morbimortalidad.
FinanciaciónLa presente revisión ha contado con la financiación no condicionada de Laboratorios TEVA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relacionado directa o indirectamente con los contenidos del manuscrito.