Existe evidencia científica que demuestra que las vías serotoninérgicas que descienden desde la médula ventromedial rostral hasta la médula espinal participan en el control inhibitorio del dolor1. Sin embargo, el efecto de la serotonina sobre la modulación del dolor en la médula espinal puede ser inhibidor o facilitador en función de los subtipos de receptores que se activen preferentemente. Los estudios farmacológicos han demostrado que en la analgesia inducida por serotonina intervienen los receptores 5-HT7, mientras que en la hiperalgesia intervienen los receptores 5-HT32. Aunque en condiciones de dolor agudo puede prevalecer la inhibición de la transmisión nociceptiva por serotonina, la hiperalgesia inducida por serotonina contribuye al desarrollo de dolor crónico después de una lesión tisular o nerviosa3.
La desinhibición de las neuronas serotoninérgicas podría provocar cambios inadaptados en las vías descendentes de la serotonina, lo que daría lugar a una sensibilización nociceptiva y a dolor crónico. Estos hallazgos contribuyen a explicar por qué los fármacos serotoninérgicos puros, como los inhibidores selectivos de la recaptación de serotonina (ISRS), no resultan eficaces para tratar el dolor neuropático4. Por el contrario, los fármacos que también inhiben la recaptación de noradrenalina, como la venlafaxina, la duloxetina y la amitriptilina, se encuentran en primera línea en el manejo terapéutico del dolor neuropático5.
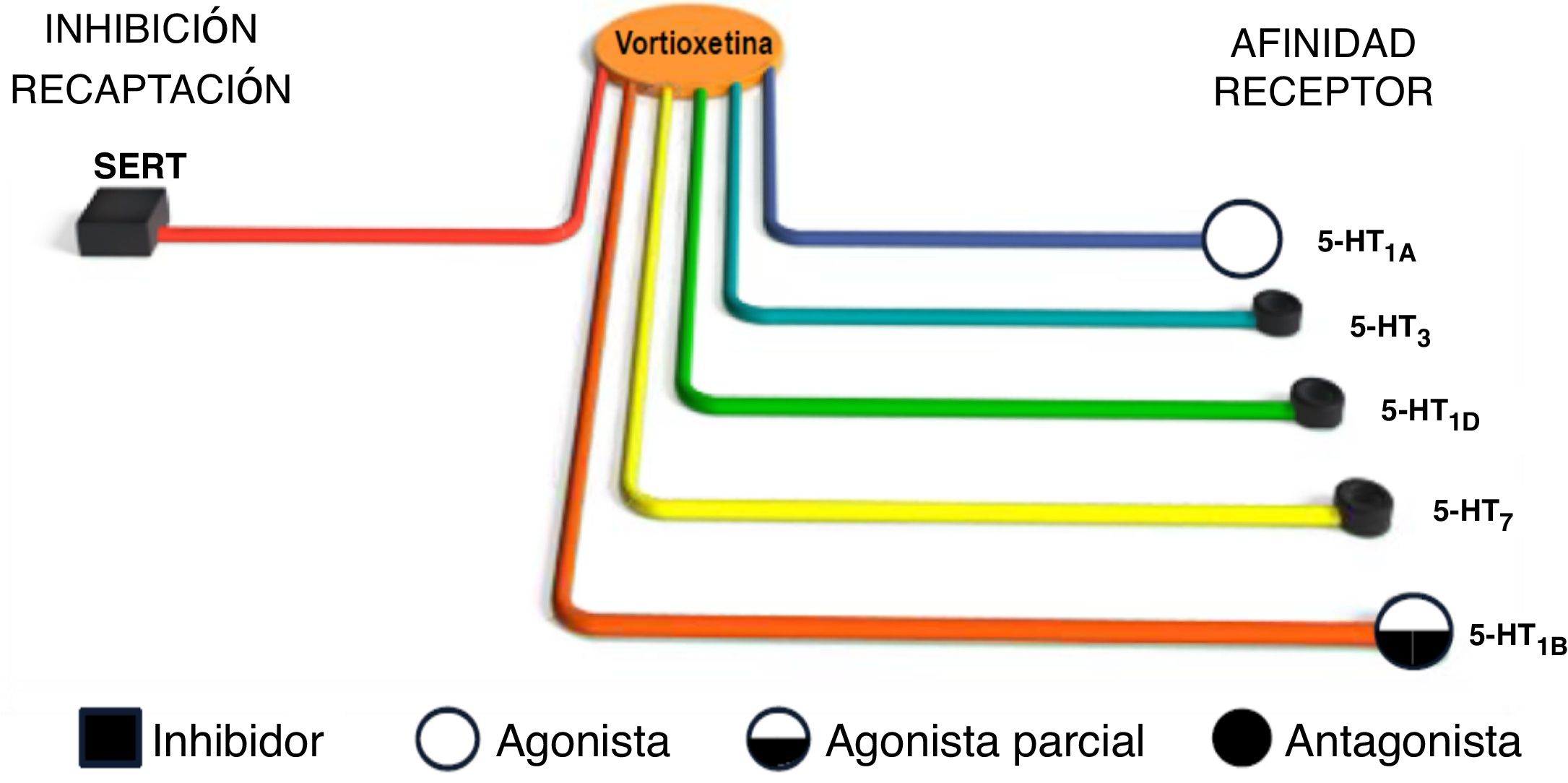
La vortioxetina es un nuevo antidepresivo multimodal que inhibe el transportador de serotonina de alta afinidad e interactúa con diferentes tipos de receptores de serotonina. En particular, la vortioxetina se comporta como agonista puro de los receptores 5-HT1A, agonista parcial de los receptores 5-HT1B y antagonista de los receptores 5-HT1D, 5-HT3 y 5-HT7 (fig. 1). La vortioxetina muestra la mayor afinidad y ocupación de receptores del sistema nervioso central para los receptores 5-HT3, y es casi tan potente como el antagonista prototipo de los receptores 5-HT3, el ondansetrón, en la inhibición del reflejo de Bezold-Jarisch dependiente de 5-HT36.
La activación de los receptores 5-HT3 podría suponer una potencial actividad analgésica de la serotonina en el dolor neuropático y planteamos la hipótesis de que la vortioxetina podría ser beneficiosa contra el dolor neuropático, al aumentar la transmisión serotoninérgica e inhibir intensamente los receptores 5-HT3 al mismo tiempo. Por ello realizamos una búsqueda bibliográfica en PubMed y Google Académico con las palabras clave «vortioxetine and neuropathic pain» y «vortioxetine and pain». Así, encontramos un estudio preclínico en el que se evaluó comparativamente el efecto de un tratamiento de larga duración con vortioxetina, el inhibidor de la recaptación de serotonina y noradrenalina (IRSN) venlafaxina, y el ISRS fluoxetina, en modelos murinos de dolor inflamatorio y neuropático crónico. La vortioxetina provocó una fuerte analgesia en ratones con lesión de constricción crónica, y su efecto fue idéntico al producido por la venlafaxina. Por el contrario, la fluoxetina fue inactiva en este modelo de lesión de constricción crónica. Sin embargo, ninguno de los 3 antidepresivos causó analgesia en el modelo de dolor inflamatorio crónico7.
Por otro lado, el dolor crónico y la depresión suelen ir de la mano. Los mecanismos que subyacen en la conexión entre dolor y depresión son complejos y no han sido suficientemente aclarados. Sin embargo, se sabe que la serotonina y la noradrenalina desempeñan un papel fundamental tanto en la modulación del procesamiento sensorial como en la regulación del afecto, y que las posibilidades actuales de tratamiento de los estados de dolor crónico y de los trastornos depresivos graves se basan principalmente en la manipulación farmacológica con sistemas centrales serotoninérgicos o noradrenérgicos. Ambos neurotransmisores son liberados en los núcleos del tronco encefálico, desde los cuales las proyecciones a la médula espinal y a los centros cerebrales superiores participan en la modulación del dolor y en el estado de ánimo. La depresión comórbida puede agravar el dolor y reducir el éxito de su tratamiento, por lo que es importante tratar ambas afecciones8.
La recuperación funcional completa de los pacientes afectados por depresión depende del control de los síntomas residuales y los trastornos comórbidos. La disfunción cognitiva, que se produce en una proporción significativa de los pacientes deprimidos, presenta un pronóstico negativo y es insensible a la mayoría de los medicamentos antidepresivos. Los pacientes deprimidos con disfunción cognitiva, que se caracteriza por el deterioro de las funciones ejecutivas, de la velocidad de procesamiento y de la memoria funcional y episódica, suelen sufrir recaídas a pesar de medicarse continuadamente, lo que se traduce en una considerable reducción de su calidad de vida9. La vortioxetina, con su mecanismo de acción multimodal, presenta una notable eficacia en la mejora de la disfunción cognitiva asociada a la depresión10. En un metaanálisis en red de 12 ensayos clínicos, unificados por el uso de la prueba de sustitución de símbolos de dígitos para medir la función cognitiva, la vortioxetina demostró una gran superioridad con respecto a todos los demás antidepresivos, como los IRSN, los ISRS, los inhibidores de la monoaminooxidasa y los antidepresivos tricíclicos11. Esta singular propiedad de la vortioxetina depende en gran medida de su capacidad para antagonizar potentemente los receptores 5-HT3 en la corteza prefrontal y en el hipocampo, mecanismo que limita la actividad inhibidora de determinadas poblaciones de interneuronas GABAérgicas en las células piramidales12. A pesar de esta importante característica, la vortioxetina no se considera todavía un fármaco de elección en los pacientes con depresión asociada a un dolor neuropático comórbido porque aún no se conoce su acción sobre la transmisión del dolor. Sin embargo, utilizando este modelo murino establecido de dolor neuropático, se demuestra que la vortioxetina presenta una fuerte actividad analgésica, que resulta indistinguible de la actividad de la venlafaxina. Hasta donde sabemos, se trata del primer ejemplo de un fármaco serotoninérgico puro que muestra actividad analgésica en un modelo de dolor neuropático7.
Como se ha indicado anteriormente, la vía serotoninérgica que desciende desde la parte inferior del tronco encefálico hasta las astas posteriores de la médula espinal se vuelve hiperalgésica en condiciones de dolor neuropático, debido a los procesos epigenéticos que tienen lugar en el rafe magnus y otros mecanismos. En la hiperalgesia inducida por serotonina interviene la activación de los receptores 5-HT3, que contrarrestan la actividad analgésica de los receptores 5-HT7. Este trabajo en ratones mostró que 10mg/kg de vortioxetina (dosis empleada en este estudio) casi satura los receptores 5-HT3 y el transportador de serotonina, pero recluta solamente entre el 20 y el 30% de los receptores 5-HT7. Así, en condiciones de hiperactividad serotoninérgica, como sucede en el dolor neuropático, la vortioxetina antagonizará eficazmente los receptores 5-HT3, dejando desocupados la gran mayoría de los receptores 5-HT7 y, por lo tanto, disponibles para ser activados por la serotonina. Partiendo de estos resultados, podríamos augurar que los ISRS podrían ser efectivos como medicamentos analgésicos contra el dolor neuropático si se combinan con un potente antagonista de los receptores 5-HT3. Esta interesante hipótesis merece ser investigada más a fondo. Nos sorprendió descubrir que la vortioxetina y la venlafaxina resultaban igualmente eficaces para causar analgesia en el modelo de lesión de constricción crónica en dolor neuropático, a pesar de que el mecanismo de acción de los 2 fármacos es diferente. No obstante, deben realizarse curvas dosis-respuesta para comparar correctamente las actividades analgésicas de la vortioxetina y la venlafaxina7.
Como los antidepresivos tienen efectos antiinflamatorios intrínsecos, no se puede descartar que la vortioxetina cause analgesia al restringir la neuroinflamación asociada al dolor neuropático13. Ninguno de los antidepresivos utilizados en este estudio causó analgesia en el modelo de dolor inflamatorio crónico, lo cual respalda la hipótesis de que los mecanismos moleculares y transinápticos que existen en la sensibilización nociceptiva en el dolor inflamatorio y neuropático son diferentes.
En nuestra búsqueda también encontramos otro estudio preclínico que examinó los efectos de la vortioxetina sobre la hipersensibilidad al dolor y el comportamiento similar a la depresión en un modelo de neuropatía inducida por oxaliplatino en ratones. La vortioxetina (1-10mg/kg por vía oral) redujo, de manera significativa y dependiente de la dosis, la alodinia mecánica y térmica, tanto en regímenes de tratamiento profiláctico repetido como de tratamiento terapéutico agudo. También redujo el comportamiento similar a la depresión en la prueba de natación forzada en ratones, en ambos paradigmas de tratamiento. Sus efectos antialodínicos y antidepresivos resultaron comparables a los de la duloxetina (1-15mg/kg por vía oral). Estos efectos podrían estar relacionados con el aumento de serotonina y noradrenalina que se ha detectado en el tronco encefálico de los ratones en este modelo de neuropatía inducida por oxaliplatino. Estos resultados revelan que la vortioxetina podría ser útil para prevenir y tratar la neuropatía inducida por quimioterapia, para aliviar el dolor y los síntomas depresivos asociados14.
En conclusión, los datos presentados en modelos preclínicos evidencian que la vortioxetina puede potenciar los recursos terapéuticos de los pacientes afectados por una depresión grave asociada a un dolor neuropático comórbido. Si se confirma en los estudios clínicos, la actividad analgésica de la vortioxetina será especialmente útil para los pacientes con disfunción cognitiva, en los que el fármaco presenta una mayor eficacia que el resto de los antidepresivos. Otra ventaja es el buen perfil de seguridad y tolerabilidad de la vortioxetina, que no causa aumentos significativos de peso ni disfunciones sexuales (a diferencia de los ISRS), ni efectos cardiovasculares nocivos (a diferencia de los IRSN)15. Por tanto, el efecto analgésico de la vortioxetina en estos modelos preclínicos allana el camino para realizar estudios clínicos en los que la vortioxetina se compare con los antidepresivos de referencia para tratar el dolor neuropático.