Ante el aparente aumento de la agresividad de la quimioterapia (QT) paliativa, el objetivo de este estudio fue conocer y analizar las características de los pacientes con cáncer que recibían QT al final de la vida en nuestro hospital.
Pacientes y métodosEstudio retrospectivo, observacional, en pacientes con neoplasias onco-hematológicas que recibieron QT entre enero del 2016 y mayo del 2017 y fallecieron en ese mismo período. Se recogieron variables clínicas y demográficas. Para identificar los factores de riesgo para recibir QT el último mes de vida, se construyó un modelo multivariante de regresión logística. Se empleó la técnica del remuestreo «bootstrap» para la selección de las variables significativas y para la estimación de la validez interna.
ResultadosDurante el período de estudio, 293 pacientes recibieron QT y fallecieron. La mediana de tiempo desde el último ciclo hasta el fallecimiento fue de 52 (0-459) días. Un total de 98 pacientes (33,4%) recibió QT durante su último mes de vida. En el análisis multivariado, la quimiosensibilidad del tumor baja, la prescripción por algunos oncólogos en concreto y el fallecimiento en el hospital se asociaron a un mayor riesgo de recibir QT el último mes de vida.
ConclusionesUn porcentaje preocupante de pacientes recibe QT al final de la vida, lo que dificulta que el paciente reciba cuidados paliativos óptimos y que fallezca en un entorno familiar. Es necesario revisar el proceso de toma de decisiones en el tratamiento de los pacientes con enfermedad oncológica avanzada.
In view of the apparent increase in the aggressiveness of palliative chemotherapy, the purpose of this study was to find out and analyse the characteristics of cancer patients treated in our hospital, and who received chemotherapy near the end of life.
Patients and methodsRetrospective, observational study in oncology-haematological patients who received chemotherapy between January 2016 and May 2017, and who died in that same period. Data on sociodemographic and clinical variables were collected. In order to determine the risk factors for receiving chemotherapy in the last month of life, a multivariate logistic regression model was developed and subsequently validated using “bootstrap” re-sampling techniques.
ResultsA total of 293 patients who received chemotherapy during the study period died. The median time between the last cycle of chemotherapy and death was 52 (0-459) days. Chemotherapy was received in their last month of life in 98 (33.4% of patients. the multivariate analysis indicated that the low chemo-sensitivity of the tumour, the particular medical oncologist, and the fact of dying in the hospital setting, were associated with an increased risk of receiving chemotherapy in the last month of life.
ConclusionsA worrying percentage of patients receive chemotherapy near the end of life. This makes it difficult to receive high-quality palliative care, as well as to die in a familiar environment. It is necessary to review the decision-making process in advanced cancer patients.
En las últimas décadas, se ha producido una expansión de los fármacos antineoplásicos, que ha contribuido a aumentar la esperanza de vida de los pacientes con cáncer. A pesar de estos avances, los tumores son actualmente la segunda causa de muerte en España, con 112.939 personas fallecidas por este conjunto de enfermedades en 20161. De ellas, entre 9.000 y 42.000 recibieron quimioterapia (QT) en el último mes de vida2.
En la enfermedad avanzada o metastásica, la QT paliativa se administra con el objetivo de prolongar la supervivencia o mejorar la calidad de vida de los pacientes. Sin embargo, hay una tendencia creciente a aumentar la agresividad de los tratamientos oncológicos al final de la vida que está generando un amplio debate, ya que publicaciones recientes sugieren que los pacientes que reciben estos tratamientos no viven más y tienen peor calidad de vida que los pacientes que optan por tratamientos de soporte3-6.
Entre estos estudios, una revisión sistemática reciente demostró que los tratamientos activos contra el cáncer, comparados con los tratamientos de soporte, no mejoraban la supervivencia global de enfermos con una expectativa de vida inferior a 6 meses y, además, estaban asociados con una mayor incidencia de reacciones adversas que empeoraban la calidad de vida3. Otra revisión confirmó que el uso de la QT en pacientes con cáncer terminal no mejoraba la calidad de vida en pacientes con una situación funcional mala y la empeoraba en los que la tenían buena4. Por otra parte, Wright et al. observaron que los pacientes tratados con QT paliativa en los últimos meses tenían mayor riesgo de ser tratados mediante procedimientos invasivos en la última semana de vida (reanimación cardiopulmonar, ventilación mecánica o alimentación por sonda) y de ser derivados a cuidados paliativos de manera tardía. Asimismo, estos pacientes tenían mayor probabilidad de morir en una unidad de cuidados intensivos y menor probabilidad de morir en el lugar deseado, sin que se encontraran beneficios en la supervivencia5.
Otra cuestión que plantea controversia es el beneficio real que aportan estos fármacos. Aunque hay ejemplos de antineoplásicos que han supuesto una auténtica revolución en el tratamiento del cáncer, hay otros muchos que solo aportan beneficios marginales. Un análisis de 71 fármacos aprobados por la Food and Drug Administration entre 2002 y 2014 para el tratamiento de tumores sólidos encontró que la mediana en supervivencia global y supervivencia libre de progresión que aportaban los nuevos medicamentos era de 2,1 y 2,5 meses, respectivamente7.
Sin embargo, a pesar de que existe la creencia de que la QT a menudo se prolonga más de lo conveniente, y de que la transferencia de los pacientes a cuidados paliativos o no se produce o llega demasiado tarde, disponemos de muy pocos datos sobre lo que está ocurriendo en nuestro país8,9. Por esta razón, hemos llevado a cabo el presente estudio, con el objetivo de conocer qué tipo de pacientes reciben QT el último mes de vida en nuestro hospital y realizar un análisis de las características de estos pacientes.
Pacientes y métodosPoblación de estudioEstudio observacional retrospectivo, en el que se incluyó a los pacientes con neoplasias onco-hematológicas que recibieron QT entre enero del 2016 y mayo del 2017 y fallecieron en ese mismo período, en un hospital de Valladolid (España), que atiende a una población de 258.000 habitantes. Nuestra atención se centró en los pacientes que recibieron QT en su último mes de vida.
VariablesLos datos se recogieron a través del programa de historia clínica electrónica (Siclinica®-Sacyl) y de los módulos de dispensación de Pacientes Ambulantes y Externos (Farmatools®-Dominion) del servicio de Farmacia, y se introdujeron anonimizados en una base de datos.
Se recogieron las siguientes variables sociodemográficas y clínicas: sexo, edad, número de historia clínica, servicio, médico prescriptor, diagnóstico, vía de administración, línea de tratamiento, quimiosensibilidad del tumor, fechas de inicio y fin de la QT, fecha y lugar del fallecimiento. La quimiosensibilidad del tumor se definió como la tasa de respuesta a la primera línea de QT estándar para la enfermedad metastásica (alta, que incluye cáncer de mama, colorrectal, pulmón microcítico o de ovario; o baja, que incluye cáncer de páncreas, hepático, renal, melanoma o del sistema nervioso central, entre otros).
Para los pacientes que recibieron QT en su último mes de vida, se recogió además: estado funcional en la escala Eastern Cooperative Oncology Group (ECOG), indicación de la QT, impacto económico (alto coste, si cada dosis parenteral o mes de tratamiento oral era mayor de 1.000 € o bajo coste, en caso contrario), intención de la QT (neoadyuvante, adyuvante, paliativa o curativa radical), líneas de tratamiento recibidas, estadio al fallecimiento, toxicidad (número y tipo de eventos adversos según la terminología para eventos adversos CTCAE versión 3.010), ingreso/s en el último mes de vida y duración de los mismos.
Análisis estadísticoSe realizó un análisis descriptivo de las variables recogidas. Los resultados se expresaron como medianas y rangos para las variables cuantitativas, y como frecuencias y porcentajes para las categóricas.
La comparación entre el grupo que recibió QT el último mes de vida y el que no la recibió se realizó con el test de la chi al cuadrado de Pearson.
Para identificar los factores de riesgo para recibir QT el último mes de vida, se construyó un modelo multivariante de regresión logística. Se empleó la técnica del remuestreo «bootstrap» para la selección de las variables significativas y para la estimación de la validez interna. Se calcularon las odds ratio (OR) ajustadas y sus intervalos de confianza (IC del 95%).
Para el análisis estadístico, se utilizó el programa IBM SPSS Statistics versión 24 y para todas las pruebas, el nivel de significación se estableció en p<0,05.
ResultadosDurante el período de estudio, 1.566 pacientes recibieron QT, de los que 293 (18,7%) fallecieron. La edad mediana (rango) de estos 293 pacientes era de 68 (26-89) años, el 61,4% eran hombres y el 38,6% mujeres. El 82,6% de los pacientes pertenecían al servicio de Oncología, el 9,9% a Hematología y el 7,5% restante a otros servicios (Urología, Digestivo y Cirugía). Los tumores más prevalentes fueron el cáncer de pulmón (21,5%), colorrectal (15,7%), páncreas (7,2%), mama (6,8%) y gástrico (6,5%). La mediana de tiempo desde el último ciclo de QT hasta el fallecimiento fue de 52 (0-459) días. Un total de 205 pacientes (70,0%) recibió QT durante los últimos 3meses de vida, 98 pacientes (33,4%) durante el último mes y 46 (15,7%) durante las últimas 2semanas.
De los 98 pacientes que recibieron QT durante su último mes de vida, 81 (82,7%) continuaban recibiendo un tratamiento previamente prescrito y 17 (17,3%) lo iniciaron ese mismo mes.
La intención del tratamiento fue neoadyuvante en un paciente, adyuvante en 3 y curativa radical en 5, pero en la mayoría (90,8%) la intención fue paliativa (56,1% en primera línea de tratamiento, 15,3% en segunda línea, 13,3% en tercera, 3,1% en cuarta y 3,1% en quinta). Se disponía del registro de los valores de la escala ECOG en 31 pacientes. De estos, 11 pacientes (11,2% del total) presentaban un ECOG 0-1, 18 (18,4%) un ECOG 2, un paciente ECOG 3 (1,0%) y un paciente ECOG 4 (1,0%). La indicación de la QT estaba fuera de ficha técnica en el 6,1% de los pacientes y en el 58,2% de los mismos la QT administrada era de alto impacto económico.
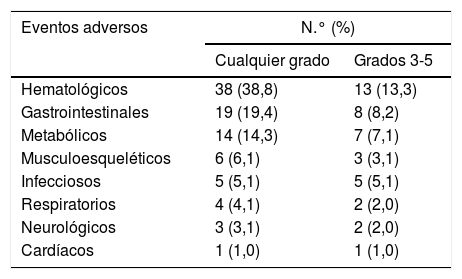
En 57 pacientes (58,2%) se registró toxicidad asociada a la QT, con eventos adversos de grado 1 en el 22,4% de los pacientes, de grado 2 en el 24,5%, de grado 3 en el 22,4%, de grado 4 en el 12,2% y de grado 5 en el 7,1%. La mayor parte de estos eventos adversos fueron hematológicos (en el 38,8% de los pacientes), seguidos de los gastrointestinales (19,4%) y metabólicos (14,3%) (tabla 1).
Toxicidad registrada en los pacientes que reciben quimioterapia el último mes de vida (N=98)
| Eventos adversos | N.° (%) | |
|---|---|---|
| Cualquier grado | Grados 3-5 | |
| Hematológicos | 38 (38,8) | 13 (13,3) |
| Gastrointestinales | 19 (19,4) | 8 (8,2) |
| Metabólicos | 14 (14,3) | 7 (7,1) |
| Musculoesqueléticos | 6 (6,1) | 3 (3,1) |
| Infecciosos | 5 (5,1) | 5 (5,1) |
| Respiratorios | 4 (4,1) | 2 (2,0) |
| Neurológicos | 3 (3,1) | 2 (2,0) |
| Cardíacos | 1 (1,0) | 1 (1,0) |
Clasificación del tipo y gravedad de los eventos adversos según la terminología CTCAE versión 3.010.
El 86,7% de los pacientes ingresaron en el hospital durante este último mes de vida, con una mediana de duración de la hospitalización de 8 (1-30) días. El 79,6% falleció en el hospital. La práctica totalidad de los pacientes (96,9%) presentaba estadio iv en el momento del fallecimiento.
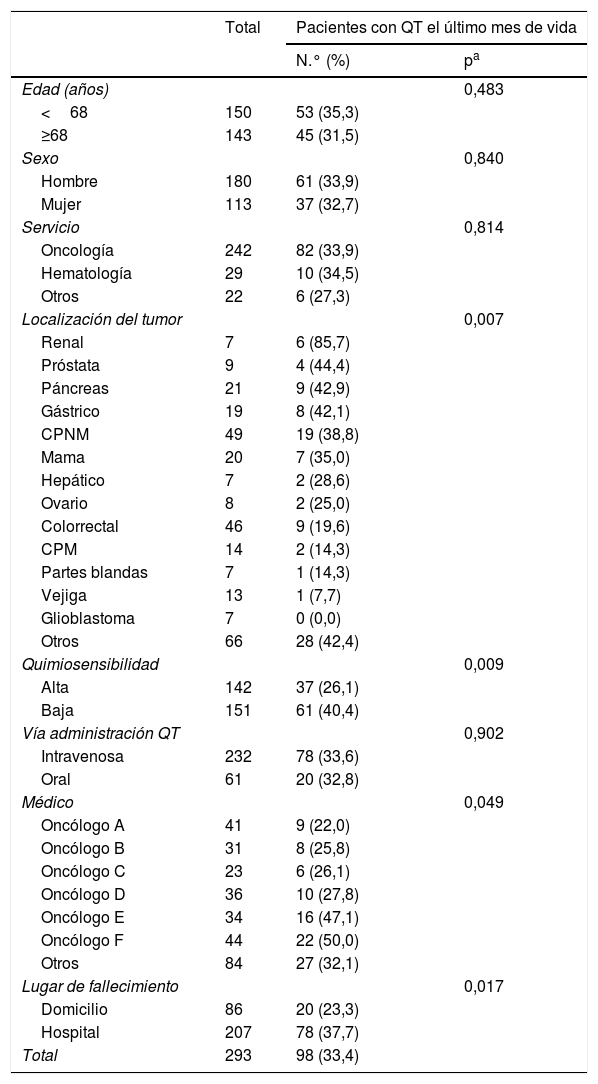
Se encontró asociación significativa entre el hecho de recibir QT durante el último mes de vida y las siguientes variables: médico prescriptor, localización del tumor, quimiosensibilidad y lugar del fallecimiento (tabla 2). No se encontraron diferencias para la edad, el sexo, el servicio o la vía de administración de la QT.
Características de los pacientes y factores asociados al hecho de recibir QT el último mes de vida
| Total | Pacientes con QT el último mes de vida | ||
|---|---|---|---|
| N.° (%) | pa | ||
| Edad (años) | 0,483 | ||
| <68 | 150 | 53 (35,3) | |
| ≥68 | 143 | 45 (31,5) | |
| Sexo | 0,840 | ||
| Hombre | 180 | 61 (33,9) | |
| Mujer | 113 | 37 (32,7) | |
| Servicio | 0,814 | ||
| Oncología | 242 | 82 (33,9) | |
| Hematología | 29 | 10 (34,5) | |
| Otros | 22 | 6 (27,3) | |
| Localización del tumor | 0,007 | ||
| Renal | 7 | 6 (85,7) | |
| Próstata | 9 | 4 (44,4) | |
| Páncreas | 21 | 9 (42,9) | |
| Gástrico | 19 | 8 (42,1) | |
| CPNM | 49 | 19 (38,8) | |
| Mama | 20 | 7 (35,0) | |
| Hepático | 7 | 2 (28,6) | |
| Ovario | 8 | 2 (25,0) | |
| Colorrectal | 46 | 9 (19,6) | |
| CPM | 14 | 2 (14,3) | |
| Partes blandas | 7 | 1 (14,3) | |
| Vejiga | 13 | 1 (7,7) | |
| Glioblastoma | 7 | 0 (0,0) | |
| Otros | 66 | 28 (42,4) | |
| Quimiosensibilidad | 0,009 | ||
| Alta | 142 | 37 (26,1) | |
| Baja | 151 | 61 (40,4) | |
| Vía administración QT | 0,902 | ||
| Intravenosa | 232 | 78 (33,6) | |
| Oral | 61 | 20 (32,8) | |
| Médico | 0,049 | ||
| Oncólogo A | 41 | 9 (22,0) | |
| Oncólogo B | 31 | 8 (25,8) | |
| Oncólogo C | 23 | 6 (26,1) | |
| Oncólogo D | 36 | 10 (27,8) | |
| Oncólogo E | 34 | 16 (47,1) | |
| Oncólogo F | 44 | 22 (50,0) | |
| Otros | 84 | 27 (32,1) | |
| Lugar de fallecimiento | 0,017 | ||
| Domicilio | 86 | 20 (23,3) | |
| Hospital | 207 | 78 (37,7) | |
| Total | 293 | 98 (33,4) | |
CPM: cáncer de pulmón microcítico; CPNM: cáncer de pulmón no microcítico; QT: quimioterapia.
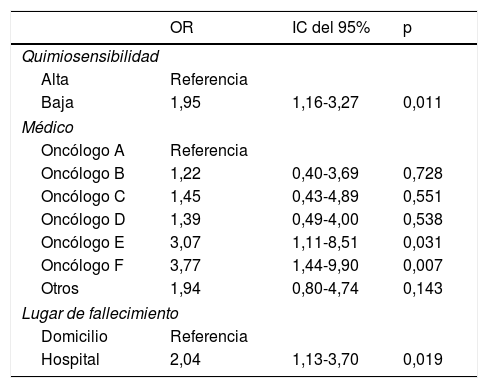
Los resultados del análisis multivariado identificaron las siguientes variables como factores de riesgo independientes para recibir QT el último mes de vida: quimiosensibilidad baja (OR 1,95, IC del 95%: 1,16-3,27), prescripción por el oncólogo E (OR 3,07, IC del 95%: 1,11-8,51) o F (OR 3,77, IC del 95%: 1,44-9,90), comparados con el oncólogo A, y fallecimiento en el hospital (OR 2,04, IC del 95%: 1,13-3,70) (tabla 3).
Predictores para recibir quimioterapia el último mes de vida derivados del análisis multivariado
| OR | IC del 95% | p | |
|---|---|---|---|
| Quimiosensibilidad | |||
| Alta | Referencia | ||
| Baja | 1,95 | 1,16-3,27 | 0,011 |
| Médico | |||
| Oncólogo A | Referencia | ||
| Oncólogo B | 1,22 | 0,40-3,69 | 0,728 |
| Oncólogo C | 1,45 | 0,43-4,89 | 0,551 |
| Oncólogo D | 1,39 | 0,49-4,00 | 0,538 |
| Oncólogo E | 3,07 | 1,11-8,51 | 0,031 |
| Oncólogo F | 3,77 | 1,44-9,90 | 0,007 |
| Otros | 1,94 | 0,80-4,74 | 0,143 |
| Lugar de fallecimiento | |||
| Domicilio | Referencia | ||
| Hospital | 2,04 | 1,13-3,70 | 0,019 |
Incluye solo las variables retenidas tras el remuestreo «bootstrap».
IC del 95%: intervalo de confianza del 95%; OR: odds ratio.
Varios estudios sugieren un aumento en la agresividad de los tratamientos oncológicos al final de la vida11. En nuestro hospital, uno de cada 3pacientes con cáncer que reciben QT y fallecen la recibe en el último mes de vida. Se trata de una cifra elevada si la comparamos con otros estudios, aunque en la literatura encontramos porcentajes muy variados, entre el 8 y el 37%2.
La interrupción del tratamiento intensivo en las etapas finales de la vida está considerada como un factor determinante de buena práctica clínica12,13, que facilita el acceso precoz a los tratamientos de soporte. En este sentido, se han desarrollado diferentes indicadores de calidad, pero nuestros resultados también se sitúan por encima: se aconseja que la administración de QT en las 2últimas semanas de vida sea inferior al 10% y que menos del 2% de los pacientes inicien un nuevo régimen de QT en el mes previo al fallecimiento. Nosotros encontramos un 15,7% y un 5,8%, respectivamente, en estos indicadores.
Una posible explicación a este sobretratamiento encontrado puede ser la inclusión de tratamientos orales en nuestro estudio (20,8% de los pacientes), que por su mayor comodidad de administración son más fácilmente prolongables, o la inclusión de pacientes con neoplasias hematológicas (9,9% del total), que suelen asociarse a cuidados más intensivos y continuos, próximos al final de la vida.
En el análisis multivariante, identificamos 3variables como factores de riesgo independientes para recibir QT el último mes de vida: el médico prescriptor, la quimiosensibilidad del tumor y el lugar del fallecimiento.
En cuanto al prescriptor, encontramos que, en función de que el paciente fuese tratado por un oncólogo u otro, tenía mayor o menor probabilidad de recibir QT en las últimas semanas de vida. De forma que la probabilidad se incrementaba hasta 3veces para pacientes tratados por el oncólogo E y cerca de 4veces para los tratados por el oncólogo F, en comparación con los tratados por el oncólogo A. En nuestro hospital, todos los oncólogos tratan todo tipo de tumores, por lo que la localización del tumor no justifica esta variabilidad. No hay muchos estudios que hayan encontrado resultados similares14.
Es difícil identificar la causa de estas llamativas diferencias entre oncólogos. En algún caso puede deberse a la dificultad para predecir la esperanza de vida real de los pacientes, en otros, al exceso de optimismo que ponen algunos médicos en los tratamientos, o a la dificultad que tienen otros para dar malas noticias, que les lleva a recomendar un nuevo ciclo de QT antes que discutir el cese de la misma6,15-18. La falta de protocolización de los tratamientos, que obliga al oncólogo a la toma de decisiones individuales, tampoco ayuda a la hora de conseguir resultados homogéneos.
Se ha demostrado que los pacientes que abordan su pronóstico con sus médicos, reciben tratamientos menos intesivos y tienen mejor calidad de vida cerca de la muerte6,16 pero, paradójicamente, los pacientes que califican mejor la relación con su médico son los que tienen expectativas erróneas con mayor frecuencia17.
La realidad es que, aunque algunos pacientes estén dispuestos a aceptar una toxicidad importante a cambio de pequeñas mejorías19,20, en general, la mayoría están mal informados: entre el 30 y el 70% de los pacientes con cáncer avanzado de pulmón que participaban en un estudio21 creían que la QT paliativa podía curarlos; del mismo modo, en otra cohorte de 1.200 pacientes, el 69% de los pacientes con cáncer de pulmón metastásico y el 81% de los pacientes con cáncer colorrectal avanzado también pensaban que el tratamiento era curativo22.
La mayor parte de las veces, la información relacionada con la supervivencia no se discute o se maneja vagamente18. Así lo demostró un estudio realizado en pacientes con cáncer avanzado que ya habían recibido QT, en el que el 88% afirmaba que repetiría de nuevo la terapia; sin embargo, cuando se les preguntaba qué supervivencia mínima debía garantizárseles, daban tiempos muy alejados de la realidad23.
Es decir, la falta de comprensión del propósito de la QT paliativa hace que los pacientes acepten alternativas más agresivas, y solo recibiendo información realista sobre las diferentes opciones y las probabilidades de éxito o de efectos adversos podrán decidir adecuadamente.
La segunda variable predictora que encontramos fue la quimiosensibilidad del tumor y, sorprendentemente, los pacientes con tumores de baja quimiosensibilidad eran más propensos a recibir QT en su último mes de vida (OR=1,95). Nuestros hallazgos se suman a otros resultados contradictorios publicados anteriormente19,24,25. El elevado uso de QT al final de la vida en tumores renales, de próstata, de páncreas o gástricos, conocidos por su baja tasa de respuesta, puede deberse a que la base del tratamiento para algunos de estos tumores es la QT oral, con mecanismos de acción diferentes de la QT citotóxica, como son los inhibidores de tirosincinasas o los antiandrógenos. Por otra parte, son tumores que en su mayoría se diagnostican en estadios avanzados. En cualquier caso, en estos pacientes el efecto paliativo de la QT es aún más cuestionable, ya que la probabilidad de tener un efecto negativo puede superar a la de conseguir una mejoría.
Finalmente, encontramos que, al igual que en otros en estudios11,26, el grupo de pacientes expuesto a la QT en sus últimos 30 días fallecieron con más probabilidad en el hospital que en casa (OR=2,04). Este es un claro indicador negativo de calidad de vida para el paciente, que al estar recibiendo tratamiento activo hasta el final no podrá pasar sus últimos días de vida en un entorno amigable y que le llevará a fallecer en un hospital, donde aún se le podrá someter a tratamientos intensivos27.
La QT cerca del final de la vida necesita encontrar un equilibrio entre beneficio y toxicidad que resulta complicado de alcanzar. Factores como el estado general del paciente, la supervivencia esperada o los efectos adversos asociados deben tenerse en cuenta a la hora de iniciar un nuevo tratamiento.
Aunque la esperanza de vida puede resultar difícil de predecir, un estado funcional limitado es uno de los mejores predictores de una corta esperanza de vida15. En nuestro centro, el estado ECOG solo se registró en la tercera parte de los pacientes que recibieron QT el último mes, y entre los que lo tenían registrado 2 pacientes presentaban ECOG 3-4. Con este estado funcional, en el que los pacientes permanecen postrados en la cama-sillón más del 50% del tiempo, no se recomienda administrar ningún tipo de QT28.
Otro de los aspectos a tener en cuenta es la línea de tratamiento, ya que a medida que la enfermedad progresa, la probabilidad de respuesta disminuye y aumenta la probabilidad de sufrir efectos perjudiciales y de ingresar en el hospital. Un 6% de nuestros pacientes recibieron QT en cuarta o quinta línea el último mes de vida. En cuanto a la toxicidad, un 42% presentó al menos un evento adverso grave y el 7% falleció por toxicidad probablemente asociada a la QT. Las causas del fallecimiento fueron: neutropenia febril (3 pacientes), perforación intestinal (2), enteritis tóxica (1) y diarrea (1). Determinar si la muerte está asociada o no a la QT en ocasiones resulta complicado, ya que depende del registro que se lleve a cabo; en cualquier caso, nuestros resultados se encuentran en la línea de los reportados por otros estudios29.
Nuestros pacientes, en su mayoría de edad avanzada y con enfermedad metastásica, reciben tratamientos paliativos, que en muchas ocasiones no van a hacer que vivan más ni mejor. Diversos estudios han demostrado que interrumpir la QT agresiva antes, introduciendo cuidados paliativos, puede incrementar el tiempo de supervivencia y la calidad de vida en este tipo de pacientes3-6. Por ello, se hace necesario ser exquisitos en la selección de los pacientes y de los tratamientos, que realmente tengan probabilidades de conseguir un beneficio clínico relevante. En caso contrario, cuando se aproxima el final de la vida, sería más adecuado remitir al paciente a cuidados paliativos y proporcionarle los mejores cuidados de soporte, para que sus últimos días los pase en un ambiente comodidad, confortable, sin sufrimiento y rodeado de sus seres queridos.
Esta es una oportunidad de mejora, que además tiene un gran impacto en términos de eficiencia para el sistema sanitario: en el año 2015, España dedicó un 12,2% de su gasto en farmacia a los tratamientos oncológicos, lo que supuso unos 2.500 millones de euros30.
Nuestro estudio también tiene varias limitaciones, como es el propio diseño retrospectivo o el hecho de no haber identificado a los pacientes que eran seguidos simultáneamente por el servicio de Cuidados Paliativos.
Como conclusiones, cabe afirmar que, en nuestro hospital, un tercio de los pacientes con cáncer que reciben QT y fallecen la reciben en el último mes de vida. La presencia de, al menos, un efecto adverso grave en casi la mitad de los pacientes y el elevado porcentaje que ingresa en el hospital el último mes de vida y fallece en él debería hacernos reflexionar sobre el tratamiento activo con QT en pacientes con enfermedad oncológica avanzada.
Muchos son los retos que tenemos por delante, como avanzar hacia un proceso de comunicación médico-paciente en el que se afronten todas las opciones terapéuticas disponibles, incluidos los cuidados paliativos; evitar el uso de tratamientos de escasa evidencia o con balance beneficio/riesgo dudoso, así como extremar la adecuación del consentimiento informado, corroborando que el paciente comprende las alternativas disponibles y que se respeta su autonomía.
FinanciaciónLa presente investigación no ha recibido ninguna beca específica de agencias de los sectores público, comercial o sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.