La prevalencia de la colitis ulcerosa (CU) en España y su carga económica asociada están aumentando. La mesalazina oral, tratamiento recomendado como primera línea para la CU leve-moderada, presenta sensibles diferencias en cuanto a formulaciones y precios.
ObjetivosEstudio de coste-efectividad entre las 2 formulaciones orales de mesalazinas gastrorresistentes de liberación prolongada que existen en España (Salofalk® y Mezavant®) en las fases de brote y de mantenimiento de la remisión.
MétodosAdaptación de modelos económicos de manejo de la CU validados internacionalmente, al uso de mesalazinas gastrorresistentes de liberación prolongada en España: análisis de minimización de costes para el tratamiento del brote (árbol de decisión) y mantenimiento de la remisión (modelo de Markov).
ResultadosEn el tratamiento del brote, Salofalk® 3g/día domina (ofrece igual resultado en salud a menor coste) a Mezavant® en dosis de 3,6 y 4,8g/día en cualquier estrategia de tratamiento que incluya mesalazinas gastrorresistentes de liberación prolongada. Comparado con Mezavant® a dosis de 2,4g/día, Salofalk® resulta la opción más coste-efectiva. En el modelo de mantenimiento, las estrategias basadas en Salofalk® 3g/día son también dominantes para todos los escenarios considerados.
ConclusionesEl menor precio por gramo de Salofalk® hace que cualquier estrategia basada en Salofalk® sea más coste-efectiva que Mezavant® para el manejo de la CU leve-moderada, tanto para tratar el brote como para mantener la remisión.
The prevalence of ulcerative colitis (UC) and its associated economic burden is increasing in Spain. Oral mesalazines, which are the recommended first-line treatment for mild-moderate UC, show considerable variability in their formulations and prices.
ObjectiveTo carry out a cost-effectiveness assessment of the use of the two formulations of oral gastro-resistant modified-release mesalazine formulations marketed in Spain (Salofalk® and Mezavant®) for the phases of induction of remission and its maintenance.
MethodsWe adapted internationally validated economic models for the management of UC to the Spanish setting. The adaptation focused on the use of oral gastro-resistant modified-release mesalazines. We conducted cost minimization analyses of remission induction (decision tree) and remission maintenance (Markov model).
ResultsFor the remission induction, Salofalk® 3g/day was superior to (same effectiveness at lower costs) Mezavant® 3.6g/day and 4.8g/day in any treatment strategy that included oral gastro-resistant modified-release mesalazines. When compared with Mezavant® 2.4g/day, Salofalk® was the most cost-effective option. For remission maintenance, all treatment strategies using Salofalk® were the most cost-effective option in all the scenarios considered.
ConclusionBecause of the lower cost per gram of Salofalk®, any treatment strategy based on this drug is more cost-effective than Mezavant® for the treatment of mild-moderate UC, whether for the induction of remission or for its maintenance.
La colitis ulcerosa (CU) es una enfermedad inflamatoria crónica del tracto gastrointestinal, de etiología parcialmente conocida, que afecta fundamentalmente al colon1. La enfermedad cursa con brotes de actividad o recaídas, seguidos de periodos de remisión de duración imprevisible2,3. La gravedad y la extensión son variables entre los diversos pacientes4, y en el mismo paciente a lo largo del tiempo, lo que obliga a seleccionar estrategias de tratamiento diferentes adaptadas a cada una de estas situaciones clínicas5.
En España, al igual que en otros países europeos, se ha observado un aumento progresivo de las tasas de incidencia de la CU6, y se estima un total de 6-10 nuevos casos por cada 100.000 habitantes/año7-9, con un impacto cada vez mayor en la población más joven10. Dado el carácter crónico de la enfermedad y su baja mortalidad, las tasas de prevalencia se han incrementado considerablemente, así como la carga económica que supone esta enfermedad para el Sistema Nacional de Salud.
El objetivo fundamental del tratamiento de la CU es conseguir y mantener la remisión de la enfermedad. El tratamiento de los pacientes con CU de leve a moderada se basa fundamentalmente en el uso de derivados del ácido 5-aminosalicílico (5-ASA)4,11. En la actualidad existe amplia evidencia científica que avala la eficacia, la efectividad y la seguridad de la mesalazina como primera línea de tratamiento, tanto en el momento del brote como para el mantenimiento de la remisión en la CU de leve a moderada12-16. Por otro lado, se ha observado un aumento del coste total de esta enfermedad17, con gran variabilidad entre los diferentes países europeos18, y el impacto del diferente manejo de los derivados del 5-ASA en cada uno de estos países ha resultado ser un factor determinante19.
En la actualidad disponemos de una gran variedad de presentaciones, dosis, vías de administración, formulaciones y marcas de 5-ASA, que se diferencian principalmente por la forma de liberación de la mesalazina activa en el colon, así como por la dosis20. Sin embargo, en España, dentro de esta gran variedad y entre las presentaciones orales con indicación de uso en una única dosis diaria, solo Mezavant® (comprimidos de 1,2g) y Salofalk® (granulado disponible en varias dosis) combinan el ser simultáneamente gastrorresistentes y de liberación prolongada. Según lo expuesto en la última actualización de la Guía NICE para el tratamiento de la CU, la British National Formulary21 establece que las características de liberación de las diferentes preparaciones orales de mesalazina pueden variar, y que dichas preparaciones no deben considerarse intercambiables y, por tanto, deben compararse unas con otras de forma independiente. Los estudios y metaanálisis que comparan estas preparaciones gastrorresistentes de liberación prolongada12-16 demuestran que no existen diferencias en la efectividad o seguridad entre ellas, por lo que determinar el perfil de coste-efectividad es particularmente relevante para llevar a cabo una adecuada elección del tratamiento.
Por ello, el objetivo del presente estudio fue valorar el coste-efectividad comparado de las formulaciones gastrorresistentes y de liberación prolongada de mesalazina, Salofalk® con respecto a Mezavant®, en términos de minimización de costes para el tratamiento de los brotes y el mantenimiento de la remisión en la CU leve-moderada.
MétodosEl presente estudio incluye una evaluación económica mediante la adaptación a España de modelos previamente validados internacionalmente por expertos clínicos, representantes de la industria farmacéutica y autoridades reguladoras de precio y reembolso13. Dichos modelos de simulación de coste-efectividad ponen en relación la ganancia en salud, medida como utilidad, obtenida mediante intervenciones alternativas, con los costes incurridos para la obtención de dichos resultados con cada intervención. Las intervenciones alternativas que se compararon fueron las distintas preparaciones orales gastrorresistentes de acción prolongada de mesalazina de uso en una única dosis diaria para el tratamiento de pacientes con CU de leve a moderada en las fases de tratamiento del brote y de mantenimiento de la remisión. El estudio se inició con una búsqueda, revisión y síntesis bibliográfica de toda la información clínica y epidemiológica relativa a la CU y su manejo. En esta valoración se identificaron y seleccionaron 2 metaanálisis actualizados (las Guías de Práctica Clínica [GPC] de GETECCU12 y NICE13) y se constató que, aparte de estas publicaciones y las contenidas en sus revisiones, no existían referencias posteriores procedentes de ensayos clínicos que modificasen la evidencia sintetizada en las mismas. La evidencia sintetizada concluyó que las opciones terapéuticas objeto de esta evaluación no presentan diferencias en cuanto a eficacia, efectividad y seguridad en el manejo de la CU leve o moderada. Los resultados de la revisión fueron valorados y refrendados por 2 gastroenterólogos especializados en el tratamiento de esta enfermedad (J.P.G., F.G.). Teniendo en cuenta estas evidencias, se planteó un análisis de minimización de costes para evaluar si las opciones terapéuticas pueden asociarse a un consumo de recursos diferente. Para ello, y tras la revisión y valoración de los expertos, nos basamos en 2 modelos económicos propuestos en la GPC de NICE13, uno para el tratamiento del brote y otro para el mantenimiento de la remisión. Dichos modelos validados se han adaptado al entorno español y circunscrito al uso de las intervenciones aquí comparadas.
Como población de estudio se consideró a los pacientes con CU de leve a moderada izquierda o extensa, mayores de 18años, que son tratados con mesalazinas gastrorresistentes de liberación prolongada, usadas en una única toma diaria. El ámbito es España en 2014, y la perspectiva es la del Sistema Nacional de Salud, considerando únicamente los costes médicos directos.
Modelos para la valoración de coste-efectividadSe llevaron a cabo 2 modelos independientes para realizar la valoración de coste-efectividad de estas preparaciones, tanto en la fase de brote como en la fase de mantenimiento de la remisión. Ambos modelos difieren en su diseño, ya que el impacto del tiempo en el tratamiento en la modelización varía entre ellos y determina aproximaciones diferentes. La inducción de la remisión debe ser valorada en periodos necesariamente cortos, expresados en términos de semanas hasta la consecución del estado de remisión o, alternativamente, el ingreso hospitalario tras el fracaso terapéutico en sucesivas líneas de tratamiento. El cambio de tratamiento o el paso de un estado a otro no dependen del tiempo sino de la respuesta de los pacientes. Por ello, la modelización de la remisión del brote no implica ciclos temporales y se modelizó mediante árboles de decisión, cuya duración podría ser tanta como la estimada para llegar a alcanzar la secuencia de tratamientos más larga antes de la remisión. Por el contrario, en la fase de mantenimiento pueden observarse cambios de estado durante periodos de seguimiento regulares que son asimilables a modelos de riesgo proporcional, por lo que se modelizó en función de ciclos temporales mediante modelos de Markov.
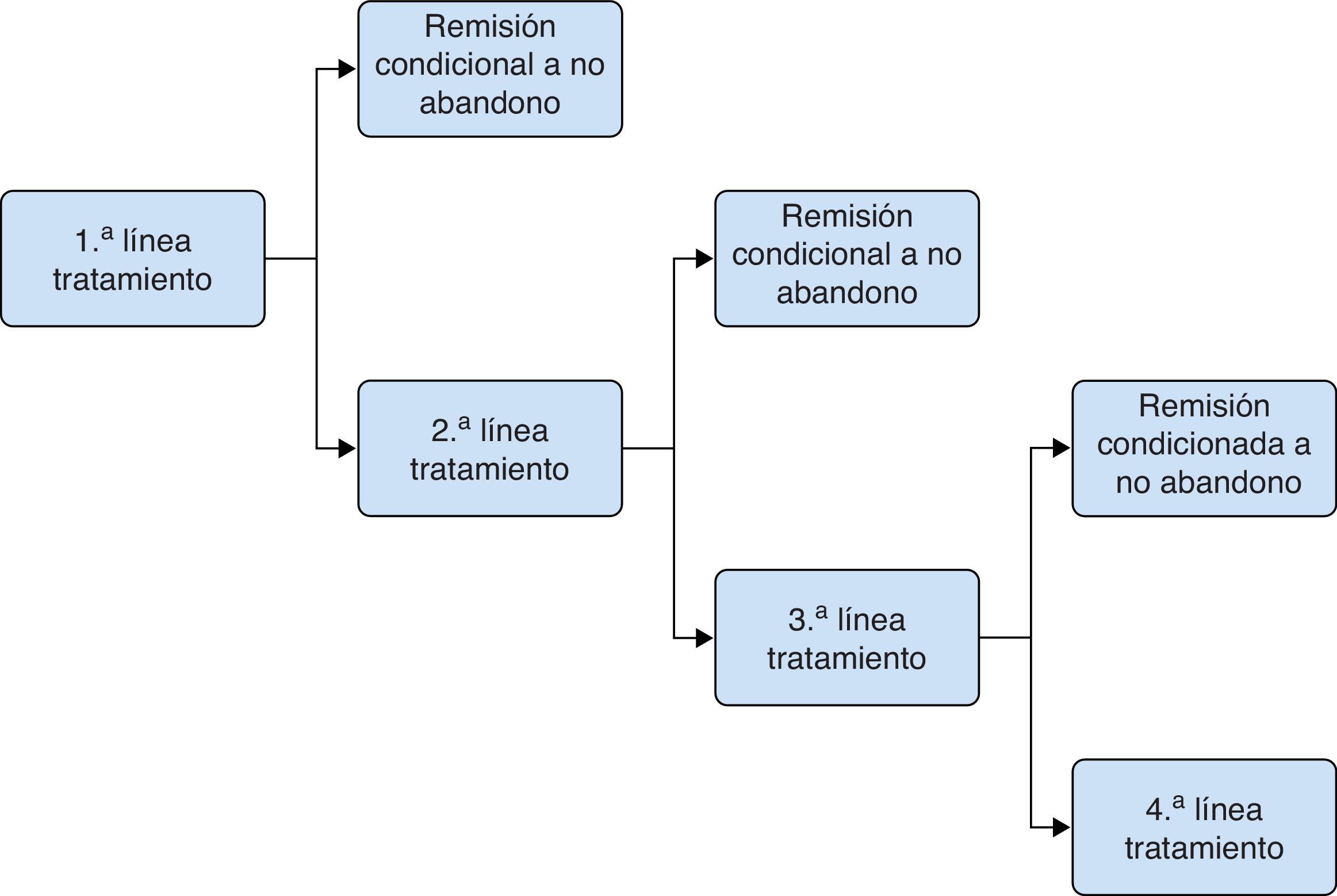
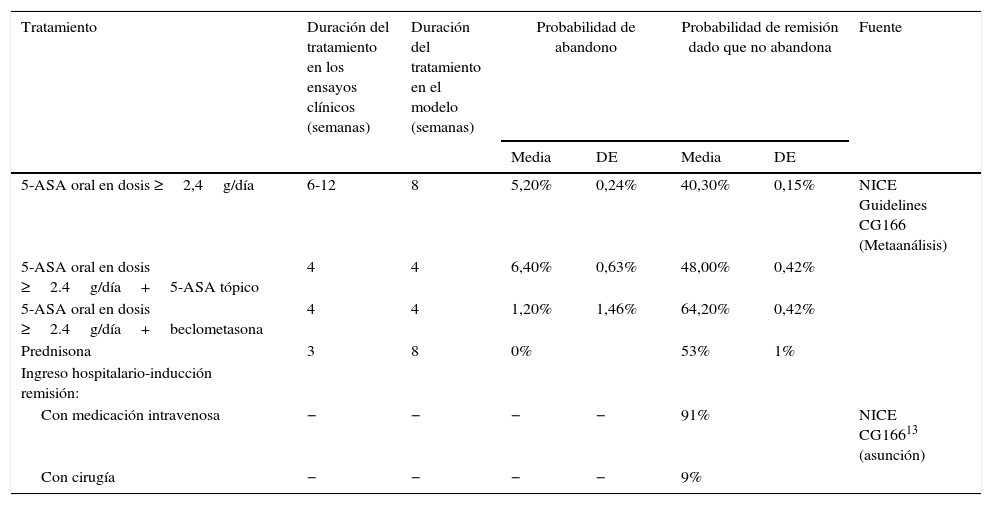
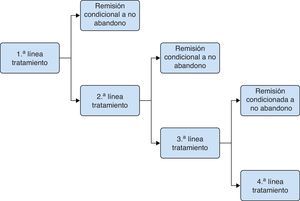
Modelo del tratamiento del broteEl objetivo terapéutico en el tratamiento del brote es conseguir la remisión y evitar que se produzca un ingreso hospitalario. Para conseguirlo, el paciente inicia tratamientos con una duración fija (4-8semanas, según la alternativa terapéutica), al cabo de la cual el paciente se evalúa nuevamente. Los resultados pueden ser la consecución de la remisión debido a continuar en tratamiento, el abandono del tratamiento con continuación del brote, o la continuación del brote estando en tratamiento. En caso de continuar el brote, el paciente cesa en esa línea de tratamiento e inicia una nueva línea de tratamiento con una duración determinada. En ningún caso los pacientes repiten la línea de tratamiento con la que estaban previamente. Se consideró un horizonte temporal de 20-24semanas. Para la modelización del tratamiento del brote se empleó un modelo de árbol de decisión probabilístico (fig. 1) en el que la inducción de la remisión se valoró en periodos cortos (semanas) hasta la consecución del estado de remisión o, alternativamente, el ingreso hospitalario tras el fracaso terapéutico de sucesivas líneas de tratamiento. El cambio de tratamiento o el paso de un estado a otro no dependen del tiempo sino de la respuesta de los pacientes. Las tasas de abandono de tratamiento y remisión se tomaron de los datos procedentes de la revisión sistemática y metaanálisis en red incluidos en la NICE Guidelines Development Group13, y se detallan en la tabla 1.
Tasas de abandono de tratamiento y remisión para el modelo de tratamiento del brote
| Tratamiento | Duración del tratamiento en los ensayos clínicos (semanas) | Duración del tratamiento en el modelo (semanas) | Probabilidad de abandono | Probabilidad de remisión dado que no abandona | Fuente | ||
|---|---|---|---|---|---|---|---|
| Media | DE | Media | DE | ||||
| 5-ASA oral en dosis ≥2,4g/día | 6-12 | 8 | 5,20% | 0,24% | 40,30% | 0,15% | NICE Guidelines CG166 (Metaanálisis) |
| 5-ASA oral en dosis ≥2.4g/día+5-ASA tópico | 4 | 4 | 6,40% | 0,63% | 48,00% | 0,42% | |
| 5-ASA oral en dosis ≥2.4g/día+beclometasona | 4 | 4 | 1,20% | 1,46% | 64,20% | 0,42% | |
| Prednisona | 3 | 8 | 0% | 53% | 1% | ||
| Ingreso hospitalario-inducción remisión: | |||||||
| Con medicación intravenosa | − | − | − | − | 91% | NICE CG16613 (asunción) | |
| Con cirugía | − | − | − | − | 9% | ||
La intervención a comparar era el tratamiento con Salofalk® 3g/día frente a cada una de las alternativas de tratamiento con Mezavant® a dosis ≥2g/día, según las recomendaciones actuales12: Mezavant® a dosis de 4,8, 3,6 o 2,4g/día. Dichas comparaciones se realizaron para 3 escenarios basados en diferentes estrategias de tratamiento con 5-ASA oral, tomadas de entre aquellas evaluadas en la guía NICE13, que incluyen el uso de mesalazinas a dosis ≥2g/día. Estrategia 1: 5-ASA oral (1.ª línea) → Prednisona (2.ª línea) → Hospitalización. Estrategia 2: 5-ASA oral (1.ª línea) → 5-ASA oral+5-ASA tópico (2.ª línea) → Prednisona (3.ª línea) → Hospitalización. Estrategia 3: 5-ASA oral (1.ª línea) → 5-ASA oral+beclometasona (2.ª línea) → Prednisona (3.ª línea) → Hospitalización.
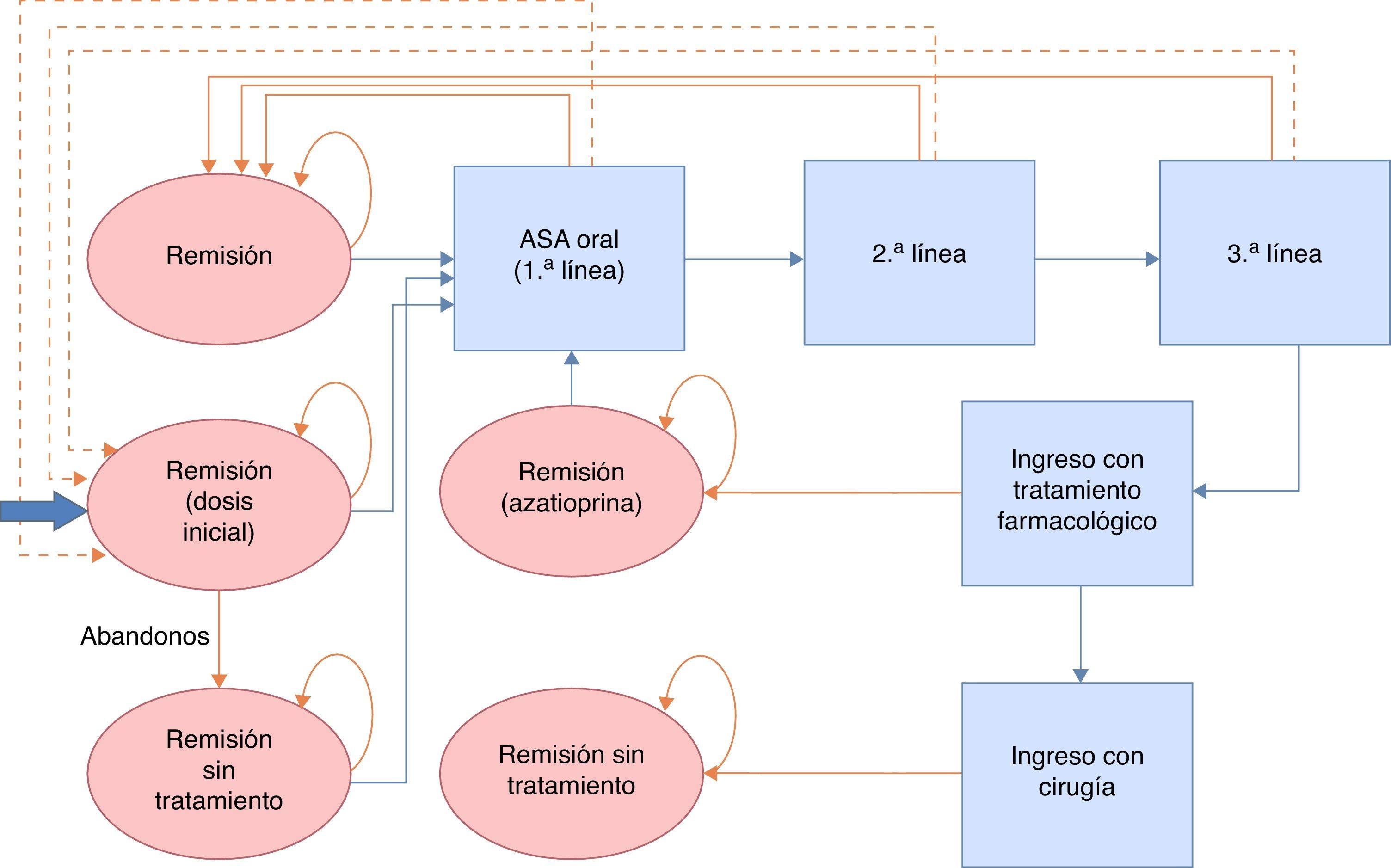
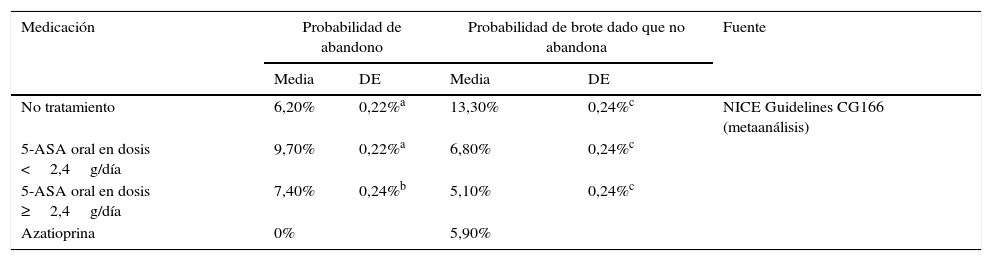
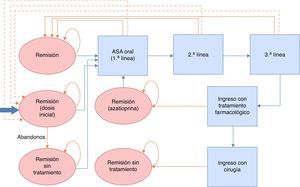
Modelo del mantenimiento de la remisiónEl objetivo terapéutico en los periodos en remisión es asegurar la continuidad en el tratamiento y evitar o retrasar que se produzca un brote. La continuidad en el tratamiento es función de la adhesión y de la aparición de brotes, y se evalúa en intervalos regulares de 2meses a lo largo de un periodo de seguimiento de 2años (correspondiente a la duración del ensayo clínico más largo publicado y siguiendo las directrices de la GPC de NICE13). En cada ciclo se valoran los abandonos o brotes que se producen y se considera que los pacientes restantes mantienen el tratamiento. Los pacientes que abandonan el tratamiento en un ciclo aumentan las probabilidades de tener un brote en la siguiente evaluación. En el caso de que el paciente estuviera en brote, se le incluyó en la estrategia de tratamiento de brote más coste-efectiva del modelo validado por NICE (la descrita como número3 en el modelo de brote) hasta conseguir la remisión. Tras la remisión, los pacientes empiezan una nueva línea de tratamiento de mantenimiento. Únicamente cuando la remisión se producía tras ingreso hospitalario se consideró administrar como tratamiento de mantenimiento azatioprina/mercaptopurina, siempre en caso de no requerir cirugía. En el caso de que los pacientes requirieran una intervención quirúrgica, se considera que los pacientes están curados y no reciben tratamiento de mantenimiento. Para la modelización del tratamiento para el mantenimiento de la remisión se llevó a cabo un modelo de Markov probabilístico (fig. 2). Las tasas de remisión se tomaron de los datos procedentes de la revisión sistemática y metaanálisis en red incluidos en la NICE Guidelines Development Group13 y se detallan en la tabla 2. Dado que la extensión del horizonte temporal es superior a un año, se ha aplicado una tasa de descuento anual del 3,5% sobre costes y resultados.
Tasas de abandono del tratamiento y remisión para el modelo de mantenimiento de la remisión
| Medicación | Probabilidad de abandono | Probabilidad de brote dado que no abandona | Fuente | ||
|---|---|---|---|---|---|
| Media | DE | Media | DE | ||
| No tratamiento | 6,20% | 0,22%a | 13,30% | 0,24%c | NICE Guidelines CG166 (metaanálisis) |
| 5-ASA oral en dosis <2,4g/día | 9,70% | 0,22%a | 6,80% | 0,24%c | |
| 5-ASA oral en dosis ≥2,4g/día | 7,40% | 0,24%b | 5,10% | 0,24%c | |
| Azatioprina | 0% | 5,90% | |||
Asunción a partir de la desviación estándar de la probabilidad de abandono estando en tratamiento con 5-ASA oral en dosis <2,4g/día aportada por NICE Guidelines CG166 para el modelo de brote.
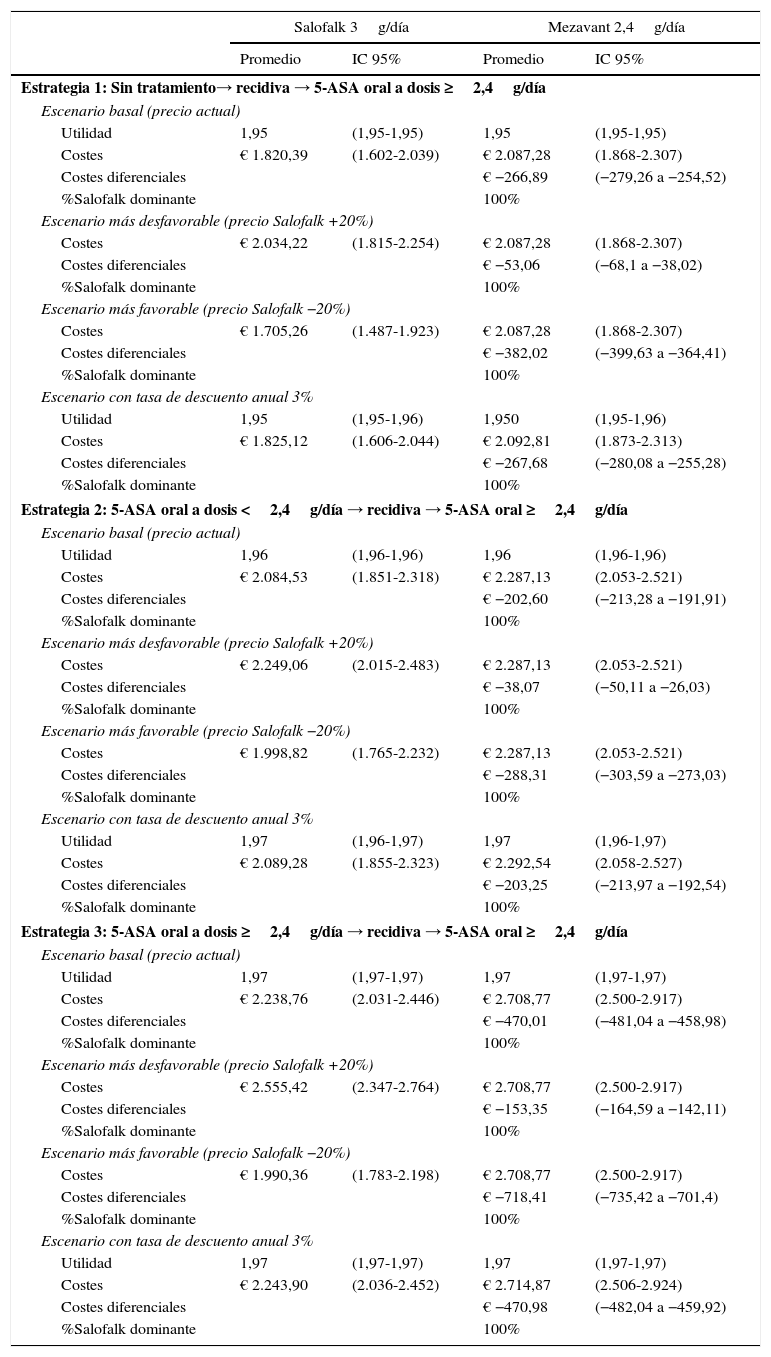
En este modelo se comparó el tratamiento con Salofalk® 3g/día frente a Mezavant® a las dosis de 2,4g/día según las 3 estrategias de tratamiento con 5-ASA orales detalladas en la guía NICE. Estrategia 1: sin tratamiento → recidiva → 5-ASA oral a dosis ≥2,4g/día. Estrategia 2: 5-ASA oral a dosis <2,4g/día → recidiva → 5-ASA oral a dosis ≥2,4g/día. Estrategia 3: 5-ASA oral a dosis ≥2,4g/día → recidiva → 5-ASA oral a dosis ≥2,4g/día.
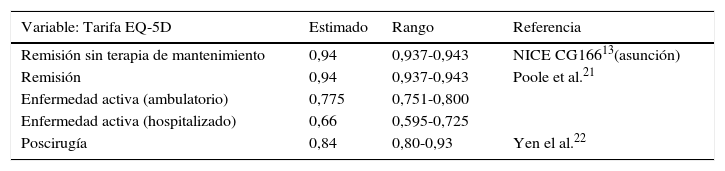
Efectividad: ganancia en saludLa efectividad, medida como cambio en una variable que mide los resultados de salud, puede ser expresada como ganancia (o pérdida) en salud. La ganancia en salud en ambos modelos se midió en términos de utilidad, que es una aproximación al valor que le otorgan los individuos de una población a un estado de salud expresando sus preferencias mediante la imputación de un valor de calidad de vida a determinados estados de salud. La medida de utilidad más comúnmente utilizada en salud son «los años de vida ganados ajustados por calidad de vida relacionada con la salud» (AVAC). Su cálculo se realizó por cada tratamiento y estrategia, a partir de la diferencia en los valores del estado de salud del que se parte y al que se llega, ajustado por el tiempo transcurrido en cada uno de los estados, medido en años. Los estados de salud asociados a los distintos valores de utilidad son la remisión, la enfermedad activa con carácter ambulatorio (leve o moderada), la enfermedad activa que requiere hospitalización (agudización) y la recuperación post-cirugía. Los valores para la simulación de las distribuciones se tomaron de los datos procedentes de la revisión sistemática y metaanálisis en red incluidos en la NICE Guidelines Development Group13,22,23 y se detallan en la tabla 3.
Valores estimados para la simulación de las distribuciones de los estados de salud asociados a los distintos valores de utilidad
| Variable: Tarifa EQ-5D | Estimado | Rango | Referencia |
|---|---|---|---|
| Remisión sin terapia de mantenimiento | 0,94 | 0,937-0,943 | NICE CG16613(asunción) |
| Remisión | 0,94 | 0,937-0,943 | Poole et al.21 |
| Enfermedad activa (ambulatorio) | 0,775 | 0,751-0,800 | |
| Enfermedad activa (hospitalizado) | 0,66 | 0,595-0,725 | |
| Poscirugía | 0,84 | 0,80-0,93 | Yen el al.22 |
El cálculo del coste asociado a las diferentes alternativas terapéuticas incluyó los costes médicos directos, procedentes de los costes de la intervención farmacológica y los costes del manejo clínico de la CU. El coste de los tratamientos se obtuvo mediante distintas aproximaciones. Para Salofalk® y Mezavant®, se obtuvo a partir de calcular el número de cajas necesarias para cubrir el total de dosis diarias necesarias en cada caso. Para los medicamentos con una única presentación comercial (beclometasona, azatioprina, mercaptopurina), el coste se obtuvo a partir de imputar el coste/día al total del periodo considerado. Para los medicamentos con diferentes presentaciones (mesalazinas tópicas, prednisona oral) se obtuvo a partir de calcular el promedio del coste de la dosis diaria de todas las presentaciones según su ficha técnica, e imputarlo al total de días del periodo considerado. En todos los casos, el precio a imputar se obtuvo de bases de datos secundarias24. Los costes unitarios de los medicamentos empleados para el presente modelo se presentan en la tabla 1 del material suplementario.
La frecuencia de uso de las consultas y de las pruebas de laboratorio por periodo de tiempo para cada modelo fue adaptada por expertos clínicos al entorno español a partir de los modelos de NICE (tabla 2 del material suplementario). Los costes del manejo clínico incluyeron los costes de las consultas (gastroenterólogo especialista, enfermera especializada en persona y telefónicamente, médico de atención primaria y enfermería de atención primaria), el coste de las pruebas de laboratorio (recuento sanguíneo y hemograma, pruebas de función renal y hepática y prueba de tiopurina metiltransferasa para pacientes con tratamiento con azatioprina/mercaptopurina) y los costes de hospitalización (tabla 3 del material suplementario).
Los costes de monitorización y pruebas se obtuvieron mediante la estimación del promedio nacional a partir de los precios de los boletines de las distintas comunidades autónomas y se actualizaron para 2014, teniendo en cuenta la tasa de inflación interanual25-31. Los gastos hospitalarios se estimaron considerando los grupos relacionados de diagnóstico (GRD), cuya información se obtuvo de los recursos sanitarios de hospitalización a partir del conjunto mínimo básico de datos de 2012 (CMBD)32, actualizado a precio de 2014. Para la hospitalización sin cirugía se utilizó el GRD179 (enfermedad inflamatoria intestinal). Para la hospitalización con cirugía, se consideró la media de los precios de los GRD148, 149, 152 y 153 (procedimientos mayores y menores de intestino delgado y grueso con y sin complicaciones), ponderada por el porcentaje de uso en 2012.
En cada modelo se calcularon los costes asociados a cada intervención y los costes diferenciales que resultaron al comparar las intervenciones. Además, para hacer posible la comparación, se consideró la expresión de la relación coste-efectividad de cada intervención en cada estrategia en términos de beneficio monetario neto (BMN). El BMN convierte la ganancia en salud (AVAC) en unidades monetarias (€) tras aplicarle un valor a la unidad de ganancia en salud (€/AVAC), y calcula el balance entre ese beneficio y el coste incurrido para obtenerlo (BMN [€]=(Utilidad obtenida [AVAC]×Umbral de eficiencia [€/AVAC])−Costes [€]). El valor asignado a la ganancia en salud se conoce como umbral de eficiencia, y es un valor o una serie de valores arbitrarios que la sociedad acepta como límites por debajo de los cuales la intervención es socialmente asumible para obtener esos resultados. El umbral utilizado en este caso fue de 30.000€/AVAC.
Asunciones en ambos modelosPara incorporar la variabilidad procedente de la incertidumbre alrededor de los valores imputados se ha asumido una aproximación probabilística. Las distribuciones consideradas en la modelización han sido: una distribución lognormal para los efectos del tratamiento (probabilidades de transición), las ponderaciones de utilidad y los costes de referencia. Para las probabilidades (dicotómicas) de transición/uso de un recurso sin información relativa a la desviación estándar (DE), se asumió una distribución beta con el valor de la probabilidad como promedio y su correspondiente DE calculada a partir de la fórmula: DE=RAIZ[(p*(1-p))/n]. Finalmente, para obtener los costes de hospitalización se asumió una distribución gamma (tabla 3 del material suplementario).
Para el modelo de tratamiento del brote, la variación en la distribución del número de pruebas de analítica sanguínea y función renal para la monitorización posterior al inicio del tratamiento con 5-ASA se modelizó mediante una distribución triangular con valores de mínimo 0, media 1 y máximo 3 por un periodo de 8semanas.
Para el modelo de mantenimiento de la remisión no se han descrito valores de la DE alrededor de la media en la GPC, por lo que de manera exploratoria se asumió la misma DE que en el modelo de brote (DE=0,22) para la probabilidad de abandono de tratamiento en pacientes no tratados y para los tratados con mesalazina a dosis <2,4g/día, DE=0,24 para los pacientes tratados con cualquier otro medicamento, y para la probabilidad de brote estando en tratamiento se ha asumido en todos los casos la misma DE (DE=0,24).
Para el modelo de tratamiento del brote se asumió que la remisión se produce en el momento intermedio dentro de cada periodo de línea de tratamiento, y para el cálculo del uso de recursos se asumió que el tratamiento dura todo el periodo, pero el resto de recursos médicos solamente se utiliza durante la primera mitad del periodo.
El coste de los medicamentos comparados (Salofalk® y Mezavant®) se consideró como un valor fijo determinado por la cantidad de días en tratamiento, y no formando parte de la simulación probabilística. Para el resto de tratamientos, el coste se obtuvo a partir de distribuciones lognormal calculadas a partir del valor medio y la DE de los precios de los medicamentos de esa denominación en el mercado español. La adhesión al tratamiento se consideró en todos los casos el 100%.
Análisis de sensibilidadPara evaluar la robustez de los resultados y su sensibilidad a la variación de ciertos parámetros se realizaron análisis de sensibilidad de una vía. Se realizaron, para ambos modelos, análisis de escenarios para un coste de Salofalk® de ±20% con respecto al actual. Además, para el modelo de mantenimiento se llevó a cabo un análisis de sensibilidad considerando una tasa de descuento anual alternativa del 3,0%33.
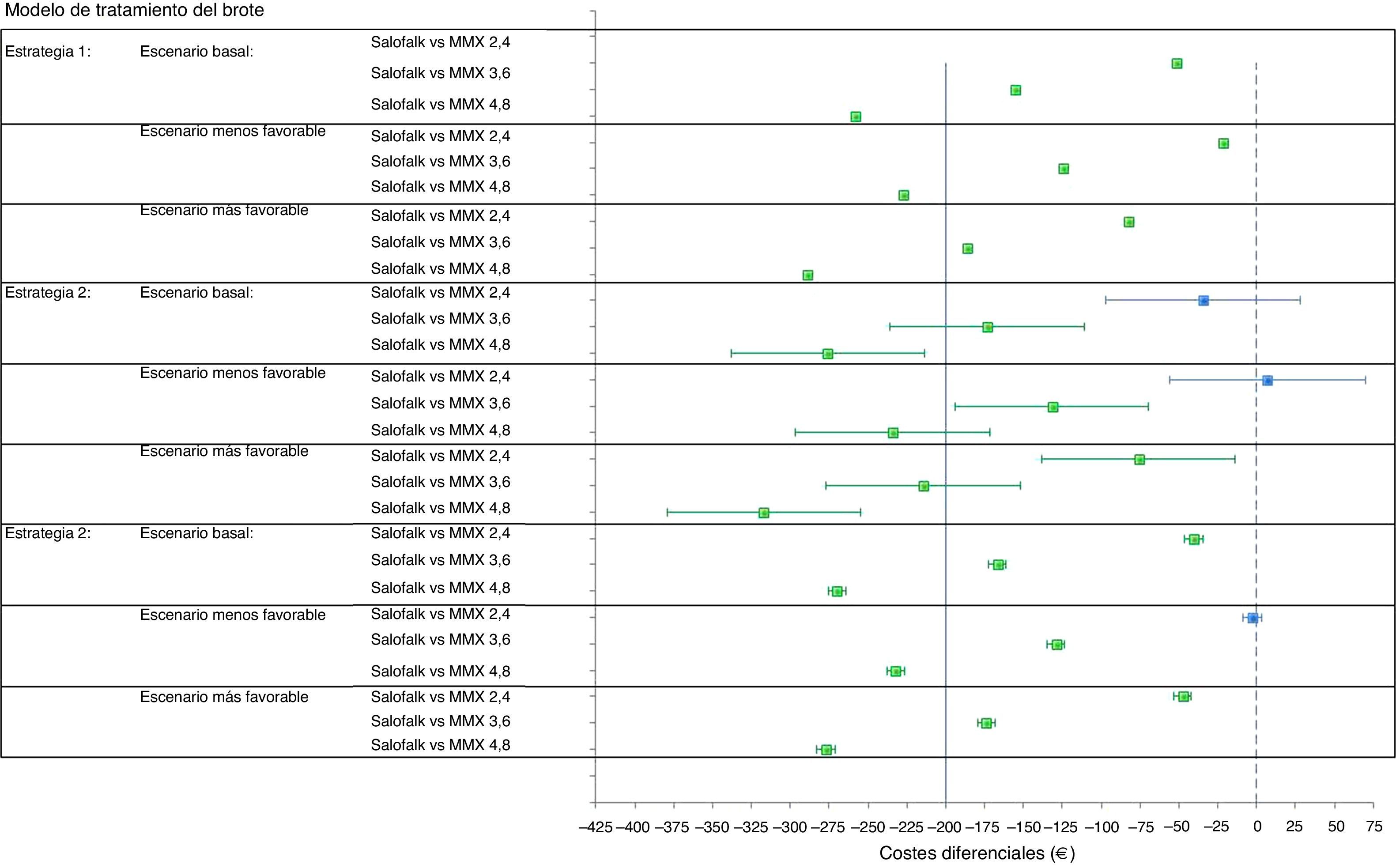
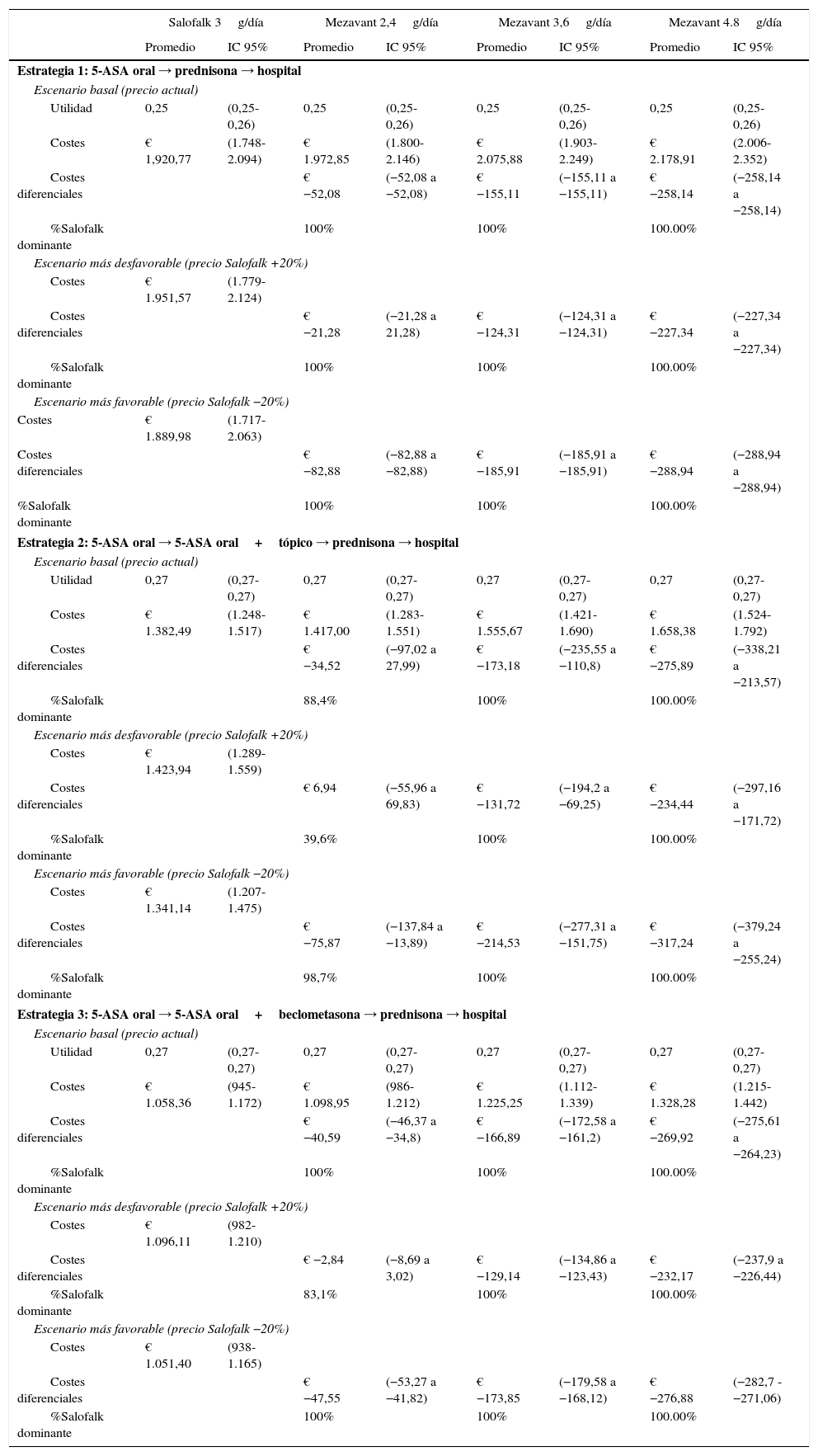
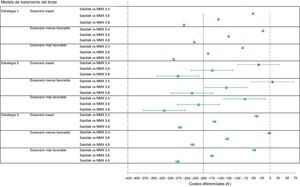
ResultadosModelo del tratamiento del broteConsiderando el escenario basal, en el que se aplican los precios actuales de los medicamentos comparados, el coste diferencial por paciente de tratar con Salofalk® 3g/día con respecto a Mezavant® 4,8g/día supuso un ahorro de 258€ en un periodo de 20-24semanas cuando se consideró la estrategia1 de tratamiento, 276€ (IC95%: 214-338) en la estrategia2 y 270€ (IC95%: 264-276) en la estrategia3. Salofalk® 3g/día ofreció siempre iguales o mejores resultados de ganancia en salud a un coste inferior que Mezavant® 4,8g/día; es decir, Salofalk® 3g/día dominó en el 100% de las simulaciones en las 3 estrategias. Al comparar Salofalk® 3g/día con Mezavant® 3,6g/día, el ahorro fue de 152€ en la estrategia1, 173€ (IC95%: 111-236) en la estrategia 2 y 167€ (IC95%; 161-173) en la estrategia3. En todas las estrategias, Salofalk® 3g/día dominó a Mezavant® 3,6g/día en el 100% de las simulaciones. Al comparar Salofalk® 3g/día con Mezavant® 2,4g/día, el ahorro que se consiguió en la estrategia1 fue de 52€; de 36€ (IC95%: 28-97) en la estrategia2, y de 41€ (IC95%: 35-46) en la estrategia 3. Salofalk® 3g/día dominó a Mezavant® 2,4g/día en el 100% de las simulaciones en las estrategias1 y 3, y fue más coste-efectiva en un 88% de las simulaciones para la estrategia 2. La estrategia más coste-efectiva con mayor BMN fue la estrategia 3, en la que Salofalk® 3g/día resultó más coste-efectivo que cualquiera de las posologías de Mezavant® y, dentro de cada estrategia, Salofalk® 3g/día fue la opción más coste-efectiva entre todas las comparadas (tabla 4 y fig. 3).
Resultados del modelo de tratamiento del brote y análisis de sensibilidad: utilidad, costes totales, costes diferenciales (Salofalk-Mezavant) y porcentaje de dominancia
| Salofalk 3g/día | Mezavant 2,4g/día | Mezavant 3,6g/día | Mezavant 4.8g/día | |||||
|---|---|---|---|---|---|---|---|---|
| Promedio | IC 95% | Promedio | IC 95% | Promedio | IC 95% | Promedio | IC 95% | |
| Estrategia 1: 5-ASA oral → prednisona → hospital | ||||||||
| Escenario basal (precio actual) | ||||||||
| Utilidad | 0,25 | (0,25-0,26) | 0,25 | (0,25-0,26) | 0,25 | (0,25-0,26) | 0,25 | (0,25-0,26) |
| Costes | € 1,920,77 | (1.748-2.094) | € 1.972,85 | (1.800-2.146) | € 2.075,88 | (1.903-2.249) | € 2.178,91 | (2.006-2.352) |
| Costes diferenciales | € −52,08 | (−52,08 a −52,08) | € −155,11 | (−155,11 a −155,11) | € −258,14 | (−258,14 a −258,14) | ||
| %Salofalk dominante | 100% | 100% | 100.00% | |||||
| Escenario más desfavorable (precio Salofalk +20%) | ||||||||
| Costes | € 1.951,57 | (1.779-2.124) | ||||||
| Costes diferenciales | € −21,28 | (−21,28 a 21,28) | € −124,31 | (−124,31 a −124,31) | € −227,34 | (−227,34 a −227,34) | ||
| %Salofalk dominante | 100% | 100% | 100.00% | |||||
| Escenario más favorable (precio Salofalk −20%) | ||||||||
| Costes | € 1.889,98 | (1.717-2.063) | ||||||
| Costes diferenciales | € −82,88 | (−82,88 a −82,88) | € −185,91 | (−185,91 a −185,91) | € −288,94 | (−288,94 a −288,94) | ||
| %Salofalk dominante | 100% | 100% | 100.00% | |||||
| Estrategia 2: 5-ASA oral → 5-ASA oral+tópico → prednisona → hospital | ||||||||
| Escenario basal (precio actual) | ||||||||
| Utilidad | 0,27 | (0,27-0,27) | 0,27 | (0,27-0,27) | 0,27 | (0,27-0,27) | 0,27 | (0,27-0,27) |
| Costes | € 1.382,49 | (1.248-1.517) | € 1.417,00 | (1.283-1.551) | € 1.555,67 | (1.421-1.690) | € 1.658,38 | (1.524-1.792) |
| Costes diferenciales | € −34,52 | (−97,02 a 27,99) | € −173,18 | (−235,55 a −110,8) | € −275,89 | (−338,21 a −213,57) | ||
| %Salofalk dominante | 88,4% | 100% | 100.00% | |||||
| Escenario más desfavorable (precio Salofalk +20%) | ||||||||
| Costes | € 1.423,94 | (1.289-1.559) | ||||||
| Costes diferenciales | € 6,94 | (−55,96 a 69,83) | € −131,72 | (−194,2 a −69,25) | € −234,44 | (−297,16 a −171,72) | ||
| %Salofalk dominante | 39,6% | 100% | 100.00% | |||||
| Escenario más favorable (precio Salofalk −20%) | ||||||||
| Costes | € 1.341,14 | (1.207-1.475) | ||||||
| Costes diferenciales | € −75,87 | (−137,84 a −13,89) | € −214,53 | (−277,31 a −151,75) | € −317,24 | (−379,24 a −255,24) | ||
| %Salofalk dominante | 98,7% | 100% | 100.00% | |||||
| Estrategia 3: 5-ASA oral → 5-ASA oral+beclometasona → prednisona → hospital | ||||||||
| Escenario basal (precio actual) | ||||||||
| Utilidad | 0,27 | (0,27-0,27) | 0,27 | (0,27-0,27) | 0,27 | (0,27-0,27) | 0,27 | (0,27-0,27) |
| Costes | € 1.058,36 | (945-1.172) | € 1.098,95 | (986-1.212) | € 1.225,25 | (1.112-1.339) | € 1.328,28 | (1.215-1.442) |
| Costes diferenciales | € −40,59 | (−46,37 a −34,8) | € −166,89 | (−172,58 a −161,2) | € −269,92 | (−275,61 a −264,23) | ||
| %Salofalk dominante | 100% | 100% | 100.00% | |||||
| Escenario más desfavorable (precio Salofalk +20%) | ||||||||
| Costes | € 1.096,11 | (982-1.210) | ||||||
| Costes diferenciales | € −2,84 | (−8,69 a 3,02) | € −129,14 | (−134,86 a −123,43) | € −232,17 | (−237,9 a −226,44) | ||
| %Salofalk dominante | 83,1% | 100% | 100.00% | |||||
| Escenario más favorable (precio Salofalk −20%) | ||||||||
| Costes | € 1.051,40 | (938-1.165) | ||||||
| Costes diferenciales | € −47,55 | (−53,27 a −41,82) | € −173,85 | (−179,58 a −168,12) | € −276,88 | (−282,7 - −271,06) | ||
| %Salofalk dominante | 100% | 100% | 100.00% | |||||
Considerando un escenario en el que Salofalk® fuera un 20% más caro que su precio actual mientras que Mezavant® conservaría su precio actual, Salofalk® 3g/día seguiría siendo un tratamiento dominante frente a cualquier estrategia que incluyese Mezavant® a dosis de 3,6 o 4,8g/día en el 100% de las simulaciones, con ahorros por paciente que van desde un mínimo de 69€ (límite inferior del IC95% para la comparación con Mezavant® 3,6g/día en la estrategia2) a un máximo de 297€ (límite superior del IC95% para la comparación con Mezavant® 4,8g/día en la estrategia2) trascurridas 20-24semanas de tratamiento. Sin embargo, en la comparación con Mezavant® 2,4g/día, dado que la duración del tratamiento combinado de mesalazina oral y tópica incluida en el modelo es de 4semanas y se requiere una única caja de Mezavant® para ese periodo a esa dosis, las diferencias se reducen: Salofalk® seguiría siendo dominante en el 100% de simulaciones en la estrategia1; pasaría a ser más coste-efectiva en el 83% de simulaciones en la estrategia3, y obtendría resultados de eficiencia similares en la estrategia2, con un 40% de resultados a favor y un IC95% que incluye resultados a favor y en contra, arrojando un promedio de un mayor coste de 7€ por paciente de diferencia.
Cuando se considera el escenario en el que Salofalk® fuera un 20% más barato que su precio actual mientras que Mezavant® conservara su precio actual, no hay estrategia ni simulación en la que Salofalk® 3g/día no ofrezca iguales resultados de ganancia en salud a un coste inferior que Mezavant® 4,8, 3,6 o 2,4g/día.
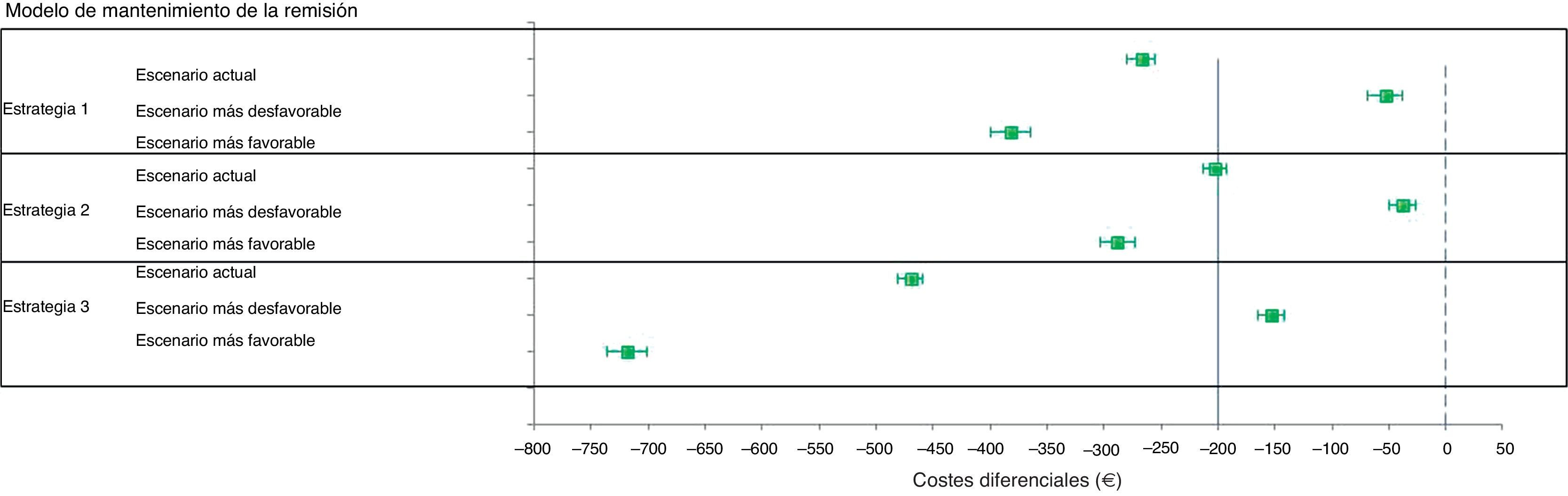
Modelo de mantenimiento de la remisiónEl ahorro promedio por paciente que se produce en 2años de tratamiento de mantenimiento en el escenario basal, con los precios actuales de tratamiento, usando Salofalk® 3g/día respecto a Mezavant® 2,4g/día, varía entre los 203€ (IC95%: 192-213) en la estrategia2 y los 470€ (IC95%: 459-481) en la estrategia3, y ofrece siempre iguales resultados de ganancia en salud a un coste inferior que Mezavant® 2,4g/día; es decir, es dominante en el 100% en todas las estrategias y simulaciones (tabla 5).
Resultados del modelo de tratamiento de mantenimiento de la remisión y análisis de sensibilidad: utilidad, costes totales, costes diferenciales y porcentaje de dominancia
| Salofalk 3g/día | Mezavant 2,4g/día | |||
|---|---|---|---|---|
| Promedio | IC 95% | Promedio | IC 95% | |
| Estrategia 1: Sin tratamiento→ recidiva → 5-ASA oral a dosis ≥2,4g/día | ||||
| Escenario basal (precio actual) | ||||
| Utilidad | 1,95 | (1,95-1,95) | 1,95 | (1,95-1,95) |
| Costes | € 1.820,39 | (1.602-2.039) | € 2.087,28 | (1.868-2.307) |
| Costes diferenciales | € −266,89 | (−279,26 a −254,52) | ||
| %Salofalk dominante | 100% | |||
| Escenario más desfavorable (precio Salofalk +20%) | ||||
| Costes | € 2.034,22 | (1.815-2.254) | € 2.087,28 | (1.868-2.307) |
| Costes diferenciales | € −53,06 | (−68,1 a −38,02) | ||
| %Salofalk dominante | 100% | |||
| Escenario más favorable (precio Salofalk −20%) | ||||
| Costes | € 1.705,26 | (1.487-1.923) | € 2.087,28 | (1.868-2.307) |
| Costes diferenciales | € −382,02 | (−399,63 a −364,41) | ||
| %Salofalk dominante | 100% | |||
| Escenario con tasa de descuento anual 3% | ||||
| Utilidad | 1,95 | (1,95-1,96) | 1,950 | (1,95-1,96) |
| Costes | € 1.825,12 | (1.606-2.044) | € 2.092,81 | (1.873-2.313) |
| Costes diferenciales | € −267,68 | (−280,08 a −255,28) | ||
| %Salofalk dominante | 100% | |||
| Estrategia 2: 5-ASA oral a dosis <2,4g/día → recidiva → 5-ASA oral ≥2,4g/día | ||||
| Escenario basal (precio actual) | ||||
| Utilidad | 1,96 | (1,96-1,96) | 1,96 | (1,96-1,96) |
| Costes | € 2.084,53 | (1.851-2.318) | € 2.287,13 | (2.053-2.521) |
| Costes diferenciales | € −202,60 | (−213,28 a −191,91) | ||
| %Salofalk dominante | 100% | |||
| Escenario más desfavorable (precio Salofalk +20%) | ||||
| Costes | € 2.249,06 | (2.015-2.483) | € 2.287,13 | (2.053-2.521) |
| Costes diferenciales | € −38,07 | (−50,11 a −26,03) | ||
| %Salofalk dominante | 100% | |||
| Escenario más favorable (precio Salofalk −20%) | ||||
| Costes | € 1.998,82 | (1.765-2.232) | € 2.287,13 | (2.053-2.521) |
| Costes diferenciales | € −288,31 | (−303,59 a −273,03) | ||
| %Salofalk dominante | 100% | |||
| Escenario con tasa de descuento anual 3% | ||||
| Utilidad | 1,97 | (1,96-1,97) | 1,97 | (1,96-1,97) |
| Costes | € 2.089,28 | (1.855-2.323) | € 2.292,54 | (2.058-2.527) |
| Costes diferenciales | € −203,25 | (−213,97 a −192,54) | ||
| %Salofalk dominante | 100% | |||
| Estrategia 3: 5-ASA oral a dosis ≥2,4g/día → recidiva → 5-ASA oral ≥2,4g/día | ||||
| Escenario basal (precio actual) | ||||
| Utilidad | 1,97 | (1,97-1,97) | 1,97 | (1,97-1,97) |
| Costes | € 2.238,76 | (2.031-2.446) | € 2.708,77 | (2.500-2.917) |
| Costes diferenciales | € −470,01 | (−481,04 a −458,98) | ||
| %Salofalk dominante | 100% | |||
| Escenario más desfavorable (precio Salofalk +20%) | ||||
| Costes | € 2.555,42 | (2.347-2.764) | € 2.708,77 | (2.500-2.917) |
| Costes diferenciales | € −153,35 | (−164,59 a −142,11) | ||
| %Salofalk dominante | 100% | |||
| Escenario más favorable (precio Salofalk −20%) | ||||
| Costes | € 1.990,36 | (1.783-2.198) | € 2.708,77 | (2.500-2.917) |
| Costes diferenciales | € −718,41 | (−735,42 a −701,4) | ||
| %Salofalk dominante | 100% | |||
| Escenario con tasa de descuento anual 3% | ||||
| Utilidad | 1,97 | (1,97-1,97) | 1,97 | (1,97-1,97) |
| Costes | € 2.243,90 | (2.036-2.452) | € 2.714,87 | (2.506-2.924) |
| Costes diferenciales | € −470,98 | (−482,04 a −459,92) | ||
| %Salofalk dominante | 100% | |||
En el escenario con Salofalk® un 20% más caro y Mezavant® al mismo precio que el actual, no cambia el grado de dominancia de Salofalk® 3g/día (ofrece siempre iguales resultados de ganancia en salud a un coste inferior), aunque el ahorro que se produce por paciente en 2años se ve reducido a valores de entre 38€ (IC95%: 26-50) en la estrategia2 y 153€ (IC95%: 142-165) en la estrategia3.
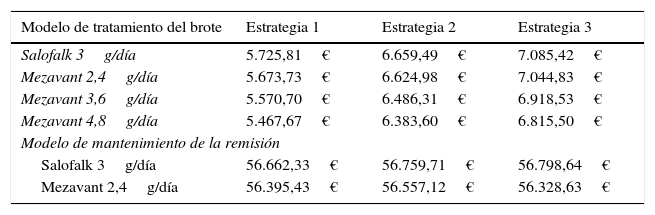
Las estrategias basadas en Salofalk® 3g/día fueron las estrategias dominantes, y Salofalk® 3g/día constituyó la elección más coste-efectiva (mayor BMN) en todas las estrategias comparadas (tabla 6 y figs. 3 y 4). Entre todas las opciones de tratamiento para el mantenimiento de la remisión, la estrategia más coste-efectiva con mayor BMN fue la 3 (fig. 4).
Beneficio monetario neto por paciente para un umbral de 30.000 euros/QALY en el modelo de tratamiento del brote y en el modelo de mantenimiento de la remisión
| Modelo de tratamiento del brote | Estrategia 1 | Estrategia 2 | Estrategia 3 |
|---|---|---|---|
| Salofalk 3g/día | 5.725,81€ | 6.659,49€ | 7.085,42€ |
| Mezavant 2,4g/día | 5.673,73€ | 6.624,98€ | 7.044,83€ |
| Mezavant 3,6g/día | 5.570,70€ | 6.486,31€ | 6.918,53€ |
| Mezavant 4,8g/día | 5.467,67€ | 6.383,60€ | 6.815,50€ |
| Modelo de mantenimiento de la remisión | |||
| Salofalk 3g/día | 56.662,33€ | 56.759,71€ | 56.798,64€ |
| Mezavant 2,4g/día | 56.395,43€ | 56.557,12€ | 56.328,63€ |
La CU es una enfermedad cada vez más frecuente en España, y los últimos datos publicados muestran un aumento de la prevalencia, que en 2014 llega a afectar a 100/100.000 habitantes7. Dentro de esta enfermedad, la CU de leve a moderada representa la mayoría de los pacientes tratados en España9, por lo que establecer el tratamiento más coste-efectivo podría tener una gran repercusión sobre la carga económica asociada a ella.
Los 5-ASA son, con diferencia, los fármacos que han demostrado mayor efectividad en este grupo de pacientes, tal y como demuestran los artículos publicados más recientemente respecto al manejo de la CU. Dentro de estas publicaciones destacan la GPC de GETECCU12, la GPC sobre el manejo en general de la CU publicada por el National Institute for Clinical Excellence (NICE) del Sistema Público de Salud inglés en 201313, y 2 revisiones Cochrane publicadas en 201214,15. Estas publicaciones constituyen los metaanálisis más actuales en los que se evalúa tanto la eficacia como la seguridad de los distintos tratamientos para las diferentes presentaciones de la enfermedad (remisión y mantenimiento) e incluyen la comparación entre formulaciones gastrorresistentes de liberación prolongada o no, comparación entre dosificaciones, comparación entre pautas de dosis única o múltiple, así como el análisis de los distintos tratamientos de manera agregada.
Para el abordaje de un estudio de evaluación económica como el planteado, la GPC de NICE aportó una revisión y valoración de las evaluaciones económicas publicadas para el tratamiento de la CU y la elaboración de 2 nuevos modelos de evaluación económica para distintos manejos de la enfermedad en sus distintas formas. Además, se trata de un documento consensuado, ya que ha sido objeto de consulta y de revisión pública en la que participaron activamente, además de otros agentes, las compañías farmacéuticas fabricantes de los medicamentos evaluados. Tomando como base estas evidencias, el presente estudio aporta una adaptación de los modelos al entorno español y se centra específicamente en el manejo de la enfermedad con las formulaciones gastrorresistentes y de liberación prolongada de mesalazina de uso en una única dosis diaria. Los estudios más recientes señalan que la administración en una sola dosis diaria es al menos tan eficaz y segura como el empleo de dosis múltiples repartidas para inducir la remisión en pacientes con CU de leve a moderada34,35, y por su mayor facilidad de cumplimiento podría ser incluso más efectiva36. Además, los estudios de preferencia de los pacientes indican una predilección por el tratamiento con una única dosis diaria frente al tratamiento convencional de varias dosis al día34.
Cuando se analiza la importancia de la dosis en este grupo de fármacos para el tratamiento de un brote de CU, la Guía GETECCU12 señala la existencia de una tendencia a una mayor tasa de remisión con un aumento de la dosis de los salicilatos orales, y especifica que cuando la variable analizada es la remisión endoscópica, las dosis ≥3g/día son más eficaces. Por ello, recomienda el uso de estos fármacos para la inducción de la remisión del paciente con brote leve-moderado de CU a dosis mínima de 2,4g/día y probablemente óptima ≥3g/día en una única dosis diaria. Respecto a la dosis de mantenimiento con estas formulaciones, el estudio de Kruis et al.37 sugiere (con evidencia moderada según la clasificación GRADE) que una toma de 3g/día de Salofalk® es superior a 1,5g/día, sin observar diferencias significativas en la seguridad entre ambos grupos. Los estudios que comparan las diferentes dosis de Mezavant® (2,4, 3,2 y 4,8g) para el tratamiento del brote de la CU no han demostrado diferencias significativas respecto a la remisión clínica, pero se ha observado una tendencia a una mayor remisión endoscópica con las dosis más altas, aunque las diferencias no alcanzaron significación estadística13.
Teniendo en cuenta todos estos aspectos, y de acuerdo con los resultados obtenidos, el tratamiento con Salofalk® 3g se asociaría en la práctica clínica en España a menores costes totales que el tratamiento con Mezavant® 2,4, 3,2 y 4,8g, tanto en el tratamiento del brote como en el mantenimiento de la remisión. Además, al relacionar los costes incurridos con la efectividad obtenida con cada tratamiento, los resultados señalan un beneficio monetario neto que favorece a Salofalk® 3g en todos los escenarios clínicos y estrategias consideradas. En consecuencia, el uso de Salofalk® 3g en lugar de Mezavant® supondría un ahorro para el Sistema Nacional de Salud, a la vez que se mantendría la efectividad.
Como limitación para la interpretación de los resultados obtenidos, cabe señalar que el presente estudio adapta modelos que incluyen un abordaje global de la CU leve a moderada con sus distintos manejos y tratamientos, y no están específicamente centrados en las mesalazinas. Consecuentemente, muchos aspectos de interés para los objetivos de nuestro estudio se abordan de manera agregada, como por ejemplo el análisis de diferentes secuencias de tratamiento (aquí denominadas estrategias) o la selección de un tratamiento promedio con mesalazina tópica para la combinación de las mesalazinas orales y tópicas. Esa agregación debe ser tenida en cuenta en la interpretación, ya que se ha sustituido cualquier tratamiento de mesalazina oral en dosis ≥2,4g/día por las mesalazinas específicas comparadas. Igualmente, cabe señalar que el estudio utiliza la mejor evidencia disponible actualmente respecto a la efectividad, la adhesión y la seguridad de los tratamientos comparados, procedente de las revisiones sistemáticas y metaanálisis más actualizados, aunque no se disponga de datos de ensayos clínicos que comparen directamente los tratamientos evaluados. Por último, cabe reseñar que se trata de un modelo validado por expertos científicos, y por las autoridades reguladoras en el caso del Reino Unido, aunque ha sido adaptado al ámbito español por gastroenterólogos especializados en el manejo clínico de la CU en España.
Otro aspecto que es preciso considerar es que en esta evaluación se ha asumido que los pacientes presentan una adhesión al tratamiento del 100%. Es bien conocido que un menor cumplimiento del tratamiento se asocia con un aumento de la probabilidad de recaídas, una disminución de la calidad de vida y, en última instancia, un aumento de los costes totales asociados a la enfermedad38. Es posible que las diferentes formulaciones (sobres frente a pastillas) determinen una adhesión diferente al tratamiento, lo que podría influir en el modelo, aunque no parece probable por los resultados de los estudios de adhesión previos.
Otra de las limitaciones a considerar en el presente estudio es que el uso combinado de 5-ASA orales y de aplicación rectal como terapia de primera línea para el tratamiento del brote no ha sido considerado como una de las opciones. Algunos estudios han señalado que esta estrategia podría inducir una respuesta más rápida y tener una mayor efectividad que la administración de cada uno de estos agentes por separado39,40 y, de hecho, algunas de las guías más recientes en las que nos hemos basado la incluyen como estrategia de primera línea. Así, la práctica clínica actualmente recomendada consiste en iniciar el tratamiento del brote combinando mesalazinas orales y tópicas durante un periodo de tiempo de entre 4 y 8semanas, y transcurrido ese periodo iniciar tratamiento con prednisolona en los pacientes que no responden. El modelo que se utiliza en el presente estudio incluye el tratamiento combinado de mesalazinas orales y tópicas seguidas de prednisolona en la estrategia2, como segunda y tercera líneas de tratamiento. Pero, a diferencia de las recomendaciones actuales, restringe la duración del tratamiento combinado a 4semanas por ser esta la duración máxima evaluada en los ensayos clínicos. Esa menor duración hace que el número de pacientes que remiten sea menor de lo que cabría esperar de la aplicación de las recomendaciones, lo que haría que más pacientes necesitaran tratamiento con prednisolona, y que finalmente el número de pacientes que necesitan ingreso hospitalario fuera mayor. En consecuencia, incluir una estrategia como la descrita en las recomendaciones clínicas, que solamente contemplara el tratamiento combinado seguido de prednisolona, resultaría, paradójicamente, en una duración más corta de la estrategia en su conjunto, y un coste final más elevado. Por ello, y para mantener en lo posible la consistencia con el modelo originalmente validado por NICE, se ha decidido limitarse a reproducir la evaluación de las estrategias tal y como fueron planteadas por dicha guía.
Cuando analizamos las evaluaciones económicas de las distintas formulaciones de mesalazina procedentes de estudios internacionales, los trabajos publicados constatan un mayor coste-efectividad de las formulaciones evaluadas en el presente estudio (preparaciones gastrorresistentes de liberación prolongada y toma única) frente a otros tipos de formulaciones de 5-ASA41,42, pero no existen estudios que hayan comparado las distintas formulaciones dentro de este último grupo.
Finalmente, dado que no existen modelos de coste-efectividad de calidad en el ámbito español que comparen el uso de las mesalazinas en el tratamiento del brote de la CU, no hemos podido comparar los resultados de nuestro estudio con otras publicaciones españolas. Recientemente se ha publicado un estudio (como comunicación a congreso) llevado a cabo en 4 centros españoles, que valora el coste promedio anual para el mantenimiento de la remisión de la CU con diferentes formulaciones de mesalazina, y demuestra un menor coste con Salofalk® (834,07€) frente a Mezavant® (1697,97€)43.
En resumen, los resultados obtenidos en el presente estudio sugieren que el menor precio por gramo de Salofalk® frente a Mezavant® hace más coste-efectivas las estrategias basadas en Salofalk® para el manejo de la CU leve-moderada, tanto para tratar el brote como para mantener la remisión.
FinanciaciónEste estudio ha sido financiado por Dr. Falk Pharma mediante un contrato con Oxon Epidemiology Limited. Oxon Epidemiology Limited es una Organización de Investigación por Contrato que trabaja para diferentes compañías farmacéuticas. Dr. Falk no ha participado en ninguna parte del desarrollo ni ha influido en ningún aspecto científico del mismo.
Conflicto de interesesEl Dr. Gisbert realiza funciones de asesoramiento científico, soporte para la investigación y/o actividades formativas para las siguientes compañías farmaceúticas: MSD, Abbvie, Hospira, Kern Pharma, Takeda, Janssen, Pfizer, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Chiesi, Casen Fleet, Gebro Pharma, Otsuka Pharmaceutical y Vifor Pharma.
El Dr. Gomollón realiza asesoramiento científico, soporte para investigación y/o actividades formativas para la siguientes compañías farmacéuticas: MSD, Abbvie, Shire Pharmaceuticals, Dr. Falk Pharma,Vifor Pharma, FAESFARMA y Pharmacosmos.
Ignacio Méndez es empleado de Oxon Epidemiology.
Los autores quieren agradecer a Antonio González del Castillo, de Oxon Epidemiology, su apoyo logístico durante el desarrollo del proyecto, y a Ana Isabel Ortega su colaboración durante la fase de redacción del manuscrito.