En la actualidad existen múltiples tipos de vacunas frente a la gripe. La irrupción de la tecnología de ácidos nucleicos utilizada en las vacunas frente al SARS-CoV-2 hace pensar en su aplicación futura frente a esta infección. Frente a la gripe se han desarrollado 2 tipos de vacunas basadas en el ARN mensajero (ARNm): las convencionales o no replicativas y las autoamplificables o replicativas (auARNm), ambas incluidas en nanopartículas lipídicas. Los estudios en animales realizados con las primeras han mostrado su intensa capacidad para inducir anticuerpos e inmunidad celular Th-1 frente a la hemaglutinina gripal con escasos efectos secundarios. Los ensayos en humanos han mostrado una seroconversión del 87% y una seroprotección del 100%. Las vacunas auARNm han obtenido resultados en animales semejantes, pero a una concentración 64 veces inferior a la convencional. Las vacunas basadas en las plataformas de ARNm cumplen los requisitos establecidos por la OMS para vacunas de gripe de la generación siguiente.
Today there are multiple types of flu vaccines. The emergence of nucleic acid technology used in vaccines against SARS-CoV-2 suggests its future application against this infection. Against influenza, two types of vaccines have been developed based on messenger RNA (mRNA): conventional or non-replicative and self-amplifying or replicative (auRNA), both included in lipid nanoparticles. Animal studies carried out with the former have shown their strong capacity to induce Th-1 antibodies and cellular immunity against influenza haemagglutinin (HA) with few side effects. Human trials have shown 87% seroconversion and 100% seroprotection. The auRNA vaccines have obtained similar results in animals but at a concentration 64 times lower than the conventional one. Vaccines based on mRNA platforms meet the WHO requirements for next generation influenza vaccines.
La gripe es una de las principales infecciones respiratorias agudas de causa viral que afecta periódicamente a la población humana. Aunque en general se la considera como una enfermedad leve, cuando afecta a las poblaciones frágiles o vulnerables debido a enfermedades subyacentes puede presentar una importante morbimortalidad. Frente a la gripe solo se dispone de algún fármaco antiviral de eficacia moderada, de modo que la vacunación es la principal y casi única posibilidad de proteger a la población frente a la misma. Debido a ello se han desarrollado diferentes tipos y variedades de vacunas con eficacias variables1. La irrupción de la tecnología de ácidos nucleicos (ARN y ADN) utilizada en las vacunas frente al SARS-CoV-2 hace pensar en su aplicación futura frente a la gripe2,3.
Vacunas de ARN mensajeroPara su utilización como vacunas se han desarrollado 2 tipos de moléculas de ARN mensajero (ARNm) con propiedades biológicas muy diferentes: convencionales o no replicativas y autoamplificables o replicativas.
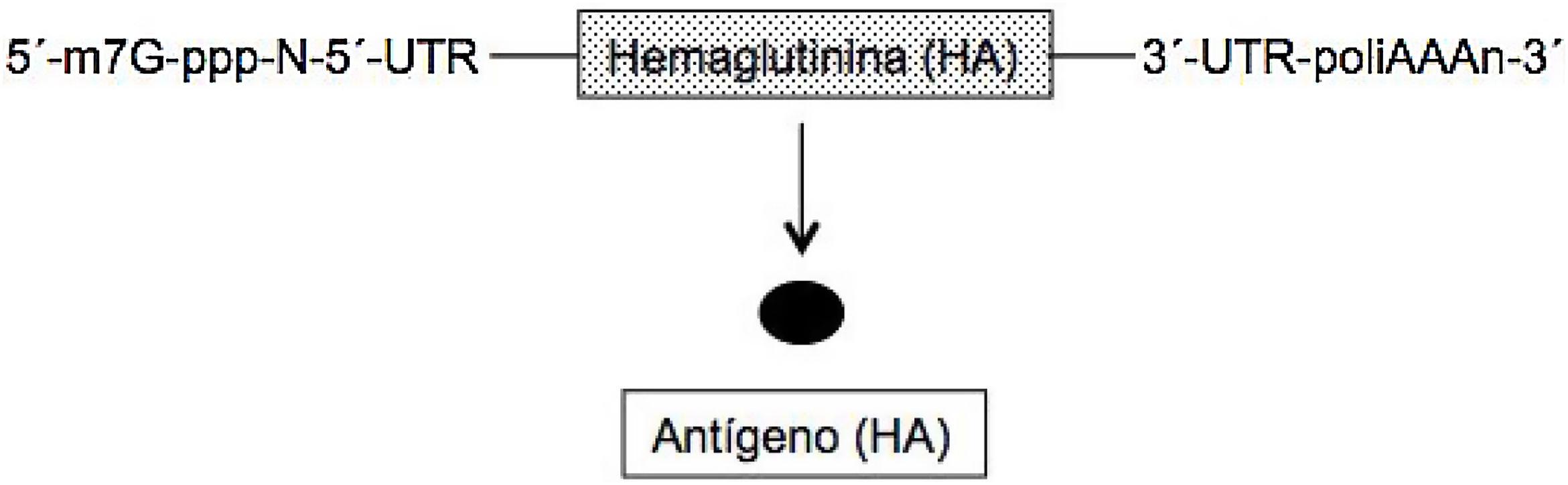
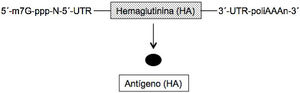
En el ARNm convencional y no replicativo, similar al celular, la secuencia genética de la proteína (antígeno) que se desea expresar está flanqueada en cada uno de sus extremos 5́ y 3́ por una secuencia untranslated region (UTR). Además, como todos los ARNm posee en el extremo 5́ la secuencia denominada cap (m7G-ppp-N-5́) y en el extremo 3́ una secuencia de adeninas de longitud variables (poliA) (fig. 1)2–4. Se han elaborado 2 tipos de estas vacunas, las de ARNm no modificado (natural) y las modificadas; en estas últimas el nucleósido uridina se ha sustituido por 1-metil-pseudouridina, lo cual estabiliza la molécula5. El ARNm posee como ventajas que es una molécula simple y pequeña (de unas 2-3kb) y al codificar una sola proteína la respuesta inmune es muy específica. Sin embargo, la expresión de este ARNm (producción de antígeno) es limitada y de naturaleza transitoria, precisando la administración de dosis elevadas de la misma para obtener una buena eficacia vacunal2–4.
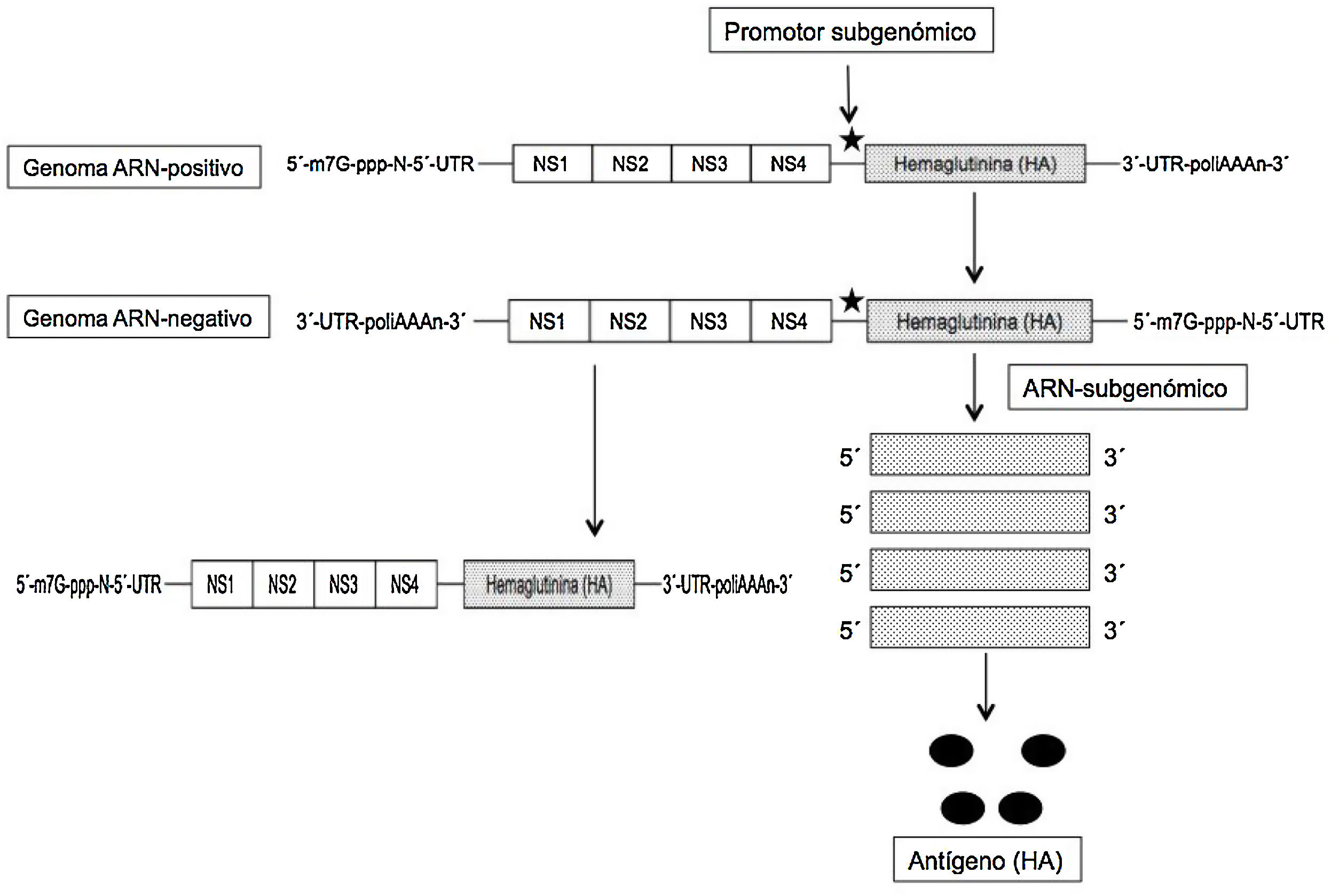
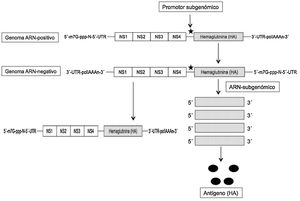
El ARNm autoamplificable (auARNm) y replicativo se basa en la utilización como vector del genoma de otro virus ARN-positivo, como un alfavirus o flavivirus, y aprovechar del mismo el conjunto de genes que codifican las proteínas no estructurales (NS) y esenciales, entre las que se incluye la ARN-polimerasa ARN-dirigida (NS1), y eliminar el resto para sustituirlo por la secuencia genética de la proteína/antígeno que se desea expresar; con ello se obtiene una molécula de unas 9kb de longitud que se denomina «replicón». Tras la replicación inicial del virus en el citoplasma se expresan los fragmentos subgenómicos (gracias a la inserción de un promotor) que codifican el antígeno deseado (fig. 2). De este modo, y gracias al proceso autorreplicativo de una sola molécula de auARNm se obtienen grandes cantidades de antígeno. A pesar de la utilización de los genes de otros virus, estos no son capaces de formar partículas viables, no existiendo el riesgo de infección por ellos2–4. Con este auARNm se necesitan concentraciones menores del mismo, y por ello también menores cantidades de nanopartículas lipídicas que los incluyan, induciendo unos efectos adversos también inferiores frente al ARNm convencional6. De este modo las vacunas auARNm solo precisan de 0,1-1,0μg para obtener una protección total, frente a los 10μg de la convencional en los ratones inmunizados con la hemaglutinina (HA) de la gripe7. Además, los replicones de ARN formados en el proceso de amplificación muestran en la superficie celular patrones de reconocimiento que incrementan la respuesta inmune. Aunque ambos tipos de ARNm inducen inmunidad humoral y celular, el auARNm determina mayores niveles de expresión y de respuesta inmune compleja8.
La fragilidad y la rápida degradación fisiológica de las moléculas de ARNm ha obligado a protegerlas para poder ser administradas en mamíferos. La mejor solución a este problema ha sido incluirlas dentro de una estructura lipídica compleja de unos 80nm, semejantes al virus gripal, formando lo que se denominan nanopartículas lipídicas (NPL)9,10.
Vacunas de ARNm frente a la gripeLas vacunas de ARNm frente a la gripe aportan una serie de ventajas en relación con otro tipo de vacunas, tales como: a) un muy favorable perfil de seguridad (el ARN es una molécula no infecciosa, no integrable en el genoma celular y es degradado rápidamente por las ARNsas citoplasmáticas); b) un proceso de producción del antígeno altamente controlable con una elevada identidad antigénica, ya que es producida de forma similar al proceso de replicación vírica en la infección natural por la propia célula humana; c) producción rápida y escalable, precisando poco tiempo para su producción inicial o posterior reactualización; y d) no precisa el empleo de huevos embrionarios ni cultivos celulares que puedan alterar la antigenicidad de la proteína final6,11.
El primer estudio sobre la eficacia de un ARNm convencional frente a la gripe se realizó en 1993, observándose cómo la administración de una vacuna liposomal de este tipo que codificaba la nucleoproteína (NP) gripal inducía una respuesta de células T citotóxicas en el ratón12. Posteriormente otros autores mostraron que la administración a ratones, hurones y cerdos de diferentes ARNm codificadores de la HA, neuraminidasa (NA) y NP también inducían una potente respuesta humoral con una única dosis11. Las vacunas de ARNm-HA habían demostrado en estos estudios ser inmunógenas en ratones y protegerlas de la infección posterior. Para su confirmación Petsch et al.13 inocularon 2 dosis de 80μg de esta vacuna en ratones de todas las edades, observando una protección duradera de por vida. También los cerdos inoculados con una dosis de 250μg de vacunas con HA, NA y NP obtenían y mantenían títulos protectores semejantes a los inducidos por la vacuna inactivada equivalente.
Los estudios realizados en primates no humanos mostraron que la administración intramuscular de una sola dosis de 10μg de un ARNm-NPL que codificaba la HA del virus gripal A/Netherlands/602/2009 (H1N1) inducía títulos protectores de anticuerpos inhibidores de la neutralización (IH) en un rango>1:4014. La administración de una segunda dosis determinó el incremento medio del título por encima de 1:160 en la totalidad de animales y durante un mínimo de un año. Además también observaron cómo la administración intramuscular de 2 dosis (separadas 4 semanas) de la vacuna que contenía la HA del virus gripal A/HongKong/4801/2014 (H3N2) inducía una intensa respuesta celular de tipo T y B superior a las vacunas inactivadas adyuvadas con MF5914.
Pardi et al.15 han comunicado que la administración de una sola dosis de 3μg, a ratones y hurones, de una vacuna ARNm-NPL-HA con la cepa A/California/07/2009 (H1N1), determinaba unos títulos de IH>1:120 a las 4 semanas de la inmunización. Una segunda dosis incrementaba estos títulos hasta alcanzar valores de 1.280-20.480, dependiendo de la dosis y ruta de administración (intradérmica o intramuscular). La vacuna no generaba anticuerpos HI frente a la cepa A/Puerto Rico/8/1934 (H1N1), pero sí protegía a los animales tras su infección, lo cual hacía pensar en la inducción de respuestas inmunológicas frente al tallo de la HA (confirmadas posteriormente) y no frente a la zona inmunodominante globular. La inoculación a ratones de una dosis de 50μg de una vacuna de ARNm-NPL tetravalente, conteniendo los genes de los antígenos HA, NA, NP y Matriz, demostró una robusta respuesta inmune frente a la cepa A (H1N1) pandémica unas 500 veces superior a una vacuna convencional. Además, los títulos de anticuerpos frente a cada uno de los antígenos era igual que el obtenido con la inoculación separada; con ello se demostraba la posibilidad de elaborar una vacuna antigripal pluriantigénica con un espectro protector amplio16.
Por su parte Bahl et al.17 observaron que una sola administración al ratón de 10μg de un ARNm-NPL modificado codificador de la HA del virus gripal A/Jiangxi-Donghu/346/2013 (H10N8) o del A/Anhui/1/2003 (H7N9) inducían una respuesta inmune humoral que persistía más allá de un año. Además, se comprobó que una sola dosis de 0,4μg del virus (H7N9) protegía a los ratones de la infección posterior por el mismo virus, y una dosis de 10μg reducía drásticamente la presencia del virus en el parénquima pulmonar de los hurones. También pudieron comprobar cómo la administración a los macacos de 2 dosis (intramuscular o intradérmica) de una vacuna ARNm-NPL-H10 inducía títulos inhibidores protectores y células T-CD4+específicas. Se podía observar cómo la vacuna inducía una infiltración rápida y local de neutrófilos, monocitos y células dendríticas en el punto de la inoculación y en ganglios linfáticos locales y una inmunidad humoral y celular persistente18,19.
A partir de estos resultados Bahl et al.17 iniciaron un ensayo clínico fase i en un pequeño grupo de voluntarios (23 vacunados y 8 placebos) a los que se les administró 2 dosis intramusculares de 100μg de ARNm-NPL-H10. El porcentaje de seroconversión fue del 87% (definido como el paso de ausencia a presencia de anticuerpos IH) y del 87% (definido como un incremento en 4 títulos). El porcentaje de seroprotección observado a los 43 días fue del 100% (definido como el porcentaje de personas que alcanzaron un título de anticuerpos IH>40) y del 87% en los títulos de microneutralización. La mayoría de los efectos adversos fueron leves y asociados al pinchazo. Estos resultados mostraban que este nuevo tipo de vacunas obtenían unos resultados de eficacia protectora muy semejantes a los de otras vacunas antigripales convencionales17.
En un ensayo clínico en humanos fase i se ha evaluado la seguridad e inmunogenicidad de una vacuna de ARNm-NPL frente a los virus gripales aviares H10N8 y H7N9. Para el H10N8 una dosis intramuscular de 100μg inducía unos títulos>1:40 en el 100% de los participantes y para el H7N9 dosis intramusculares de 10, 25 y 50μg inducían títulos>1:40 de 36%, 96,3% y 89,7% respectivamente. Las tasas de seroconversión para el H10N8 fueron del 78,3% y frente al H7N9 del 96,3%. En este estudio se confirman la inmunogenicidad de las vacunas de ARNm-NPL en el ser humano y los escasos efectos adversos inducidos por ellas20.
Los primeros estudios sobre las vacunas auARNm demostraron que la administración de 10μg de la HA del virus gripal A/Puerto Rico/8/34 (H1N1) inducía en ratones una respuesta humoral que protegía parcialmente la posterior infección gripal21. Hekele et al.6 desarrollaron una vacuna auARNm-NPL frente a los virus A/California/07/2009 (H1N1) y A/Shanghai/2/2013 (H7N9). Dos dosis de 0,1-1,0μg inducían en ratones niveles de anticuerpos protectores del tipo IH semejantes a las vacunas convencionales. Por su parte Magini et al.22 ensayaron una vacuna auARNm-NPL codificadora de la NP y de la proteína M1 (proteína de matriz interna que envuelve el virus por encima de la nucleocápside) a partir de la cepa A/Puerto Rico/8/34 (H1N1). La administración intramuscular de 0,1-0,2μg de la vacuna con la NP o M1, o la combinada NP+M1, determinaban una intensa respuesta de células T específicas (CD4 Th1), asociado a una cierta protección posterior. Así mismo inducían una robusta expansión de la memoria inmunológica celular y de la memoria efectora, necesarias para la protección a largo plazo. En el estudio de Brazzoli et al.8 se comprueba cómo la administración en ratones y hurones de este tipo de vacuna frente a la HA de la cepa A/California/07/2009 (H1N1) determinaba protección cruzada frente a la cepa homóloga y heteróloga (A/Puerto Rico/8/34) debido a la inducción de células T-CD8 multifuncionales.
Vogel et al.23 han comparado la respuesta inmune y la eficacia protectora de una vacuna auARNm y una ARNm convencional (ambos del tipo NPL) frente a la gripe en ratones. Los animales se inmunizaron con dosis crecientes de la HA de la cepa A/Puerto Rico/8/34 (H1N1). Ambos tipos vacunales indujeron protección frente a la infección por la cepa homóloga. Sin embargo, se comprobó que la vacuna auARNm conseguía el mismo nivel de protección inmunológica con una dosis 64 veces inferior a la convencional (1,25μg frente a 80μg). Además, la inmunización con una vacuna auARNm trivalente que contenía las HAs de las cepas A/California/07/2009 (H1N1), A/Hong Kong/1/68/ (H3N2) y B/Massachusetts/2/2012 protegía a los animales frente a los virus homólogos. Por primera vez se demostró la eficacia y utilidad de las vacunas auARNm-NPL formuladas con más de un componente antigénico de 2 tipos gripales distintos.
A pesar de los resultados preliminares obtenidos en los modelos experimentales todavía no se ha iniciado con la vacuna de tipo auARNm ningún ensayo clínico, con lo cual se desconoce la respuesta inmune y la capacidad de protección de las mismas en el ser humano.
En el documento de requisitos para las nuevas o futuras vacunas frente a la gripe elaborado por la OMS24 se especifican los siguientes: a) prevención de la gripe A y B grave confirmada por laboratorio; b) estudios de seguridad y eficacia de los diferentes grupos de edad; c) bajos niveles de reactogenicidad; d) ausencia de interferencia con otras vacunas; d) duración de la inmunidad entre 1-5 años; e) empleo de antígenos con capacidad de estimular el sistema inmune celular; y f) establecer un correlato de protección que permite evaluar la eficacia de las nuevas vacunas.
Las vacunas de ARNm cumplen la mayoría de estos requisitos, habiendo demostrado capacidad en animales para proteger frente a diferentes cepas gripales, aunque estos datos deberían ser trasladados al ser humano. Son seguras y con escasos efectos adversos, pueden reactualizarse en función de la variación antigénica de los virus gripales y muestran una durabilidad inmune como mínimo de un año. Además su producción no precisa del crecimiento del virus en cultivos celulares, sino tan solo su identificación, optimización y la expresión del ARNm codificador del antígeno elegido25. Por todo ello es muy posible que tras el éxito de las vacunas de ARNm frente al SARS-CoV-2, la nueva generación de vacunas frente a la gripe estén basadas en este mismo modelo de ingeniería molecular de ácidos nucleicos.
Conflicto de interesesEl autor declara no presentar ningún conflicto de intereses.