El adenocarcinoma (ADC) del canal anal es una entidad rara que representa el 5% de todas las neoplasias anorrectales y un 1,5% de los tumores gastrointestinales. De acuerdo con la Organización Mundial de la Salud se pueden distinguir 3 tipos: el primero tiene su origen en la mucosa de transición del canal superior, el segundo deriva de las glándulas (ductos) anales, y el último deriva de una fístula perianal crónica. Los pacientes con ADC del canal anal presentan mayor porcentaje de enfermedad avanzada, de metástasis a distancia y menor supervivencia global que aquellos con carcinoma escamoso. La escasa casuística publicada sobre esta neoplasia implica que no existe un esquema terapéutico plenamente comprobado. La mayoría de los autores abogan por un tratamiento con quimiorradioterapia (QRT) neoadyuvante seguido de cirugía radical. El objetivo de este artículo es realizar una revisión de la literatura existente sobre las características clinicopatológicas y el manejo del ADC del canal anal.
Adenocarcinoma (ADC) of the anal canal is a rare disease comprising only 5% of all anorectal neoplasias and 1.5% of all gastrointestinal tumours. The World Health Organisation classifies anal ADC into 3 types: the first may arise from the mucosa of the transitional zone in the upper canal, the second from the anal glands (ducts) and the last can develop in the environment of a chronic anorectal fistula. Patients with ADC of the anal canal have high rates of pelvic failure, distant metastasis, and lower overall survival than patients with epidermoid carcinoma. Because of limited case reports about this neoplasia, management strategies have not been well established. Most authors of related studies recommend preoperative chemoradiotherapy (CRT) followed by radical surgery. The aim of the present study is to review clinicopathology features and management of anal canal ADC.
El canal anal es la porción terminal del intestino grueso, y corresponde a una estructura tubular de 3-4cm que se extiende desde la piel perianal hasta el final del recto. Se encuentra revestido en su porción superior por mucosa de tipo rectal, en su zona media (coincidiendo con la línea de interfase pectínea) por mucosa transicional y, en su tramo inferior, por una mucosa con epitelio escamoso estratificado1.
Los carcinomas de esta región se clasifican como carcinomas del canal anal y los patrones de diferenciación son, principalmente, de tipo basalioide (de naturaleza básicamente escamoide, similar a su homónimo del tracto aéreo-digestivo superior), tipo epidermoide, análogo a los tumores cutáneos, y aquellos con una línea de diferenciación hacia adenocarcinoma1.
El objetivo de este artículo es realizar una revisión de la literatura sobre la histopatología, la clínica, el diagnóstico y el tratamiento del ADC del canal anal.
MetodologíaSe ha realizado una revisión de la literatura existente utilizando para ello las bases de datos MEDLINE Pubmed y Ovid desde el año 1997 hasta el 2012. Se han utilizado como palabras clave: «anal adenocarcinoma», «anal neoplasm», «anal gland carcinoma», «anal duct carcinoma», «anal canal», «immunohistochemistry», «chemoradiotherapy» y «radical surgery».
HistopatologíaA pesar de que el canal anal tiene una longitud corta, presenta gran variedad de tumores, lo que refleja la complejidad anatómica, embriológica e histológica de esta estructura. Asegurar la localización de estos tumores e interpretar los hallazgos morfológicos es controvertido y, en ocasiones, muy difícil2.
El adenocarcinoma (ADC) del canal anal es una entidad rara. La mayoría tienen un fenotipo colorrectal y representan tumores derivados de la porción superior del canal anal o de células de características glandulares de la zona de transición. Distinguir un verdadero ADC del canal anal de un ADC rectal bajo con extensión al canal anal puede ser extremadamente difícil. De acuerdo con la Organización Mundial de la Salud (OMS) se pueden distinguir 3 tipos de ADC con relación, principalmente, a su origen: los que tiene su origen en la porción superior del canal anal, los que derivan de las glándulas o ductos anales y aquellos asociados a fístulas anorrectales crónicas2,3:
- -
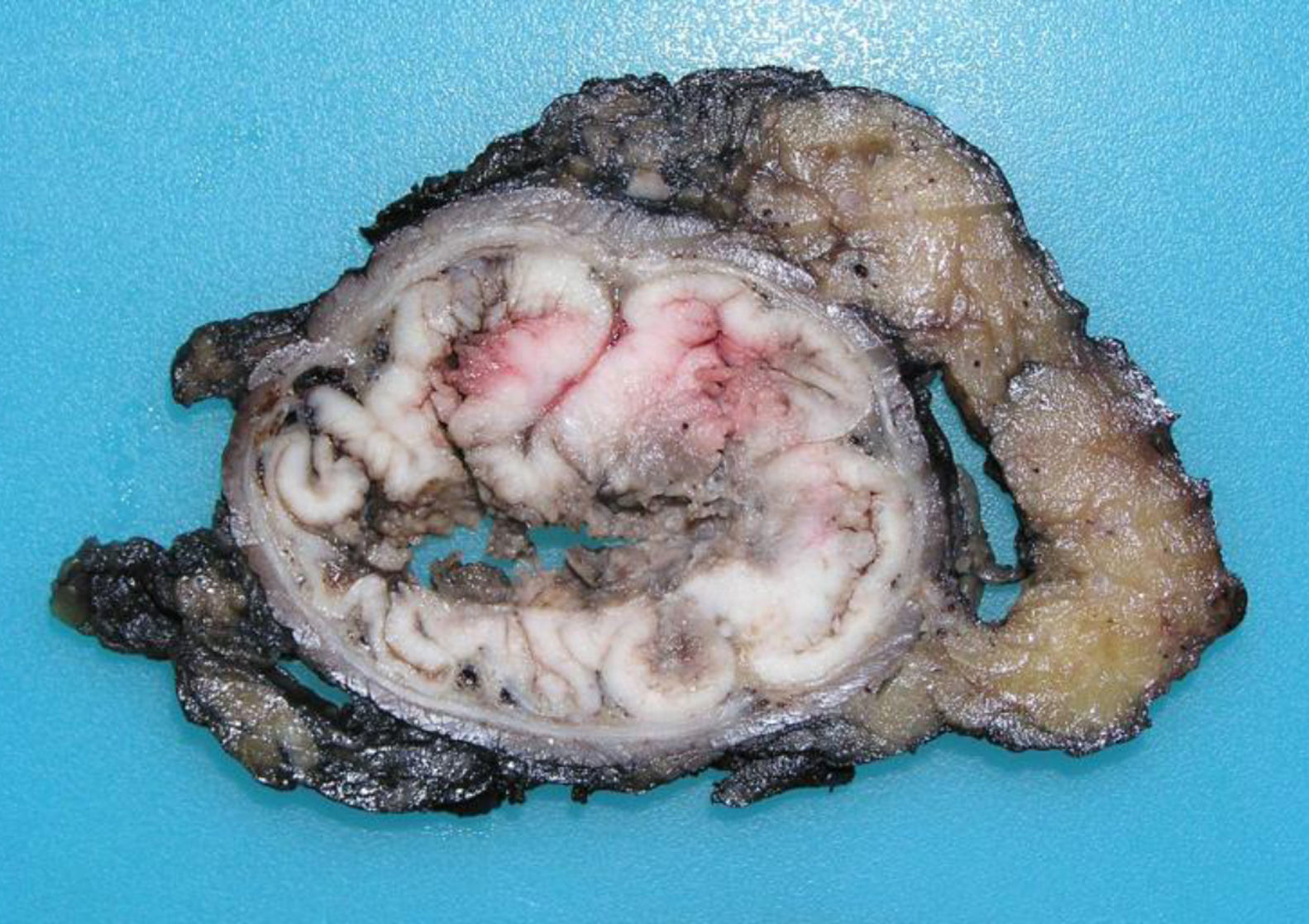
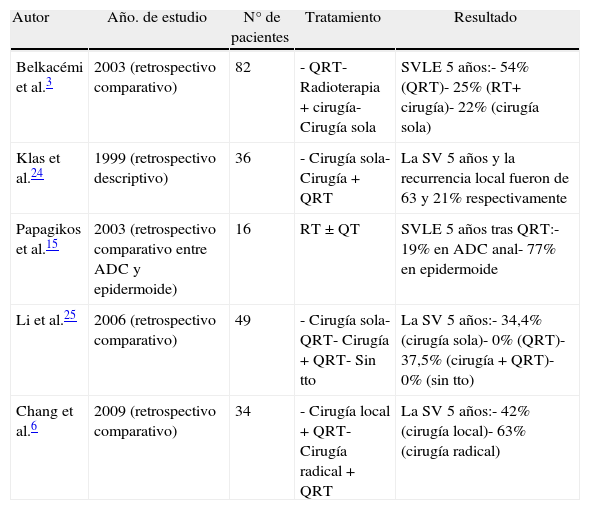
Los tumores originados en la mucosa del tramo superior del canal anal son los más comunes (fig. 1) y presentan un fenotipo colorrectal. Es extremadamente difícil, en fases evolucionadas, distinguirlos de un ADC rectal distal. Su principal implicación clínica se basa en su capacidad de extensión local, atendiendo al drenaje linfático doble hacia las cadenas inguinal y femoral. El fenotipo inmunohistoquímico usual coincide con el perfil inmunohistoquímico del ADC del segmento rectal bajo, consistente en CK20+, CK7- y CDX2+. La CK7 es ocasionalmente positiva, como también puede ocurrir excepcionalmente en el ADC rectal, pero como en este, coexpresaría característicamente CK202,4,5.
- -
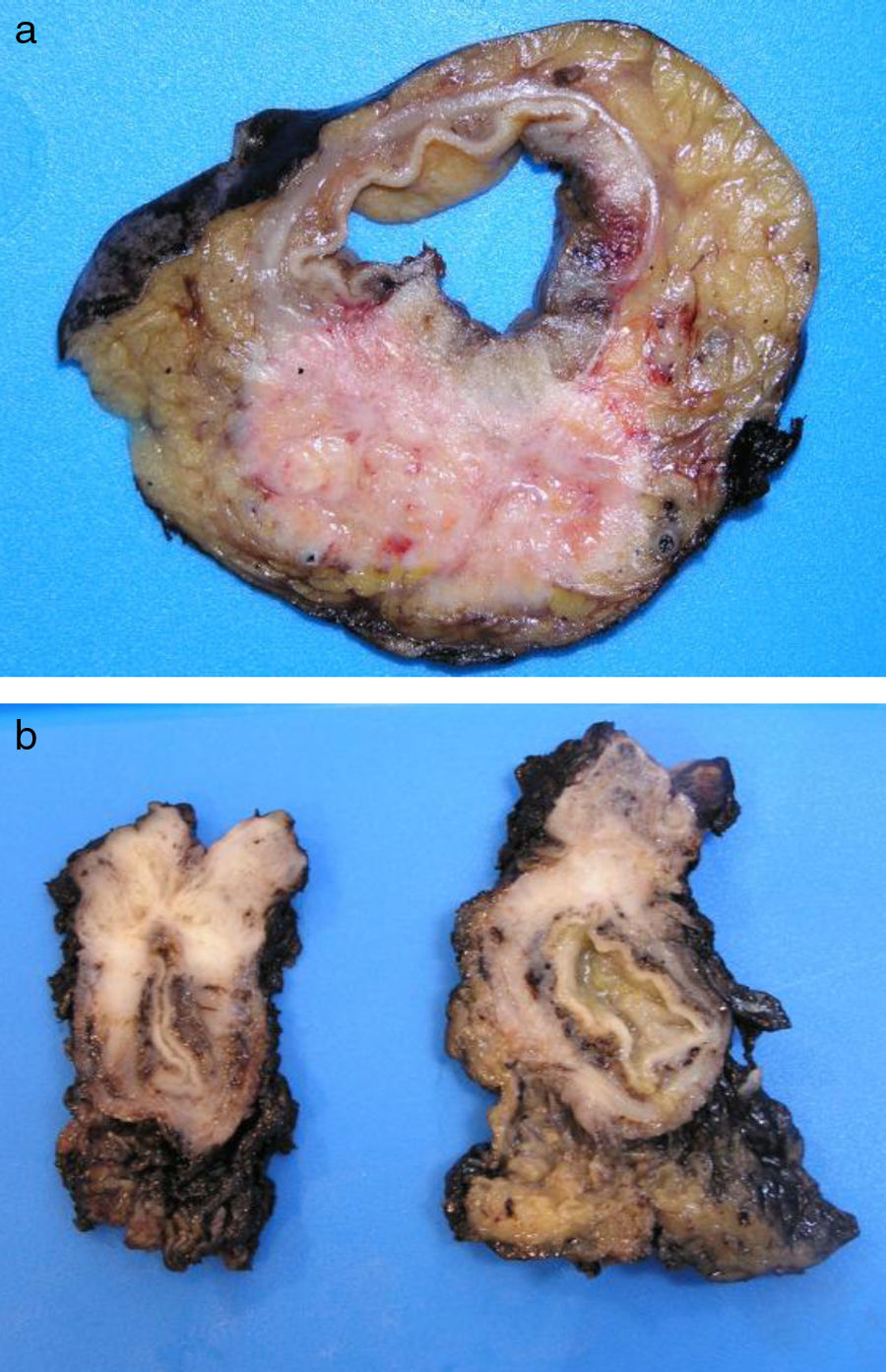
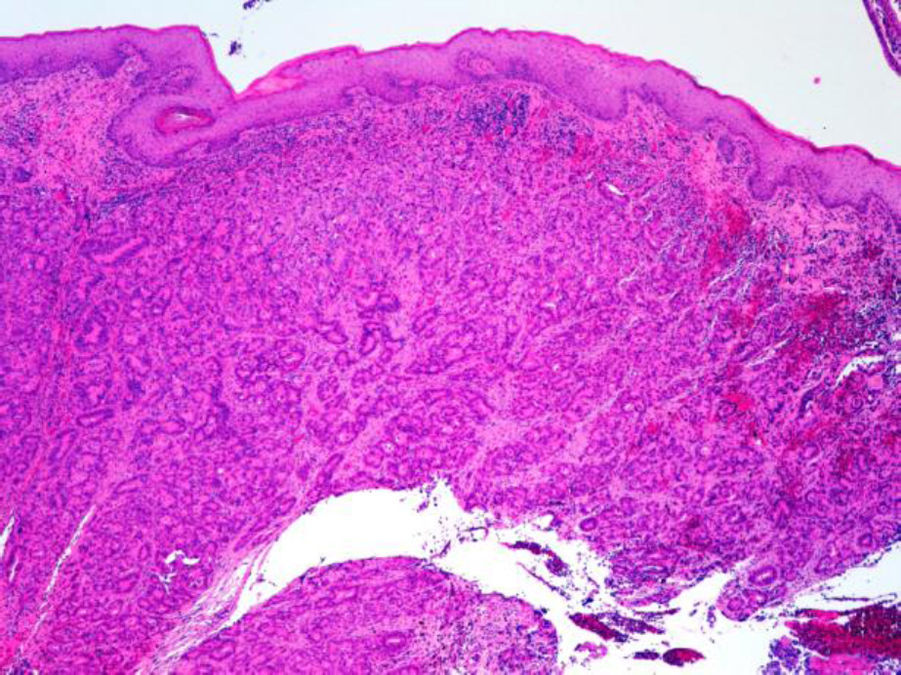
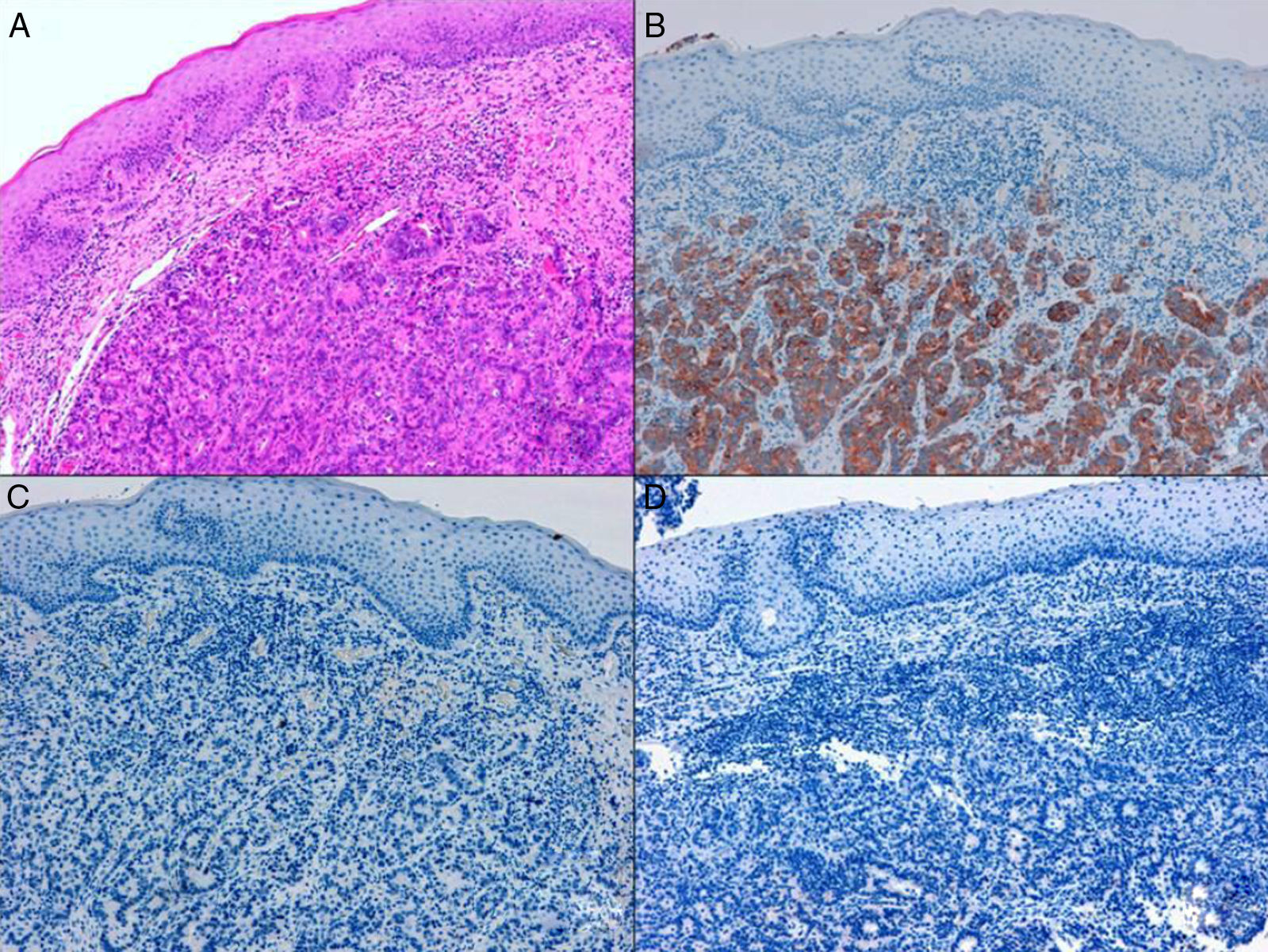
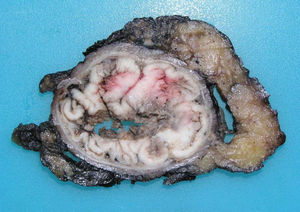
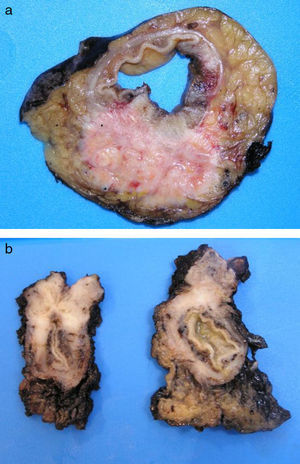
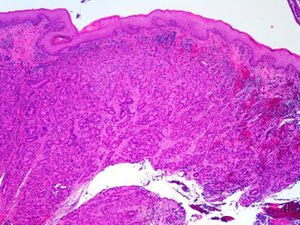
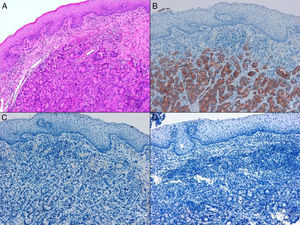
Los ADC desarrollados en el ducto o en las glándulas del canal anal (ADC ductal anal o ADC de glándula anal) son extremadamente infrecuentes. Corresponden a un subtipo de ADC específico intramural del canal anal (figs. 2A y B), y a veces, su diagnóstico es por exclusión, ya que detectar histológicamente elementos glandulares normales y sus ductos asociados o en continuidad al ADC, ocurre generalmente, en etapas muy precoces. La reciente definición de ADC de glándulas anales de Hobbs et al.4 no requiere la demostración de esa continuidad con glándulas del canal anal, adquiriendo mayor protagonismo en el diagnóstico, además de las características morfológicas de la neoplasia, que esta no presente un crecimiento intraluminal (hay que reseñar que las glándulas normales del canal anal se distribuyen en la capa submucosa, penetrando en la musculatura esfinteriana y alcanzan incluso, grasa perianal). Adicionalmente, este subtipo tumoral no se asocia a displasia de la superficie mucosa (fig. 3) y, generalmente, no se relaciona con fístulas preexistentes. Pueden producir mucina en escasa cantidad y su perfil inmunohistoquímico es de CK20-, CK7+ y CDX2- (fig. 4), equiparable al perfil inmunohistoquímico de las glándulas normales del canal anal y similar al perfil del epitelio transicional del canal anal2,4–8.
Figura 4.A) Componente glandular neoplásico submucoso en ADC de glándulas anales (hematoxilina y eosina × 20). B) ADC de glándulas anales con inmunoexpresión positiva en las glándulas para CK7 (citoqueratina 7×10). C) ADC de glándulas anales negativo para CK20 (citoqueratina 20×10). D) ADC de glándulas anales negativo para CDX2 (CDX2×10).
(0,57MB). - -
Finalmente, el ADC asociado a fístulas colorrectales crónicas (congénitas o adquiridas), de larga evolución (10-20 años), suele ser secundario a procesos inflamatorios crónicos como la enfermedad de Crohn o a otras enfermedades perianales benignas evolucionadas. A veces, las fístulas son secundarias a dilataciones de glándulas del canal anal o de sus ductos, y la morfología e inmunohistoquímica del tumor sería idéntica a la de un ADC de glándulas/ducto anal. Jones y Morson9 han sugerido que algunos de estos carcinomas asociados a fístulas se originan en duplicaciones congénitas de la parte final distal del intestino posterior (hindgut). Generalmente, adoptan un patrón de ADC mucinoso bien diferenciado, pero el origen histogenético exacto es, a menudo, imposible de demostrar, pudiendo pertenecer a cualquiera de los subtipos anteriores. Además, hay que distinguirlo del ADC de recto bajo productor de mucina. En este sentido, el estudio inmunohistoquímico (CK20, CK7 y CDX2) puede ser variable, y solo combinando características morfológicas, inmunofenotípicas y clínico-evolutivas se podría plantear un origen u otro2,4,5,7–9.
Los tumores anales son neoplasias poco frecuentes del tubo digestivo, que representan el 5% de todas las neoplasias anorrectales y un 1,5% de los tumores gastrointestinales. Las claves microscópicas en los tumores del canal anal han ido cambiando progresivamente con los años. El aumento de la experiencia y el apoyo de técnicas inmunohistoquímicas y estudios moleculares hanprovocado numerosos cambios en la nomenclatura. La lesión más frecuente, tanto del canal anal como de la piel perianal, es el carcinoma escamoso, que representa entre el 70 y el 80%10–13. El ADC anal supone alrededor del 10% de todas las lesiones anales malignas (5-19%): presenta una historia natural más agresiva que el carcinoma escamoso con menor supervivencia y mayores tasas de recurrencia, tanto local como a distancia2,6,10,13–15.
Aunque se han descrito buenos resultados en pacientes con neoplasias que se detectan en fases evolutivas precoces, la similitud clínica con otras enfermedades benignas y la menor expresión del componente tumoral en la mucosa suelen ser razones que retrasan el diagnóstico y, por tanto, empobrecen el pronóstico16. Pacientes con ADC del canal anal se presentan en mayor porcentaje con enfermedad avanzada, metástasis a distancia y, consecuentemente, menor supervivencia global frente al carcinoma escamoso. Datos del National Cancer Data Base (NCDB) revelan que, en el momento de presentación, el 9,8% de pacientes con ADC anal se encuentran en estadio iv, comparado con el 5% de los carcinomas escamosos. De la misma manera, lesiones a distancia ocurren en el 28,1% de los pacientes con ADC frente al 11,8% de los escamosos. El porcentaje de supervivencia a los 5 años en los pacientes con ADC es peor en todos los estadios que el de los pacientes con carcinoma epidermoide, constatando una mayor diferencia en el estadio iv (13% para pacientes con ADC y 29% para aquellos con epidermoide)15.
La edad de presentación se encuentra alrededor de la sexta década de la vida, con igualdad de distribución por sexos3,14. Se han propuesto múltiples factores de riesgo como el VPH y VIH, el tabaco y la inmunosupresión10,17. La presencia de fístulas perianales crónicas, asociadas o no a enfermedad de Crohn, suponen un factor de riesgo importante, principalmente cuando superan los 10 años de historia17,18. El linfogranuloma venéreo (LGV), como causa de proctitis, puede provocar estenosis y fístulas perianales y se asocia también con un aumento de riesgo de ADC rectal19.
Clínica y diagnósticoLas manifestaciones clínicas suelen ser inespecíficas. Los pacientes pueden presentar dolor, induración, abscesos, fístulas o masa palpable. Otros síntomas incluyen el sangrado, prurito, manchado, prolapso y pérdida de peso6,13. En la serie de Kline et al.20, un 15% de los pacientes eran asintomáticos. Es típica la presencia de fístula perianal de más de 10 años de evolución o la existencia de fístulas recurrentes incluso después de la cirugía6.
La sospecha diagnóstica temprana es crucial para evitar el retraso en el diagnóstico y tratamiento. Aunque las características clínicas nos pueden hacer sospechar de este tipo de tumor, el diagnóstico definitivo solo puede establecerse mediante una biopsia y estudio histológico. En caso de enfermedad fistulosa avanzada no está claro si la biopsia debe tomarse del canal anal cercano al orificio interno o por legrado del orificio externo17.
Adicionalmente, se deben explorar las adenopatías inguinales, ya que, como se ha expuesto previamente, se trata de lesiones agresivas con alta capacidad de invasión local y a distancia. La diseminación local tiende a ser mayor en aquellos tumores originados en las glándulas del canal anal o de tractos fistulosos ya que, al estar localizados por fuera de la pared intestinal, la diseminación se inicia desde una posición más avanzada.
Otros métodos diagnósticos para estudiar su extensión local y a distancia incluyen la ecografía endoanal, la resonancia magnética pélvica y la tomografía computarizada17,18.
TratamientoLa escasa casuística publicada sobre el ADC del canal anal implica que no existe un esquema terapéutico plenamente comprobado6. Hasta los años 90, la mayor parte de los autores recomendaban la cirugía radical (amputación abdominoperineal [AAP]) como tratamiento de elección para el ADC del canal anal21–23.
En un análisis retrospectivo de 192 pacientes con cáncer del canal anal tratados en la Universidad de Minnesota, Klas et al.24 describen su experiencia con 36 pacientes diagnosticados de ADC. Veintidós (61%) fueron tratados con cirugía sola (6 AAP y 16 resecciones locales) y 14 (39%) con cirugía seguida de quimiorradioterapia (QRT). La supervivencia a 5 años y la recurrencia local fueron de 63 y 21%, respectivamente. No compararon las modalidades terapéuticas entre sí debido al número insuficiente de pacientes. Atribuyen los buenos resultados a que la mayor parte de las lesiones (78%) eran menores de 5cm, y defienden el tratamiento con QRT pre- o postoperatoria para lesiones mayores (>5cm).
Un estudio multicéntrico retrospectivo que incluye 82 pacientes diagnosticados de ADC anal tratados en diferentes centros europeos3 recomendaba la QRT combinada como mejor tratamiento, reservando la cirugía radical (AAP) solo como rescate. En dicho estudio, los pacientes fueron manejados con QRT combinada, radioterapia (RT) más cirugía o cirugía sola. La supervivencia global y libre de enfermedad fue superior en aquellos pacientes con QRT, frente a aquellos con RT más cirugía o cirugía sola. El análisis multivariante mostraba que el estadio T y N, el grado histológico y la modalidad terapéutica eran factores pronósticos independientes para la supervivencia. Sin embargo, este trabajo tiene bastantes carencias: no se empleó neoadyuvancia en ningún grupo, no se utilizó quimioterapia adyuvante tras la cirugía, los pacientes que entraron en el grupo de RT y cirugía eran significativamente mayores que los pacientes del grupo de QRT combinada y en el 75% de los pacientes operados se realizó resección local. Estos factores podrían ser responsables del alto grado de recurrencia local y a distancia del grupo con RT y cirugía.
Papagikos et al.15 estudian a 16 pacientes con ADC anal que fueron tratados con RT con o sin quimioterapia con intención curativa. Los resultados de este tratamiento fueron comparados con un grupo de pacientes con carcinoma epidermoide que fueron tratados con QRT. La media de seguimiento fue de 45 meses para pacientes con ADC y 44 para aquellos con epidermoide. Aunque los pacientes con carcinoma epidermoide presentaban tumores primarios más avanzados, las recurrencias locales y a distancia fueron significativamente superiores en pacientes con ADC. Más aún, la supervivencia libre de enfermedad a 5 años tras QRT fue del 19% en pacientes con ADC en comparación con el 77% de aquellos con carcinoma epidermoide. Este estudio concluye que el tratamiento con QRT definitiva, que ha demostrado utilidad en tumores epidermoides, presenta un control local pobre y una cifra alta de recurrencias a distancia en pacientes con ADC. Recomiendan QRT preoperatoria seguida de AAP para maximizar el control pélvico de la enfermedad. La quimioterapia adyuvante podría ser considerada para la enfermedad micrometastásica.
Un estudio retrospectivo realizado por Li et al.25, en el que se incluye a 49 pacientes con ADC del canal anal, concluye que la AAP junto con QRT es el tratamiento recomendado. La supervivencia a 5 años en pacientes con AAP sola, QRT, AAP más QRT, y sin ningún tratamiento era del 34,4, 0, 37,5 y 0%, respectivamente.
Chang et al.6 muestran una serie de más de 20 años de experiencia en su serie de 34 pacientes en los que aquellos potencialmente curables fueron tratados mediante cirugía local seguida de RT o QRT, o tratamiento quirúrgico radical (AAP) más QRT pre- o postoperatoria. La supervivencia libre de enfermedad fue de 13 meses tras resección local y 32 meses tras cirugía radical, y la supervivencia global a 5 años fue del 43% para el tratamiento local y del 63% para los pacientes tratados mediante cirugía radical (tabla 1).
Estudios sobre tratamiento del ADC anal
| Autor | Año. de estudio | N° de pacientes | Tratamiento | Resultado |
| Belkacémi et al.3 | 2003 (retrospectivo comparativo) | 82 | - QRT- Radioterapia + cirugía- Cirugía sola | SVLE 5 años:- 54% (QRT)- 25% (RT+ cirugía)- 22% (cirugía sola) |
| Klas et al.24 | 1999 (retrospectivo descriptivo) | 36 | - Cirugía sola- Cirugía + QRT | La SV 5 años y la recurrencia local fueron de 63 y 21% respectivamente |
| Papagikos et al.15 | 2003 (retrospectivo comparativo entre ADC y epidermoide) | 16 | RT ± QT | SVLE 5 años tras QRT:- 19% en ADC anal- 77% en epidermoide |
| Li et al.25 | 2006 (retrospectivo comparativo) | 49 | - Cirugía sola- QRT- Cirugía + QRT- Sin tto | La SV 5 años:- 34,4% (cirugía sola)- 0% (QRT)- 37,5% (cirugía + QRT)- 0% (sin tto) |
| Chang et al.6 | 2009 (retrospectivo comparativo) | 34 | - Cirugía local + QRT- Cirugía radical + QRT | La SV 5 años:- 42% (cirugía local)- 63% (cirugía radical) |
QRT: quimiorradioterapia; RT: radioterapia; SV: supervivencia; SVLE: supervivencia libre de enfermedad; tto: tratamiento.
Los pacientes con adenopatías inguinales en la presentación de la enfermedad tienen peor pronóstico debido al alto porcentaje de enfermedad a distancia15,18. Según algunos autores3,6,26, la dosis inguinal de RT debe ser diferente de acuerdo a la existencia o no de afectación inguinal y a la modalidad terapéutica. De esta manera, se aconseja utilizar dosis superiores a 54-55Gy cuando se utiliza QRT inicial, mientras que, en aquellos casos en los que solo se utilice RT, la dosis correspondiente debe aumentarse a 60-66Gy. En aquellos pacientes sin invasión inguinal conocida que reciban tratamiento con QRT asociada o no a cirugía, la dosis profiláctica aconsejada es de 45Gy. Papagikos et al.15, debido al mal pronóstico de pacientes que se presentan con adenopatías inguinales, priorizan el uso de QRT inicial (con dosis superiores a 55Gy) y quimioterapia sistémica adicional, con resección quirúrgica utilizada selectivamente o para salvar recurrencias locales aisladas.
Actualmente, la mayoría de los autores abogan por maximizar el control local de la enfermedad, evitando la resección transanal (que ha tenido un impacto negativo en la supervivencia de algunas series6,27), y por disminuir el riesgo de metástasis con el uso de una quimioterapia intensiva.
Dado que las glándulas anales son histológica y embriológicamente diferentes al epitelio escamoso anal, el esquema de quimioterapia aconsejado no suele incluir mitomicina, utilizándose generalmente los regímenes clásicos utilizados en el ADC rectal, basados en 5-fluoracilo, asociado o no a oxaliplatino6,7,15.
ConclusionesEl ADC del canal anal es una entidad rara y, en ocasiones, difícil de distinguir de un ADC rectal bajo con extensión al canal anal. Su sospecha precoz es crucial para evitar el retraso en el diagnóstico y tratamiento, ya que presenta un comportamiento agresivo. Aunque no existe un protocolo estandarizado para el tratamiento del ADC del canal anal, el esquema actualmente aconsejado es la QRT preoperatoria seguida de cirugía radical (AAP), considerando posteriormente un tratamiento adyuvante en la prevención de micrometástasis. La QRT como único tratamiento debe reservarse para aquellos pacientes que no toleren una cirugía radical y, según algunos autores, ante la presencia de metástasis ganglionares inguinales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.