Los tumores de mediastino en niños son poco frecuentes, el 25% de ellos corresponde a tumores malignos. El timoma es una neoplasia poco común, en adultos corresponde al 30% de los tumores de mediastino anterior y con un pico de incidencia es entre los 55-65 años.
Caso clínicoSe reporta el caso de un timoma linfocítico en una paciente de 4 años, sin sintomatología previa ni asociada, solo aumento de volumen en región anterior de cuello. Las radiografías y tomografías de cuello y tórax confirman una masa mediastinal anterior, que rodea a la aorta y la cava, así como múltiples adenomegalias mediastinales.
ConclusionesEl diagnóstico temprano y la resección completa son la base del tratamiento y del pronóstico.
Mediastinal tumours in children are rare. Around 25% of them can be malignant. The thymoma is an uncommon neoplasm, and during adulthood it corresponds to 30% of anterior mediastinum tumours. The peak incidence is between 55-65 years.
Clinical caseA case of lymphocytic thymoma case is reported in a 4 year old patient with no previous or associated symptomatology. There was only a volume increase on the anterior neck region. The neck radiography and neck and chest tomography confirmed an anterior mediastinal mass surrounding the aorta and vena cava, as well as multiple mediastinal lymph nodes
ConclusionsEarly diagnosis and complete resection are the basis for management and prognosis.
Los tumores mediastinales son poco frecuentes en niños, corresponden al 3% del total de cirugías de tórax en niños. El 45-50% corresponden a tumores primarios y, de estos, el 40-45% a tumores malignos, y el tercio de estos se presentan en menores de 2 años1–3. De los tumores primarios, los principales son tímicos, neurogénicos, linfáticos, de células germinales o mesenquimatosos; los secundarios son por diseminación linfática de órganos intratorácicos hacia mediastino2. La mayor localización se tiene en mediastino posterior y la mayoría son de origen neurogénico y benigno1.
Debido a que la mayoría son asintomáticos, la mayor parte de los tumores son diagnosticados como hallazgos radiográficos1 y en ocasiones suelen presentarse con fiebre, pérdida de peso, mal estado general, insuficiencia respiratoria aguda con disnea, tiraje intercostal, atelectasias o más agresivamente como síndrome de vena cava superior, disfagia, disfonía, espasmo laríngeo por compromiso del nervio laríngeo recurrente, parálisis diafragmática por afectación del nervio frénico o bien síndrome de Horner por compromiso de ganglios y nervios simpáticos1,2. Una vez localizada la lesión, el protocolo de estudio incluye: biometría hemática, panel metabólico completo, y de infecciones, marcadores tumorales. Es necesario complementar la radiografía de tórax con una proyección lateral. El estándar de oro es la tomografía axial simple y contrastada; en ocasiones resonancia magnética, medicina nuclear con Iodo123 o Iodo131 para búsqueda de tejido tiroideo ectópico, con Tecnecio99 para búsqueda de mucosa gástrica en duplicaciones intestinales, uso de metaiodobenzilguanidina para el diagnóstico de neuroblastoma; en niños suele ser útil la realización de ultrasonido cervical y torácico inclusive con biopsia con aguja fina; sin embargo, ello puede condicionar limitantes para el diagnóstico y el riesgo de sangrado2,4,5. El tratamiento habitual consiste en cirugía a excepción de los tumorales germinales y linfáticos, a realizarse vía abordaje cervical y esternal, mediastinoscopia o videotoracoscopia4,5.
El timo es un órgano linfoide central, correspondiente a mediastino anterior, en el que las células madre de la médula ósea se diferencian en linfocitos T maduros, con tendencia a degenerar alrededor de los 2 años de edad; cuando persiste puede crecer o malignizarse siendo de las 2 maneras funcional, de ahí la asociación de la hiperplasia (70%) y timomas (15%) con la miastenia gravis al ser los linfocitos T intolerantes a los anticuerpos antiacetilcolina6. El timo puede ser un sitio de metástasis de cáncer de pulmón, mama o tiroides. El timoma es un tumor de baja frecuencia y de comportamiento incierto, corresponde al 26-50% de los tumores mediastinales y el 82% de los tumores del timo4,6,7; su diagnóstico es generalmente incidental a través de una radiografía de tórax y una tomografía axial computada para determinar la localización y extensión del tumor5,6. En cuanto a la clasificación de los timomas, aunque no existe una clasificación estándar, el propuesto por Masaoka et al.3 es el que se utiliza habitualmente. Dicha clasificación los divide en 4 categorías de acuerdo al grado de infiltración tumoral en: I, cápsula íntegra; II, invasión de la cápsula; III, con infiltración macroscópica a órganos vecinos; IVa y IVb, con diseminación a pleura o pericardio y metástasis linfáticas o hematógenas a distancia, respectivamente. Y la clasificación de la OMS con: epitelial A, mixto AB, linfocítico B1, fusiforme B2 y carcinoma tímico C4,6,7. El carcinoma tímico es la neoplasia de mayor malignidad del timo, cuya sintomatología tiende a presentarse de forma más temprana y agresiva con dolor, pérdida de peso, síndrome de vena cava superior, disnea por derrame pericárdico y compresión de la vía aérea; es muy poco frecuente, y presenta atipia de sus células que no se parecen a las originales del timo; representa alrededor del 5% de los tumores mediastinales en adultos y aproximadamente el 1-2% de los tumores mediastinales en niños1,2,4,7–9. La piedra angular del tratamiento de los tumores de timo consiste en la resección quirúrgica4–6,9,10 sea con esternotomía, cervicoesternotomía alta, toracotomía, videotoracoscopia, mediastinoscopia, y lo ideal es la resección quirúrgica completa; en casos contrarios se debe complementar el manejo con radioterapia y/o quimioterapia de acuerdo al tipo de tumoración, invasión y extensión4,6–10. Las complicaciones de la cirugía pueden ser neumonías, hemotórax, neumotórax, dehiscencia de esternotomía, mediastinitis, osteomielitis10 y en menor frecuencia quilotórax, parálisis diafragmática, disfonía y crisis miasténica.
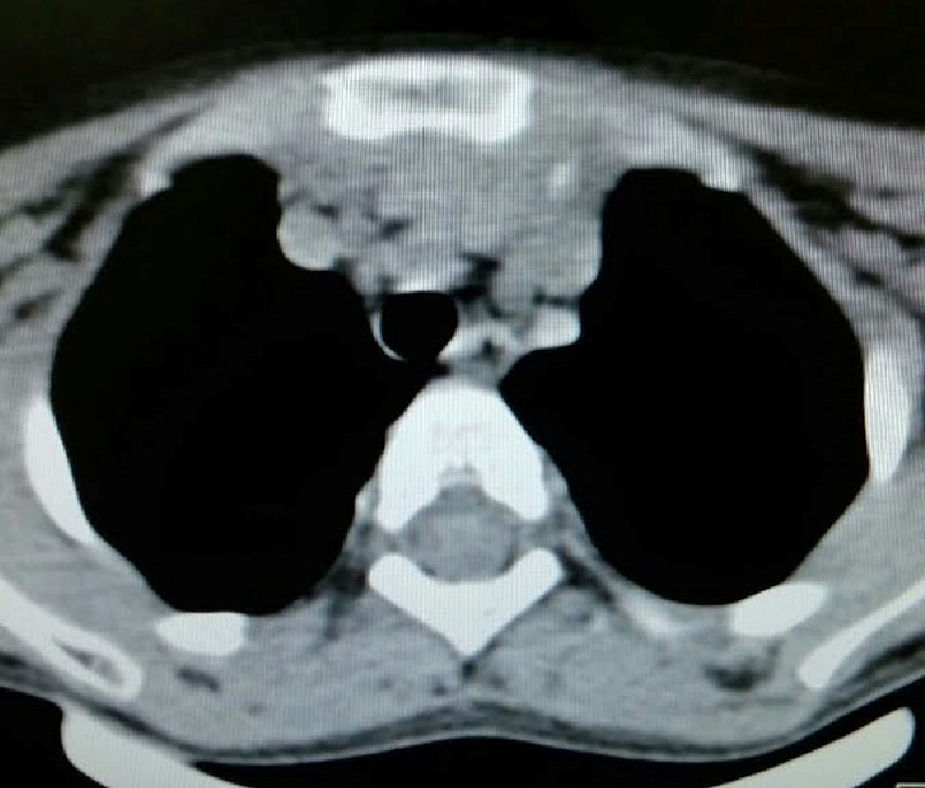
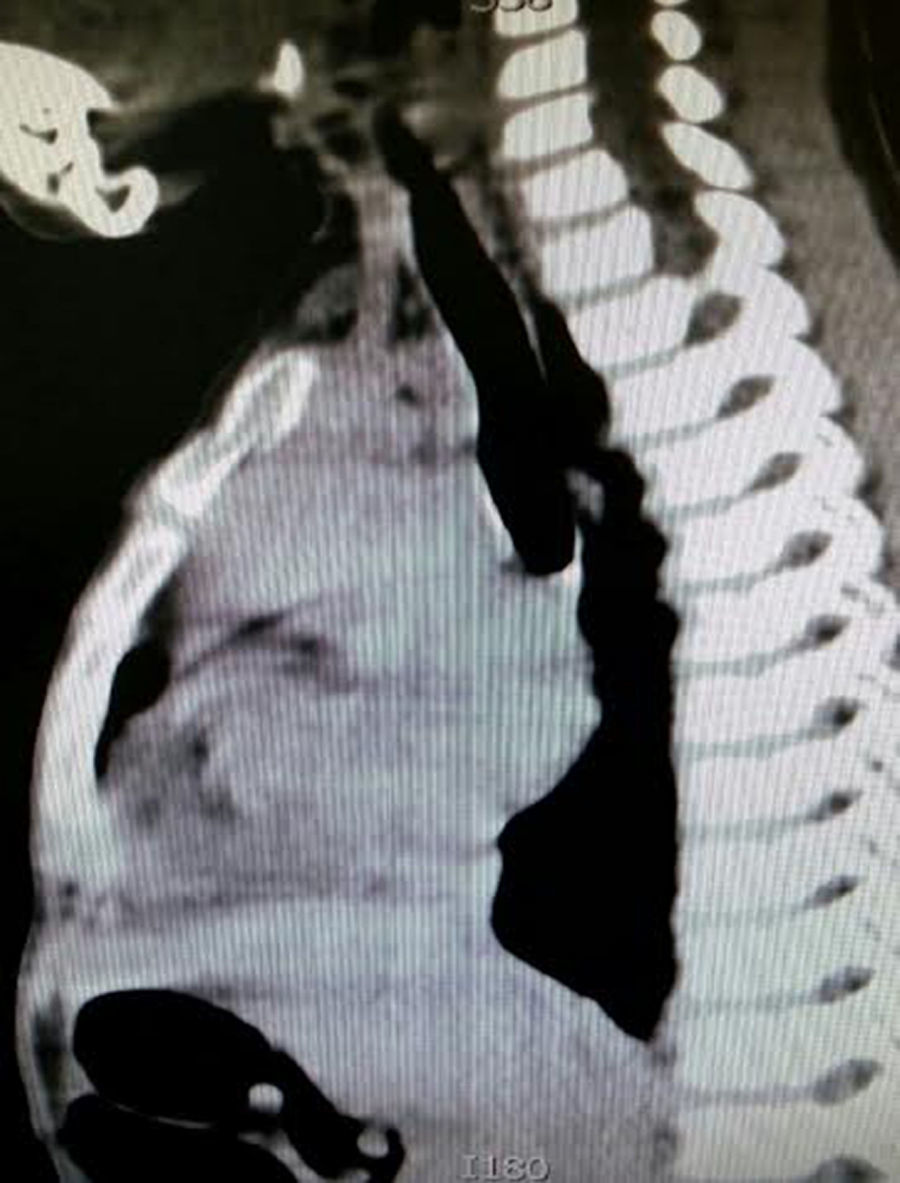
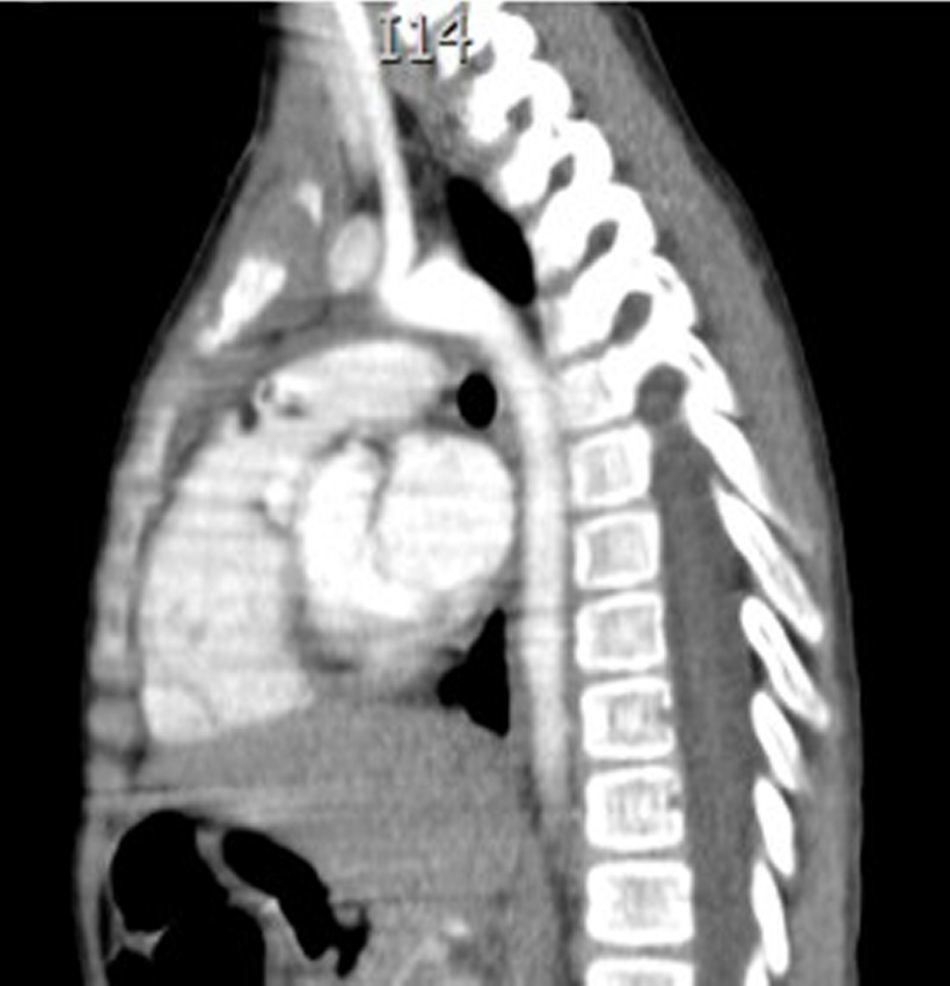
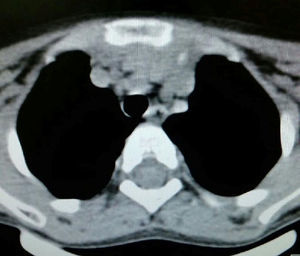
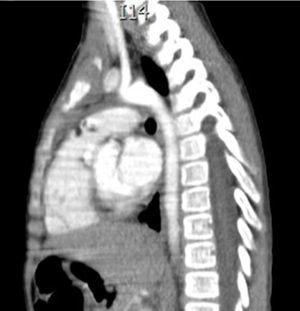
Caso clínicoEl caso corresponde a una femenina de 4 años de edad, producto de la segunda gesta, embarazo normoevolutivo, obtenida por parto eutócico a las 39 semanas, APGAR 8/9; 3,100g al nacer, desarrollo normal, fue enviada a la consulta por aumento de volumen en cuello de 2 meses de evolución, sin disnea, disfagia, cianosis, palidez, fiebre, tos, pérdida de peso ni alteraciones neuromusculares. A la exploración se encontró paciente femenina eutrófica, frecuencia cardíaca 100/min, frecuencia respiratoria 28/min, 36.2°C, saturación al medio del 97%, peso 19kg, sin disnea ni disfonía, con adecuada coloración tegumentaria, bien hidratada, con faringe sin hiperemia. Cuello con aumento de volumen de aproximadamente 1.5-2cm en zona I hueco supraesternal, blando, no doloroso, poco móvil, superficie lisa, consistencia renitente, sin cambios de coloración dérmicas, no móvil a la deglución; tiroides sin masas palpables, móvil, no dolorosa. Adenomegalias blandas de aproximadamente 5-7mm en cadena ganglionar yugular III-IV bilateral, no dolorosas, de superficie lisa, móviles, no fijas a planos profundos. Tórax sin deformaciones, con adecuada entrada y salida de aire, sin estertores ni sibilancias, ruidos cardíacos con buen tono e intensidad sin soplos ni agregados. Abdomen blando, depresible, no doloroso sin visceromegalias, peristalsis normoactiva. Extremidades íntegras, con llenado capilar inmediato, sin cianosis. Sus estudios de laboratorio reportan: leucocitos de 5,600/ul, hemoglobina de 14.6g/dl, plaquetas de 324,000/ul, 47.6% de linfocitos totales reactivos, neutrófilos totales de 31%, fosfatasa alcalina elevada de 250UI/l (40-150), transaminasas normales, amilasa de 92U/l, lipasa 19 /l, colesterol 169mg/dl, triglicéridos 68mg/dl, ácido úrico 3.5mg/dl, tiempos de coagulación normales, bilirrubinas totales 0.1mg/dl, albúmina de 3.1g/dl, glucosa 96mg/dl, nitrógeno ureico de 10mg/dl, creatinina de 0.46mg/dl, calcio 9.1mg/dl, sodio de 140mmol/l, potasio de 4mmol/l, cloro 110mmol/l, fósforo 4.3mg/dl, magnesio 2.4mg/dl, examen general de orina normal, hormona folículo estimulante 13.5mlU/ml, hormona luteinizante 0.36mlU/ml, prolactina 25ng/ml, antígeno carcinoembrionario 2.1ng/ml todos estos últimos normales; perfil tiroideo normal con T3T 15.7ng/dl, TSH 2.61uU/ml, T4L 0.97 /ml, eosinófilos en moco nasal negativos, inmunoglobulina G 887mg/dl (681-1648), inmunoglobulina A 117mg/dl (84-484), inmunoglobulina M 285mg/dl (48-312), inmunoglobulina E 18.34mg/dl (menor de 60), coproparasitoscópicos negativos. Exudado nasal y faríngeo negativos. El ultrasonido de cuello reporta quiste tiroideo izquierdo simple. La tomografía de cuello demuestra lesión redonda, heterogénea de 1cm en hueco supraesternal, así como una masa heterogénea, irregular en mediastino superior, con compresión parcial de estructuras mediastinales, así como adenomegalias cervicales nivel II, III y VII aproximadamente 0.8cm sin derrame pleural ni afectación parenquimatosa ni pleural (figs. 1 y 2). Se llevó a cabo procedimiento quirúrgico con anestesia general, posición de Rosier, se realizó incisión transversa cervical; a nivel de región supraesternal pretiroidea se localiza lesión redondeada de cápsula delgada, coloración amarilla, que se extiende hacia mediastino anterior rodeando aorta y cava superior por lo cual se realizó esternotomía media alta, así como se localizan tiroides de aspecto normal y múltiples adenomegalias en niveles IV, V y VI, se reseca lesión y se realiza vaciamiento ganglionar mediastinal niveles IV, V y VI y cervicales II y III; aproximadamente; se colocó una sonda mediastinal 19Fr y un drenaje tipo Penrose en cuello, se afronta esternotomía con vicryl l.
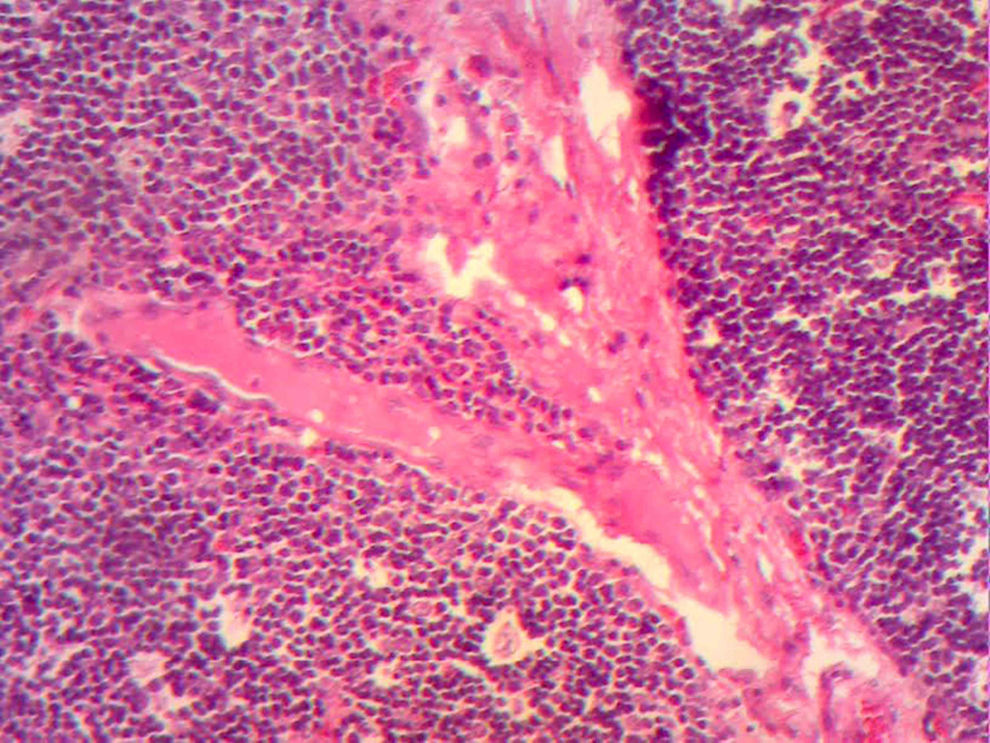
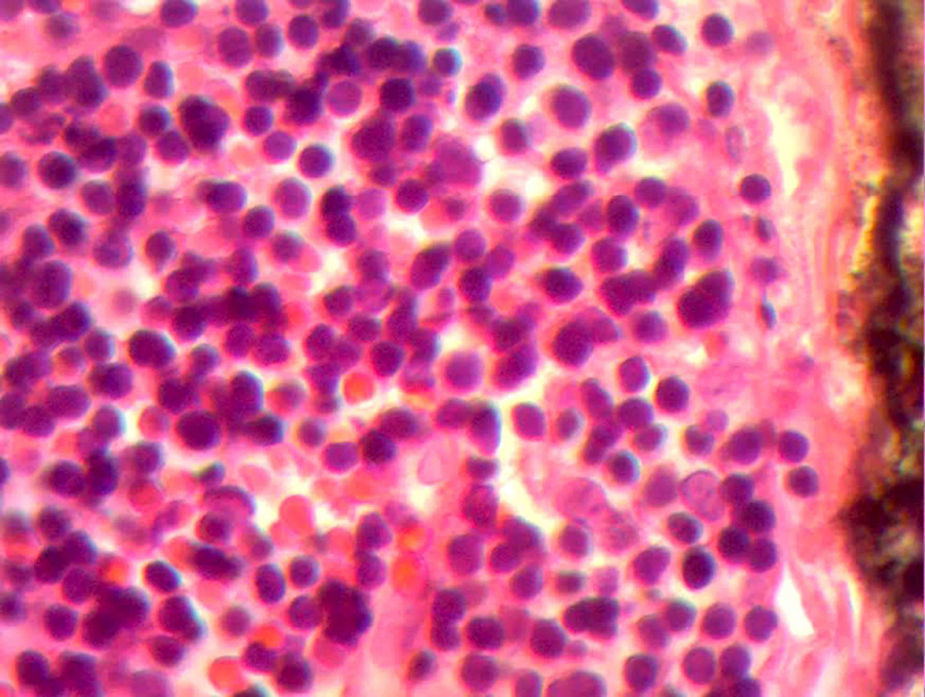
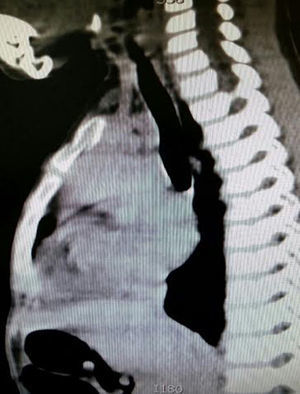
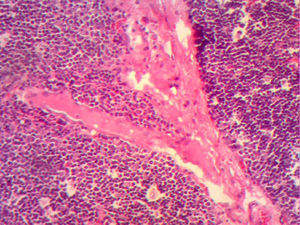
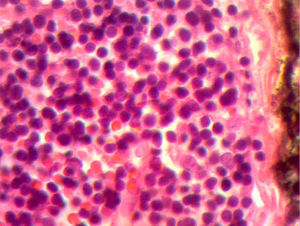
En la telerradiografía de tórax de control se encontró una adecuada expansión pulmonar, sin derrames; al segundo día se retiró el drenaje Penrose; al tercer día se retiró la sonda mediastinal y fue egresada del hospital. El histopatológico señala: quiste de inclusión con queratina, ganglios de cuello y mediastinales sin células neoplásicas pero con hiperplasia linfoide. Timoma linfocítico B1 de la clasificación de la OMS o Masaoka I (figs. 3 y 4); se envió a valoración por Oncopediatría en donde se menciona no amerita manejo coadyuvante. En la consulta se encuentra asintomática a 4 meses de la cirugía, sin datos de miastenia gravis. En la tomografía de control se encuentra cuello sin adenomegalias, tiroides normal, mediastino central, sin masas, con grandes vasos sin lesión alguna, parénquimas pulmonares sin masas, no existe derrame pleural (fig. 5).
Imagen histológica con HE, se aprecia pérdida de la arquitectura normal, sin restos medulares con una red de células neoplásicas grandes, con núcleos vesiculosos grandes y nucléolos prominentes dispuesta en red de vasos y septos con linfocitos inmaduros dispersos alrededor de los vasos.
Los timomas son poco frecuentes aun en etapa adulta; en la edad pediátrica el abordaje se inicia considerando el sitio anatómico del mediastino y edad de los pacientes ya que los de origen neurogénico son más frecuentes en menores de 3 años y los de origen linfático en la edad escolar y adolescentes2–4; pueden asociarse o no a la miastenia gravis, aunque se sabe que aproximadamente el 15-25% de los pacientes con miastenia tiene timoma y que de los pacientes con crecimiento tímico maligno o benigno, el 35-50% van a desarrollar miastenia gravis6. La miastenia gravis es una enfermedad de la placa motora caracterizada por fatiga y debilidad muscular, su fundamento es autoinmune con la presencia de anticuerpos contra los receptores de acetilcolina; fue descrita por primera vez en 1672 por Thomas Willis, pero clasificada por Osserman en etapa infantil, neonatal, congénita, juvenil y del adulto-menor de 40 años) y subclasificada en: grado I, ocular uni- o bilateral; grado IIa generalizada; grado IIb, generalizada y bulbar; grado III aguda respiratoria; y grado IV respiratoria crónica, siendo los grados IIa, IIb y III los que se benefician con la timectomía2,4,6; es 6 veces más frecuente en mujeres. Además de la miastenia, junto a los timomas y carcinomas tímicos (Masaoka IV, OMS C) pueden presentarse la anemia pura de células rojas, hipogammaglobulinemia, artritis reumatoide, lupus eritematoso sistémico, pénfigo, polimiositis, tiroiditis de Hashimoto, síndrome nefrótico5. En el estudio se presenta el caso de una paciente 4 años, clasificado como timoma B1 Masaoka I, sin síntomas asociados al tumor, solamente elevación de linfocitos reactivos; el diagnóstico de la tumoración mediastinal se realizó como hallazgo tomográfico2,4,5 y se confirmó con el reporte histopatológico. La miastenia hasta este momento no se ha desarrollado, pero considerando el antecedente y que es femenina, puede esperarse su presentación futura1,3,4,6. El timoma debe considerarse una tumoración maligna1,2,7–10 por lo que actualmente se recomienda abandonar el término timoma benigno, utilizado para los tumores Masaoka I.
Gracias al avance en las técnicas quirúrgicas, abordajes, esquemas de quimioterapia2–4,6–10 para el manejo del cáncer en niños se tienen mejores resultados en cuanto a supervivencia. El tratamiento electivo dependerá del reporte histopatológico y extensión de la lesión. La cirugía es el manejo de elección inicial, excepto en los tumores germinales y linfáticos7,8 en donde la elección una vez hecho el diagnóstico es la radioterapia. El ideal quirúrgico es una resección R0 (completa), en las cirugías R1 y R2 deben acompañarse de radio y/o quimioterapia1,2,4,5. La quimioterapia para este tipo de tumores se basa en cisplatino, ciclofosfamida, esteroides y adriamicina. Se reporta una supervivencia a 5 años en tumores Masaoka I del 85-100%, Masaoka II del 70-90%, Masaoka IIIa del 59-75%, y un Masaoka IVa y IVb del 40% y 10%, respectivamente3,4,7,8,10. Cuando se tiene una tumoración mediastinal, sobre todo de mediastino anterior, es de suma importancia la valoración preoperatoria anestésica ya que la misma lesión puede estar comprimiendo la vía aérea y estructuras vasculares lo cual condiciona un reto para la intubación, además de que aunque no se presenten datos de compresión prequirúrgica, una vez relajado el paciente, puede presentarse de forma aguda la compresión y con ello condicionar problemas para la intubación1,2.
ConclusionesSi bien los tumores tímicos son raros en niños, ante una lesión cervical baja o mediastinal anterior se debe pensar en la posibilidad de un tumor mediastinal aun en ausencia de síntomas asociados, ello para evitar el retraso del diagnóstico y por ende del tratamiento. El que la tumoración se presente sin síntomas puede asociarse a benignidad; sin embargo, no existen estudios que especifiquen esto y se sabe que, como en cualquier tumor, el pronóstico será de acuerdo a la etapa en que se encuentre la lesión, el grado de resección quirúrgica (R0), grado de infiltración y de metástasis linfáticas, alteraciones hematológicas y la presencia o ausencia de miastenia gravis.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.