La fístula aortoentérica es una entidad rara y potencialmente letal; entre sus presentaciones se encuentra la fístula enteroparaprotésica, producto de una lesión en el intestino como consecuencia del contacto directo con la prótesis vascular.
ObjetivoEste reporte trata de un caso de fístula enteroparaprotésica, donde el único germen aislado fue Candida parapsilosis, un germen inhabitual.
Caso clínicoHombre de 65 años de edad, fumador, con bypass aortobifemoral de dacron por enfermedad oclusiva aortoilíaca, que fue reintervenido por trombosis de la rama izquierda a los 6 meses. Fue hospitalizado a los 22 meses por síndrome tóxico que tras exploraciones complementarias fue diagnosticado como fístula enteroparaprotésica. Se le retiró la prótesis y posteriormente se le realizó revascularización extraanatómica. Las muestras microbiológicas extraídas del segmento duodenal, en contacto con la prótesis del segmento protésico y del frotis del líquido periprotésico, fueron positivas para C. parapsilosis.
DiscusiónEs relevante la presencia de C. parapsilosis en los cultivos tomados durante la cirugía, con hemocultivos negativos y sin otros focos infecciosos conocidos. Este es un germen inhabitual, con baja virulencia, limitada con respecto a otras especies de Cándida. Nuestro paciente no presentó datos clínicos habituales en casos de infección por C. parapsilosis y se desconoce el mecanismo de infección de la prótesis.
ConclusiónLa fístula enteroparaprotésica por C. parapsilosis puede resultar anecdótica; sin embargo, sus consecuencias pueden ser igual de graves. El estudio microbiológico resulta útil para ajustar una terapia antibiótica posterior a la cirugía. Queda en entredicho su utilidad para la determinación etiológica y puede incluso tratarse de un hallazgo incidental.
Aorto-enteric fistula is a rare and potentially lethal entity. Its presentation may be as an enteric-paraprosthetic fistula, due to injury in the gut caused by direct contact with the vascular prosthesis.
ObjectiveWe report a case of enteric-paraprosthetic fistulae with the unusual finding of Candida parapsilosis as the only isolated pathogen.
Clinical caseA 65-year-old male, smoker, with aortobifemoral revascularisation with dacron due to aortoiliac occlusive disease, and re-intervention for thrombosis of left arm at 6 months. Hospitalisation at 22 months was required due to a toxic syndrome, which was diagnosed as enteric-paraprosthetic fistulae after complementary studies. The graft was removed and an extra-anatomic revascularisation was performed. Microbiology specimens taken from the duodenal segment in contact with the prosthesis showed the prosthetic segment and peri-prosthetic fluid were positive to C. parapsilosis.
DiscussionThe finding of C. parapsilosis in all cultures taken during surgery, along with negative blood cultures and no other known sources of infection, is of interest. It is an unusual pathogen with low virulence and limited as regards other Candida species. Our patient had no clinical data common to cases of infection with C. parapsilosis, and the mechanism of graft infection is unknown.
ConclusionGraft infection by C. parapsilosis may be anecdotal. However, its consequences can also be severe. Microbiological tests can be useful to adjust antimicrobial therapy in the post-operative period, but their usefulness for determining the aetiology is doubtful, as it may be just an incidental finding.
La fístula aortoentérica es una entidad rara y potencialmente letal que puede producirse por comunicación entre la aorta, habitualmente aneurismática, y el tracto entérico (fístula primaria) o tras procedimientos reconstructivos de aorta con prótesis, bypass aortorrenal o endarterectomía (fístula secundaria). Esta última puede presentarse de 2 maneras: la comunicación anastomótica entre la luz aórtica e intestinal, conocida como fístula enteroprotésica verdadera, y la menos común, por la erosión aortoentérica, sinus enteroparaprotésico o fístula enteroparaprotésica, en la cual se produce una lesión en el intestino como consecuencia del contacto directo con la prótesis vascular1–3.
La incidencia de las fístulas aortoentéricas secundarias es baja y cifrada entre el 0.4 y el 1.6%4, número nada despreciable considerando la frecuencia de los injertos implantados. El germen etiológico más frecuente es el Staphylococcus spp. con un 40% de los casos, los bacilos gramnegativos, que representan en conjunto un porcentaje similar y las infecciones polimicrobianas, que alcanzan un 10-15% de los casos5. Las infecciones por hongos son infrecuentes, sin evidencia conocida para Candida parapsilosis.
El género de cándida se considera como un hongo emergente, en el que se han descrito múltiples mecanismos patogénicos, tales como: la producción de prostaglandinas, especialmente D2 y E2, lo cual le permite modular la respuesta de los linfocitos helper, derivar su respuesta a Th2 y conferirle a la cándida un mecanismo de resistencia. Asimismo, se ha descrito la creación de biofilms y respuestas inflamatorias fuertes relacionadas con interleucina 22 y el factor de necrosis tumoral alfa6,7.
La vía horizontal en medios hospitalarios ha sido relacionada como el principal mecanismo de transmisión, con la fungemia como la morbilidad más importante, ya que en varias regiones del mundo se considera la C. parapsilosis el germen más comúnmente aislado en estos casos, no así en Estados Unidos de América y en países nórdicos, donde Candida albicans y Candida glabarata son más frecuentes. Otras morbilidades se han descrito como: endocarditis sobre la válvula protésica, artritis y onicomicosis8,9.
ObjetivoPresentar un caso de fístula enteroprotésica, en el que el único germen aislado fue C. parapsilosis, un germen inhabitual.
Caso clínicoPaciente de 65 años de edad, fumador de 68 paquetes/año, sin otros antecedentes relevantes, que fue remitido a nuestro centro hospitalario por isquemia crítica de extremidades inferiores con índices tobillo-brazo de 0.31 en el derecho y 0.19 en el izquierdo. La arteriografía digital por sustracción mostró: doble arteria renal bilateral, con permeabilidad de aorta, ilíaca común derecha e hipogástrica derecha con oclusión de la ilíaca externa derecha y de todo el eje ilíaco izquierdo; asimismo, oclusión de ambas arterias femorales comunes, arterias femorales superficiales y femorales profundas en su inicio con permeabilidad de ramas distales de la arteria femoral profunda a través de colaterales. Las arterias poplíteas y los troncos distales eran permeables bilateralmente.
Se realizó un bypass aortobifemoral con prótesis de dacron (16×8mm, Vaskutek Ltd. Escocia, Reino Unido) con anastomosis proximal lateroterminal en aorta y terminolateral en ambas femorales profundas. Se cumplieron correctamente los protocolos de profilaxis antibiótica, que fueron adecuados a este tipo de cirugía, es decir: amoxicilina clavulánico 2g + gentamicina 210mg en dosis única, previamente al procedimiento. Durante el postoperatorio solo destacó el íleo paralítico, que se resolvió con tratamiento médico. Los índices tobillo-brazo postoperatorios fueron de 0.54 bilaterales.
A los 6 meses se reintervino por isquemia aguda de la extremidad inferior izquierda, por oclusión de la rama izquierda del injerto aortobifemoral. Se le realizó trombectomía y prolongación a poplítea izquierda. Se cumplió nuevamente la profilaxis antibiótica.
A los 8 meses de la reintervención, se le practicó examen angiográfico por la sospecha de estenosis de salida de la rama derecha, detectada en controles ecográficos, cuya severidad no se confirmó y por consiguiente se adoptó actitud expectante.
A los 22 meses ingresó nuevamente al hospital para el estudio de síndrome tóxico con datos clínicos de 5-6 meses de evolución, consistente en: pérdida de 10kg de peso, anorexia, astenia, sensación de plenitud posprandial, odinofagia, disfagia, náuseas, vómitos, dolor abdominal con alteración del hábito intestinal y de las evacuaciones. Sin hemorragia digestiva alta o baja, ni fiebre o sensación distérmica.
El examen físico se encontró dentro de la normalidad, excepto por la presencia de tumoración no pulsátil, en región inguinal izquierda; los pulsos femorales estaban presentes, sin datos clínicos sugestivos de isquemia distal ni lesiones tróficas.
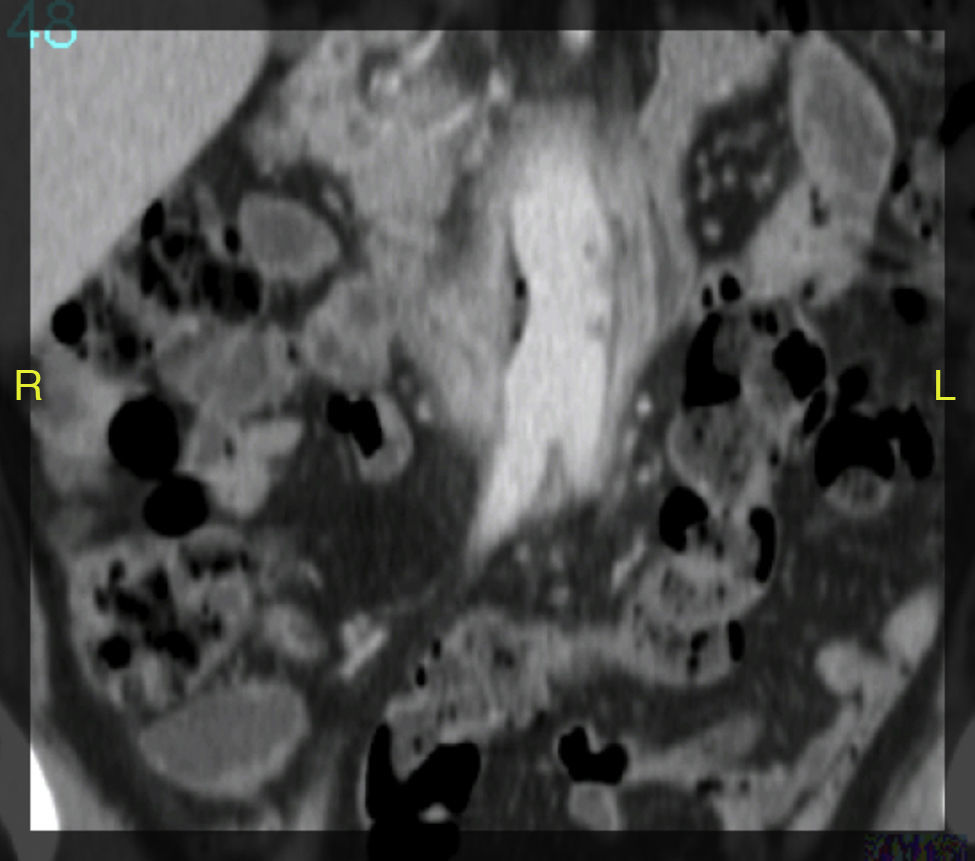
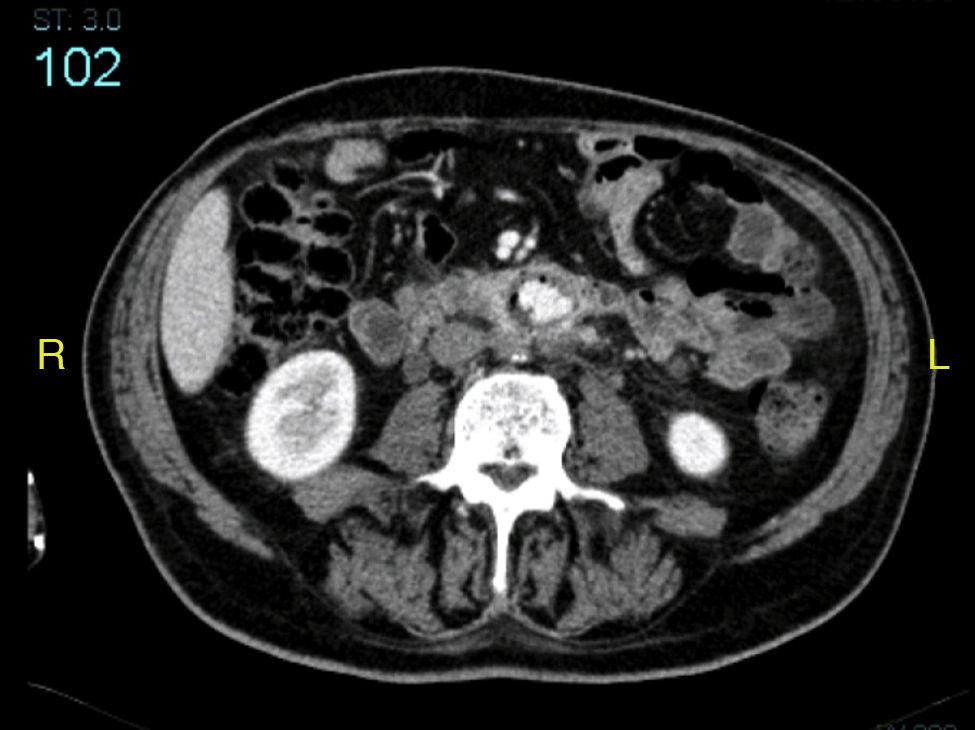
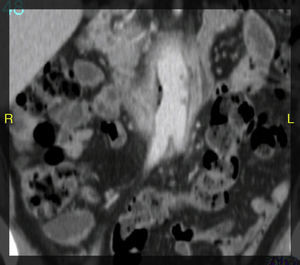
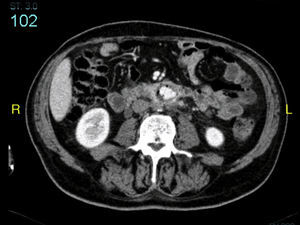
La angio-TAC mostró: halo hipodenso en el segmento proximal del bypass, con la presencia de aire en íntimo contacto con la tercera porción duodenal y visualizándose una dudosa línea de contigüidad con luz intestinal. Asimismo, se observaron protrusiones hipodensas hacia la luz de la prótesis, en contigüidad del halo hipodenso referido (figs. 1 y 2). Desde el punto de vista radiológico, los hallazgos eran sugestivos de infección protésica.
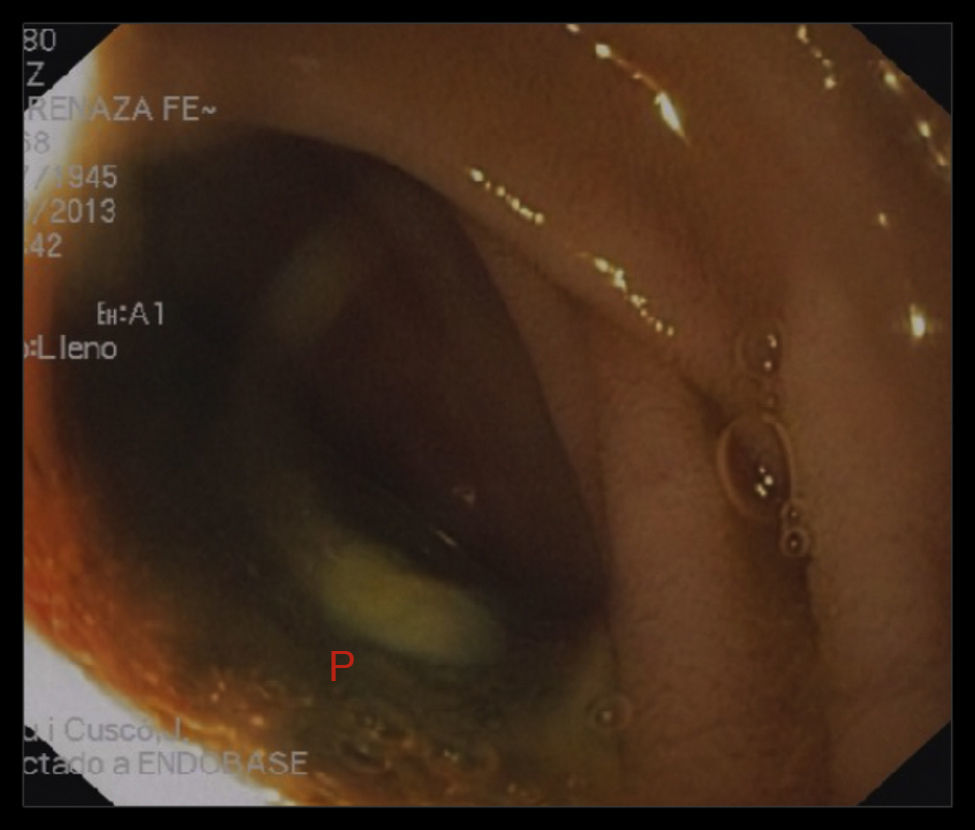
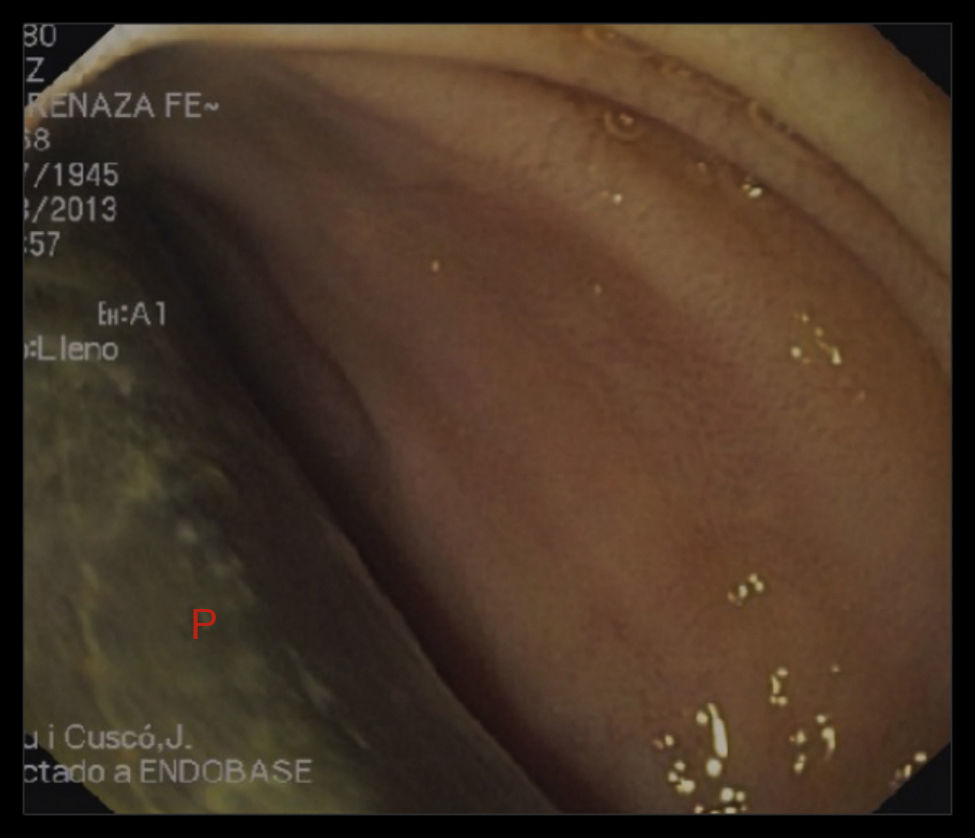
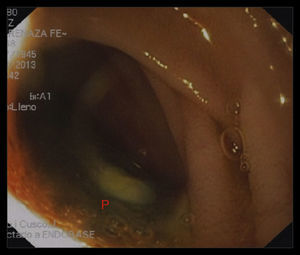
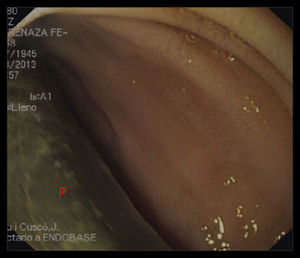
Una endoscopia digestiva alta evidenció contacto de la prótesis de dacron a través de la luz intestinal a nivel del primer segmento duodenal (figs. 3 y 4).
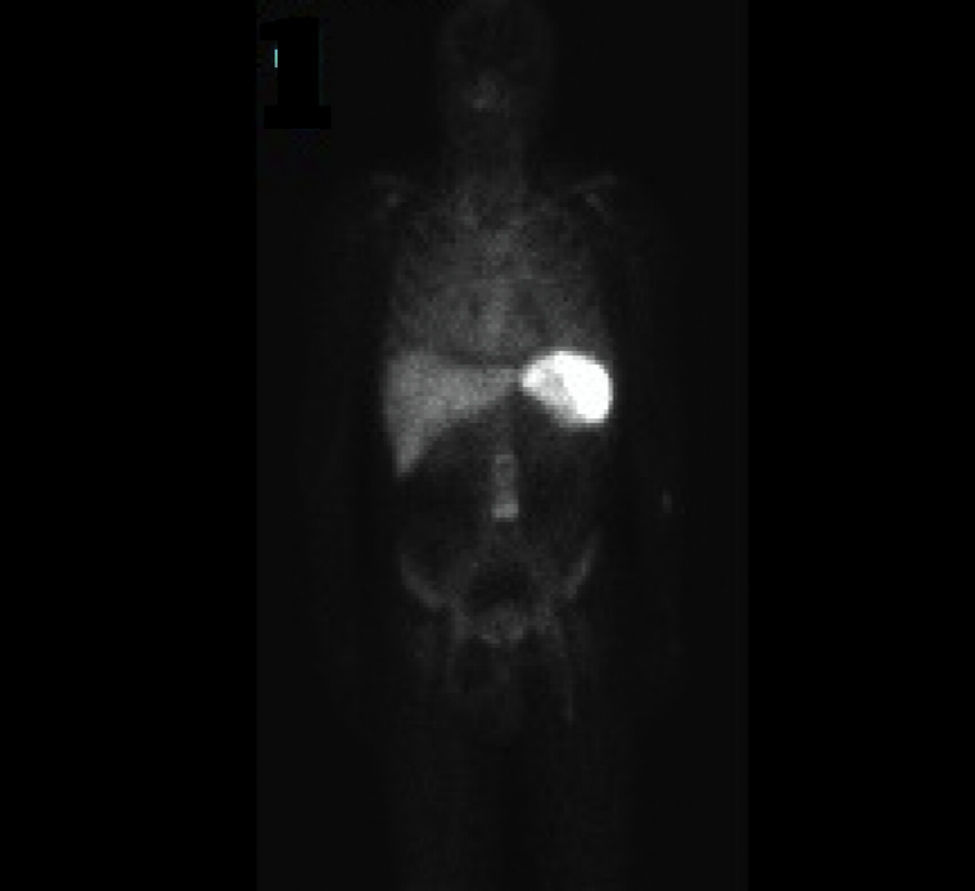
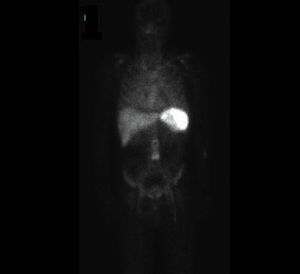
La gammagrafía evidenció un proceso infeccioso circunscrito a la zona periprotésica que se extendía desde el nacimiento de la arteria mesentérica superior hasta la bifurcación ilíaca, sin evidencias de infección en otras localizaciones (fig. 5).
En los estudios de laboratorio destacan: leucocitos 14,600/mm3, con neutrofilia del 80%; proteína C reactiva en 6.2mg/dl; protrombina del 62% (INR de 1.41). El resto de los estudios que se realizaron para localizar un foco infeccioso alternativo fueron negativos.
Se programó cirugía en 2 tiempos. En el primer tiempo quirúrgico se realizó de forma inmediata bypass axilobifemoral con politetrafluoroetileno expandido y desconexión de ambas ramas femorales del bypass previo. Con una semana de diferencia se le realizó el segundo tiempo quirúrgico, que se adelantó debido a que se observó un sangrado digestivo bajo con un descenso en el estudio de laboratorio de 2g/dl de hemoglobina; durante la cirugía se observó el ángulo de Treitz íntimamente adherido a masa flogótica periaórtica. Una vez disecada, permitió visualizar la ausencia de pared posterior duodenal a nivel de la tercera porción, con prótesis exteriorizada hacia ella. Se extrajo la prótesis aortobifemoral y la sutura del muñón aórtico infrarrenal con doble rafia de prolene 0. La exclusión duodenal fue realizada mediante anastomosis latero-lateral transmesocólica en cara anterior de la segunda porción duodenal.
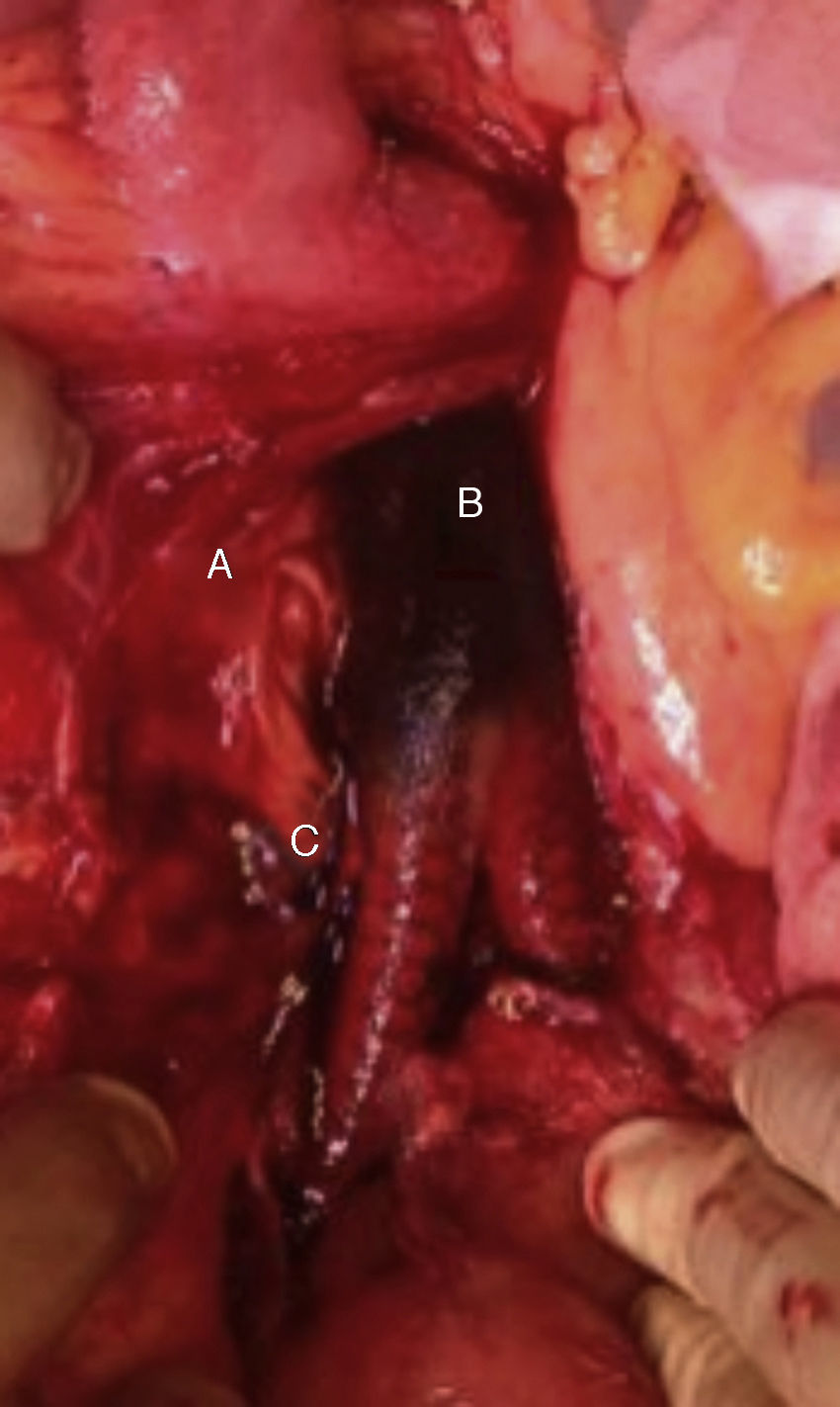
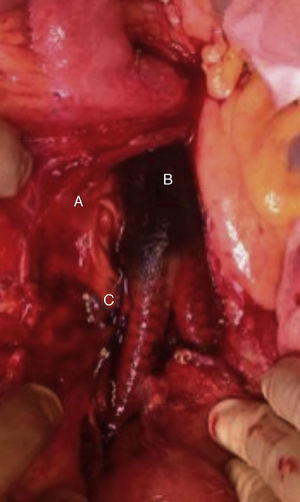
Se tomaron 3 muestras de cultivo durante la cirugía que corresponden al segmento duodenal en contacto con la prótesis, segmento protésico y frotis del líquido periprotésico, todas ellas fueron positivas para C. parapsilosis (fig. 6).
Campo quirúrgico, con exposición protésica. Se señalan con las letras A, B y C los sitios en los que se tomaron durante la cirugía las 3 muestras para su cultivo, que corresponden: A) al segmento duodenal en contacto con la prótesis, B) al segmento protésico y C) al frotis del líquido periprotésico.
El postoperatorio transcurrió sin incidencias, excepto por el íleo paralítico, que se resolvió con tratamiento médico. El tratamiento postoperatorio fue con fluconazol, inicialmente intravenoso que al momento del alta del hospital fue continuado vía oral. Después de 2 años, el paciente presenta una valoración física dentro de los límites normales, niega sintomatología y no existen exploraciones complementarias posteriores debido a su negativa a las revisiones.
DiscusiónLas fístulas enteroparaprotésicas han sido citadas en ocasiones como erosión protésica o erosión aortoentérica. La localización más frecuente, tal como lo fue en nuestro caso, es el duodeno. En el caso de la bibliografía, la indicación por síndrome de Leriche contrasta con lo expuesto en otras publicaciones, que señalan una incidencia casi insignificante cuando la técnica es realizada por enfermedad arterial oclusiva4,10.
Los signos clínicos descritos para fístula enteroparaprotésica pueden variar desde hemorragia gastrointestinal hasta ser clínicamente inespecífica y caracterizada solo por pérdida de peso, síndrome febril, que puede ir desde febrícula ocasional hasta shock séptico, dolor abdominal o síntomas inespecíficos.
Nuestro paciente fue ingresado con sospecha de síndrome tóxico y el hallazgo fue incidental durante un procedimiento radiológico. Sin embargo, hay que destacar que se adelantó el segundo tiempo quirúrgico al observar hemorragia digestiva baja4. La angio-TAC mostraba imágenes típicas como son el gas periprotésico, el contacto directo del intestino con el tejido inflamatorio y con la prótesis.
Dentro de los factores de riesgo para C. parapsilosis se han descrito: el uso de antibióticos como vancomicina y doripenem y la posible relación con antecedentes de dependencia al alcohol. En el caso que presentamos no existían antecedentes de uso de estos antimicrobianos, no había ingresos hospitalarios recientes ni tampoco destacaba la dependencia o consumo significativo de alcohol11.
Para el tratamiento de esta entidad se han descrito múltiples aproximaciones, desde el manejo conservador no quirúrgico hasta la reparación local con el retiro del injerto, con sustitución in situ o, como en nuestro caso, asociada a revascularización extraanatómica. Los resultados son variables según la literatura que se consulte2,12.
Con relación al tratamiento antibiótico, la susceptibilidad del germen permite su tratamiento con: anfotericina B, fluconazol, itraconazol, voriconazol y caspofungina. Sin embargo, la resistencia a fluconazol ha sido descrita principalmente relacionada con la mutación postexposición a fluconazol de los genes ERG11, CDR1 y menos frecuentemente MDR1 que codifican bombas de expulsión del fármaco. Nuestra primera línea de tratamiento antifúngico fue fluconazol, sin demostrarse persistencia del germen posterior al tratamiento13,14.
Sin embargo, nuestro hallazgo más relevante es la presencia de C. parapsilosis en todos los cultivos tomados durante la cirugía, con hemocultivos negativos y sin otros focos infecciosos conocidos. Clásicamente se han descrito como mecanismos de infección la contaminación directa de la prótesis en el momento de su implantación, en cuyo caso su periodo de presentación suele ser el primer año posterior a su instalación, que no es nuestro caso. Otra posibilidad es la infección diferida por vía hematógena, pero nuestro paciente no presentaba otros posibles focos infecciosos. Todo ello pone en entredicho el valor de los hallazgos microbiológicos en estos casos.
Adicionalmente a las técnicas habituales de cultivo y tipificación mediante viabilidad en CHROMagar y medio de Sabouraud se han descrito técnicas de tipificación mediante análisis genómico. En nuestro caso se realizó mediante agar de Sabouraud, ya que nuestro centro no tenía disponibles los kits de análisis genómico. Aun así, para nosotros los hallazgos de C. parapsilosis solo fueron considerados para ajustar la terapia antifúngica. Se desconoce si mecanismos etiopatogénicos del germen, como son la actividad hemolítica, fosfolipasa, esterasa y fitasa, jugaron un papel decisivo en la evolución de nuestro paciente, ya que estos no fueron analizados13.
Es conocida la baja virulencia de C. parapsilosis, limitada con respecto a otras especies de cándida; principalmente se relaciona con endocarditis en casos de uso de drogas por vía parenteral, enfermedades valvulares preexistentes, cirugías cardiacas previas, más letal en pacientes diabéticos15,16. Ninguna de estas condiciones estaba presente en el paciente descrito. Nuestro estudio incluyó la realización de ecocardiografía transtorácica y transesofágica que descartaron la presencia de endocarditis. Otras enfermedades que se han relacionado con C. parapsilosis son la endoftalmitis, artritis y peritonitis, usualmente relacionadas con procedimientos invasivos previos.
ConclusionesLa fístula enteroprotésica es de diagnóstico particularmente complejo y de elevada morbimortalidad asociada. La infección protésica por C. parapsilosis puede resultar anecdótica, sin embargo, sus consecuencias pueden ser igual de graves. El valor del estudio microbiológico resulta útil para ajustar una terapia antibiótica posterior a la cirugía. Queda en entredicho su utilidad para la determinación etiológica y puede incluso tratarse de un hallazgo incidental.
Se debe considerar el diagnóstico de fístula enteroparaprotésica en paciente con antecedente de injerto aórtico con signos clínicos de síndrome febril, asociado o no a hemorragia digestiva. La endoscopia digestiva alta, utilizada como primera elección en caso de hemorragia digestiva alta, puede permitir la visualización directa de parte de la pared protésica en la luz intestinal, aunque su realización supone riesgos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.