El uso de inhibidores de la enzima convertidora de angiotensina es eficaz para retardar la progresión de retinopatía diabética; se desconoce si su empleo se asocia con un mejor desenlace visual en pacientes con edema macular diabético.
Material y métodosEstudio observacional, comparativo, longitudinal y retrospectivo. Se evaluaron pacientes con edema macular diabético tratados mediante fotocoagulación, y con hipertensión arterial sistémica tratados con inhibidores de la enzima convertidora de angiotensina (grupo 1), y no hipertensos (grupo 2). La variable dependiente fue la proporción de mejoría visual, definida operativamente como la ganancia de una o más líneas de visión, 3 semanas después de la fotocoagulación; la variable independiente fue la presencia o ausencia del tratamiento con inhibidores de la enzima convertidora de angiotensina. Se comparó la proporción de ojos con mejoría visual entre grupos mediante χ2.
ResultadosTreinta y tres ojos (51.6%) se asignaron al grupo 1 y 31 (48.4%) al 2; el promedio de agudeza visual mejoró a las 3 semanas, con respecto al basal (p=0.002). La proporción de ojos con mejoría visual no difirió entre los pacientes tratados con inhibidores de la enzima convertidora de angiotensina (45.5%) y aquellos que no los recibían (51.6%, p=0.4).
ConclusionesLa proporción de ojos con mejoría visual entre los pacientes tratados con inhibidores de la enzima convertidora de angiotensina y quienes no lo usaban no tuvo diferencia significativa. No se sustenta inhibir la angiotensina II como terapia adjunta a la fotocoagulación focal, para mejorar el desenlace en pacientes con edema macular diabético.
Angiotensin converting enzyme inhibitors are effective in delaying the progression of diabetic retinopathy. It is unknown if their use is associated with a better visual outcome in patients with diabetic macular oedema.
Material and methodsA non-experimental, comparative, longitudinal and retrospective study was performed on patients with diabetic macular oedema treated by focal photocoagulation, and with systemic arterial hypertension treated with angiotensin converting enzyme inhibitors (Group 1), and without hypertension (Group 2). The dependent variable was the proportion with visual improvement, operatively defined as the gain of one or more lines of vision three weeks after photocoagulation. The independent variable was the use of angiotensin converting enzyme inhibitors. The proportion of eyes with visual improvement after treatment was compared between groups using the Chi squared (χ2) test.
ResultsA total of 33 eyes (51.6%) were assigned to group 1, and 31 (48.2%), to group 2. The mean of visual acuity improved after three weeks, compared with baseline (p=0.002). The proportion of eyes with visual improvement did not differ between patients treated with angiotensin converting enzyme inhibitors (45.5%) and those that did not use them (51.6%, p=0.4).
ConclusionsThere was no statistical difference in the proportion of eyes with visual improvement between patients treated with angiotensin converting enzyme inhibitors and in those where they were not used. There is no support for the inhibition of angiotensin II in addition to photocoagulation for improving the outcome in patients with diabetic macular oedema.
El edema macular es la principal causa de pérdida visual en pacientes con cualquier grado de retinopatía diabética, y el edema macular se caracteriza por el engrosamiento de la mácula debido a la acumulación de líquido en el tejido retiniano, que separa los fotorreceptores, por lo que disminuye la visión1.
La pérdida de las células de soporte en los capilares de la retina (pericitos) forma microaneurismas y permite la filtración de líquido y elementos inflamatorios que producen edema macular2–4. La fuga capilar puede surgir de una lesión localizada (edema focal), o de una red capilar extensa dañada (edema difuso).
El tratamiento estándar para el edema macular con filtración localizada es la fotocoagulación focal, que cierra los sitios de fuga capilar y promueve la resorción del líquido extravasado; este tratamiento reduce la incidencia de pérdida visual moderada (3 líneas de visión) del 33 al 13%5.
Aunque la fotocoagulación logra la involución del edema, en pocas ocasiones consigue mejorar la visión6,7. Esta ausencia de mejoría podría asociarse con otros elementos que contribuyen a formar el engrosamiento, como inflamación, factores de permeabilidad vascular y angiotensina II (Ang II)8.
El factor de crecimiento endotelial vascular, también conocido como factor de permeabilidad vascular, permite el transporte transcitótico del líquido hacia la retina a través de unas estructuras de la pared endotelial, conocidas como caveolas. El líquido que fuga por las caveolas puede retirarse mediante la enzima ATPasa del epitelio pigmentario; este mecanismo es insuficiente en los ojos con edema macular, por el aumento de la concentración retiniana del factor de crecimiento endotelial vascular, que favorece la persistencia del engrosamiento de la mácula.
Otro componente en la formación del edema macular diabético es el sistema renina-angiotensina-aldosterona, que también existe en la retina9; la Ang II es una hormona reguladora del balance de líquido y sodio, así como del crecimiento celular10, que ejerce su efecto mediante 2 receptores principales: AT1 y AT2. Los receptores AT1 median la vasoconstricción, la liberación de vasopresina y aldosterona, la fibrosis, el crecimiento y la migración celular. Los AT2 conllevan reacciones contrarreguladoras como vasodilatación, liberación de óxido nítrico e inhibición de la proliferación y el crecimiento11.
La síntesis de Ang II en la retina se realiza por la acción de la enzima convertidora de angiotensina, que se produce en el endotelio capilar y en el epitelio pigmentario retiniano; el receptor tipo 1 de Ang II se localiza en el mismo sitio que el del factor de crecimiento endotelial vascular12.
Se ha reportado que los inhibidores de la enzima convertidora de angiotensina son más eficaces para disminuir la incidencia y la progresión de la retinopatía diabética, y para favorecer su regresión en diabéticos tipo 213; no se ha descrito el efecto que tendría bloquear la Ang II en un evento de corto plazo, como la resolución del engrosamiento después de la fotocoagulación focal, en ojos con edema macular diabético.
La Ang II aumenta la expresión de factor de crecimiento endotelial vascular, por lo que su bloqueo farmacológico teóricamente permitiría acelerar la resolución del engrosamiento macular, al reducir la filtración capilar dependiente de las caveolas; este mecanismo podría facilitar la resolución del edema y ayudar a mejorar la función visual después de la fotocoagulación focal.
Se desarrolló un estudio para comparar la proporción de ojos con mejoría visual después de la fotocoagulación, entre pacientes ya tratados con inhibidores de la enzima convertidora de angiotensina y los pacientes que no los recibían, con la finalidad de identificar si bloquear la Ang II podría ser eficaz para mejorar el desenlace funcional en diabéticos con edema macular.
Material y métodosSe realizó un estudio observacional, comparativo, longitudinal y retrospectivo, en pacientes con edema macular diabético de tipo focal.
La población objetivo fueron los pacientes diabéticos con edema macular, que acudieron al Servicio de Oftalmología, del Hospital Juárez de México, de la Secretaría de Salud en la Ciudad de México y su área metropolitana; la población accesible fueron los pacientes tratados en un hospital general entre el 26 de marzo de 2008 y el 3 de diciembre de 2013. El estudio se desarrolló del 20 de abril al 20 de mayo de 2015, y fue autorizado por las Comisiones de Investigación y Ética, y de Investigación de la institución donde se realizó.
Se incluyeron pacientes de cualquier género, y de edad adulta, con diagnóstico de edema macular clínicamente significativo, que hubieran sido tratados mediante fotocoagulación focal por un mismo especialista en retina, y que además tuvieran hipertensión arterial sistémica tratada con inhibidores de la enzima convertidora de angiotensina o sin hipertensión arterial, que contaran con registro de agudeza visual mejor corregida bajo refracción subjetiva, medida en equivalente decimal y con un mapa rápido macular de tomografía de coherencia óptica, el día de la fotocoagulación y 3 semanas después.
Se excluyeron los pacientes con cualquier otro tratamiento antihipertensivo, o con opacidad de cristalino, así como otras enfermedades oculares que disminuyeran la visión.
Se eliminaron los pacientes que no asistieron a las visitas de seguimiento y aquellos con datos incompletos.
La variable dependiente fue la mejoría de la agudeza visual, definida operativamente como la ganancia de una o más líneas de visión después de la fotocoagulación; la variable independiente fue el uso de inhibidores de la enzima convertidora de angiotensina. Ambas variables cualitativas nominales se calificaron como presente o ausente.
Se definieron como variables secundarias el grosor del punto central, grosor del campo central y volumen macular, y se midieron por tomografía de coherencia óptica con el equipo Stratus OCT (Carl Zeiss, Meditec, Dublin, CA, EE. UU.). Se identificaron los promedios de cambio a las 3 semanas posteriores a la fotocoagulación focal mediante t de Student para muestras pareadas.
Se comparó la proporción de ojos con mejoría visual entre los pacientes que tenían el tratamiento con inhibidores de la enzima convertidora de angiotensina y quienes no lo tenían, mediante χ2.
Se consideró significativa a una p<0.05; la información se almacenó y analizó con el programa SPSS IBM versión 22, para Windows.
ResultadosSe evaluaron 64 ojos de 53 pacientes, con edad entre 25 y 80 años (promedio 61, DE±9.7); 35 correspondieron a pacientes del sexo masculino (54.7%). El tiempo de evolución de la diabetes tuvo un recorrido de uno a 30 años (promedio 14.4, DE±6.9), 17 ojos eran de pacientes tratados con insulina (26.6%) y 48 de pacientes tratados con hipoglucemiantes orales o dieta. Treinta y tres ojos correspondían a pacientes que padecían hipertensión arterial sistémica (44.6%).
El grado de retinopatía diabética fue no proliferativa leve en 10 ojos (15.6%), no proliferativa moderada en 35 (54.7%), no proliferativa severa en 3 (4.7%), y proliferativa en 16 (25%); en 45 ojos el edema macular era monofocal (70.3%).
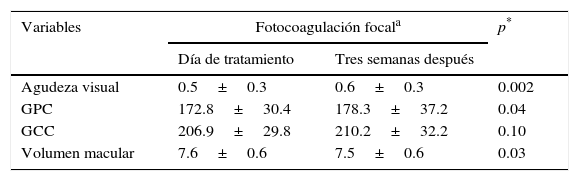
Antes de la fotocoagulación, la agudeza visual tuvo un recorrido de 0.13 a 1.00, el grosor del campo central de 146 a 287μm, el grosor del punto central de 122 a 260μm, y el volumen macular de 6.24 a 8.76 mm3. Tres semanas después de la fotocoagulación, la agudeza visual tuvo un recorrido de 0.10 a 1.00, el grosor del campo central de 131 a 313μm, el grosor del punto central de 112 a 307μm y el volumen macular de 6.35 a 8.87 mm3. La comparación de las variables medidas el día de la aplicación del láser macular selectivo y 3 semanas después se muestra en la tabla 1.
Comparación de agudeza visual y variables anatómicas el día de tratamiento y 3 semanas después
| Variables | Fotocoagulación focala | p* | |
|---|---|---|---|
| Día de tratamiento | Tres semanas después | ||
| Agudeza visual | 0.5±0.3 | 0.6±0.3 | 0.002 |
| GPC | 172.8±30.4 | 178.3±37.2 | 0.04 |
| GCC | 206.9±29.8 | 210.2±32.2 | 0.10 |
| Volumen macular | 7.6±0.6 | 7.5±0.6 | 0.03 |
GCC: grosor del campo central; GPC: grosor del punto central.
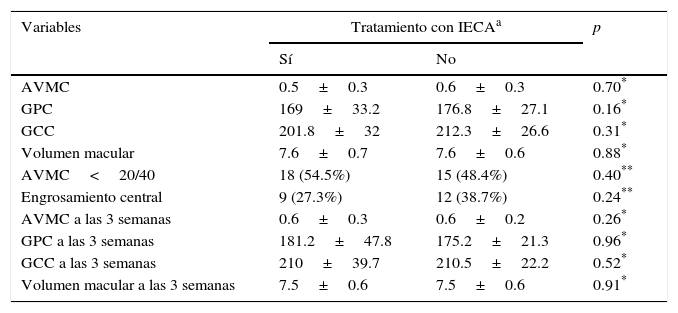
Del total de la muestra, 33 ojos eran de pacientes tratados con inhibidores de la enzima convertidora de angiotensina (51.6%), los cuales se asignaron al grupo 1, y los 31 restantes (48.4%) al grupo 2. La comparación de las variables entre grupos se muestra en la tabla 2; no existieron diferencias en las variables previas al tratamiento entre ambos grupos.
Comparación de agudeza visual y variables anatómicas entre grupos
| Variables | Tratamiento con IECAa | p | |
|---|---|---|---|
| Sí | No | ||
| AVMC | 0.5±0.3 | 0.6±0.3 | 0.70* |
| GPC | 169±33.2 | 176.8±27.1 | 0.16* |
| GCC | 201.8±32 | 212.3±26.6 | 0.31* |
| Volumen macular | 7.6±0.7 | 7.6±0.6 | 0.88* |
| AVMC<20/40 | 18 (54.5%) | 15 (48.4%) | 0.40** |
| Engrosamiento central | 9 (27.3%) | 12 (38.7%) | 0.24** |
| AVMC a las 3 semanas | 0.6±0.3 | 0.6±0.2 | 0.26* |
| GPC a las 3 semanas | 181.2±47.8 | 175.2±21.3 | 0.96* |
| GCC a las 3 semanas | 210±39.7 | 210.5±22.2 | 0.52* |
| Volumen macular a las 3 semanas | 7.5±0.6 | 7.5±0.6 | 0.91* |
AVMC: agudeza visual mejor corregida; GCC: grosor del campo central; GPC: grosor del punto central.
La proporción de ojos con mejoría visual en pacientes que recibían tratamiento con inhibidores de la enzima convertidora de angiotensina (45.5%) no difirió significativamente de la encontrada en los pacientes que no recibieron este tratamiento (51.6%, p=0.40) (tabla 3).
Comparación de mejoría visual entre grupos
| Tratamiento con IECA | Mejoría visual | Sin mejoría visual | p* |
|---|---|---|---|
| Sí | 15 (45.5%) | 18 (54.5%) | 0.40 |
| No | 16 (51.6%) | 15 (48.4%) |
IECA: inhibidor de la enzima convertidora de angiotensina.
La proporción de ojos con edema macular que presentó mejoría visual 3 semanas después de la fotocoagulación focal, fue semejante entre los pacientes que recibían tratamiento con inhibidores de la enzima convertidora de angiotensina y los que no lo recibían.
Se esperaba que la proporción de ojos con mejoría visual después de la fotocoagulación fuera mayor en pacientes tratados con inhibidores de la enzima convertidora de angiotensina, por el efecto benéfico que estos fármacos han tenido sobre la incidencia y progresión de la retinopatía diabética14.
En 2007, Cha y Kim15 reportaron que pequeñas dosis de inhibidores de la enzima convertidora de angiotensina no mostraban efectos benéficos, para retardar la progresión de retinopatía diabética no proliferativa severa.
Mauer et al.16 describieron en 2009 una reducción de 2 o más estadios en la incidencia de progresión de retinopatía diabética mediante el uso de un inhibidor de la enzima convertidora de angiotensina y un bloqueador de receptores 1 de Ang II, independientemente de los cambios en la presión sanguínea. Estos resultados coinciden con los encontrados por Harindhanavudhi et al.17 quienes reportaron en 2011 que 62 de los pacientes tratados con enalapril y losartán (27.8%) tuvieron una reducción significativa del 65 y 70% en la incidencia de progresión de retinopatía diabética, respectivamente.
Hogeboom van Buggenum et al.18 encontraron en 2002 que los ojos de pacientes tratados con inhibidores de la enzima convertidora de angiotensina tenían menores concentraciones de factor de crecimiento endotelial vascular en el vítreo, comparados con los de los pacientes que no tenían este tratamiento. Reducir la concentración ocular del factor de crecimiento endotelial vascular con sus fármacos antagonistas es el principio del tratamiento intravítreo en pacientes con edema macular; el efecto de la Ang II era teóricamente un elemento que podría haber favorecido la involución del engrosamiento y la mejoría visual.
La proporción de mejoría visual no cambió entre los pacientes que utilizaban tratamiento con inhibidores de la enzima convertidora de angiotensina y los que no, 3 semanas después de la fotocoagulación; esto podría deberse a que la intervención sobre la Ang II tuviera un efecto menor a corto plazo. Los estudios que evalúan la progresión en la retinopatía diabética tienen mediciones a largo plazo, ya que no se espera un cambio en el grado de retinopatía en un periodo corto.
Otro factor que pudiera haber intervenido es que el bloquear la Ang II inhibiera funciones protectoras, como las reguladas por el receptor tipo 2 de Ang II; se ha identificado que la fotocoagulación aumenta la expresión génica de los receptores tipo 2 de Ang II19, que facilitan el retiro del líquido intrarretiniano. El bloqueo completo de la producción de Ang II evitaría los efectos benéficos de la activación de los receptores tipo 2, y los asociados con la producción de Ang 1-714.
La enzima convertidora de angiotensina 2 transforma la Ang I en Ang 1-9 y también convierte la Ang II en angiotensina 1-7; esta última, que también puede generarse a partir de la Ang 1-9, tiene una acción antiproliferativa y vasodilatadora, capaz de contrarrestar los efectos mediados por el receptor 1 de Ang II (Burrell et al.20 2004). La expresión de Ang 1-7 disminuye conforme progresa la diabetes; Verma et al. demostraron en 201214 que la inyección de Ang 1-7 recombinante confiere un efecto protector contra la incidencia de retinopatía diabética en roedores.
Se ha descrito que los inhibidores de la enzima convertidora de angiotensina y los antagonistas de receptores de angiotensina (ARA II) no atraviesan la barrera hematorretiniana, debido a su peso molecular21, pero en el edema macular clínicamente significativo el daño en esta estructura permite la salida de moléculas más grandes (lipoproteínas)22, lo que permitiría a esos fármacos alcanzar el tejido retiniano; además, el efecto esperado se llevaría a cabo en las células endoteliales23, por lo cual no sería indispensable que cruzaran la barrera hematorretiniana.
La participación del sistema renina-angiotensina en la fisiopatología del edema macular diabético ya está documentada, pero no se ha establecido aun el sitio sobre el cual debe intervenirse para obtener una mejoría funcional con un tratamiento adjunto. Además de la información bioquímica disponible, los resultados de este estudio no sustentan el uso de inhibidores de la enzima convertidora de angiotensina para aumentar la incidencia de mejoría visual después de la fotocoagulación en edema macular diabético; por lo que se requiere evaluar prospectivamente el uso de antagonistas del receptor 1 de Ang II, para determinar si su empleo como terapia adjunta después de la fotocoagulación aumenta la incidencia de mejoría visual en pacientes diabéticos con edema macular.
ConclusionesLa proporción de ojos con mejoría visual no difirió significativamente entre los pacientes tratados con inhibidores de la enzima convertidora de angiotensina y los pacientes que no los usaban. No se cuenta con evidencia que apoye el bloqueo de la producción de Ang II como terapia adjunta después de la fotocoagulación focal, en edema macular diabético.
Conflicto de interesesLos autores manifiestan no tener conflictos de intereses.