Este estudio investigó la transformación de la zeolita tipo cancrinita, junto con fases secundarias, en un sistema hidrotermal. Se emplearon como precursores el mineral caolín y NaOH bajo presión autogenerada a 140°C, variando el tiempo de reacción en intervalos de 0 a 10horas. El caolín, precursor principal, se sometió a análisis de difracción de rayos X (DRX), composición química elemental (FRX) y espectroscopia IR por transformada de Fourier (FT-IR). Los sólidos resultantes se caracterizaron mediante DRX. Inicialmente, se formaron fases cristalinas como zeolitas Na-P2, gismondina, analcima, natrolita y sodalita, pero con el tiempo se volvieron inestables y se disolvieron para formar nuevas fases. A las 8horas de reacción, predominaba la zeolita cancrinita, cumpliendo el objetivo principal del estudio. Se analizó el material sólido con microscopia electrónica de barrido (MEB) y FT-IR. Se evaluó el comportamiento de Na, Si y Al en las soluciones a lo largo del tiempo mediante plasma de acoplamiento inductivo (ICP). Se demostró concluyentemente que el caolín de Hidalgo es un precursor factible para sintetizar zeolitas, tipo cancrinita como fase predominante en 8horas a 140°C, empleando concentraciones moderadas de NaOH.
This study investigated the transformation of cancrinite-type zeolite, together with secondary phases, in a hydrothermal system. The mineral kaolin and NaOH were used as precursors under self-generated pressure at 140°C, varying the reaction time at intervals of 0 to 10hours. The kaolin, the main precursor, was subjected to X-ray diffraction (XRD), elemental chemical composition (XRF) and Fourier Transform IR Spectroscopy (FT-IR) analyses. The resulting solids were characterized by XRD. Initially, crystalline phases such as Na-P2 zeolites, gismondine, analcime, natrolite and sodalite were formed, but with time they became unstable and dissolved to form new phases. At 8hours of reaction, the cancrinite zeolite predominated, fulfilling the main objective of the study. The solid material was analyzed by scanning electron microscopy (SEM) and FT-IR. The behavior of Na, Si and Al in the solutions was evaluated over time by inductre coupled plasma (ICP). It was conclusively demonstrated that kaolin from Hidalgo is a feasible precursor to synthesize zeolites, cancrinite type as predominant phase in 8hours at 140°C, using moderate concentrations of NaOH.
En la actualidad las zeolitas sintéticas son consideradas como importantes materiales avanzados utilizados en numerosas aplicaciones técnicas, entre las más comunes están: tamices moleculares, catalizadores, fertilizantes, absorbentes, entre otras. Sus propiedades físicas y químicas, como la porosidad, el intercambio iónico, la absorción de agua, la biocompatibilidad y estabilidad química, hacen a las zeolitas cada vez más útiles en diversos campos de la biomedicina, incluidos en los sistemas de administración de fármacos, cicatrización de heridas, andamiajes utilizados en la ingeniería de tejidos, agentes antibacterianos, absorción de gases, hemodiálisis y relleno de raíces dentales1.
Existen diferentes tipos de precursores para la síntesis de estos materiales. Los más utilizados son productos químicos sintéticos de alta pureza y por lo tanto costosos2,3. No obstante, también existen precursores de bajo costo, como rocas feldespáticas, lodos de alumbre, cenizas volantes, minerales como la moscovita, desechos sólidos industriales y caolín4–10. Este último es uno de los precursores más utilizados para la síntesis de zeolitas debido a su accesibilidad y a su bajo costo en diversos países9,11–14. El estado de Hidalgo, México, alberga yacimientos de caolín, destacando la comunidad de Metepec. Este material posee características esenciales como blancura, brillo, aislamiento eléctrico, maleabilidad, resistencia a temperaturas, no toxicidad, compacidad y suavidad15. Sus aplicaciones clave abarcan: a) Refractarios: elaboración de perfiles, bloques y ladrillos refractarios de alta alúmina. b) Cerámica: producción de sanitarios, comedores, porcelana eléctrica y tejas de alto grado. c) Vidrio: formulación de placas de vidrio. d) Pinturas: pigmentos de extensión y fabricación de tintas. e) Plásticos: utilizado como relleno en hules y plásticos15. Sin embargo, la bibliografía científica hace mención que, para sintetizar zeolitas utilizando caolín13,16, este material en su gran mayoría requiere de un pretratamiento para transformarlo en metacaolín. Este proceso se realiza a temperaturas que van de los 600 a 900°C9,13,16–19. El uso de materiales inorgánicos naturales de baja calidad contribuye a la reducción de los problemas medioambientales y minimiza los costos de producción de las zeolitas, que se consideran minerales de alto valor9,20.
Entre los métodos para la síntesis de zeolitas destaca el método convencional o síntesis hidrotermal9,16,21,22, la cual se lleva a cabo en un reactor de politetrafluoretileno (PTFE), que se coloca dentro de un recipiente de acero inoxidable23. Se utiliza para obtener zeolitas variando los parámetros experimentales como: tiempo, temperatura y la concentración de los precursores, los cuales tienen una gran influencia en el tipo de zeolita que se desea obtener.
Una de las zeolitas que se ha sintetizado con materiales de bajo costo es la zeolita tipo cancrinita (CAN), la cual se caracteriza por su alta capacidad de adsorción debido a su estructura porosa17. Tiene una relación Si/Al=1, además de presentar anillos paralelos, los cuales se encuentran formados por un tetraedro de SiO4 y AlO4, donde los átomos de silicio y aluminio se encuentran alineados, formando pequeñas jaulas ɛ formadas por 5 anillos de 6 miembros y 6 anillos de 4 miembros que dan lugar a canales continuos formados por anillos de 12 miembros18,24. La fórmula química general de la cancrinita se representa como: [M6+xAy(H20)n]SiAlO4]6 donde M es un catión monovalente o divalente y A es un pequeño anión25. Sin embargo, diversos autores han logrado sintetizar la cancrinita, obteniendo más elementos químicos en su fórmula, dando como resultado variaciones de esta zeolita26. La zeolita tipo cancrinita posee varias aplicaciones en la industria farmacéutica, como agente antibacteriano y terapéutico contra la acidez estomacal27,28. Además, puede ser utilizada como tamiz molecular, contribuyendo a la eliminación de metales pesados en el tratamiento de aguas residuales29. Una aplicación adicional de este material fue su utilización en la fabricación de pasta para mortero, como se detalla en el estudio de Bayat et al.30. En dicho proceso, una mezcla de lodo rojo obtenido del proceso Bayer fue activada alcalinamente con hidróxido de sodio, resultando en la formación de zeolita tipo cancrinita como una de las fases cristalinas principales.
García et al.20 realizaron síntesis hidrotermal de la zeolita tipo cancrinita y fases secundarias, a partir de 2g de cerámica sanitaria fabricada a base de caolín. La cerámica pulverizada se mezcló con NaOH 5M a temperaturas de 100°C, 150°C y 200°C, variando el tiempo de reacción de 1 a 30 días. A 150°C las fases encontradas fueron: mullita, cuarzo, analcima y cancrinita. Esta última fue la fase principal en estas condiciones experimentales. La evolución a 200°C fue similar a 150°C teniendo a la cancrinita como fase principal. Los autores concluyen que los parámetros más adecuados para la síntesis de la cancrinita con la menor cantidad de fases secundarias son los siguientes; a) 150°C y 30 días de reacción, se alcanzó un máximo de 76% en masa. b) 200°C y 4 días de reacción se alcanzó un máximo de 92% en masa.
Passos et al.17 realizaron la síntesis de cancrinita y sodalita, por medio de metacaolín. El caolín fue calcinado a temperaturas de 700° y 900°C durante 2horas. La experimentación fue realizada con metacaolín, NaOH, Na2CO3 y H2O en recipientes de acero inoxidable durante 30-270min a temperaturas de 150-230°C. Las muestras se caracterizaron por difracción de rayos X (DRX), resonancia magnética nuclear, microscopia electrónica de barrido (MEB), termogravimetría y potencial Zeta. Concluyeron que los parámetros experimentales adecuados para la obtención de la fase cancrinita son: 230°C, 270min y una alta concentración de Na2CO3.
En la literatura se menciona que, a altas concentraciones de NaOH (16M), se produce preferentemente la sodalita, y concentraciones medias conducen a la formación de cancrinita31. Ocanto et al.31 obtuvieron zeolitas tipo cancrinita desordenada e intermedia a partir de la zeolita X. Para la obtención de la cancrinita desordenada, utilizaron una variación de NaOH (3M – 4M), y un tiempo de reacción de 14 días. Del mismo modo, para la cancrinita intermedia utilizaron una concentración NaOH 4M a un tiempo de reacción de 4 días. Además, mencionan que la formación de la cancrinita ideal transcurre en varias etapas y que la cancrinita desordenada y la fase intermedia son precursores en la formación de la cancrinita ideal.
Ríos et al.19 realizaron la síntesis hidrotermal de zeolita cancrinita y otras fases por medio de caolinita y metacaolinita (obtenida por medio de calcinación a temperaturas de 600, 950 y 1000°C) con concentraciones variables de NaOH (1,99-3,99M), a temperaturas de reacción de 100 a 200°C durante diferentes tiempos de reacción (de 6horas a 7 días). Los sólidos sintetizados fueron caracterizados por DRX, espectroscopia infrarroja mediante transformada de Fourier (FT-IR), MEB y análisis termogravimétrico. Las mejores condiciones para la obtención de una mezcla de fases de las zeolitas tipo cancrinita, sodalita y zeolita LTA fueron a bajas temperaturas y concentraciones de NaOH (1,33M, 100°C) y a un tiempo de reacción hidrotermal de 5 días. Mientras, a mayores temperaturas y concentraciones de NaOH (200°C 3,99M) y a un tiempo de 7 días de reacción, se obtuvo un mayor número de fases como la cancrinita, sodalita, analcima, faujasita y zeolitas LTA y JBW19.
De acuerdo con la información recabada, los tiempos de reacción en la síntesis de la fase cancrinita (en la mayoría de las investigaciones) superan las 24horas de reacción hidrotermal, además de realizar otros procesos experimentales previos a la materia prima, como un tratamiento térmico a temperaturas elevadas, desde 600 hasta, 900°C con el propósito de convertir el caolín a metacaolín18. Esto significa un importante consumo de energía para efectuar la síntesis hidrotermal, lo cual puede ser perjudicial para el medio ambiente. Otro punto a resaltar son los materiales o reactivos químicos para la síntesis de la fase cancrinita, ya que algunos trabajos experimentales utilizan zeolitas sintéticas (X)31, o carbonato de sodio como precursores químicos sintéticos19, lo que representa un costo elevado para la obtención de la cancrinita.
El propósito principal de esta investigación es utilizar caolín de baja calidad, proveniente del municipio de Metepec, estado de Hidalgo, México, para examinar la influencia del tiempo de reacción en la síntesis hidrotermal y en la transformación del material. Se busca analizar las distintas fases cristalinas obtenidas a lo largo del tiempo, con el objetivo principal de lograr predominantemente la fase tipo cancrinita en un solo paso, prescindiendo así de la generación de metacaolín y utilizando únicamente la adición de hidróxido de sodio. Adicionalmente, se realiza un análisis detallado del comportamiento de los elementos sodio, silicio y aluminio presentes en la solución. El objetivo es esclarecer la contribución de cada elemento en la formación o desintegración de cada fase cristalina a medida que se extiende el tiempo de reacción. La síntesis de la zeolita tipo cancrinita es de particular importancia, ya que, debido a sus aplicaciones, puede contribuir significativamente a la remediación del medio ambiente mediante la eliminación de metales pesados de aguas residuales. Además, la morfología semiesférica de este material lo hace apto para aplicaciones en la industria farmacéutica.
Materiales y métodosSíntesis hidrotermalLa síntesis de zeolitas se realizó en reactores de acero inoxidable. Se utilizó caolín de baja calidad de la empresa Moliendas Beycar S. de R.L. de C.V del estado de Hidalgo, México, y una solución precursora de NaOH 3M, marca MEYER con una pureza de 97% y agua desionizada.
Enseguida se adicionó 1g de caolín sin ningún tratamiento con un tamaño de partícula de 38μm junto a 30ml de la solución precursora en un recipiente de politetrafluoroetileno (teflón), el cual se colocó dentro de un reactor de acero inoxidable. La reacción hidrotermal fue realizada a los tiempos de 0, 1, 2, 4, 6, 8 y 10horas, a una temperatura constante de reacción de 140°C. Una vez finalizado el proceso hidrotermal, los reactores se enfriaron con agua fría con el fin de detener la reacción. A continuación, se procedió a realizar la filtración por gravedad mediante el uso de papel filtro y abundante agua desionizada y se secaron en un horno a 60°C durante 24horas. Finalmente, las muestras obtenidas se molieron manualmente en un mortero de ágata y se guardaron en pequeñas bolsas de plástico. Cada uno de los experimentos se realizó por triplicado. El caolín como precursor principal fue analizado por DRX, FRX y FT-IR, mientras que los sólidos sintetizados fueron caracterizados por DRX. La cancrinita como fase predominante se obtuvo de la muestra correspondiente a 8horas de reacción hidrotermal. Dicha muestra fue caracterizada por MEB y FT-IR. Finalmente, las soluciones derivadas de cada muestra se analizaron por medio de plasma de acoplamiento inductivo (ICP) con la finalidad de evaluar el comportamiento del Na, Si y Al en función del tiempo de reacción estudiado.
Técnicas de caracterizaciónA continuación, detallamos las técnicas empleadas en la caracterización tanto del caolín en calidad de materia prima como de los sólidos derivados de la reacción hidrotermal.
Fluorescencia de rayos X (FRX)Se llevó a cabo el análisis de composición química del caolín mediante fluorescencia de rayos X (FRX) utilizando un espectrómetro de marca RIGAKU ZSX Primus II operado en un ambiente de vacío. El equipo se calibró utilizando diversos óxidos minerales de composición conocida. Para la preparación de las muestras, se realizó una fusión de 0,8g de la muestra con 7,2g de fundente compuesto por Li2B2O7 y LiBO2 granular grado ultra puro en una proporción de 1:1. La irradiación se realizó utilizando una fuente de Rh y se utilizaron los cristales LiF200, Ge111 y T1AP. La pérdida por calcinación (PXC) se obtuvo mediante el proceso de calentamiento de 1g de la muestra previamente triturada y desecada a una temperatura de 950°C durante una hora, seguido por la medición de la disminución en la masa en términos porcentuales.
Difracción de rayos X (DRX)El caolín y los sólidos obtenidos por medio de la síntesis hidrotermal se caracterizaron por medio de la técnica de DRX para observar la identificación de las fases cristalinas. Los materiales se analizaron con un difractómetro marca INEL modelo Equinox 2000, el rango del ángulo 2θ se ejecutó de 10-55°, la fuente de irradiación fue de Co Kα1 (λ=1,789010Å), con un detector curvo, 30mA de corriente y un voltaje de 25kV. Los patrones de DRX se procesaron con el programa Match.
Microscopia electrónica de barrido (MEB)El análisis de MEB se realizó en un equipo JSM-IT300 (JEOL Ltd., Tokio, Japón) y un detector de rayos X OXFORD (Oxford, Reino Unido) con 20kV de tensión de aceleración. Previo al análisis las tres muestras correspondientes a las 8horas de reacción se colocaron en una fracción de cinta de grafito, ensambladas a su vez en un porta muestras. Se realizaron rutinas puntuales semicuantitativas en áreas de barrido de aproximadamente 10,9mm2.
Espectroscopia infrarroja por transformada de Fourier (FT-IR)El análisis de transformación infrarroja de Fourier se realizó por medio de un espectrofotómetro Perkin Elmer FT-IR con accesorio universal de muestra ATR (Atemnated Total Reflectance), la cual proporciona la identificación de especies químicas e información estructural tanto del caolín como precursor principal como de los sólidos obtenidos a 8horas de reacción mediante la síntesis hidrotermal. El análisis se realizó en un rango de 400 a 4000cm–1 de longitud de onda.
Análisis químico por espectroscopia de emisión óptica con plasma de acoplación inductiva (ICP)El análisis por inducción de plasma acoplado inductivamente (ICP) se realizó en el equipo Optical Emission Spectrometer marca Perkin Elmer Optima 8300 ICP-OES, el cual permitió el análisis elemental simultáneo de las soluciones procedentes de las muestras correspondientes a 0, 1, 2, 4, 6, 8 y 10horas de reacción hidrotermal. Las mediciones se realizaron introduciendo las muestras acuosas en un plasma de argón a alta temperatura (6000-8000°C).
Resultados y discusiónCaracterización del caolínFluorescencia de rayos X (FRX) del caolínLa tabla 1 muestra los resultados del análisis de elementos mayoritarios llevado a cabo mediante FRX en la muestra de caolín empleada. Dentro de las especies identificadas, el SiO2 y Al2O3 destacan como las especies mayoritarias. Nótese un valor de la pérdida por calcinación (PXC) de 10,1, lo que indica la presencia de impurezas. Se asume principalmente la deshidroxilación de la caolinita, posible contenido de carbonatos (no detectados en DRX debido a sus bajas concentraciones) y materia orgánica, como se ha observado en investigaciones anteriores32,33. En otras palabras, si el porcentaje de óxido de silicio es alto y el porcentaje de la PXC es bajo, se trata de un caolín de baja calidad.
En cuanto a la composición porcentual, se aprecia que la muestra mayoritariamente consiste en sílice (SiO2), representando un 68,799% en masa, mientras que el contenido de óxido de aluminio (Al2O3) es del 19,577%. La suma total de los porcentajes de SiO2, Al2O3 y la pérdida por calcinación alcanza el 98,477% en masa, indicando que aproximadamente un 1,5% de la masa total corresponde a otros compuestos presentes, tales como óxidos de potasio, titanio, hierro, sodio y calcio. La relación SiO2:Al2O3 resulta en 3,5, lo cual confirma que se trata de un caolín de baja calidad32.
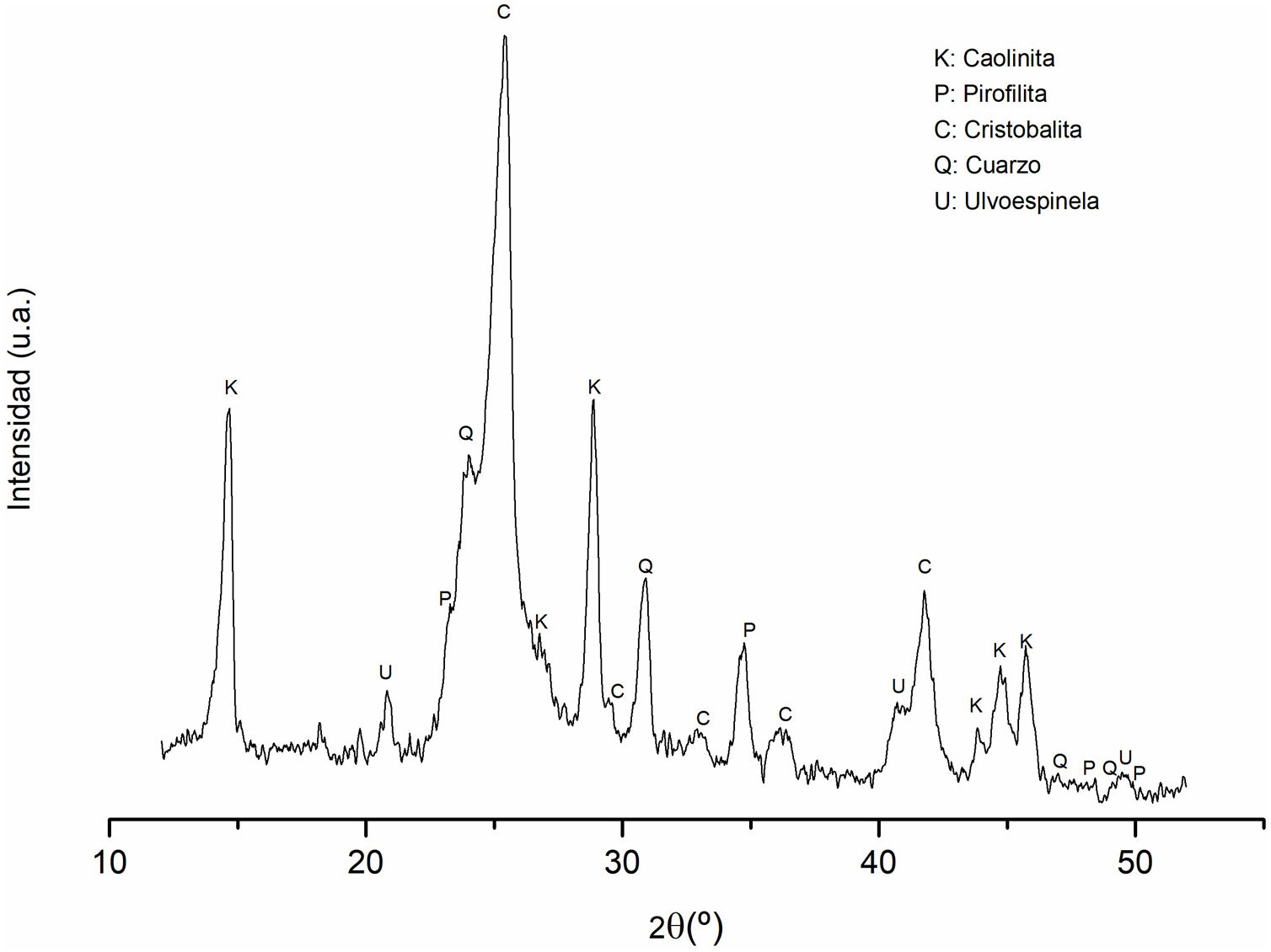
Difracción de rayos X (DRX) del caolínEl análisis cristalográfico del caolín se exhibe en la figura 1. Al examinar las señales de difracción, es posible discernir la presencia de dos fases polimórficas de sílice como fases mayoritarias. La primera se manifiesta en forma de cristobalita, mientras que la segunda se identifica como cuarzo, correspondiendo a JCPDS por sus siglas en inglés (Joint Committee on Powder Diffraction Standards) 969008227 y 969005021, respectivamente. Además de estas, una tercera fase cristalina se revela como caolinita (JCPDS 969009231); finalmente, con menor presencia se detectó una cuarta fase identificada como pirofilita (JCPDS 969000278).
Asimismo, se detectan indicios de la presencia de ulvoespinela como una quinta fase, respaldada por JCPDS - 969013546. Esta identificación se fundamenta con la presencia Fe2O3 y TiO2 en la composición química del caolín (ver tabla 1).
Las señales de difracción con mayor intensidad corresponden al óxido de silicio, siendo atribuidas principalmente a la cristobalita y al cuarzo. Por otro lado, los picos asociados a la caolinita muestran una intensidad menor, debido a la elevada proporción de sílice presente en la muestra, lo cual concuerda con los resultados del análisis químico realizado mediante FRX (tabla 1). Además de ello, se han identificado pirofilita, y, finalmente, se vinculan otros picos a la presencia de la fase mineralógica de ulvoespinela.
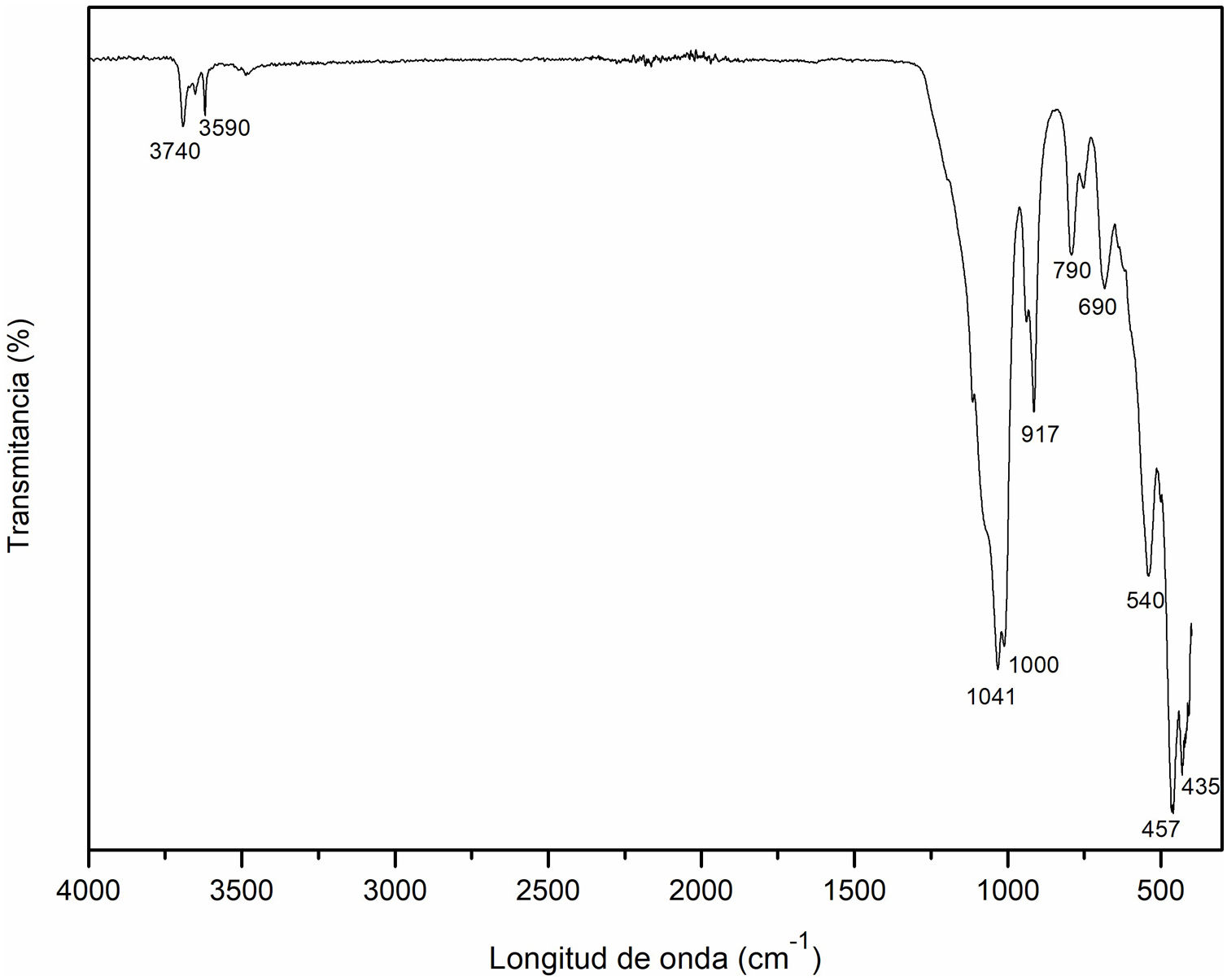
Espectroscopia infrarroja por transformada de Fourier (FT-IR) del caolínEn la figura 2 se muestra el espectro del caolín como material de partida mediante el análisis FT-IR. Los modos de vibraciones que se observan en las bandas a 435cm–1, 457cm–1, 690cm–1 y 790cm–1 son correspondientes a las vibraciones simétricas y asimétricas características de la presencia de cuarzo (enlace Si-O), así como la banda a 540cm–1 hace referencia al enlace Al-O, resultados similares a los obtenidos por Lozada et al.34 y Torres et al.35. La banda correspondiente a 917cm–1 puede referirse a la vibración O-H causada principalmente por los grupos Al-OH18. Mientras las bandas a 1000cm–1 y 1041cm–1 corresponden a las vibraciones de red Si-O-Si y Al-O del grupo Al-O-H, similar a lo publicado por Ríos et al.18. Finalmente, las bandas a 3590cm–1 y 3740cm–1 hacen referencia a los picos de absorción de la vibración de las moléculas de agua (O-H). Resultados similares en estudios anteriores divulgados por Lozada et al.34 Torres et al., 201135 y Davarcioglu36.
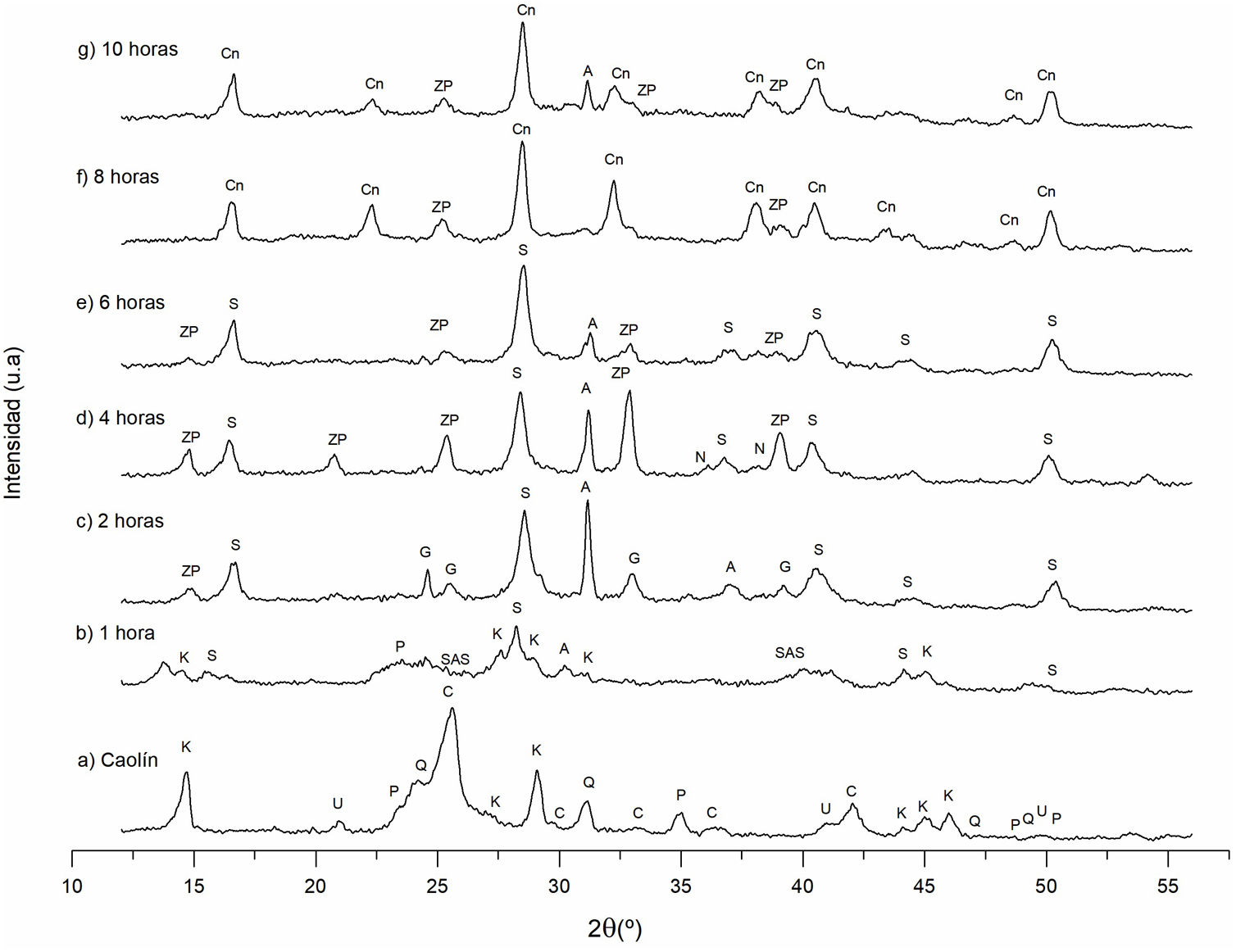
Estudio cristalográfico del proceso de transformación del caolín a cancrinitaDifracción de rayos X (DRX) de los sólidos sintetizadosEn la figura 3 se observan los difractogramas obtenidos a diferentes tiempos de reacción hidrotermal, a una concentración de NaOH 3M y temperatura constante. Al identificar las señales de difracción se aprecia la formación de distintas fases cristalinas, como la zeolita Na-P2, sodalita, cancrinita, analcima, entre otras, al igual que el cambio de intensidad de las fases cristalinas formadas respecto al incremento del tiempo de reacción.
Difractograma de los sólidos sintetizados a diferentes condiciones experimentales (tiempo de reacción). K: caolinita; P: pirofilita; C: cristobalita; Q: cuarzo; U: ulvoespinela; SAS: aluminosilicato de sodio; ZP: zeolita Na-P2; G: gismondina; S: sodalita; N: natrolita; A: analcima; Cn: cancrinita.
Las diferentes fases cristalinas se obtienen conforme el tiempo de reacción aumenta. A continuación, se analiza el tiempo en el cual las fases cristalinas se transforman.
Como se muestra en el anterior apartado «Difracción de rayos X (DRX) del caolín», las fases existentes iniciales son: cristobalita, cuarzo, caolinita, pirofilita y ulvoespinela. Se demuestra que estas fases cristalinas experimentan una modificación en su estructura al incrementar el tiempo de reacción. Las fases iniciales tienden a disolverse proporcionando a la solución silicio y aluminio para la formación de diversas estructuras cristalinas presentados a 1, 2, 4, 6, 8 y 10horas de reacción hidrotermal. Estas fases encontradas son similares a lo reportado por García et al.20, a otras condiciones de estudio.
Influencia del tiempo de reacción en las fases zeolíticas obtenidasTiempo de reacción de 0 a 1horaLa caolinita, cuarzo y cristobalita que se encuentran en el caolín son las fases de partida (fig. 3a). Estas fases son la fuente de Si y Al para formar las diversas fases zeolíticas. La figura 3b corresponde al polvo después de una hora de reacción, observando que el cuarzo y la cristobalita se disuelven parcialmente, mientras la caolinita comienza a disolverse progresivamente. Se distingue además la formación de nuevas fases cristalinas como son: sodalita, analcima y aluminosilicato de sodio.
Tiempo de reacción de 2horasEn la figura 3c ya no se observa la fase caolinita ni el aluminosilicato de sodio. Se asume que estas fases se disolvieron siendo fuente de aluminio, silicio y sodio para la formación de nuevas fases, las cuales son: zeolita Na-P2, sodalita, gismondina, analcima; estas dos últimas con una mayor intensidad. Estos resultados concuerdan con lo reportado por García et al.20, quienes mencionan que las fases correspondientes a la sodalita y la zeolita Na-P2 son las primeras fases en surgir a una concentración NaOH 5M.
Tiempo de reacción de 4horasLa figura 3d muestra que, a un tiempo de 4horas de reacción, las fases formadas son: zeolita Na-P2, sodalita, analcima y natrolita. Esta última es casi inapreciable. Comparando el tiempo de reacción de 2 y 4horas, se distingue la disminución de la fase analcima, mientras ocurre el incremento cristalino de las fases sodalita y zeolita Na-P2, cuyas señales de difracción están ubicadas a 28,29° y 32,81°, respectivamente (picos de mayor intensidad). Bajo estas condiciones experimentales la zeolita gismondina se asume que se disolvió.
Tiempo de reacción de 6horasEn la figura 3e se identifican las fases cristalinas formadas a un tiempo de 6horas de reacción. Dichas fases son: zeolita Na-P2, analcima y sodalita, siendo esta última la fase mayoritaria. Los picos ubicados a 14,89°, 25,36°, 32,99° y 38,98° pertenecientes a la zeolita Na-P2 empiezan a disminuir, lo equivalente ocurre con el pico ubicado a 31,36° propio de la analcima, mientras que la natrolita ya no está presente. La zeolita Na-P2, la sodalita y la analcima se comportan como fases metaestables, permaneciendo como minerales consolidados en estas condiciones experimentales.
Tiempo de reacción de 8horasEl estudio a un tiempo de 8horas de reacción hidrotermal se muestra en la figura 3f. Las fases formadas son: cancrinita y zeolita Na-P2. De acuerdo con las señales de difracción la cancrinita es la fase mayoritaria. Los picos de mayor intensidad correspondientes a esta fase están ubicados a valores de 16,68°, 28,43°, 32,31°, 38,02°, 40,49° y 50,20°, mientras que los picos correspondientes a la zeolita Na-P2 son: 25,26° y 39,17°.
Bajo estas condiciones, la fase analcima se volvió inestable y se disolvió parcialmente, mientras las intensidades de los picos correspondiente a la zeolita Na-P2 empiezan a disminuir con respecto a las 6horas de reacción. La disolución de la analcima proporcionó al sistema acuoso Si y Al, favoreciendo la cristalización de cancrinita20. En consecuencia, la cancrinita se convirtió en la fase mayoritaria en estas condiciones experimentales.
Tiempo de reacción de 10horasA este tiempo de reacción, la intensidad de los picos de la zeolita Na-P2 aumentaron, mientras la fase analcima nuevamente apareció como se muestra en la figura 3g. Caso contrario ocurre con la intensidad de los picos de la cancrinita, que bajo estas condiciones experimentales empiezan a disminuir, asumiendo que esta fase comienza a disolverse, proporcionando Si y Al al sistema provocando el crecimiento de la zeolita Na-P2 y analcima. Esto indica que el tiempo idóneo para obtener cancrinita como fase mayoritaria bajo estas condiciones es de 8horas de reacción.
Es evidente que los parámetros experimentales como el tiempo, la temperatura de reacción y la concentración de NaOH tienen una gran influencia en las fases zeolíticas a obtener. Asimismo, solo es necesario alterar uno de estos parámetros experimentales para obtener diversas fases. En este trabajo de investigación, el tiempo de reacción fue el parámetro experimental que se modificó.
En la tabla 2 se muestran los porcentajes de las diferentes fases cristalinas obtenidas. Dichos porcentajes varían al aumentar el tiempo de reacción: 2, 4, 6, 8 y 10horas, donde a un tiempo de 8horas la cancrinita es la fase mayoritaria con un porcentaje de 68,7%. También se muestran las formulas químicas de cada fase obtenidas por el software Match. La concentración molar de NaOH (3M) y la temperatura (140°C) permanecen como parámetros experimentales constantes.
Fases zeolíticas formadas de acuerdo con los resultados de DRX, representadas en valores porcentuales
| Tiempo (horas) | ZP (%)Al H14 Na O9.25 Si3 | S (%)Al3 Cl Na4 O12 Si3 | G (%)Al2 Ca H8.606 O12.303 Si2 | A (%)Al1.806 H4 Na1.71 O14 Si4.194 | N (%)Al2 H4 Na2 O12 Si3 | Cn (%)Al3 Na4 O14.35 Si3 |
|---|---|---|---|---|---|---|
| 2 | 5,5 | 18,3 | 25,1 | 50,8 | - | - |
| 4 | 23,9 | 24,8 | - | 31,7 | 19,6 | - |
| 6 | 25,7 | 54,2 | - | 20,1 | - | - |
| 8 | 31,3 | - | - | - | - | 68,7 |
| 10 | 27,4 | - | - | 44,3 | - | 28,3 |
ZP: zeolita Na-P2; S: sodalita; G: gismondina; A: analcima; N: natrolita; Cn: cancrinita.
Una vez analizada y discutida la influencia del tiempo de reacción en la aparición de las fases zeoliticas, ahora se describe de manera global el estudio de las transiciones de dichas fases en el tiempo estudiado.
El comportamiento reactivo del sistema Na2O-Al2O3-SiO2-H2O en un rango de 10horas, a condiciones isotérmicas y con concentraciones de alta alcalinidad en la solución hidrotermal, da evidencia de dos tipos de transiciones de fases: a) se encuentra la transición de fases polimórficas sodalita >> cancrinita, y b) la transición gismondina >> analcima, se muestra a partir de dos estructuras gismondina (G) (i.e., gismondina y Na-P2) y la analcima con un comportamiento metaestable37. El primer caso representa la transición más claramente observable debido a que la sodalita es estable entre 1 y 6horas, transitando a cancrinita a partir de las 8horas, sin que ambas coexistan en ninguno de los difractogramas. Ambas fases tienen una relación Si/Al igual a 1 y el término polimórfico es asumible cuando la fórmula ideal básica anhidra corresponde a Na8Al6Si6O24(OH)2, es decir, un compuesto hidroxilado, las posiciones aniónicas «extraframework» son ocupadas por grupos OH− y con Na+ en todas sus posiciones catiónicas o en clústeres con moléculas de H2O, en su caso. La sodalita está reportada normalmente como fase cúbica P4¯3n38 y la cancrinita cristaliza en el grupo hexagonal P6339.
En el segundo tipo de transición, la analcima (grupo triclínico P1, pseudocúbico con a ≈ 13,7 Å, también reportado en grupos cúbicos, tetragonales u ortorrómbicos40) aparece en coexistencia, en todos los tiempos de reacción, con una o dos estructuras topológicamente asociadas al armazón G o, dicho de otra manera, al grupo de la gismondina que cristalizan en el sistema tetragonal o de celda unidad pseudotetragonal, con grupo aristotipo P41/amd. La analcima normalmente se reporta con la fórmula química variable Na16-x(H2O)16+x[Al16-xSi32+xO96], con Si entre 28,6 y 36,3, y 12xAlxSi16−xO32·yH2O con 32Al2Si2O8·4H2O) está representada solo en el difractograma de 2horas de reacción, estabilizándose la fase Na-P2 en los demás difractogramas. El aporte de SiO2 disuelto en la solución hidrotermal a partir de la disolución del cuarzo y la cristobalita promueve la formación de Na-P2 o zeolita G con una mayor relación Si/Al que la de la gismondina.
De esta manera, dividimos el comportamiento reactivo de la solución hidrotermal de alta alcalinidad en dos sectores: el primero es aquel que evoluciona a partir de una relación Si/Al=1, mostrando una transición polimórfica (sodalita >> cancrinita); y el segundo está gobernado por una relación 1,4
Por otro lado, las trazas de aluminosilicato de sodio (SAS) son un subproducto de la reacción entre la caolinita y el NaOH, en los primeros estados de la evolución reactiva que, normalmente, viene acompañado con una porción amorfa de esa misma composición. Es, probablemente, un precursor de la gismondina y la analcima. La natrolita (NaAl2Si3O10·2H2O) aparece como fase metaestable enriquecida en Si con un papel residual en la estabilización de Na-P2. En la siguiente sección, se realizará un análisis en función del Na, Si y Al detectados en solución, durante el tiempo estudiado.
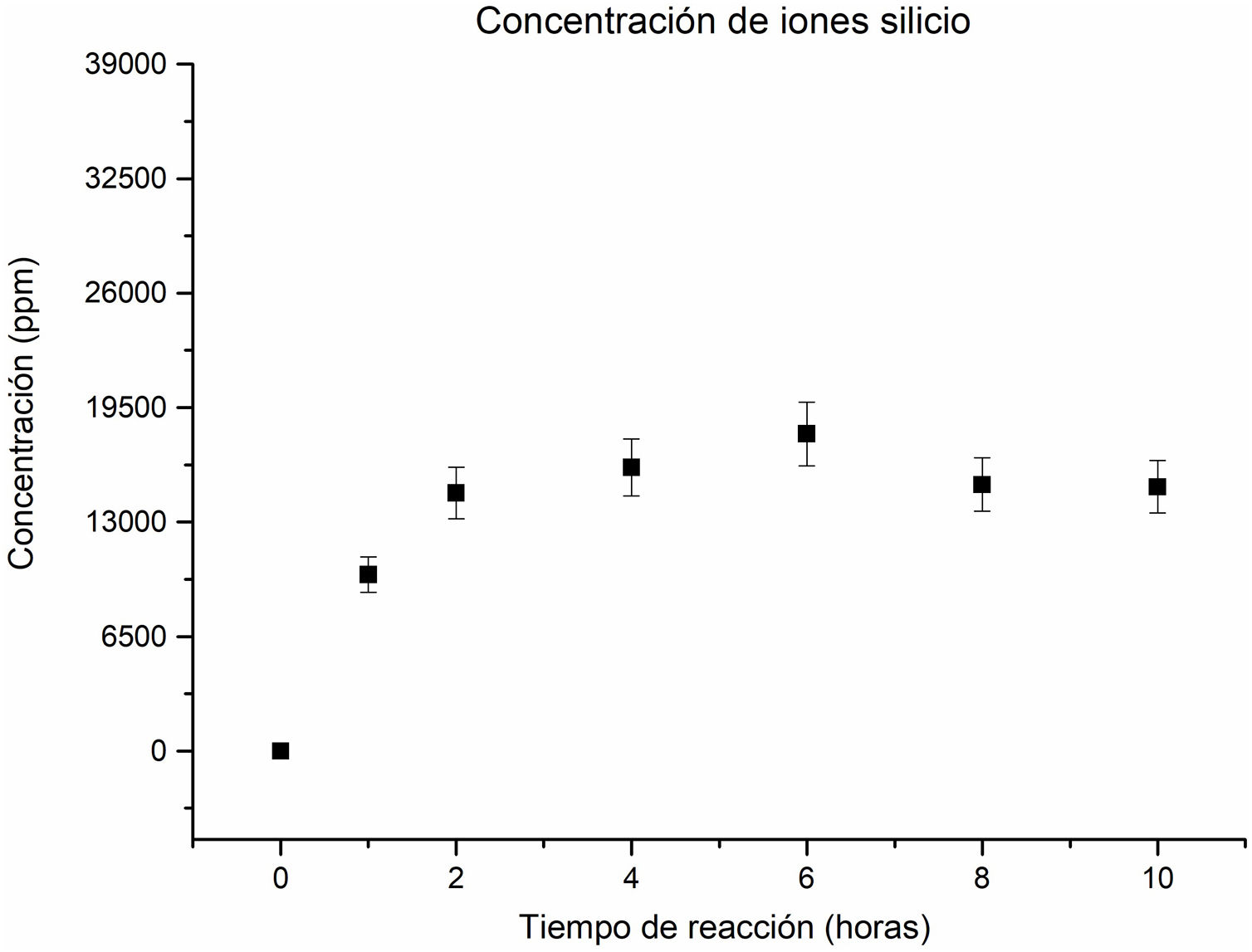
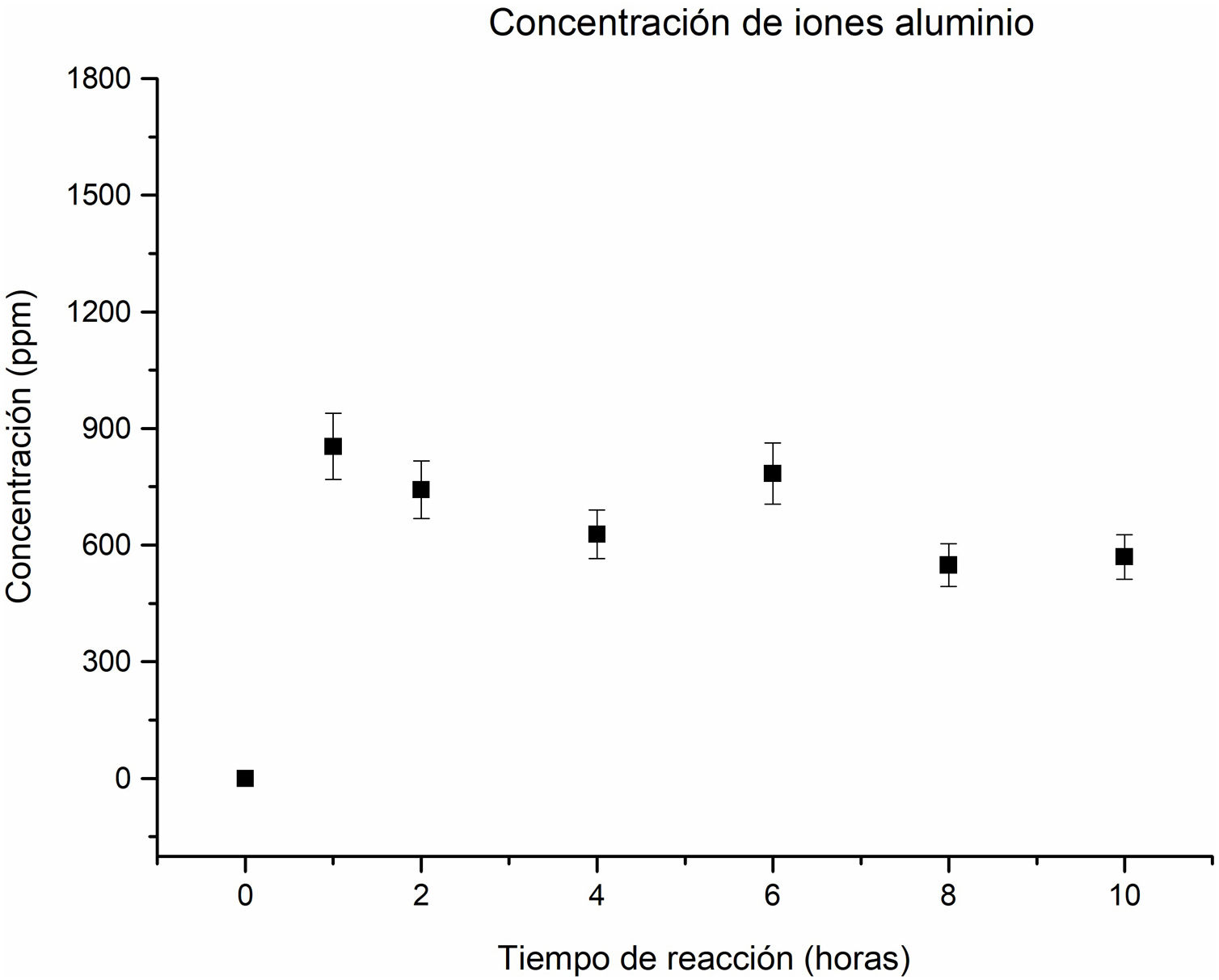
Análisis químico por espectroscopia de emisión óptica con plasma de acoplación inductiva (ICP) del Na, Si y Al, contenidos en las soluciones a los tiempos de reacción estudiadosSe realizó el análisis mediante ICP de las soluciones de todas las muestras sometidas a distintos tiempos de reacción. Se cuantificaron los elementos mayoritarios: Na, Si y Al, que conforman la estructura de las fases zeolíticas obtenidas. El objetivo principal fue medir la concentración de estos elementos presentes en las soluciones, para corroborar la formación de las diferentes fases zeolíticas a lo largo de todo el proceso.
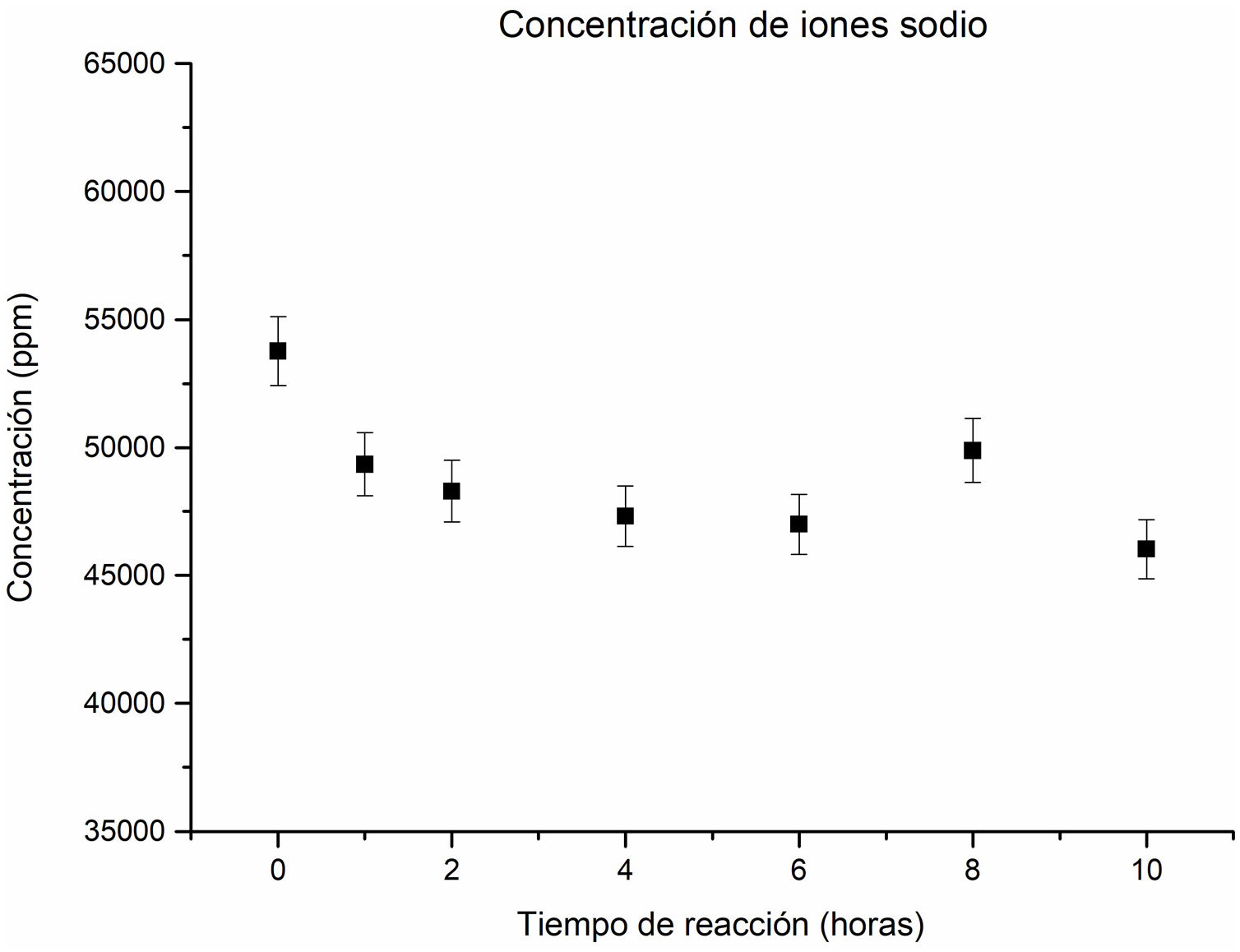
El análisis de la concentración de los iones sodio en la solución revela una tendencia descendente a medida que transcurre el tiempo de reacción hidrotermal, como se aprecia en la figura 4. Este comportamiento descendente es superior a un tiempo de una hora, lo cual se debe al consumo de iones sodio pasando de la solución al sólido y contribuyendo a la formación de nuevas fases zeolíticas, así como de los silicoaluminatos de sodio. Se observa que, en el intervalo de 1hora hasta 6horas de reacción, la concentración de sodio no presenta cambios significativos.
Sin embargo, a las 8horas de reacción, se observa un ligero aumento en la concentración de iones sodio en la solución. Este incremento se atribuye a la disolución parcial de fases obtenidas a las 6horas, tales como la analcima y la zeolita Na-P2, resultados acordes al estudio cristalográfico. Estos resultados proporcionan una perspectiva más clara sobre la evolución de las fases zeolíticas y su relación con la concentración de sodio a lo largo del proceso de reacción hidrotermal. Finalmente, a las 10horas de reacción, se observa una disminución de la concentración de iones sodio, lo cual se atribuye a la formación de la analcima y a una disminución de la fase de la cancrinita.
En relación con la concentración de los iones silicio en la solución, se ha observado un comportamiento ascendente hasta alcanzar las 6horas de reacción, como se puede apreciar en la figura 5. Esta tendencia indica una disolución gradual de la sílice inicialmente presente en el caolín, que alberga las fases cristalinas, caolinita, pirofilita y cuarzo (en la primera hora), como de las zeolitas que se forman y posteriormente se disuelven. Esto permite mantener un suministro constante de iones silicio en la solución durante todo el proceso, favoreciendo la formación continua de nuevos cristales de zeolita.
No obstante, a las 8horas, la concentración de iones silicio disminuye, lo que podría ser resultado de que, en ese tiempo, la cancrinita se convierte en la fase mayoritaria, consumiendo silicio en el proceso. Este cambio de concentración sugiere que se requiere una mayor cantidad de silicio para la formación de la zeolita tipo cancrinita. Estos resultados proporcionan una valiosa comprensión de cómo la concentración de iones silicio se relaciona con la formación de diferentes fases zeolíticas durante el proceso de reacción hidrotermal. A las 10horas la concentración de iones silicio permanece sin alteración significativa con respecto a las 8horas.
En relación con la concentración de los iones aluminio en la solución, se observa una disolución importante a una hora de reacción, lo que sugiere la disolución del aluminio contenido en las fases de partida como caolinita y pirofilita en el caolín. A partir de este punto y hasta las 4horas de reacción, la concentración muestra una tendencia descendente, como se aprecia en la figura 6. Este comportamiento indica un consumo de iones aluminio para contribuir a la formación de las fases zeolíticas.
A las 6horas de reacción, la concentración de los iones aluminio aumenta. En este comportamiento se asume que algunas fases como la analcima, natrolita y zeolita Na-P2 comienzan a disolverse, liberando iones aluminio a la solución. Sin embargo, a las 8horas, la concentración vuelve a descender, debido a que la cancrinita se convierte en la fase mayoritaria, lo que implica que los iones de aluminio contribuyeron a formar las nuevas fases cristalinas, favoreciendo la cristalización de la cancrinita, en coherencia con el estudio cristalográfico que se aprecia en la figura 3f. La concentración de iones aluminio de 8 a 10horas no tiene cambios significativos, comportamiento similar al de los iones silicio.
Microscopia electrónica de barrido (MEB) del sólido obtenido a 8h (cancrinita)Mediante la aplicación de la técnica de MEB se examinó la morfología del sólido obtenido tras 8horas de reacción a una temperatura de 140°C (fig. 7). Se observa que las partículas exhiben una configuración con tendencia hexagonal, propia de la estructura cristalina de la zeolita tipo cancrinita, coincidente con lo reportado por Deng et al.41 y Ocanto et al.31. Además, se notó una tendencia a la aglomeración de las partículas, conformando una entidad de mayor tamaño, con una longitud aproximada de 37,5μm.
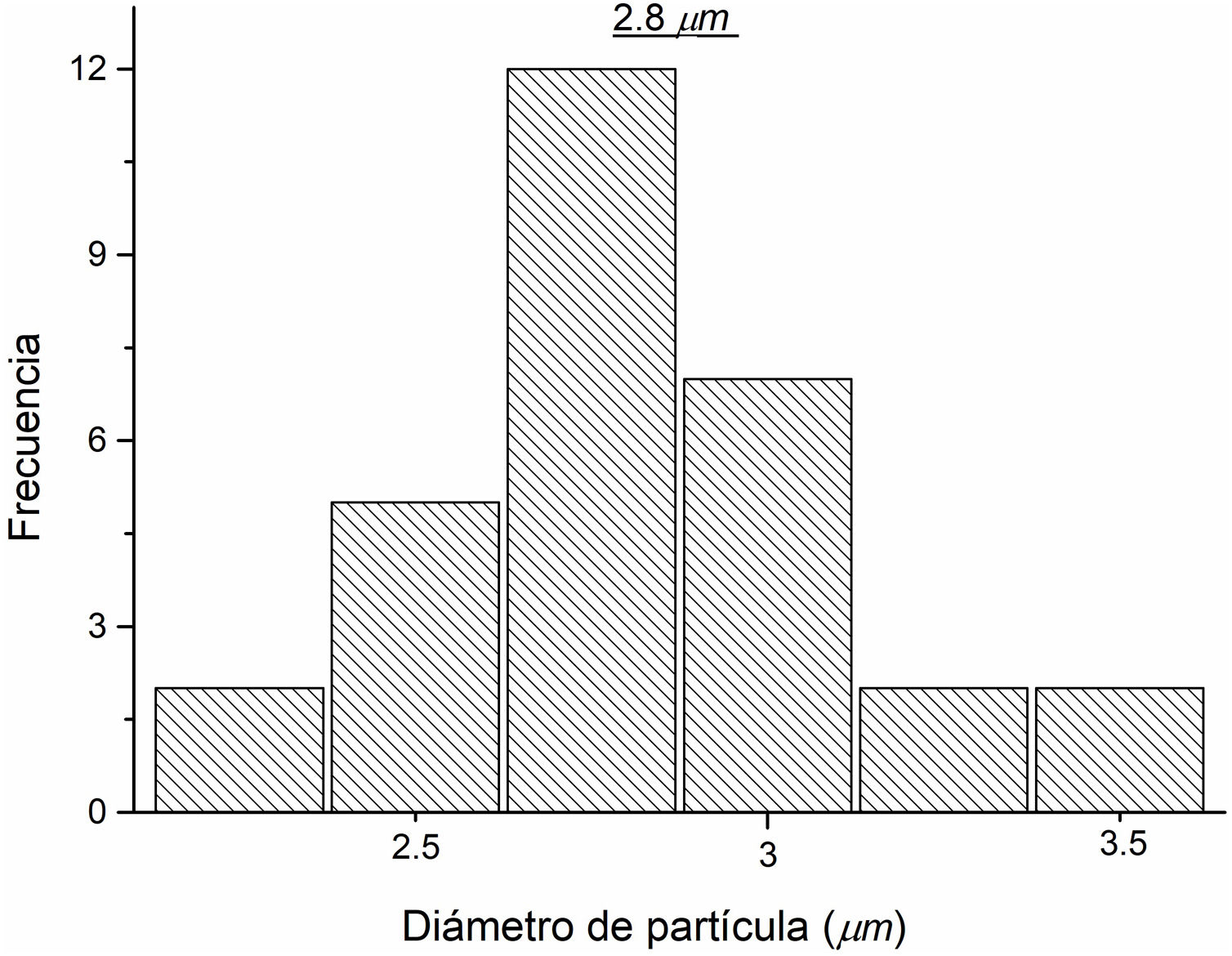
Para determinar el tamaño aproximado de las partículas presentes en la micrografía obtenida a través del análisis MEB, se realizó un análisis de tamaños de dichas partículas, contabilizando todas aquellas partículas claramente definidas en la figura previa. En la figura 8 se observa la distribución de tamaños de las partículas, las cuales tienen un rango de 1,7 a 3,57μm, mientras que la distribución promedio del tamaño de las partículas es de 2,8μm.
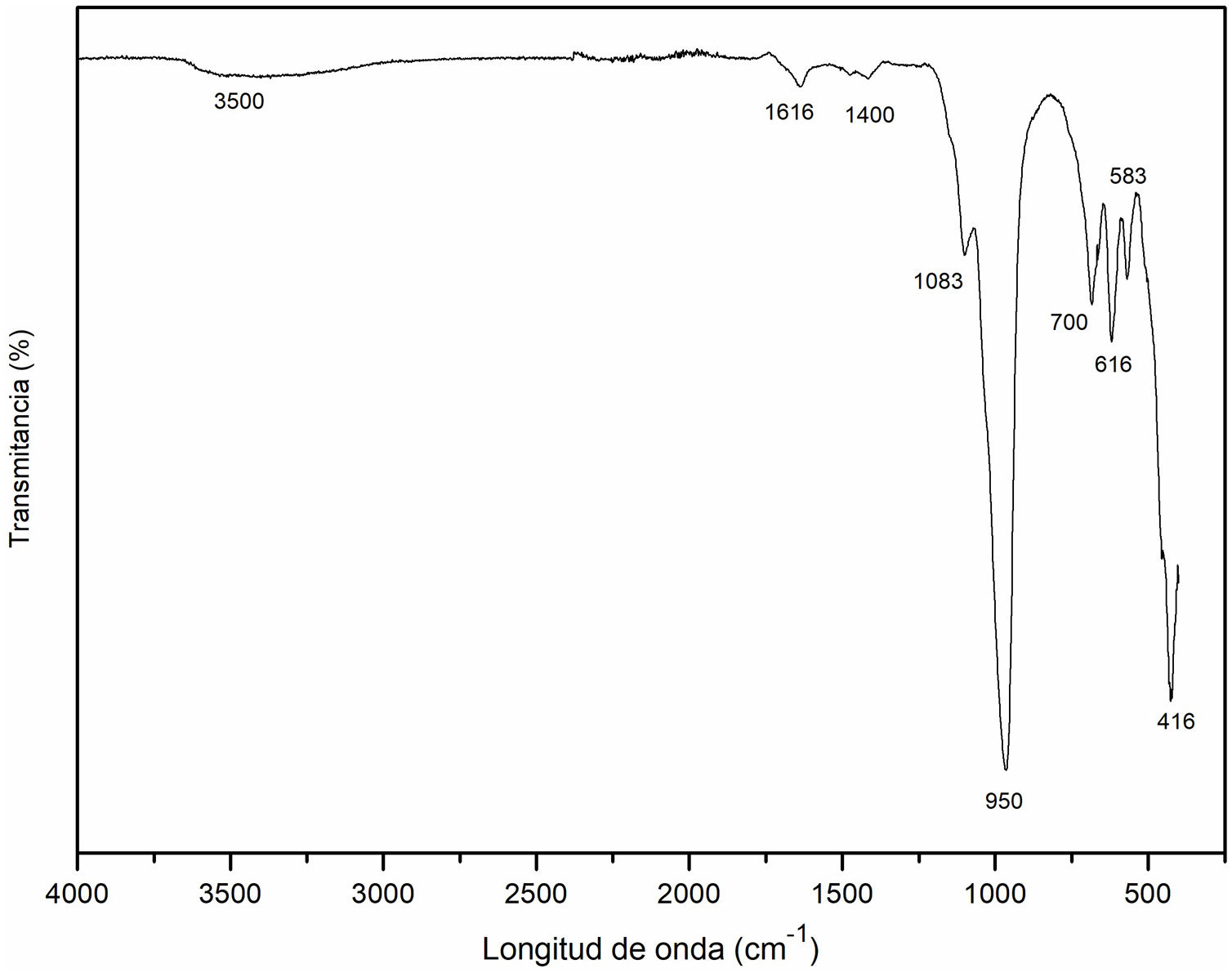
Espectroscopia infrarroja por transformada de Fourier (FT-IR) de la cancrinitaEn la figura 9 se representa el espectro infrarrojo de la muestra obtenida a un tiempo de 8horas de reacción hidrotermal, donde se obtienen las fases: zeolita Na-P2 y cancrinita, esta última como fase mayoritaria. La banda a 3500cm–1 se produce por la absorción de las moléculas de agua O-H. Este resultado concuerda con lo mostrado en la literatura, donde se menciona que las bandas entre 3600 y 3400cm–1 corresponden a grupos de O-H, típicamente relacionadas con estructuras zeolíticas20, mientras que las bandas a 1616cm–1 y 1400cm–1 corresponden a la vibración de estiramiento de los grupos O-H, debido al agua intersticial, la cual da lugar a las bandas de deformación20,42.
Las bandas localizadas a 1083cm–1 y 950cm–1 se refieren a los modos de vibración de estiramiento (stretching) asimétrico O-Al asociado a la presencia de cancrinita. De acuerdo con Ríos et al.18, con la desaparición de la caolinita, aparecieron en los espectros bandas correspondientes a zeolitas, incluyendo el estiramiento asimétrico O-Al localizado en la región de 1250-950cm–1 asociada a la presencia de cancrinita. Estos resultados son acordes a lo publicado por Linares y Brikgi43.
Las bandas a 700cm–1, 616cm–1 y 583cm–1 son características de la presencia de la cancrinita, resultados que concuerdan con lo publicado por Linares y Brikgi43. Finalmente, la banda a 420cm–1 está relacionada con las vibraciones tetraédricas internas de los enlaces Si-O y Al-O que de acuerdo con Karge et al.42, Ríos et al.44, García et al.20 y Rios et al.18 se trata de cancrinita y posiblemente de sodalita. En conclusión, la región 800-400cm–1 puede considerarse como la región de huella dactilar de las zeolitas tipo cancrinita y sodalita tal y como lo han sugerido en estudios anteriores18.
ConclusionesUno de los aspectos novedosos y enormemente significativos de este proceso reside en la capacidad para obtener zeolitas, incluida la cancrinita, y otras fases secundarias a partir de un subproducto industrial subestimado, como es el caolín de baja calidad. Este subproducto, comúnmente pasado por alto, se revela como un recurso potencialmente idóneo para la síntesis de zeolitas. La particularidad distintiva de este enfoque radica en la posibilidad de generar fases zeolíticas en un solo paso mediante la transformación directa del caolín e hidróxido de sodio. Este proceso prescinde de la necesidad de un tratamiento previo de calcinación, detalle de gran relevancia que caracteriza la singularidad de la investigación.
Durante el análisis de la transformación de las fases cristalinas formadas, se pone en evidencia que, gracias a la disolución del cuarzo, y por lo tanto una concentración importante de iones silicio propició la producción de diversos fenómenos físicos y químicos que inducen a la formación de sodalita y analcima, evidenciando que son las fases cristalinas precursoras para la formación de la cancrinita. Algunas de estas fases no resultan estables bajo las condiciones experimentales aplicadas, lo que implica que, a medida que aumenta el tiempo de reacción, ciertas fases como la gismondina, analcima, natrolita y zeolita Na-P2 tienden a disolverse.
Por lo tanto, es posible obtener la cancrinita como fase predominante mediante un proceso de reacción hidrotermal con una duración de 8horas, a una temperatura de 140°C y utilizando una concentración de NaOH de 3M. Es fundamental destacar que el caolín proveniente de Hidalgo, México, con una relación de sílice-alúmina de 3,5 y sin haber sido sometido a tratamientos previos, se revela como una opción óptima para la síntesis de zeolitas.
Los autores agradecen el financiamiento proporcionado por CONAHCYT a través del proyecto con número CF2019-39216 de la convocatoria de Ciencia de la Frontera, así como la beca otorgada con el número de CVU 893902. También expresamos nuestro agradecimiento a la UNAM (Universidad Nacional Autónoma de México) por su colaboración en el análisis de FRX. Por último, queremos expresar nuestro agradecimiento a la empresa Moliendas Beycar S. de R.L. de C.V., ubicada en el municipio de Metepec, estado de Hidalgo, México. Todas las organizaciones, instituciones y empresas mencionadas en esta sección están ubicadas en México.