El virus del papiloma humano (VPH) es el agente causal del 5% de los casos de cáncer en humanos, siendo causa necesaria para el desarrollo del cáncer cervical y responsable de un porcentaje variable de casos de cáncer de ano, vulva, vagina, pene y orofaringe.
Desde 2007, en España se comercializan 2 vacunas frente al VPH: bivalente (tipos VPH 16/18) y tetravalente (tipos VPH 6/11/16/18).
Con el fin de ampliar la protección conferida por las vacunas frente al VPH, en el año 2006 se inició el programa clínico de la nueva vacuna nonavalente, que incluye 9 tipos de VPH (6/11/16/18/31/33/45/52/58). Estos tipos son responsables del 90% de cánceres cervicales, del 82% de lesiones precancerosas anogenitales de alto grado y del 90% de verrugas genitales.
El objetivo de esta publicación es poner a disposición del profesional sanitario los datos científicos que avalan la nueva vacuna, así como el valor clínico que ofrece en nuestro medio.
Human papillomavirus (HPV) is the causative agent of 5% of human cancers. HPV infection is necessary for the development of cervical cancer and is responsible of a variable percentage of cancers of anus, vulva, vagina, penis, and oropharynx.
Since 2007, 2 vaccines against HPV have been commercially available in Spain: bivalent (HPV types 16/18), and tetravalent (HPV types 6/11/16/18).
In order to extend the protection afforded by HPV vaccines, a clinical program was launched in 2006 for the new nonavalent vaccine, including 9 HPV types (6/11/16/18/31/33/45/52/58). These types are responsible for 90% of cervical cancers, 82% of high-grade ano-genital pre-cancerous lesions, and 90% of genital warts.
The purpose of this publication is to provide healthcare professionals with the scientific evidence that supports the new vaccine, as well as the clinical value that it offers in our environment.
La familia del virus del papiloma humano (VPH) incluye más de 150 tipos de virus1, 12 de los cuales (16/18/31/33/35/39/45/51/52/56/58/59) se asocian a cánceres o lesiones precancerosas de alto grado1,2. Otros tipos como el 6 y el 11 se asocian a procesos benignos como verrugas genitales y papilomatosis respiratoria recurrente1.
Se estima que el VPH es el agente causal del 5% de los casos de cáncer en humanos. La infección por VPH es causa necesaria para el desarrollo de cáncer de cuello de útero y está relacionada con una elevada proporción de cánceres de ano, vulva, vagina, pene y orofaringe3,4.
Estudios europeos estiman que los VPH 16/18 son responsables de aproximadamente el 70% de los cánceres de cérvix y de una fracción variable de los cánceres de vulva, vagina, pene, ano y orofaringe; y los tipos VPH 6/11 del 90% de verrugas genitales y de los casos de papilomatosis respiratoria. Si a los 4 tipos previos se añaden 5 tipos oncogénicos más (31/33/45/52/58), estos 9 tipos están relacionados con el 89% de los cánceres anogenitales y el 82% de las lesiones precancerosas de alto grado asociadas a VPH en estas localizaciones4. Teniendo en cuenta estos datos, en España, se estima que, de los 2.308 casos de cáncer de cérvix anuales, 2.054 estarían causados por los 9 tipos, así como los 20.604-38.678 casos de neoplasias intraepiteliales de cérvix (CIN) grado 2 (CIN2), grado 3 (CIN3) y adenocarcinoma in situ4.
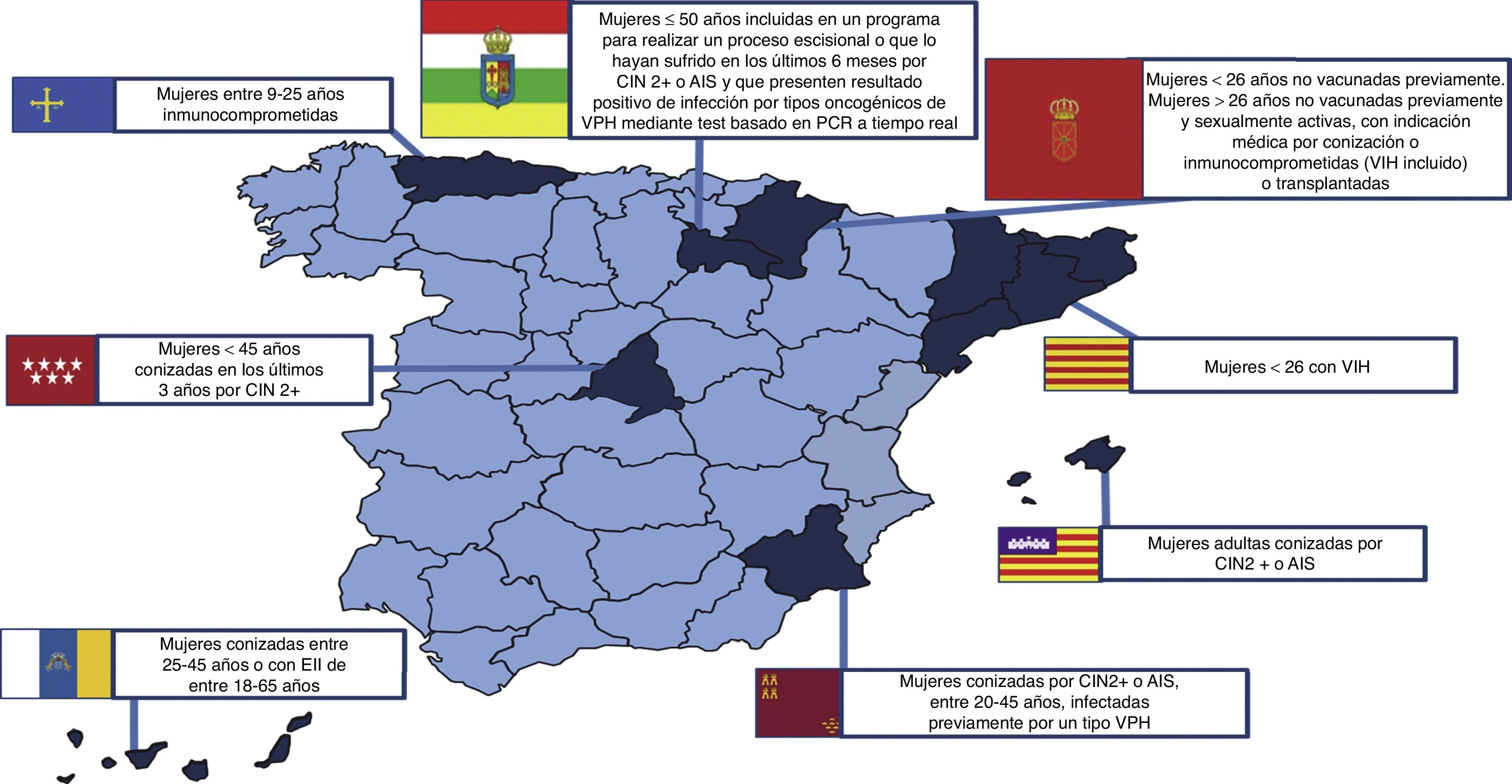
Desde el 2007 están comercializadas 2 vacunas frente al VPH en España: la bivalente (2vVPH), que contiene los tipos VPH 16/18, y la tetravalente (4vVPH) con los tipos VPH 6/11/16/185. Desde ese mismo año, el programa de vacunación nacional frente al VPH se dirige a niñas entre 11-14 años6. Actualmente se recomienda vacunar a todas las niñas de 12 años y con una pauta de 2 dosis7 espaciadas entre 6 y 12 meses. Los últimos datos de cobertura de vacunación frente al VPH, referentes a 2015, muestran una media nacional del 79,2%8. Además, recientemente se han incluido otros grupos especialmente susceptibles al VPH en los programas de vacunación de algunas comunidades autónomas con resultados de cobertura todavía no comunicados (fig. 1)9.
Programas de vacunación en grupos de pacientes susceptible a la enfermedad por VPH que complementan a la vacunación sistemática de las niñas dentro de los programas de vacunación. Fuente: Campins et al.9.
En el año 2006 se inició el desarrollo de la vacuna nonavalente (9vVPH) que incluye los tipos VPH 6/11/16/18/31/33/45/52/582 con el objetivo de obtener un mayor nivel de protección frente a cánceres y lesiones precancerosas asociadas al VPH
A la espera de que próximamente la 9vVPH se comercialice en nuestro país, la presente publicación pretende poner de manifiesto el valor clínico de esta nueva vacuna en la reducción de la enfermedad asociada al VPH.
Para ello, se ha realizado una selección de los principales artículos sobre la 9vVPH y la vacunación VPH en general, que incluye ensayos clínicos, artículos de revisión y recomendaciones de organismos internacionales. La información se ha estructurado y sintetizado en diferentes apartados teniendo en cuenta su relevancia para la práctica clínica del profesional sanitario.
Desarrollo, composición, aprobación e indicaciones de la 9vVPHEl principal reto en el desarrollo de la 9vVPH fue conseguir una composición que proporcionara una elevada protección frente a la enfermedad asociada a los 5 tipos adicionales de VPH, sin perder la inmunogenicidad conferida por la 4vVPH frente a los tipos comunes, y con un perfil de seguridad aceptable. La formulación que cumplió este objetivo fue evaluada en un estudio fase iii que permitió confirmar la composición final de la 9vVPH2.
Una dosis de 0,5ml de la 9vVPH contiene 30/40/60/40/20/20/20/20/20μg de proteína L1 de los VPH tipo 6/11/16/18/31/33/45/52/58, respectivamente, y 500μg de hidroxifosfato sulfato de aluminio amorfo, como adyuvante. Con el fin de evitar una menor inmunogenicidad debida a la interferencia inmunológica, las dosis incluidas de cada antígeno y adyuvante son superiores a las incluidas en la 4vVPH. El tipo de adyuvante y su concentración es la misma que se utiliza en determinadas vacunas frente al virus de la hepatitis B. Adicionalmente, como excipientes contiene cloruro sódico, L-histidina, polisorbato 80 y borato sódico10.
En junio de 2015, la 9vVPH fue aprobada por la Agencia Europea del Medicamento (EMA, según sus siglas en inglés)11, con indicación para la inmunización activa de mujeres y varones a partir de los 9 años, sin límite superior de edad12, frente a lesiones precancerosas y cánceres que afectan al cuello de útero, vulva, vagina y ano; y verrugas genitales, causados por los tipos de VPH incluidos en la vacuna10.
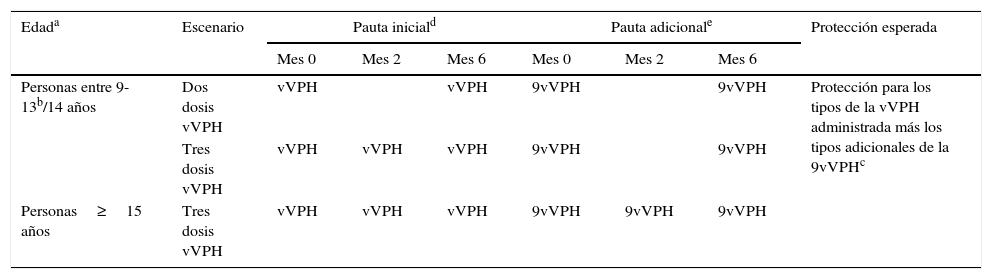
La 9vVPH debe administrarse en régimen de 2 dosis en personas de 9-14 años (inclusive) en el momento de la primera dosis. Se recomienda que la segunda dosis se administre entre 5-13 meses después de la primera; si se administra antes de 5 meses es preciso administrar una tercera dosis10. Esta pauta fue aprobada por la EMA en febrero del 201611.
El régimen de 3 dosis está indicado para mujeres y varones de 15 años en adelante. La segunda debe administrarse al menos un mes después de la primera y la tercera al menos 3 meses después de la segunda. Las 3 dosis deben administrarse en el plazo máximo de un año10 (tabla 1).
Pautas de administración de la 9vVPH según edad de administración de la 1.a dosis10
| Edad de administración de la 1.a dosis | Mes 0 | Mes 2 | Mes 6 + | Observaciones |
|---|---|---|---|---|
| Personas 9-14 años | 9vVPH | 9vVPH | La 2.a dosis debe administrarse entre 5-13 meses después de la 1.a; si se administra antes de 5 meses es preciso administrar una 3.a dosis | |
| Personas≥15 años | 9vVPH | 9vVPH | 9vVPH | La 2.a dosis debe administrarse al menos un mes después de la 1.a y la 3.a al menos 3 meses después de la 2.a. Las 3 dosis deben administrarse en el plazo máximo de un año |
9vVPH: vacuna frente al virus del papiloma humano nonavalente.
Se recomienda que aquellas personas que inicien la vacunación con 9vVPH, completen el régimen con 9vVPH10.
Poblaciones en las que se ha evaluado la 9vVPHLa 9vVPH se ha evaluado en ensayos clínicos en niños y niñas entre 9-15 años y mujeres y varones entre 16-26 años12.
La eficacia clínica, en términos de reducción de infección persistente y lesiones cervicales (neoplasia cervical intraepitelial grado 2 o superior [CIN2+]) de la 9vVPH se ha demostrado en mujeres entre 16-26 años10. En el resto de poblaciones existen estudios de inmunogenicidad puente, que permiten extender las recomendaciones de vacunación a grupos difíciles de evaluar en los ensayos de eficacia, bien sea por razones éticas (niños y niñas menores de 15 años), bien por tiempo de seguimiento13.
Para las vacunas VPH no se ha establecido ningún correlato inmune de eficacia clínica, es decir, no se ha definido el umbral de anticuerpos necesarios para establecer la eficacia que asegura la protección3. Por ello, estos estudios se basan en la comparación de los niveles de anticuerpos inducidos por la vacuna entre 2 grupos de sujetos, habiéndose documentado previamente datos de eficacia clínica en uno de ellos (en mujeres de 16 a 26 años). Se asume que, con niveles no inferiores de anticuerpos, los datos de eficacia son extrapolables entre ambos grupos.
Dado que éticamente ya no es posible evaluar la eficacia de la 9vVPH comparándola contra un placebo debido a que la vacunación frente a VPH está ampliamente recomendada por sus beneficios, el programa clínico de la 9vVPH utilizó como comparador la 4vVPH2,14.
Está previsto realizar un estudio de eficacia en mujeres entre 25-45 años. Aunque ahora no están disponibles, en este grupo, cabría esperar resultados similares a los obtenidos con la 4vVPH para los tipos comunes12.
Datos de inmunogenicidad y eficacia frente a los tipos VPH 6/11/16/18 de la 9vVPH vs. la 4vVPHPuesto que ambas vacunas son muy eficaces frente a los tipos comunes VPH 6/11/16/18, la incidencia de lesiones de alto grado o de infección persistente relacionadas con estos tipos en los ensayos clínicos fue tan baja que no fue posible realizar comparaciones estadísticas directas para las variables de eficacia entre ambas2.
En cuanto a inmunogenicidad, se ha demostrado la no inferioridad de la 9vVPH vs. la 4vVPH respecto a la media geométrica de los títulos anti-VPH 6/11/16/18 en mujeres y varones entre 16-26 años, un mes después de la administración de la tercera dosis. Las tasas de seroconversión en la población por protocolo para estos 4 tipos fueron cercanas al 100% para ambas vacunas14,15.
En niñas entre 9-15 años, la respuesta inmune para los tipos VPH 6/11/16/18 de la 9vVPH fue comparable a la de la 4vVPH después de la administración de la tercera dosis16.
Datos de inmunogenicidad y eficacia frente a los 5 tipos VPH adicionales (31/33/45/52/58) de la 9vVPH vs. la 4vVPH en mujeresEn el ensayo clínico pivotal de la 9vVPH, que incluyó 14.215 mujeres de 16-26 años, se observó que entre el 99,6-100% de las mujeres vacunadas con 9vVPH seroconvirtieron para los tipos VPH 31/33/45/52/58 un mes después de la última dosis de la vacuna. Al igual que para los tipos VPH 6/11/16/18, la 9vVPH indujo una respuesta inmunológica consistente para los 5 tipos adicionales14.
En este ensayo clínico se observó una eficacia del 96,7% (IC95%: 80,9-99,8) frente a CIN2/3 y neoplasias intraepiteliales grados 2/3 de vulva y de vagina asociadas a los tipos VPH 31/33/45/52/58 en la población por protocolo. La eficacia frente a la infección persistente (más de 6 meses de duración) causada por estos 5 tipos fue del 96% (IC95%: 94,4-97,2) en esta misma población14.
Datos de inmunogenicidad y eficacia de la 9vVPH en varonesExisten 2 ensayos clínicos de fase iii que evalúan la seguridad la inmunogenicidad de la 9vVPH en varones entre 16-26 años15,17.
Uno de ellos compara esta población con mujeres entre 16-26 años, observándose que un mes después de la tercera dosis, las medias geométricas de los títulos anti-VPH 6/11/16/18/31/33/45/52/58 de los varones fueron no inferiores a las de las mujeres del estudio, con tasas de seroconversión de alrededor del 99,5%. Estos resultados sustentan la extrapolación (inmunogenicidad puente) de los resultados de eficacia de la 9vVPH en mujeres entre 16-26 años a varones heterosexuales entre 16-26 años17.
El segundo estudio se realizó en varones entre 16-26 años aleatorizados para recibir 9vVPH o 4vVPH. La respuesta al régimen de 3 dosis de 9vVPH para los VPH 6/11/16/18 fue similar a la de la 4vVPH, con un perfil de seguridad comparable para ambas vacunas. Estos resultados respaldan la extrapolación de los resultados de eficacia de la 4vVPH a la 9vVPH para los tipos comunes15.
La 4vVPH ya demostró su eficacia en la reducción de lesiones genitales externas relacionadas con los tipos VPH 6/11/16/18 en varones heterosexuales y homosexuales entre 16-26 años18. Además, en los homosexuales de esta edad, la 4vVPH resultó eficaz en la reducción de la incidencia de neoplasia intraepitelial anal grados 2/3 relacionada con estos 4 tipos18.
Persistencia de la respuesta inmune de la 9vVPHEn mujeres entre 16-26 años la persistencia de la respuesta inmune se demostró durante al menos 3,5 años; observándose que el 78-98% de las mujeres vacunadas, dependiendo del tipo de VPH, seguían siendo seropositivas, con títulos significativamente superiores a los obtenidos tras la infección natural. Tras un seguimiento medio de 43 meses (máximo 67 meses) después de la tercera dosis, la eficacia se mantiene en niveles>95% en todas las mujeres hasta finalizar el estudio10,14. En niños y niñas entre 9-15 años la persistencia de la respuesta inmune se demostró durante al menos 3 años. El 93-99% de los vacunados, dependiendo del tipo de VPH, seguían siendo seropositivos10.
Actualmente están en marcha estudios de seguimiento a largo plazo para seguir determinando la duración de la protección de la 9vVPH10.
Perfil de seguridad de la 9vVPHEl perfil de seguridad se ha evaluado en 7 estudios de fase iii (incluyendo más de 15.000 personas de ambos sexos entre 9-26 años)19. La 9vVPH es generalmente bien tolerada en las poblaciones evaluadas, con un perfil de seguridad similar al de la 4vVPH19.
La 9vVPH presenta mayor número de reacciones adversas en el lugar de inyección que la 4vVPH (dolor, hinchazón y eritema en el 89,9; 40 y 34% de los casos, respectivamente), aunque son generalmente de intensidad leve/moderada19.
Administración de la 9vVPH con otras vacunas del calendarioLa 9vVPH se puede administrar concomitantemente con una vacuna de refuerzo combinada de tétanos, difteria y tosferina (componente acelular) (Tdap) y/o la vacuna antipoliomielítica inactivada (IPV) (vacunas Td-IPV, Tdap-IPV)10,20.
En la actualidad no se ha realizado ningún estudio específico que evalúe la administración concomitante de las vacunas VPH con vacunas antimeningocócicas del serogrupo C. Sin embargo, siguiendo los principios generales de la vacunología y dado que se trata de 2 vacunas inactivadas, se podrían administrar de forma simultánea en lugares anatómicos distintos21. No obstante, sí se estudió la concomitancia con una vacuna antimeningocócica tetravalente (A-C-Y-W135) adyuvada con toxoide diftérico22. En dicho estudio no se observó interferencia inmunológica cuando ambas vacunas se administraban concomitantemente22.
En el actual calendario común de vacunaciones del Consejo Interterritorial, la administración de la vacuna frente al VPH puede coincidir puntualmente con la vacuna frente a la varicela7. No se ha estudiado la concomitancia entre dichas vacunas.
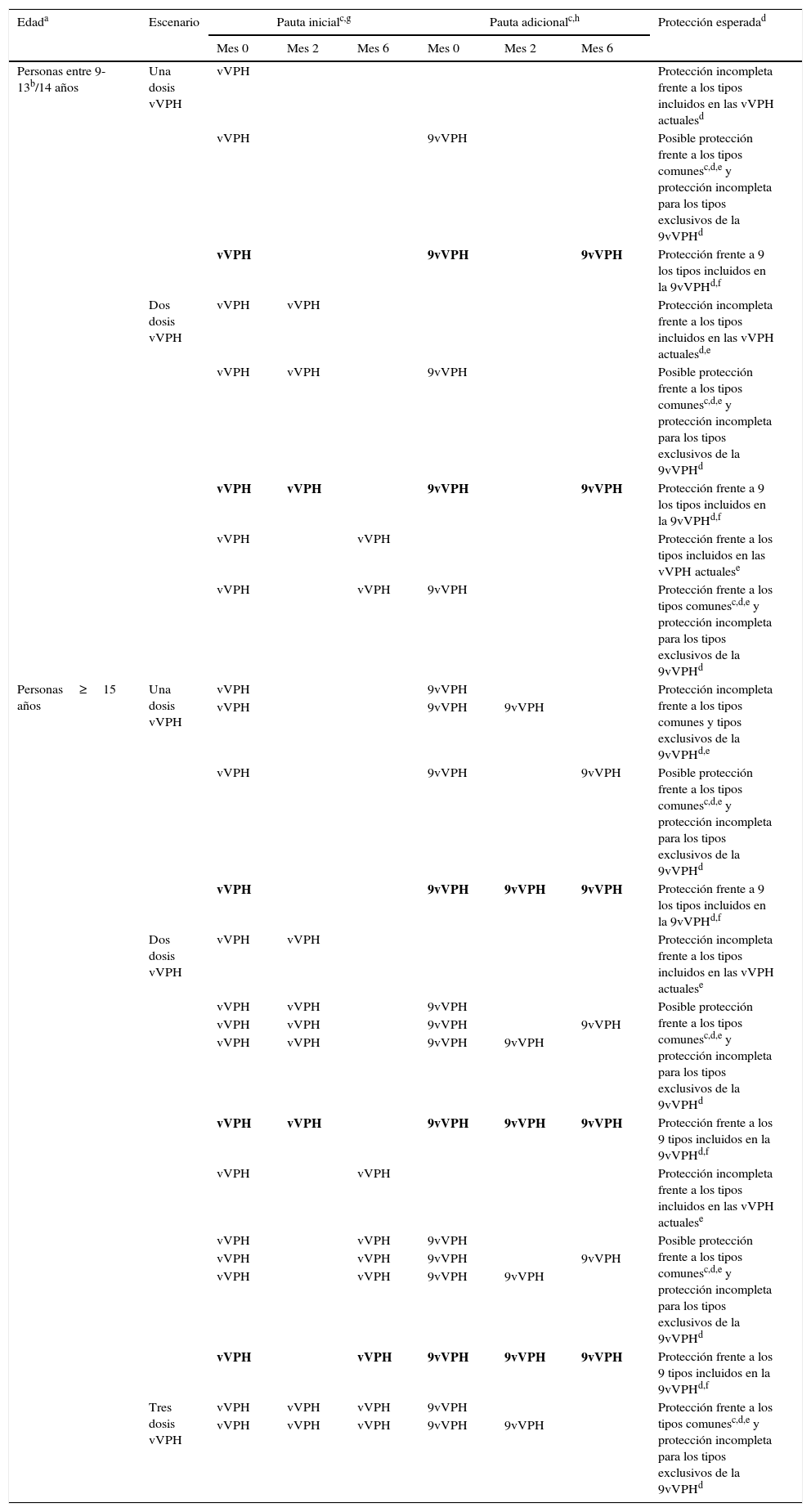
Vacunación con 9vVPH de personas previamente vacunadas frente al VPHLos sujetos vacunados previamente con un régimen de 3 dosis de 4vVPH pueden recibir 3 dosis de 9vVPH10, en base a un estudio que evaluaba el perfil de seguridad e inmunogenicidad de 3 dosis de 9vVPH en mujeres y niñas entre 12-26 años que previamente habían recibido la pauta completa de 4vVPH. Se observó una respuesta anamnésica para los tipos VPH 6/11/16/18 y una respuesta inmunológica consistente para los tipos VPH 31/33/45/52/58, siendo generalmente bien tolerada y con un perfil de seguridad aceptable23 (tabla 2).
Escenarios y aproximaciones propuestas con la vacuna 9vVPH para personas previamente vacunadas con una pauta completa frente al VPH
| Edada | Escenario | Pauta iniciald | Pauta adicionale | Protección esperada | ||||
|---|---|---|---|---|---|---|---|---|
| Mes 0 | Mes 2 | Mes 6 | Mes 0 | Mes 2 | Mes 6 | |||
| Personas entre 9-13b/14 años | Dos dosis vVPH | vVPH | vVPH | 9vVPH | 9vVPH | Protección para los tipos de la vVPH administrada más los tipos adicionales de la 9vVPHc | ||
| Tres dosis vVPH | vVPH | vVPH | vVPH | 9vVPH | 9vVPH | |||
| Personas≥15 años | Tres dosis vVPH | vVPH | vVPH | vVPH | 9vVPH | 9vVPH | 9vVPH | |
VPH: virus del papiloma humano; vVPH: vacuna frente al virus del papiloma humano (incluye la 2vVPH que contiene los tipos VPH 16/18 y la 4vVPH que contiene los tipos VPH 6/11/16/18); 2vVPH: vacuna frente al virus del papiloma humano bivalente; 4vVPH: vacuna frente al virus del papiloma humano tetravalente; 9vVPH: vacuna frente al virus del papiloma humano nonavalente.
Edad en el momento de la administración de la primera dosis. A la luz de los datos actuales, se considera que una persona vacunada con 2 dosis de 4vVPH antes de los 13 años o 2 dosis de 2vVPH/9vVPH antes de los 14 años está correctamente vacunada frente a los genotipos que contenga la vacuna correspondiente, siempre que se hayan respetado los intervalos mínimos entre dosis. A partir de los 14 años para 4vVPH y 15 años para 2vVPH/9vVPH, se considera que la pauta completa consta de 3 dosis respetando los intervalos mínimos entre dosis.
La pauta de 2 dosis con 4vVPH está indicada en individuos entre 9-13 años y con 2vVPH y 9vVPH en individuos entre 9-14 años. Se recomienda que la pauta completa de la 4vVPH y 9vVPH se administre en el periodo de un año. Sin embargo, organismos internacionales como el Advisory Committee on Immunization Practices (ACIP) consideran que si la pauta de vacunación es interrumpida no sería necesario reiniciarla, siempre que los intervalos mínimos entre las dosis se hayan respetado. La segunda dosis se debe administrar al menos un mes después de la primera dosis y la tercera dosis al menos 3 meses después de la segunda dosis30.
En la actualidad no hay una recomendación específica sobre el intervalo de tiempo recomendado entre una pauta de vacunación con vVPH y una pauta con 9vVPH para la revacunación. En el ensayo clínico que evaluaba el perfil de seguridad e inmunogenicidad de 3 dosis de 9vVPH en mujeres y niñas previamente vacunadas con 3 dosis de 4vVPH hubo una separación de 12 meses entre la última dosis de 4vVPH y la primera dosis de 9vVPH23. No hay datos específicos con la 2vVPH.
No existen datos de seguridad, inmunogenicidad o eficacia que apoyen la intercambiabilidad entre vacunas frente al VPH10. Recomendaciones de un grupo de expertos proponen que la 9vVPH se puede utilizar para completar un régimen de vacunación incompleto frente al VPH o añadir a una pauta previamente completada para aumentar la protección frente al resto de los tipos. Estas recomendaciones tienen en cuenta las dosis administradas previamente y el tiempo transcurrido entre ellas24. En general, se asume que para una protección completa frente a los 9 tipos de la 9vVPH será necesaria una pauta completa de dicha vacuna24 (tabla 3). En el futuro se determinará si es posible reducir el número de dosis manteniendo el mismo nivel de protección que confieren las pautas actualmente aprobadas.
Posibles escenarios y aproximaciones propuestas con la vacuna 9vVPH para personas parcialmente vacunadas frente al VPH con las vacunas actualmente disponibles (2vVPH y 4vVPH)
| Edada | Escenario | Pauta inicialc,g | Pauta adicionalc,h | Protección esperadad | ||||
|---|---|---|---|---|---|---|---|---|
| Mes 0 | Mes 2 | Mes 6 | Mes 0 | Mes 2 | Mes 6 | |||
| Personas entre 9-13b/14 años | Una dosis vVPH | vVPH | Protección incompleta frente a los tipos incluidos en las vVPH actualesd | |||||
| vVPH | 9vVPH | Posible protección frente a los tipos comunesc,d,e y protección incompleta para los tipos exclusivos de la 9vVPHd | ||||||
| vVPH | 9vVPH | 9vVPH | Protección frente a 9 los tipos incluidos en la 9vVPHd,f | |||||
| Dos dosis vVPH | vVPH | vVPH | Protección incompleta frente a los tipos incluidos en las vVPH actualesd,e | |||||
| vVPH | vVPH | 9vVPH | Posible protección frente a los tipos comunesc,d,e y protección incompleta para los tipos exclusivos de la 9vVPHd | |||||
| vVPH | vVPH | 9vVPH | 9vVPH | Protección frente a 9 los tipos incluidos en la 9vVPHd,f | ||||
| vVPH | vVPH | Protección frente a los tipos incluidos en las vVPH actualese | ||||||
| vVPH | vVPH | 9vVPH | Protección frente a los tipos comunesc,d,e y protección incompleta para los tipos exclusivos de la 9vVPHd | |||||
| Personas≥15 años | Una dosis vVPH | vVPH | 9vVPH | Protección incompleta frente a los tipos comunes y tipos exclusivos de la 9vVPHd,e | ||||
| vVPH | 9vVPH | 9vVPH | ||||||
| vVPH | 9vVPH | 9vVPH | Posible protección frente a los tipos comunesc,d,e y protección incompleta para los tipos exclusivos de la 9vVPHd | |||||
| vVPH | 9vVPH | 9vVPH | 9vVPH | Protección frente a 9 los tipos incluidos en la 9vVPHd,f | ||||
| Dos dosis vVPH | vVPH | vVPH | Protección incompleta frente a los tipos incluidos en las vVPH actualese | |||||
| vVPH | vVPH | 9vVPH | Posible protección frente a los tipos comunesc,d,e y protección incompleta para los tipos exclusivos de la 9vVPHd | |||||
| vVPH | vVPH | 9vVPH | 9vVPH | |||||
| vVPH | vVPH | 9vVPH | 9vVPH | |||||
| vVPH | vVPH | 9vVPH | 9vVPH | 9vVPH | Protección frente a los 9 tipos incluidos en la 9vVPHd,f | |||
| vVPH | vVPH | Protección incompleta frente a los tipos incluidos en las vVPH actualese | ||||||
| vVPH | vVPH | 9vVPH | Posible protección frente a los tipos comunesc,d,e y protección incompleta para los tipos exclusivos de la 9vVPHd | |||||
| vVPH | vVPH | 9vVPH | 9vVPH | |||||
| vVPH | vVPH | 9vVPH | 9vVPH | |||||
| vVPH | vVPH | 9vVPH | 9vVPH | 9vVPH | Protección frente a los 9 tipos incluidos en la 9vVPHd,f | |||
| Tres dosis vVPH | vVPH | vVPH | vVPH | 9vVPH | Protección frente a los tipos comunesc,d,e y protección incompleta para los tipos exclusivos de la 9vVPHd | |||
| vVPH | vVPH | vVPH | 9vVPH | 9vVPH | ||||
VPH: virus del papiloma humano; vVPH: vacuna frente al virus del papiloma humano (incluye la 2vVPH que contiene los tipos VPH 16/18 y la 4vVPH que contiene los tipos VPH 6/11/16/18); 2vVPH: vacuna frente al virus del papiloma humano bivalente; 4vVPH: vacuna frente al virus del papiloma humano tetravalente; 9vVPH: vacuna frente al virus del papiloma humano nonavalente.
La pauta de 2 dosis con 4vVPH está indicada en individuos entre 9-13 años, y con 2vVPh y 9vVPH en individuos entre 9-14 años. A la luz de los datos actuales, se considera que una persona vacunada con 2 dosis de 4vVPH antes de los 13 años o 2 dosis de 2vVPH/9vVPH antes de los 14 años está correctamente vacunada frente a los genotipos que contenga la vacuna correspondiente, siempre que se hayan respetado los intervalos mínimos entre dosis. A partir de los 14 años para 4vVPH y 15 años para 2vVPH/9vVPH, se considera que la pauta completa consta de 3 dosis respetando los intervalos mínimos entre dosis.
Se recomienda que la pauta completa de la 4vVPH y 9vVPH se administre en el periodo de un año. Sin embargo, organismos internacionales como el Advisory Committee on Immunization Practices (ACIP) consideran que si la pauta de vacunación es interrumpida no sería necesario reiniciarla, siempre que los intervalos mínimos entre las dosis se hayan respetado. La segunda dosis se debe administrar al menos un mes después de la primera dosis y la tercera dosis al menos 3 meses después de la segunda dosis30.
Opinión de expertos. Los criterios de la opinión de los expertos sobre el nivel de protección están basados en: 1. La distinción entre las edades (hasta 14 años y por encima de 14 años). 2. Para clasificar una protección frente a un genotipo determinado de «posible» se requieren al menos 2 o 3 dosis de vacuna (en función de la edad) que incluya dicho genotipo, manteniendo los intervalos mínimos entre dosis indicados en las fichas técnicas de las vacunas. 3. Para afirmar que existe protección frente a unos determinados genotipos con una pauta especificada son necesarios los resultados de al menos un ensayo clínico que lo demuestre. 4. No existe contraindicación para la revacunación.
Pauta que, en base a los datos actuales, ofrecería protección frente a los 9 tipos incluidos en 9vVPH.
Dosis adicional.
Los resaltados en negrita señalan aquellas pautas que se consideran completas para los 9 tipos de VPH incluidos en 9vVPH.
Adaptada de van Damme et al.24.
Actualmente no existen datos específicos de la 9vVPH en este tipo de población. Sin embargo, dado que para los 4 tipos comunes la 9vVPH y la 4vVPH han demostrado una protección similar, se podrían extrapolar los datos de la 4vVPH. Diversos estudios muestran que la tasa de segundas lesiones de la enfermedad cervical en mujeres con lesiones cervicales previas menores de 46 años es inferior en aquellas vacunadas con 4vVPH vs. las no vacunadas6,25.
En uno de estos estudios se aleatorizó a 737 mujeres con CIN2/3 tratadas por un procedimiento de resección electroquirúrgica para recibir 4vVPH o placebo. La tasa de segundas lesiones CIN2+ en el grupo placebo fue del 7,2% y del 2,5% en el grupo vacunal. La no vacunación con 4vVPH se asoció a un aumento significativo del riesgo de segundas lesiones CIN2+ en el grupo control, hazard ratio: 2,8 (IC95%: 1,3-6,0; p<0,01)25.
9vVPH en pacientes inmunocomprometidosActualmente no existen datos específicos de la 9vVPH en este tipo de pacientes. Sin embargo, dado que en personas sanas la inmunogenicidad frente a los tipos comunes y la seguridad de la 4vVPH y la 9vVPH son similares, se podría suponer que en estas poblaciones también lo sea, por lo que la EMA concluye que en esta población no se requieren nuevos estudios con la 9vVPH12.
Por otra parte, existen múltiples estudios con la 4vVPH que evalúan su seguridad e inmunogenicidad en personas infectadas por el virus de inmunodeficiencia humana y otras poblaciones inmunocomprometidas como pacientes con enfermedad inflamatoria intestinal o trasplantados, entre otros. En estos estudios, el perfil de seguridad de 4vVPH es favorable y los niveles de inmunogenicidad aceptables9,18.
Hasta que se disponga de más evidencia en estas poblaciones, la Organización Mundial de la Salud recomienda para los pacientes inmunocomprometidos y/o infectados por el virus de inmunodeficiencia humana una pauta de 3 dosis para las vacunas VPH independientemente de la edad13.
Administración de la 9vVPH en mujeres con infección VPH presente o previa y beneficio que les puede ofrecerNo se espera que las vacunas frente al VPH sean efectivas para tratar infecciones activas por VPH. Sin embargo, cualquier mujer sexualmente activa se podría beneficiar de la vacunación, con máximo beneficio si no ha estado previamente expuesta a los tipos vacunales. En personas infectadas por algún tipo vacunal, su administración puede ser beneficiosa para prevenir la reinfección o reactivación en aquellos que han aclarado la infección, ya que la inmunidad natural no confiere protección duradera26.
Entre los sujetos seropositivos para alguno de los tipos vacunales, las vacunas pueden proteger frente al resto de los tipos que incluyen26.
Uso de la 9vVPH en mujeres embarazadas o en periodo de lactanciaLa 9vVPH puede administrarse durante la lactancia10, sin embargo, debido a que los datos existentes son insuficientes, no se recomienda su administración durante el embarazo, por lo que la vacunación debe posponerse hasta el término de este10. En los estudios de las vacunas de la primera generación en las mujeres que fueron vacunadas estando inadvertidamente embarazadas o que iniciaron un embarazo entre dosis, no se identificó ningún efecto colateral en cuanto a la evolución del embarazo27.
Impacto de la vacunación con la 9vVPH en el cribado de cáncer cervicalActualmente las recomendaciones sobre la modificación del cribado en mujeres vacunadas frente al VPH son limitadas. Diversos estudios indican que, puesto que la vacunación disminuye los casos de CIN2/3, la frecuencia e intensidad del cribado se podría disminuir de forma segura en las pacientes vacunadas28. En el caso de la 9vVPH, dado que confiere protección frente a un número mayor de tipos VPH, la frecuencia de lesiones precancerosas en estas pacientes vacunadas será aún menor.
Este nuevo escenario permite plantear nuevas propuestas como el protocolo HPV-FASTER basado en combinar vacunación y cribado con test VPH con el fin de acelerar la reducción de la incidencia y mortalidad del cáncer cervical y obtener un modelo más coste-efectivo. Esta propuesta consiste en extender los programas de vacunación a mujeres hasta los 30 años de edad y hasta 45-50 años en determinados ámbitos, y realizar al menos un test de VPH en mujeres de 30 años o más28.
Países en los que actualmente está disponible la 9vVPHLa 9vVPH está comercializada en EE. UU., Canadá y Australia. En Europa está aprobada en 26 países y comercializada, desde mediados de 2016, en Austria y Alemania. Se espera que próximamente más países la incluyan en sus calendarios. Desde noviembre del 2016, la única vacuna frente al VPH disponible en EE. UU. es la 9vVPH29, administrada en una pauta de 2 dosis entre los 9-14 años30. La transición a la vacuna 9vVPH en este país ha sido ampliamente aceptada por todos los colectivos involucrados.
A modo de sumario, la tabla 4 recoge los aspectos fundamentales tratados en los puntos anteriores.
Sumario de las características de la 9vVPH en España
| Beneficio de incluir 5 tipos adicionales de VPH en la 9vVPH |
| En Europa, los 5 tipos adicionales son responsables del 19% de los casos de cáncer anogenital y del 35% de las lesiones precancerosas de alto grado causadas por el VPH |
| Desarrollo y composición de la 9vVPH |
| Cada dosis de 0,5ml de la 9vVPH contiene 30/40/60/40/20/20/20/20/20μg de proteína L1 del VPH tipo 6/11/16/18/31/33/45/52/58, respectivamente, y 500μg de hidroxifosfato sulfato de aluminio amorfo, como adyuvante. Como excipientes contiene cloruro sódico, L-histidina, polisorbato 80 y borato sódico |
| Aprobación e indicaciones de la 9vVPH |
| Fue aprobada por la EMA en junio de 2015 |
| Está indicada para la inmunización activa de personas a partir de los 9 años de edad frente a las siguientes enfermedades por VPH |
| - Lesiones precancerosas y cánceres que afectan al cuello de útero, vulva, vagina y ano causados por los tipos del VPH de la vacuna |
| - Verrugas genitales (condiloma acuminata) causadas por tipos VPH incluidos en la vacuna |
| Edad de administración de la 9vVPH y pautas recomendadas en función de la edad |
| Se puede administrar a partir de los 9 años, sin límite superior de edad |
| Se administra en régimen de 2 o 3 dosis para personas de 9-14 años de edad (inclusive) en el momento de la primera inyección, o de 3 dosis a personas≥15 años en el momento de la primera dosis |
| Poblaciones en las que se ha evaluado la 9vVPH |
| En niños y niñas entre 9-15 años y mujeres y varones entre 16-26 años |
| El comparador utilizado en el desarrollo clínico de la 9vVPH es la 4vVPH |
| Datos de inmunogenicidad y eficacia frente a los tipos VPH 6/11/16/18 de la 9vVPH vs. la 4vVPH |
| La 9vVPH induce respuestas inmunes anti-VPH 6/11/16/18 no inferiores a las obtenidas con la 4vVPH |
| Datos de inmunogenicidad y eficacia frente a los 5 tipos VPH adicionales (31/33/45/52/58) de la 9vVPH vs. la 4vVPH en mujeres |
| En el ensayo clínico pivotal se observó que entre el 99,6-100% de las mujeres vacunadas con 9vVPH seroconvirtieron para los tipos 5 tipos VPH adicionales un mes después de la última dosis de la nueva vacuna. En la población por protocolo se observó una eficacia frente a CIN2/3, VIN2/3 y VaIN2/3 asociada a los 5 tipos adicionales del 96,7% (IC95% 80,9-99,8) |
| En cuanto a la incidencia de infección persistente (>6 meses de duración) por los 5 tipos, la eficacia de la vacuna fue del 96% (IC95%: 94,4-97,2) |
| Datos de inmunogenicidad y eficacia de la 9vVPH en varones |
| Se llevaron a cabo 2 ensayos clínicos de fase III en varones entre 16-26 años |
| En hombres heterosexuales las GMT anti-VPH 6/11/16/18/31/33/45/52/58 no fueron inferiores a las de las mujeres de 16-26 años, pudiéndose extrapolar los datos de eficacia obtenidos en la población femenina a los varones |
| Además, para los tipos comunes, 9vVPH induce una respuesta similar a la de la 4vVPH, pudiéndose extrapolar los datos de eficacia de la 4vVPH en varones a la 9vVPH |
| Persistencia de la respuesta inmune de la 9vVPH |
| Se ha demostrado persistencia después de la vacunación durante≥3,5 años en mujeres de 16-26 años y durante≥3 años en niños y niñas de 9-15 años |
| Perfil de seguridad de la 9vVPH |
| Es generalmente bien tolerada en todas las poblaciones evaluadas, con mayor reactogenicidad local, pero con un perfil de seguridad comparable al de la 4vVPH |
| Administración de la 9vVPH con otras vacunas del calendario |
| Se puede administrar de forma concomitante con una vacuna de refuerzo combinada de tétanos, difteria y tosferina y/o la vacuna antipoliomielítica inactivada |
| Vacunación con 9vVPH a personas previamente vacunadas frente al VPH |
| Sí, además se ha demostrado que generalmente es bien tolerada y con un perfil de seguridad aceptable |
| Vacunación con 9vVPH a personas que no han completado una pauta de vacunación VPH con una de las vacunas actualmente existentes |
| No se ha evaluado la intercambiabilidad de las vacunas VPH. Sin embargo, los expertos recomiendan valorarla teniendo en cuenta el número de dosis previamente administradas, el tiempo transcurrido entre ellas y la edad del individuo |
| Beneficio de la 9vVPH en pacientes con lesiones cervicales previas |
| Actualmente no existen datos para la 9vVPH en pacientes con lesiones cervicales previas, pero se espera que para los tipos comunes los resultados sean extrapolables a los de la 4vVPH |
| 9vVPH en pacientes inmunocomprometidos |
| La EMA indica que no es necesario realizar estudios adicionales en esta población, dado que se estiman resultados similares a los de la 4vVPH para los tipos comunes, siendo esta segura e inmunógena en individuos infectados por el VIH |
| Administración de la 9vVPH en mujeres con infección VPH presente o previa y beneficio que les puede ofrecer |
| Se considera que cualquier mujer sexualmente activa se podría beneficiar de la vacunación, teniendo el máximo beneficio si no ha estado previamente expuesta a los tipos incluidos en las diferentes vacunas |
| Uso de la 9vVPH en mujeres embarazadas o en periodo de lactancia |
| La vacuna puede ser utilizada durante el periodo de lactancia |
| No se recomienda el uso de la vacuna durante el embarazo |
| Impacto de la vacunación con la 9vVPH en el cribado de cáncer cervical |
| Actualmente no existen recomendaciones sobre la implicación de la vacunación frente al VPH en los programas de cribado cervical, aunque diversos estudios indican que se podría disminuir su frecuencia e intensidad en pacientes vacunadas, con el consiguiente ahorro de costes |
| Países en los que está disponible la 9vVPH |
| Actualmente la vacuna está comercializada en EE. UU., Canadá, Australia, Austria y Alemania, además de estar aprobada en otros 24 países europeos |
CIN2/3: neoplasias intraepiteliales de cérvix grados 2 y 3; EE. UU.: Estados Unidos; EMA: European Medicines Agency; GMT: Geometric Mean Titers (media geométrica de los títulos); VaIN 2/3: neoplasias intraepiteliales de vagina grados 2 y 3; VIH: virus de la inmunodeficiencia humana; VIN 2/3: neoplasias intraepiteliales de vulva grados 2 y 3; VPH: virus del papiloma humano; vs.: versus; 4vVPH: vacuna frente al virus del papiloma humano tetravalente; 9vVPH: vacuna frente al virus del papiloma humano nonavalente.
Los 9 tipos incluidos en la vacuna nonavalente son responsables del 90% de los cánceres de cuello de útero, del 80% de las lesiones cervicales de alto grado y del 50% de las de bajo grado. Estas lesiones, en general, se asocian a un número sustancial de procedimientos invasivos, que suponen un uso importante de recursos sanitarios y un alto impacto en la calidad de vida de los pacientes. Dicho impacto podría verse potencialmente reducido con el uso de la nueva vacuna nonavalente, que ha demostrado su potencial preventivo frente a estos tipos en su desarrollo clínico. Adicionalmente, los 9 tipos también son responsables de entre el 85-95% de otros cánceres anogenitales asociados a VPH, los cuales carecen de métodos de prevención secundaria estandarizados, y del 90% de las verrugas genitales y de la papilomatosis respiratoria recurrente. Globalmente, la 9vVPH representa un avance médico importante en la prevención de las enfermedades asociadas al VPH.
En los últimos años se ha observado una importante evolución en el conocimiento sobre el VPH. El objetivo inicial de los programas de vacunación era la prevención del cáncer cervical. Sin embargo, en la actualidad, con herramientas preventivas más avanzadas como la vacuna 9vVPH o la sustitución de la citología por la prueba VPH en el cribado primario, el objetivo es más ambicioso y se centra en el control del virus. Para conseguirlo es necesario seguir avanzando en obtener mejores coberturas en los programas de vacunación, ampliar la población objetivo de dichos programas a colectivos como niños entre 11 y 12 años, varones y mujeres adultas y conseguir una integración efectiva entre vacunación y cribado.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónPara la realización de este artículo los autores han recibido una beca no condicionada por parte de Sanofi Pasteur MSD, España.
Conflicto de interesesFrancesc Xavier Bosch ha recibido ayudas a la investigación a través de su institución de Genticel, GlaxoSmithKline, Merck, Qiagen, Roche y Sanofi Pasteur MSD, así como el reembolso de gastos de viaje para asistir a simposios, reuniones y/o conferencias de GlaxoSmithKline, Merck, Qiagen, Roche y Sanofi Pasteur MSD.
David Moreno ha colaborado en actividades docentes subvencionadas por Sanofi Pasteur MSD y como consultor en Advisory Boards de GlaxoSmithKline.
Esther Redondo ha recibido honorarios como consultor/asesor y/o ponente, así como becada para asistir a conferencias o cursos por GlaxoSmithKline, Sanofi Pasteur MSD, Merck, Sanofi Pasteur, Pfizer y Novartis.
Aureli Torné ha recibido ayudas a la investigación a través de su institución y honorarios por actividades docentes de Sanofi Pasteur MSD, GlaxoSmithKline y Roche Diagnostics.