Establecer la correlación que existe entre la escala de Tarplay y los pacientes con síndrome de Sjögren positivo.
MétodosSe revisaron 321 casos de pacientes con sospecha de tener síndrome de Sjögren de la UMAE, Centro Médico Nacional «La Raza», los cuales fueron remitidos entre enero del 2001 y diciembre del 2005 al Servicio de Cirugía Maxilofacial como parte de su protocolo de estudio, en donde se les realizó una biopsia de glándulas salivales labiales bajo anestesia local y mediante la técnica descrita por Daniels, siendo evaluadas mediante microscopia de luz y clasificadas con base en la escala de Tarplay. El diagnóstico de síndrome de Sjögren se estableció con base en los criterios propuestos por el Grupo de Consenso Americano y Europeo en el 2002, empleando como principal criterio objetivo la histopatología de las glándulas salivales labiales.
ResultadosSe encontró una asociación directa entre el incremento del índice de Tarplay de las biopsias de glándulas salivales labiales y el diagnóstico positivo para el síndrome de Sjögren, empleando la prueba exacta de Fisher con una p<0.001, razón de momios (OR) = 0.13 con un intervalo de confianza del 95% y un rango de 0.004–0.045. No se encontró asociación entre el grado de fibrosis y el diagnóstico de síndrome de Sjögren positivo. La presencia de artritis reumatoide y lupus eritematoso sistémico se asoció directamente con el diagnóstico de síndrome de Sjögren secundario positivo (p<0.001, OR = 3.25 con IC 95% = 1.8–5.6 y p=0.004, OR = 4.0 con IC 95% = 1.4–10.9 respectivamente).
ConclusionesLa evaluación histológica de las glándulas salivales labiales mediante la escala de Tarplay es una prueba confiable para establecer el diagnóstico del síndrome de Sjögren.
To establish any existing correlation between Tarplay’s grading system and patients with positive diagnosis of Sjögren’s syndrome.
Methods321 cases of patients suspected to be afflicted with Sjögren’s syndrome were reviewed at the Highly Specialized Medical Units (UMAE), Centro Médico Nacional «La Raza» («La Raza» National Medical Center). These patients had been referred to the said center between January 2001 and December 2005. Patients had been referred as part of their study protocol. Patients were subjected to labial salivary gland biopsy. The procedure was undertaken under local anesthesia and using the technique described by Daniels. Evaluation was achieved using light microscopy and patients were graded according to Tarplay’s grading system. Sjögren’s syndrome diagnosis was established based on criteria proposed in 2002 by the Group of American and European Consensus. The main objective criterion used was histopathology of labial salivary glands.
ResultsDirect association was found between Tarplay’s index increase of labial salivary gland biopsies and Sjögren’s syndrome positive diagnosis. Fisher exact test was used with p<0.001. OR = 0.13, with 95% confidence interval (CI) and 0.004–0.045 rank. No association was found between the degree of fibrosis and positive diagnosis of Sjögren’s syndrome. Presence of rheumatoid arthritis and systemic lupus erythematosus was directly associated with secondary positive Sjögren’s syndrome (p<0.001, OR = 3.25 with CI 95% = 1.8–5.6 and p=0.004, OR = 4.0 with CI 95% = 1.4–10.9 respectively).
ConclusionsHistological evaluation of labial salivary glands using Tarplay’s grading system is a reliable test to establish diagnosis of Sjögren’s syndrome.
El síndrome de Sjögren (SS) es una enfermedad crónica, autoinmune, caracterizada por la sequedad de mucosas, principalmente oral (xerostomía) y ocular (xeroftalmía), debida a la disminución o ausencia de secreciones glandulares.1 La hiposecreción glandular es el resultado de mecanismos tanto de interacción celular (infiltrado linfoplasmocítico) como humoral (autoanticuerpos y mediadores inflamatorios solubles), los cuales producen la destrucción acinar y de las células epiteliales ductales, con pérdida del parénquima, por lo que prácticamente todas las glándulas exocrinas pueden verse afectadas en un paciente.2 Su etiología es aún desconocida, se han sugerido varias causas: genéticas, hormonales, infecciosas e inmunitarias, así como factores intrínsecos y extrínsecos.3 El SS es la segunda enfermedad autoinmune más frecuente después de la artritis reumatoide, se cree que afecta aproximadamente al 0.5–4.8% de la población general adulta, y alrededor del 5% de la población mayor de 55 años.4–6 Las manifestaciones clínicas suelen aparecer entre la cuarta y séptima décadas de la vida, con una edad promedio de 50 a 60 años, en mujeres postmenopáusicas, pero pueden presentarse a cualquier edad, desde la infancia hasta la vejez. Predomina en el sexo femenino, con una relación respecto al masculino de 9:1.2,7
El SS puede presentarse solo (primario) o asociado con otra enfermedad del tejido conectivo (secundario).8 Actualmente su diagnóstico se basa en los criterios de clasificación propuestos por el Grupo de Consenso Americano y Europeo, publicados en el 20028 (Cuadros IyII), los cuales son seis e incluyen criterios subjetivos como los síntomas oculares y orales; y criterios objetivos como signos oculares, histopatología de glándulas salivales menores, afección de glándulas salivales y autoanticuerpos. La sialadenitis focal y los anticuerpos son considerados los marcadores más específicos de la enfermedad,8 aunque se sabe que al menos 15% de los pacientes con SS pueden escapar a la detección de autoanticuerpos por los métodos utilizados rutinariamente.9–11 En la evaluación histológica de las glándulas salivales el registro por focos de infiltrado linfocitario, es el índice histológico más útil de la severidad de la enfermedad;12 la rentabilidad diagnóstica de este procedimiento depende en gran parte de la adecuada extracción y análisis de la muestra.3,13 La biopsia de glándulas salivales labiales es la prueba más frecuentemente empleada y el principal criterio objetivo para establecer el diagnóstico de pacientes con sospecha de tener SS, aunque los resultados de la biopsia se aplican al componente oral y no al síndrome completo. La sialadenitis se considera la característica histológica más específica del SS, ya que es posible encontrar también fibrosis, atrofia e infiltración grasa en personas mayores de 50 años, sin que presenten el síndrome.3,14,15
| I. Síntomas oculares: una respuesta positiva a por lo menos una de las siguientes preguntas: |
| 1. ¿Ha tenido diariamente persistente resequedad ocular por más de 3 meses? |
| 2. ¿Tiene sensación recurrente de arenilla en los ojos? |
| 3. ¿Utiliza lágrimas artificiales más de 3 veces al día? |
| II. Síntomas orales: una respuesta positiva a por lo menos una de las siguientes preguntas: |
| 1. ¿Ha tenido diariamente resequedad de boca por más de 3 meses? |
| 2. ¿Tiene aumento de volumen recurrente de glándulas salivales? |
| 3. ¿Ingiere frecuentemente líquidos para lubricación oral? |
| III. Signos oculares: evidencia objetiva de afectación ocular definida como resultado positivo en al menos una de las siguientes dos pruebas: |
| 1. Prueba de Schirmer, realizada sin anestesia (- 5mm en 5 minutos) |
| 2. Puntuación en la prueba de rosa de Bengala u otra tinción ocular (+ 4 de acuerdo con el sistema de van Bijsterveld) |
| 3. Gammagrafía salival mostrando retraso en la excreción y/o disminución de la concentración salival |
| IV. Histopatología: en glándulas salivales menores (obtenidas de mucosa con apariencia normal) sialadenitis linfocítica focal, evaluada por un experto patólogo, con un puntaje de + de un foco, definiendo el puntaje por focos como el número de linfocitos (los cuales son adyacentes a los ácinos mucosos aparentemente normales y que contienen + de 50 linfocitos) por cada 4mm2 de tejido glandular |
| V. Afección de glándulas salivales: evidencia objetiva definida por un resultado positivo en al menos una de las siguientes pruebas diagnósticas: |
| 1. Flujo salival sin estimulación (- 1.5mL en 15 minutos) |
| 2. Sialografía parotídea que muestre la presencia de sialectasias difusas, sin evidencia de obstrucción en los conductos mayores |
| 3. Cintigrafía salival que demuestre retraso en la excreción y/o concentración reducida de la saliva |
| VI. Autoanticuerpos: |
| 1. Anticuerpos para Ro (SSA) o La (SSB), o ambos |
Tomado de Vitali C, Bombardieri S, Moutsopoulos HM et al. Classification criteria for Sjögren’s syndrome: a revised version of the European criteria proposed by the American-European Consensus Group. Ann Rheum Dis. 2002; 61: 554–558.8
| SS primario: en pacientes sin alguna enfermedad asociada, se puede definir como sigue: |
| a. La presencia de 4 de los 6 puntos indica SS primario, si el punto IV o VI son positivos |
| b. La presencia de 3 de los 4 criterios objetivos (puntos III, IV, V y VI) |
| c. El procedimiento de clasificación en el árbol representa una alternativa válida para la clasificación |
| SS secundario: en pacientes con una enfermedad de tejido conectivo asociada, la presencia del punto I o II, o algunos 2 de entre los puntos III, IV y V |
| Criterios de exclusión: |
| Radioterapia en cabeza y cuello |
| Infección por virus de la hepatitis C |
| Síndrome de inmunodeficiencia adquirida |
| Linfoma persistente |
| Sarcoidosis |
| Enfermedad injerto contra huésped |
| Uso de drogas anticolinérgicas |
Tomado de Vitali C, Bombardieri S, Moutsopoulos HM et al. Classification criteria for Sjögren’s syndrome: a revised version of the European criteria proposed by the American-European Consensus Group. Ann Rheum Dis. 2002; 61: 554–558.8
En el Centro Médico Nacional «La Raza», el Servicio de Reumatología remite a la consulta externa de Cirugía Maxilofacial pacientes con sospecha de tener síndrome de Sjögren primario o secundario, como parte de su protocolo de estudio, a los cuales se les realiza una biopsia de glándulas salivales labiales, la cual es evaluada por el Servicio de Anatomía Patológica mediante microscopia de luz y clasificada en base a la escala de Tarplay (Cuadro III), por lo que es importante determinar la correlación que existe entre el índice de Tarplay de las biopsias y el número de casos positivos para el síndrome de Sjögren primario o secundario.
| 1+ = 1 o 2 agregados celulares mononucleares por lóbulo |
| 2+ = 3 o más agregados por lóbulo |
| 3+ = infiltración celular mononuclear difusa más que agregados focales, con destrucción acinar |
| 4+ = infiltración celular mononuclear difusa con completa destrucción de la arquitectura lobular |
| En la escala de Tarplay el grado de fibrosis se establece subjetivamente de la siguiente manera: |
| Ausente = 0 |
| Mínimo = 1+ |
| Moderado = 2+ |
| Severo = 3+ |
Se realizó un estudio retrospectivo en el que se incluyeron 321 casos de pacientes con sospecha de tener SS, de ambos sexos y edad mayor a 18 años, los cuales fueron remitidos por el Servicio de Reumatología a la consulta externa del Servicio de Cirugía Maxilofacial de la UMAE, Centro Médico Nacional «La Raza», entre enero del 2001 y diciembre del 2005 como parte de su protocolo de estudio. A los pacientes se les realizó una biopsia de glándulas salivales labiales bajo anestesia local y mediante la técnica descrita por Daniels,16 que consiste en evertir el labio inferior y realizar una incisión de 1.5 a 2cm sobre la mucosa labial, entre la línea media y la comisura, penetrando el epitelio y liberando las glándulas de la fascia que les rodea por disección directa, siendo removidas por separado y colocadas en formalina al 10%, finalizando el procedimiento mediante la sutura de la herida.
Las glándulas obtenidas se enviaron al Servicio de Anatomía Patológica del hospital, para su procesamiento de rutina y tinción con hematoxilina y eosina, siendo evaluadas posteriormente por unos patólogos expertos y clasificadas de acuerdo con la escala de Tarplay,14 la cual evalúa la presencia o ausencia de infiltrado inflamatorio crónico, focal y difuso (sialadenitis). Esta escala muestra un balance adecuado entre sensibilidad y especificidad (82.4 y 86.2% respectivamente) y consiste en determinar el número de agregados de células mononucleares (en su mayoría linfocitos, células plasmáticas e histiocitos), que se observan en un campo de 4mm2 de tejido glandular, empleando un índice de 1+ al 4+, con 0 representando una glándula salival labial menor normal, tomando en cuenta que cada «agregado» o «foco» equivale a 50 células/4mm2. El grado de fibrosis se establece subjetivamente como sigue: ausente = 0, mínimo = 1+, moderado = 2+, severo = 3+.
Se recopilaron los resultados histopatológicos de las biopsias realizadas y se evaluaron los expedientes clínicos de los pacientes para determinar aquellos casos que cumplían con los criterios de diagnóstico de SS propuestos por el Grupo de Consenso Americano y Europeo en el 2002.8 Por lo que el diagnóstico de síndrome de Sjögren primario se estableció con base en los síntomas orales y oculares positivos, signos oculares positivos determinados mediante la prueba de Schirmer y como principal criterio objetivo de diagnóstico la biopsia de glándulas salivales menores con presencia de más de un foco de 50 linfocitos por cada 4mm2 de tejido glandular evaluada mediante la escala de Tarplay. El diagnóstico de síndrome de Sjögren secundario se estableció en aquellos casos que tenían una enfermedad de tejido conectivo asociada, así como la presencia de síntomas oculares y orales o prueba de Schirmer y biopsia de glándulas salivales menores positivas. No se incluyeron en el estudio pacientes con presencia de neoplasia benigna o maligna de glándulas salivales menores y se excluyeron aquellos casos que no contaban con información completa en el expediente clínico o el reporte histopatológico, así como aquellos pacientes que recibieron radioterapia en cabeza y cuello, los que tenían infección por virus de la hepatitis C, síndrome de inmunodeficiencia adquirida, linfoma preexistente, sarcoidosis, enfermedad injerto contra huésped o quienes utilizaban drogas anticolinérgicas.
Consideraciones éticasEl presente estudio se sustentó en el principio deontológico de que la salud y los derechos de los individuos tienen preeminencia sobre los de la sociedad en lo concerniente con los futuros pacientes o los de la ciencia, según la declaración de Helsinki de 1975; la Ley General de Salud en materia de investigación para la salud enmendada en 1989 y la normatividad de investigación científica del IMSS.
Análisis estadísticoLa correlación entre el índice de Tarplay de las biopsias de glándulas salivales labiales y los pacientes con síndrome de Sjögren positivo se estableció mediante la prueba exacta de Fisher. Para determinar la asociación entre los pacientes con SS secundario y las enfermedades sistémicas relacionadas se empleó la prueba de χ2. El riesgo estimado de la enfermedad se calculó mediante una razón de momios y todo el análisis de datos se llevó a cabo con el software SPSS, versión 15.0.
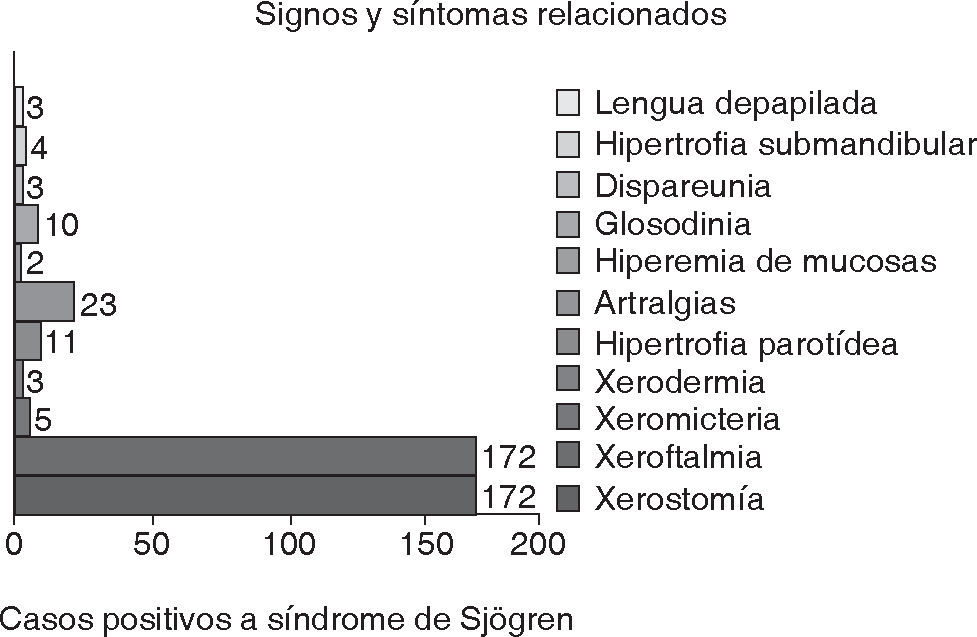
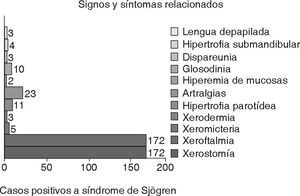
ResultadosSe evaluaron 321 casos, de los cuales 172 fueron positivos para síndrome de Sjögren, 71 (41%) para el tipo primario y 101 (59%) para el tipo secundario, estableciendo el diagnóstico con base a los criterios propuestos por el Grupo de Consenso Americano y Europeo publicados en el 2002.8 En la distribución por género de los casos positivos se encontraron 160 (93%) mujeres y 12 (7%) hombres, con un rango de edad de los pacientes entre 18 y 79 años y una media de 48.6 años. Los signos y síntomas encontrados en los pacientes con síndrome de Sjögren positivo fueron la xerostomía y la xeroftalmia en el 100% de los casos, artralgias en 23 casos (13.3%), hipertrofia parotídea en 11 (6.3%), glosodinia en 10 (5.8%), xeromicteria en 5 (2.9%), hipertrofia submandibular en 4 (2.3%), xerodermia, dispareunia y atrofia de papilas linguales en 3 (1.7%) casos respectivamente (Figura 1).
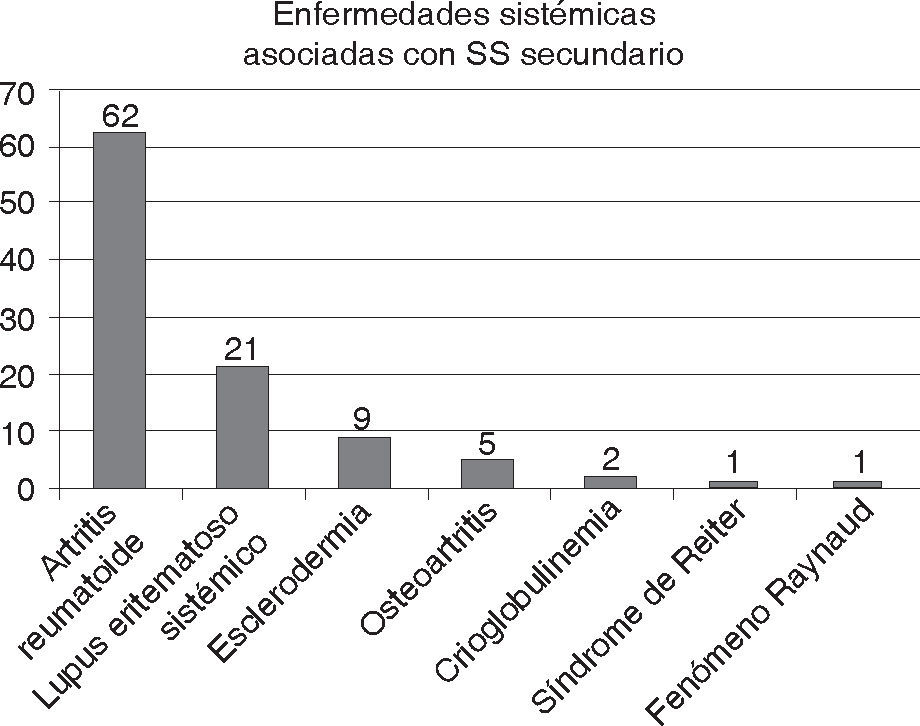
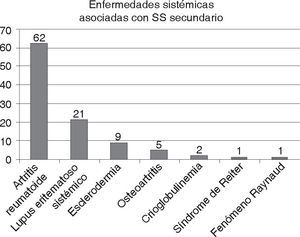
En los pacientes con síndrome de Sjögren secundario la enfermedad sistémica más encontrada fue la artritis reumatoide que se presentó en 62 casos (61.1%), seguida de lupus eritematoso sistémico en 21 casos (20.3%), esclerodermia en 9 casos (8.9%), osteoartritis en 5 casos (4.8%), crioglobulinemia en 2 casos (1.9%), síndrome de Reiter y fenómeno de Raynaud en un caso (0.5%) respectivamente (Figura 2). Se encontró una asociación directa entre la presencia de la artritis reumatoide y el diagnóstico de SS secundario positivo mediante la prueba de χ2, obteniendo una p<0.001, razón de momios igual a 3.25 con un intervalo de confianza del 95% y un rango de 1.8 a 5.6, por lo que en aquellos pacientes con sospecha de tener SS y que tengan artritis reumatoide existe un riesgo tres veces mayor de presentar la enfermedad. Por otra parte, también se encontró asociación entre el lupus eritematoso sistémico y el diagnóstico de SS secundario positivo con la prueba de χ2, obteniendo una p=0.004, con una razón de momios de 4.0 y un intervalo de confianza del 95%, rango de 1.4 a 10.9,
observando que en aquellos pacientes con sospecha de tener SS y que padecen lupus eritematoso sistémico el riesgo es cuatro veces mayor de presentar la enfermedad.
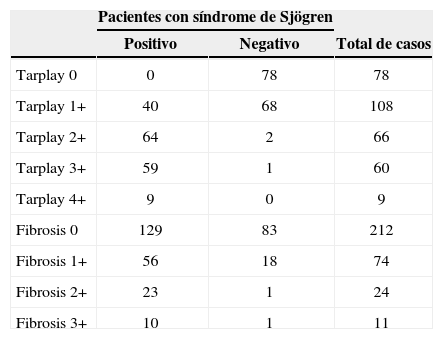
En cuanto a los resultados histopatológicos de las biopsias de los 321 pacientes evaluados (Cuadro IV), ninguno de los 172 casos positivos a SS tuvieron un índice de Tarplay de 0, 40 casos tuvieron Tarplay 1+, 64 casos Tarplay 2+, 59 casos Tarplay 3+ y 9 casos Tarplay 4+. De los 149 casos con SS negativo, 78 de ellos tuvieron Tarplay 0, 68 casos Tarplay 1+, 2 casos Tarplay 2+, un caso Tarplay 3+ y ninguno obtuvo un índice de Tarplay 4+. Para establecer la asociación entre el índice de Tarplay obtenido en las biopsias y el diagnóstico positivo para SS, se realizaron tablas de contingencia en las cuales se excluyeron las variables con valor menor a cinco, por lo que se colapsaron los grados de Tarplay y sólo se compararon aquellos casos que obtuvieron un Tarplay 1+, 2+ o 3+, empleando la prueba exacta de Fisher, encontrando una relación directa entre el incremento del índice de Tarplay de las biopsias de glándulas salivales labiales y el diagnóstico positivo para síndrome de Sjögren con una p<0.001, una razón de momios de 0.13 y un intervalo de confianza del 95%, con un rango de 0.004 a 0.045, por lo que entre mayor es el índice de Tarplay obtenido, la posibilidad de tener el síndrome aumenta. De los 172 casos positivos a síndrome de Sjögren sólo 89 presentaron algún grado de fibrosis, 56 casos tuvieron fibrosis mínima (1+), 23 casos fibrosis moderada (2+) y un caso con fibrosis severa (3+). No se encontró alguna asociación entre el grado de fibrosis de las biopsias y el diagnóstico positivo para el síndrome de Sjögren.
Características histológicas de las biopsias de glándulas salivales labiales de los 321 pacientes con sospecha de tener síndrome de Sjögren.
| Pacientes con síndrome de Sjögren | Total de casos | ||
|---|---|---|---|
| Positivo | Negativo | ||
| Tarplay 0 | 0 | 78 | 78 |
| Tarplay 1+ | 40 | 68 | 108 |
| Tarplay 2+ | 64 | 2 | 66 |
| Tarplay 3+ | 59 | 1 | 60 |
| Tarplay 4+ | 9 | 0 | 9 |
| Fibrosis 0 | 129 | 83 | 212 |
| Fibrosis 1+ | 56 | 18 | 74 |
| Fibrosis 2+ | 23 | 1 | 24 |
| Fibrosis 3+ | 10 | 1 | 11 |
El uso de los criterios más específicos para establecer el diagnóstico de SS es sumamente importante, ya que un inapropiado diagnóstico condiciona al paciente a vivir con el espectro de una incurable y potencialmente progresiva enfermedad, y a su vez lo priva del tratamiento para una condición reversible que imita al síndrome de Sjögren, tal como una hipofunción secretoria causada por efectos colaterales de drogas, meibomitis, blefaritis, conjuntivitis alérgica, etc. En el presente estudio el diagnóstico de SS se basó en los criterios propuestos por el Grupo de Consenso Americano y Europeo en el 20028 que incluyen las nuevas reglas para la correcta clasificación de los pacientes con síndrome de Sjögren primario y secundario, así como una lista de criterios de exclusión, que los convierte en un instrumento valioso para el diagnóstico de los pacientes, empleando como principal criterio objetivo la histopatología de las glándulas salivales labiales. En el Centro Médico Nacional «La Raza» no se realizan pruebas de autoanticuerpos de rutina como parte del protocolo de estudio de pacientes con sospecha de tener SS, pues se sabe que al menos 15% de los pacientes con SS pueden escapar a la detección de autoanticuerpos por los métodos utilizados rutinariamente;10,11 por lo que la biopsia de glándulas salivales labiales se considera como el principal criterio objetivo para establecer el diagnóstico de SS. Drossos et al., encontraron al estudiar una población geriátrica de hombres y mujeres en Grecia una prevalencia de síndrome de Sjögren primario de 4.83%, basado en la presencia de queratoconjuntivitis, proporción anormal de flujo parotídeo, y un registro de más de 2+ focos en glándulas salivales labiales (evaluadas con la escala de Tarplay), el 6% de esas personas tuvieron un resultado positivo a ANA, pero ninguna tuvo anticuerpos Ro o La,9 lo que apoya lo encontrado por Vitali10 y Anaya11 en sus estudios acerca de la exactitud de las pruebas de autoanticuerpos.
En 1966, la biopsia de glándulas salivales labiales fue vinculada por primera vez como parte importante del diagnóstico de SS, por lo que se han propuesto diversas pruebas para realizar la evaluación histológica de las glándulas salivales labiales, aunque la mayoría de los estudios coinciden en que la presencia de más de un foco de linfocitos por 4mm2 de tejido glandular salival labial es un hallazgo constante en pacientes con síndrome de Sjögren, además de que provee una medida semicuantitativa del componente oral de la enfermedad.15 Para Daniels y Whitcher el hallazgo histológico de sólo un foco puede representar una forma temprana o leve del componente oral del SS y debe levantar la sospecha de la enfermedad, pero no debe emplearse como criterio diagnóstico.6 En nuestro estudio encontramos que de los 172 casos positivos a SS, 40 casos tuvieron Tarplay 1+, 64 casos Tarplay 2+, 59 casos Tarplay 3+ y 9 casos Tarplay 4+, lo que concuerda con lo descrito por Talal,3 Moutsopoulos16 y Chisholm,17 quienes describen como imagen histológica típica del síndrome de Sjögren un grado de infiltración linfocítica 2+ a 4+.
En algunos estudios,18–22 se considera que la escala de Tarplay es cualitativa y que por lo tanto no distingue adecuadamente entre los patrones de inflamación del tejido glandular salival. En nuestro estudio encontramos una asociación directa entre el incremento del índice de Tarplay obtenido en las biopsias de glándulas salivales labiales analizadas y el diagnóstico positivo para SS, sin encontrar relación con el grado de fibrosis, ya que de los 172 casos positivos sólo 89 presentaron algún grado de fibrosis y de los 149 casos negativos, 20 tuvieron fibrosis, lo que también coincide con lo descrito por Talal,3 Moutsopoulos16 y Chisholm,17 quienes consideran a la sialadenitis como la característica más específica del síndrome de Sjögren, ya que es posible encontrar fibrosis, atrofia e infiltración grasa en personas mayores de 50 años, sin que presenten síndrome de Sjögren.
Finalmente, no encontramos diferencias significativas con lo publicado hasta ahora acerca de la edad de presentación de la enfermedad, sus manifestaciones clínicas y la predilección por el sexo femenino.
ConclusionesEl diagnóstico de síndrome de Sjögren se basa actualmente en los criterios de clasificación propuestos por el Grupo de Consenso Americano y Europeo, publicados en el 2002, los cuales incluyen la histopatología de las glándulas salivales menores como uno de los principales criterios objetivos de diagnóstico, aunque los resultados de la biopsia deben aplicarse al componente oral y no al síndrome completo. En el presente estudio se demostró que la escala de Tarplay es un método confiable para evaluar histológicamente las biopsias de glándulas salivales labiales y establecer el diagnóstico de SS, ya que existe una asociación directa entre el índice de Tarplay obtenido y la posibilidad de tener síndrome de Sjögren.