La adición directa de células troncales mesenquimales puede aumentar las posibilidades de curación de las lesiones meniscales en zona avascular. El objetivo de este estudio es averiguar si la aplicación postoperatoria de la fracción vasculoestromal (FVE) obtenida a partir de tejido adiposo puede tener un efecto en la vascularización y la proliferación celular en el menisco suturado.
MétodosA 4 cerdos (8 rodillas) se les realizó una lesión longitudinal de 10mm en zona avascular del menisco medial de ambas rodillas. Dos meses más tarde se reparó la lesión de ambas rodillas con un punto simple. Al mismo tiempo se obtuvieron 50g de grasa abdominal de la que se consiguieron 2cm3 de FVE (donde se objetivó la presencia de aproximadamente 1-5×106células troncales mesenquimales) y se inyectaron en una de las 2 rodillas de cada cerdo 4h después de la cirugía (grupo FVE), siendo la otra rodilla el grupo de control. Los animales se sacrificaron 15 días después. Se evaluaron los siguientes parámetros histológicos en tinción con hematoxilina-eosina: grado de curación, neovascularización del tejido, proliferación de fibrocondrocitos alrededor de la lesión y presencia de repoblación condrocitaria.
ResultadosLa tasa de curación (no curado/cicatrización parcial/curación completa) para el grupo de FVS fue 1/1/2, y para el grupo control fue de 2/2/0 (diferencias no significativas). El grado de neovascularización fue mayor en el grupo FVE (3,25 vs. 2). El grado de proliferación de fibrocondrocitos fue mayor en el grupo FVE (2,5 vs. 1,75). Aparecieron formaciones de condrocitos isogénicos en 2 meniscos del grupo FVE y en ninguno del grupo control.
ConclusionesLa inyección intraarticular postoperatoria inmediata de FVE parece aumentar la neovascularización, la proliferación fibrocondrocítica y la repoblación de condrocitos a los 15 días después de la reparación de una lesión meniscal en cerdos.
Nivel de evidenciaEstudio experimental.
Relevancia clínicaSe plantea una manera de administración de células troncales que puede ser más sencilla de implementar en humanos que el cultivo celular.
The addition of mesenchymal stem cells may increase the chance of healing of meniscal lesions in the avascular zone. The objective of this study is to find out if the postoperative application of the stromal vascular fraction (SVF) from adipose tissue can have an effect on vascularization and cell proliferation in the sutured meniscus.
MethodsFour pigs (8 knees) underwent a longitudinal injury of 10mm in the avascular area of the medial meniscus in both knees. Two months later the injury was repaired on both knees with a simple suture. At the same time 50g of abdominal fat was removed and 2cm3 of SVF was purified (in which it was found to contain approximately 1-5×106mesenchymal stem cells). This was injected into one of the knees of each pig 4h after the surgery (SVF group), using the other knee as the control group. The animals were sacrificed after 15 days. The following histological parameters with hematoxylin-eosin staining were evaluated: degree of healing, neo-vascularization of tissue and the proliferation of fibro-chondrocytes around the lesion and the presence of new chondrocytes.
ResultsThe healing rate (unhealed / partial healing / healed) for the SVF group was 1/1/2, and was 2-2-0 for control group (non-significant differences). The degree of neo-vascularization was higher in the SVF group (3.25 vs 2). The degree of fibro-chondrocytes proliferation was greater in the SVF group (2.5 vs 1.75). The formation of isogenic chondrocytes was observed in 2 menisci of the SVF group and none in the control group.
ConclusionsThe postoperative intra-articular injection of SVF might increase the neovascularization, the proliferation of fibro-chondrocytes and the repopulation of chondrocytes 15 days after the repair of meniscal injury in pigs.
Evidence levelExperimental study.
Clinical relevanceA system for the use of stem cells is presented that might be easier to implement in humans that cell cultures.
Los meniscos son partes esenciales en la función de la rodilla y son objeto frecuente de lesión. La resección meniscal tiene efectos deletéreos bien conocidos por lo que el cirujano debe intentar conservar la mayor parte posible de menisco1–3. Sin embargo, el tejido meniscal tiene un potencial regenerador muy escaso debido a, entre otras razones, su pobre celularidad y, en la zona central avascular, a la ausencia de vasos y de las células progenitoras que se hallan en ellos4. Por todo esto, las terapias regenerativas celulares tienen un campo de aplicación significativo en la afección meniscal5. En este sentido, se ha evaluado en animales el uso de células troncales mesenquimales (CTM) tanto para el tratamiento de defectos tisulares como para mejorar las posibilidades de reparación de una sutura meniscal6–10.
El tejido adiposo representa una excelente fuente de células troncales ya que los depósitos subcutáneos de tejido adiposo son accesibles (a través de liposucción), abundantes y reponibles. El tejido adiposo se compone fundamentalmente de 2 líneas celulares, los adipocitos maduros, y la fracción vasculoestromal (FVE)11,12. La FVE se compone de una pléyade heterogénea de tipos celulares incluyendo preadipocitos, células endoteliales, células musculares lisas, pericitos, macrófagos, fibroblastos y CTM derivadas de la grasa13,14. Estas CTM derivadas de la purificación del lipoaspirado se diferencian in vitro en múltiples linajes celulares: adipocitos, condrocitos, hepatocitos, osteoblastos, células endoteliales, epiteliales, hematopoyéticas, neuronales y miogénicas15–19.
A la hora de plantear el uso en humanos de CTM autógenas el cultivo celular presenta dificultades logísticas y de coste. La FVE se presenta como una alternativa adecuada, y su efectividad ya ha sido comprobada en el uso clínico en humanos20.
El objetivo de este estudio es evaluar el efecto de CTM autógenas obtenidas mediante la purificación de la FVE de grasa sobre una lesión crónica suturada en menisco de cerdo, con la hipótesis de que son útiles para mejorar los resultados de dicha sutura.
Material y métodosEste es un estudio experimental en el que se utilizaron 4 cerdos hembra de 20kg. El protocolo del estudio fue aprobado por el Comité de Bienestar Animal de nuestro centro, y fue llevado a cabo de acuerdo con la legislación europea.
Protocolo de lesión y sutura meniscalSe usó un modelo de lesión crónica de menisco medial según la técnica descrita por Díaz Heredia21. En una primera intervención, bajo anestesia general y por una artrotomía longitudinal medial se aborda el menisco medial del cerdo y con un bisturí se realiza una lesión meniscal completa de 10mm de largo, paralela al borde libre del menisco y situada en la unión del cuerpo con el cuerno anterior y entre el tercio medio y el tercio central del menisco (en la zona avascular). La lesión no se sutura y se cierra el abordaje quirúrgico. A los animales se les permite libertad de movimiento en su zona de estabulación durante 2 meses.
Pasados 2 meses de la lesión meniscal se realiza la intervención para la sutura meniscal. Bajo anestesia general, y siguiendo el protocolo de la primera intervención, a través de la cicatriz se aborda el menisco medial. Se identifica la zona lesionada en el cuerno anterior, se comprueba que no esté cicatrizada, y se sutura con un punto simple de Prolene® 5/0 colocado en el centro de la lesión, se da desde el muro meniscal hasta 1,5mm del borde medial de la lesión y se anuda lateralmente. Se cierra el abordaje y se les permite libertad de movimiento.
Extracción de la fracción vasculoestromalEl protocolo de extracción y purificación de las células de la FVE usado es el descrito por García-Olmo et al.20. Inmediatamente antes de la segunda intervención sobre la rodilla se realiza una laparotomía tipo Pfanestiel y se obtienen unos 50cm3 de tejido adiposo subcutáneo e inguinal. Se lava extensivamente con volúmenes iguales de solución salina con tampón fosfato estéril (GIBCO BRL, Paisley, Reino Unido), solución salina y anestésico local. El tejido resultante se digiere con colagenasa tipo i (GIBCO BRL) en concentración final del 0,075% en solución salina a 37° C durante 45min para liberar la fracción celular. La colagenasa se inactiva añadiendo medio de Eagle modificado de Dulbeco (GIBCO) con suero bovino fetal (10% v/v), y la suspensión de células resultantes se centrifuga durante 10min a 250×g. El precipitado de células se lava con solución salina con tampón fosfato, se centrifuga nuevamente y se trata con cloruro de amonio 160mM a temperatura ambiente durante 10min para eliminar cualquier eritrocito restante. Las células posteriormente se lavan, se filtran a través de malla de nailon de 40μm y se suspenden en solución Ringer-lactato estéril (Griffols S.A., Barcelona, España) para la implantación inmediata sin expansión (FVE). Se resuspenden en 2cm3 de suero salino y se hace un recuento por citometría de flujo del número de células obtenido.
Inyección de la fracción vasculoestromalEn cada animal se usó la rodilla izquierda como grupo control y la rodilla derecha para el tratamiento con FVE. Cuatro horas tras la sutura meniscal y la obtención del tejido adiposo se seda al animal con ketamina intramuscular y se infiltra la FVE mediante inyección intraarticular en la rodilla derecha.
Obtención de muestras y análisis histológicoLos animales se mantuvieron estabulados sin restricción para el movimiento de las extremidades durante 2 semanas. Entonces fueron sacrificados mediante una inyección intravenosa de Propofol®. Se realizó una artrotomía transversa subpatelar y se extrajeron ambos meniscos mediales completos.
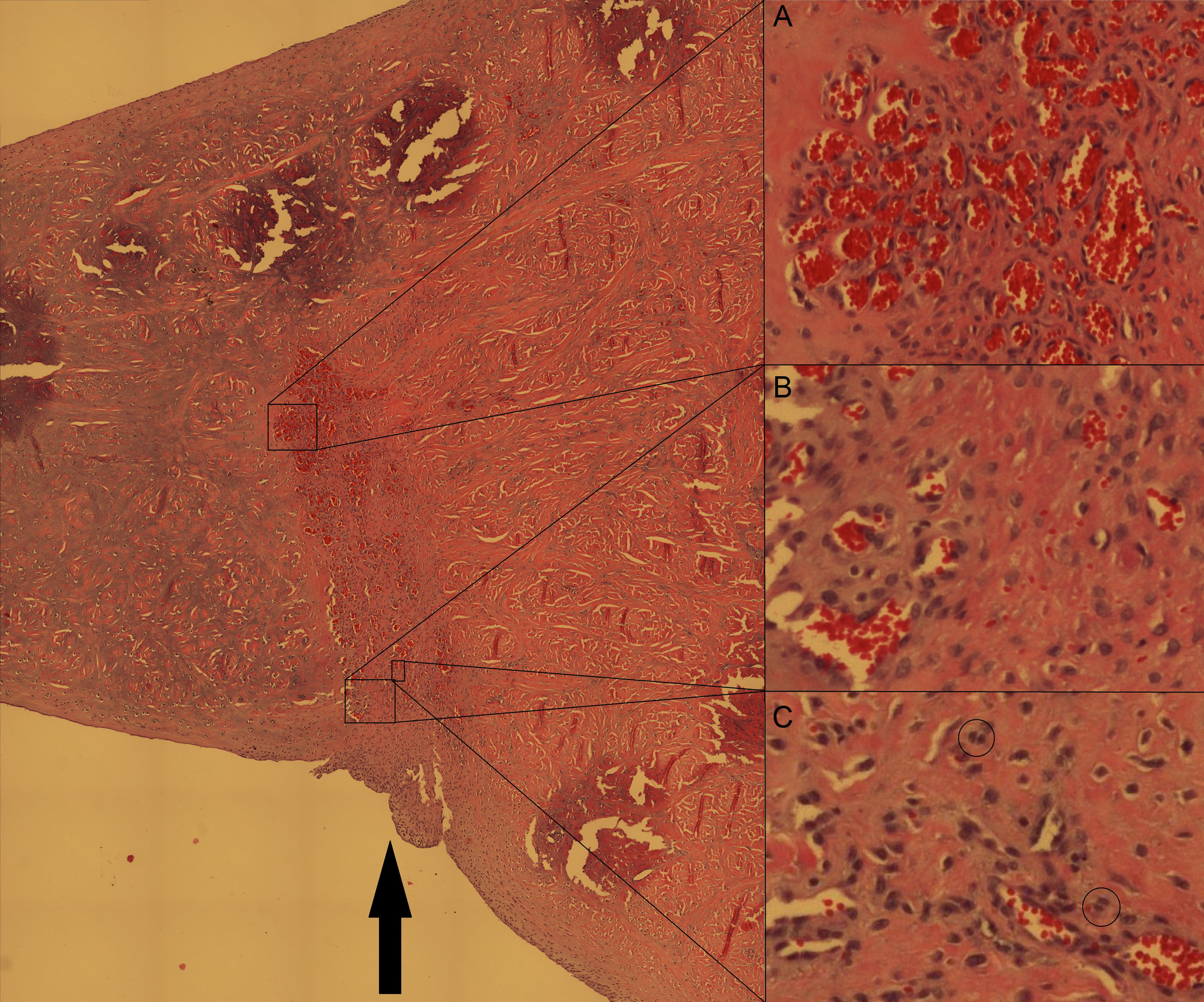
Se fijaron los meniscos en formaldehído (solución A DiaPath®) durante 15 días, y se descalcificaron con ácido hidroclórico y EDTA (solución B DiaPath®) durante 3 semanas. Se incluyeron en parafina y se realizaron cortes de 5-10μm en el plano coronal del menisco perpendicularmente a la lesión. Los meniscos se tiñeron con hematoxilina-eosina. Se evaluaron los siguientes parámetros histológicos: grado de curación(no curado/cicatrización parcial/curación completa), la neovascularización del tejido y la proliferación de fibrocondrocitos alrededor de la lesión (ambas con una escala semicuantitativa de 5 grados) y la presencia de repoblación condrocitaria (por evaluación de formas isogénicas). Se analizaron las muestras bajo microscopia a 20x y a 100x.
Análisis estadísticoEl análisis estadístico se realizó con el programa SPSS 16.0. Todas las variables fueron consideradas como no paramétricas. Las diferencias encontradas en las diversas variables fueron evaluadas usando el test de Friedman. El nivel de significación aceptado fue p<0,05.
ResultadosTras la purificación de la FVE se obtuvieron siempre entre 2 y 4×106 células. Se confirmó la viabilidad celular con azul de tripán (Sigma, St Louis, MO, EE. UU.), y siempre fue superior al 95%.
Durante la segunda intervención a los 2 meses de la lesión no se objetivó que ninguna de las roturas meniscales se hubiera curado espontáneamente.
Al evaluar los resultados a los 15 días tras la sutura meniscal y aporte de CTM, la tasa de curación (no curado/cicatrización parcial/curación completa) para el grupo tratado fue 1/1/2 y para el grupo control fue de 2/2/0 (p>0,05). La media del grado de neovascularización fue mayor en el grupo tratado (3,25±1,5 vs. 2±1,4) (p>0,05). La media del grado de proliferación de fibrocondrocitos fue mayor en el grupo tratado (2,5±1 vs. 1,75±0,5) (p>0,05). Aparecieron formaciones de condrocitos isogénicos en 2 meniscos del grupo tratado y en ninguno del grupo de control (fig. 1).
Corte axial del menisco medial del cerdo al nivel de la lesión meniscal (flecha negra) suturada. Tinción hematoxilina-eosina, ampliación original 20×. Pese a que han pasado solo 2 semanas, la curación de la lesión es evidente. Se aprecian zonas de neovascularización extensas (detalle A) en la zona de lesión mientras que a ambos lados de la zona lesionada estas no aparecen, confirmando que la lesión inicial se realizó en zona avascular. También se aprecia hipercelularidad evidente a expensas de fibrocondrocitos maduros en la zona lesionada (detalle B). Asimismo se aprecian en algunas localizaciones formaciones isogénicas de condrocitos (detalle C, círculos pequeños).
El uso de CTM mediante la inyección intraarticular de la FVE del tejido adiposo para el tratamiento de lesiones crónicas en zona avascular del menisco medial del cerdo parece favorecer la neovascularización, la proliferación de fibrocondrocitos y la repoblación condrocítica evaluadas a las 2 semanas postratamiento.
La necesidad de conservar la mayor parte posible de tejido meniscal en la cirugía de las lesiones meniscales es una regla esencial de esta cirugía. Las técnicas actuales de sutura meniscal se encuentran con limitaciones relacionadas con las características mecánicas y bioquímicas del menisco, de manera que las lesiones que se producen en la zona avascular del menisco presentan tasas de curación con las técnicas actuales de en torno al 20-30%22. Existe, pues, la necesidad de diseñar estrategias biológicas que mejoren las expectativas de las suturas meniscales en zona avascular.
Las CTM obtenidas de grasa se han utilizado ampliamente en terapéutica de regeneración tisular. En estudios previos9,23 se ha comprobado que el uso de CTM derivadas de grasa tiene un efecto positivo en la curación de lesiones en el cuerno anterior del menisco medial del conejo. La tasa de éxito de la sutura primaria fue mayor cuando se añadieron 10×5CTM. Este estudio se realizó usando CTM alogénicas proliferadas, que es adecuado para su uso experimental pero que presenta diversas dificultades logísticas y económicas para trasladarlo a la clínica con humanos.
La FVE es el producto de lipoaspiración que se obtiene de la liposucción del tejido adiposo. La lipoaspiración contiene una gran población de células llamadas células adiposas derivadas, que comparte muchas similitudes con las CTM14,24. García-Olmo et al.20 han demostrado que el uso de la FVE presenta un comportamiento similar a las CTM autógenas proliferadas en lesiones de fistulas de Crohn. La FVE ha sido usada en humanos en el tratamiento de las fístulas de Crohn25–27, en el manejo de enfermedades autoinmunes como la esclerosis múltiple28 y la esclerodermia29, en el campo de la cirugía plástica24,30,31, y para tratar lesiones cardiacas32 y pulmonares33,34. En cirugía ortopédica, la inyección intraarticular de FVE en humanos se ha descrito para el tratamiento de lesiones osteocondrales de astrágalo35 y para el manejo de la artrosis de rodilla36. Hay que resaltar que no se han descrito complicaciones mayores relacionadas con el uso de la FVE en la infiltración intraarticular en rodilla en humanos.
Una estrategia atractiva para la regeneración es la inyección intraarticular de células progenitoras que pueden participar en la regeneración de los tejidos y mejorarla. Este enfoque presenta varias ventajas: (i) es fácil de llevar a cabo en un régimen ambulatorio con mínima morbilidad; (ii) puede ser utilizado para tratar lesiones individuales o enfermedades degenerativas; (iii) funciona en 2 direcciones, entregando las células que pueden activamente regenerar los tejidos dañados y secretan factores tróficos y antiinflamatorios que pueden restablecer la homeostasis conjunta37,38; (iv) se puede repetir; y (v) minimiza la difusión sistémica de las células implantadas8.
La inyección intraarticular de CTM39 ya se ha usado previamente para el tratamiento de lesiones meniscales. Murphy et al.40 realizaron una resección completa del menisco medial y el ligamento cruzado anterior para provocar artrosis en cabras; posteriormente realizaban infiltraciones intraarticulares de CTM derivadas de médula ósea, y observaban presencia de estas células en el menisco regenerado y menor progresión de la artrosis en las rodillas tratadas. Los autores asociaban los buenos resultados obtenidos no solo a la acción propia de las CTM, sino también a su efecto reclutador de trófico para otras células. Horie et al.8 investigaron el potencial para la regeneración del menisco de la inyección intraarticular de CTM derivadas de la membrana sinovial en un modelo de ratas con defecto meniscal. Se demostró la participación activa de las CTM inyectadas en el proceso de regeneración, adhiriéndose a los sitios lesionados y sintetizando nuevos tejidos; también se apreció, con análisis de imagen in vivo, que las células inyectadas no se movilizaban fuera de la articulación inyectada. Este es un tema crucial de la seguridad con respecto a una posible aplicación clínica en humanos. Otro interesante punto en este trabajo es que los autores podían detectar actividad MSC en la articulación hasta 28 días después de la inyección pero no tras un tiempo más largo. Esto puede explicarse por el hecho de que, después de activar la regeneración de los tejidos, la mayor parte de las células mueren mientras que unas pocas permanecen en el tejido neoformado. Esto es una prueba más que apoya la hipótesis de las CTM como liberadoras de factores tróficos para la reparación de los tejidos.
En el presente estudio el uso de la FVE y la inyección intraarticular bajo sedación de las células obtenidas ha posibilitado el aporte de CTM a una lesión meniscal en un intervalo horario de 4h. Este espacio temporal aporta ventajas logísticas y económicas sobre lo que se tardaría en obtener CTM autógenas proliferadas, y es aceptable a la hora de plantearnos la incorporación clínica de esta terapia. Los resultados histológicos a 2 semanas de la sutura e infiltración de la FVE permiten objetivar una influencia beneficiosa de las mismas, favoreciéndose la neovascularización en la zona lesionada como paso inicial e indispensable para la reparación de los tejidos. También se produce un aumento de la proliferación de fibrocondrocitos y la diferenciación condral de las células, que se traduce en un inicio de la reparación de la lesión.
LimitacionesEl estudio con animales de experimentación aporta numerosos factores de distorsión, uno de ellos es la variación de comportamiento entre individuos con un número tan pequeño de animales. Este factor fue esencial también en la imposibilidad de obtener resultados con relevancia estadística en el análisis histológico. Sin embargo siempre se planteó el estudio como exploratorio de las posibilidades de la técnica, que parece prometedora. Se debe evaluar a más largo plazo la influencia de la infiltración intraarticular de la FEV en meniscos tanto no suturados como suturados.
ConclusionesEl uso de CTM mediante la inyección intraarticular de la FVE del tejido adiposo asociado a la sutura de lesiones crónicas en zona avascular del menisco medial del cerdo parece favorecer la neovascularización, la proliferación de fibrocondrocitos y la repoblación condrocítica evaluadas a las 2 semanas postratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.