El síndrome de Sjögren (SS) es una enfermedad autoinmune que compromete la función de las glándulas exocrinas, produciendo xerostomía y xeroftalmia. El método utilizado para cuantificar la disfunción glandular salival es el flujo salival no estimulado (FSNE). Describir las principales técnicas de recolección del FSNE en pacientes con SS.
Revisión sistemática de la literatura (guías PRISMA) de estudios observacionales tipo casos y controles, cohorte y corte transversal que incluyeran pacientes con síntomas secos y diagnóstico de SS por criterios clasificatorios internacionales, que fueran comparados con una población de referencia sana o con síntomas secos no Sjögren y en los cuales se reportara la técnica y el valor del FSNE como desenlace principal. Para la calificación del nivel y calidad de la evidencia se utilizaron las guías Oxford y el Joanna Briggs Institute.
Veintinueve artículos fueron incluidos, con una población total de 2.730 pacientes: 1.397 casos y 1.333 controles. La técnica más frecuentemente reportada fue la de Navazesh por recogida espontánea de drenaje durante 5min. El punto de corte más frecuentemente encontrado fue 0,1ml/min.
Por primera vez se describen, a través de una revisión sistemática de la literatura, las principales técnicas utilizadas para evaluar el FSNE en individuos con SS cuando se comparan con personas sanas o con síndrome seco no SS, resaltando que es una técnica validada, no invasiva, reproducible y de bajo costo.
Sjögren's syndrome (SS) is an autoimmune disease that compromises the function of exocrine glands, producing xerostomia and xerophthalmia. The method used to quantify saliva gland dysfunction is by unstimulated whole saliva flow (UWSF).
To describe the main UWSF techniques in patients with SS.
Systematic review of the literature (following PRISMA guidelines) of results that include analytical observational studies of case-control, cohort, and cross-sectional studies that include patients with sicca symptoms and diagnosis of SS by international classification criteria, which were compared with healthy subjects or those with non-Sjögren sicca symptoms, and in which the technique and the value of the UWSF was reported as the main outcome. Qualification of the level and quality of the evidence was obtained using the Oxford and Joanna Briggs Institute guidelines.
A total of 29 articles were included, with total population of 2,730 patients: 1,397 cases and 1,333 controls. The most frequently reported technique was that of Navazesh by spontaneous drainage collection for 5min. The most frequent cut-off point found was 0.1ml/min. For the first time in the literature, and by using a systematic review of the literature, a description is presented of the main techniques used to evaluate UWSF in individuals with SS when compared with healthy people or with sicca non-SS syndrome, highlighting that it is a valid, non-invasive, reproducible, and low cost technique.
El síndrome de Sjögren (SS) es una enfermedad autoinmune crónica que compromete la función de las glándulas exocrinas de la piel, la boca, los ojos, las fosas nasales y otras mucosas, produciendo síntomas secos, predominantemente a nivel ocular y oral1. Su forma de presentación puede ser aislada (síndrome de Sjögren primario) o asociada a otra enfermedad autoinmune (llamado recientemente poliautoinmunidad y previamente, síndrome de Sjögren secundario), como la enfermedad tiroidea autoinmune (15-30%), la artritis reumatoide (4-31%), el lupus eritematoso sistémico (9-19%) y la esclerosis sistémica (14%)2.
El sello distintivo de la enfermedad lo conforman los síntomas secos oculares y orales, además de la fatiga y el dolor articular, presentándose en más del 80% de los casos. Alrededor del 40% de los pacientes con SS presentan manifestaciones sistémicas o extraglandulares3. La prevalencia del SS se estima entre 0,3-1 caso/1.000 personas3, con una incidencia anual de 6,92 casos/100.000 personas4. Es una entidad predominante en el sexo femenino, alcanzando una razón de 9:1 con respecto a los hombres, y se registra un pico diagnóstico a los 50 años3.
Los mecanismos fisiopatológicos de la enfermedad no son claramente conocidos, sin embargo, se reconoce que existe daño epitelial glandular por una respuesta inmunológica mediada por células T y B (contra antígenos Ro/SSA y La/SSB) e infiltrado linfocítico periepitelial en diferentes tejidos, que conllevan la destrucción tisular. Su etiología es multifactorial, con interacción de factores genéticos, epigenéticos, hormonales y medioambientales5.
El diagnóstico del SS se realiza a partir de la presencia de hipofunción glandular ocular u oral, sumada a otros ítems incluidos en los criterios de clasificación del American College of Rheumatology/European League Against Rheumatism (ACR/EULAR). Estos criterios permiten clasificar a aquellos pacientes con sospecha de SS, bien sea por la presencia de síntomas secos oculares u orales (definida por una pregunta positiva de las 5 establecidas para sequedad), bien por la hipertrofia glandular salival o el compromiso extraglandular6.
La xerostomía se establece como la principal manifestación clínica en el SS, pues impacta negativamente en los índices de calidad de vida7,8 por su asociación con el desarrollo de enfermedad periodontal, caries dental, halitosis, candidiasis oral, disgeusia y problemas en la deglución y la emisión del lenguaje9. Teniendo en cuenta lo anterior, resulta de gran importancia evaluar de forma rutinaria la medición objetiva de la producción salival (sialometría). Se mencionan diferentes técnicas para su estimación, bien sea de todas las superficies orales combinadas durante el reposo y sin ningún tipo de estímulo (flujo salival no estimulado [FSNE]) o con estimulación (flujo salival estimulado)10, bien de glándulas salivales individuales. La medida del FSNE es una prueba no invasiva, rápida, fácil de realizar y forma parte de los criterios clasificatorios para SS en sus diferentes versiones6,11,12; la técnica descrita por Navazesh et al. es la que se encuentra validada de acuerdo con los últimos criterios internacionales establecidos por el ACR/EULAR6,10,13–15.
La medición del FSNE es una herramienta útil para detectar hipofunción glandular y se encuentra indicada en aquellos pacientes que cursen con xerostomía. Se ha definido el valor de 0,1ml/min o 1,5ml/15min como punto de corte para diferenciar los individuos con síndrome seco (sicca, xerostomía) de aquellos sin xerostomía, aplicándose así mismo para clasificar individuos sanos con riesgo de desarrollar caries dental. Dada la subjetividad de la xerostomía, el equipo de la salud puede identificar a estos pacientes mediante diferentes cuestionarios16,17. En el caso de un paciente con sospecha de SS, se realizan 5 preguntas para evaluar sequedad; si presenta por lo menos una respuesta afirmativa, se deben iniciar estudios con miras a descartar SS6, incluyendo el FSNE, criterio que históricamente no siempre se había tenido presente en los diversos consensos internacionales18.
Por otro lado, un amplio número de profesionales de la salud (médico general, reumatólogo, otorrinolaringólogo, cirujano maxilofacial, odontólogo) que valoran pacientes con síndrome seco, desconocen su forma de realización, y sus puntos de corte, o siguen utilizando otras formas no validadas en la actualidad dentro de los criterios clasificatorios para medir la función glandular salival, como la gammagrafía, en el contexto de pacientes con sospecha de SS. El objetivo de esta revisión sistemática de la literatura consiste en describir las principales técnicas de sialometría a través del FSNE en estudios que comparan individuos con SS versus pacientes con sicca no SS o individuos sanos.
Materiales y métodosSe realizó una revisión sistemática de la literatura siguiendo las guías PRISMA19.
Criterios para incluir estudios en la revisión- 1.
Tipo de estudio: estudios observacionales analíticos de tipo casos y controles, corte transversal y estudios de cohorte.
- 2.
Población: pacientes mayores de 18 años de edad, con síntomas secos diagnosticados con SS según los criterios clasificatorios del ACR/EULAR6, el American-European Consensus Group11, Fox et al.12, Vitali et al., 199320.
- 3.
Tipos de medición: medida del FSNE.
- 4.
Grupo control: pacientes con síntomas secos sin SS y pacientes sanos.
- 1.
Estudios que no registraran la técnica empleada ni los valores estimados con sus respectivas unidades de medida.
- 2.
Estudios que compararan pacientes con otra enfermedad autoinmune.
- 3.
Estudios en pacientes embarazadas.
Se realizó una búsqueda sistemática de la literatura en las siguientes bases de datos: Medline/OVID, Lilacs, Embase y Cochrane/OVID. La última búsqueda bibliográfica se realizó el 26 de abril de 2019. Los datos para esta revisión incluían SS y estudios específicos donde se estimara el FSNE. A continuación se exponen los términos MesH utilizados: «Adult», «Sjogren's Syndrome», «Sjogrens», «Sjögren», «Sjögren's», «Sjogren», «Gougerot», «Gougerot-Sjogren», «Gougerot-Sjögren», «Primitive Gougerot-Sjögren», «Gougerot-Sjögren», «Gougerot-Houwers-Sjögren», «Unstimulated salivaly flow», «USF», «Unstimulated whole salivaly flow», «Whole unstimulated salivaly flow», «Unstimulated saliva», «Basal salivaly flow», «sialometry», «Whole unstimulated salivation». En la construcción de las ecuaciones de búsqueda, cada uno de los términos MeSH fue cruzado con las palabras clave utilizando los operadores boleanos (OR, AND, NOT) y los truncadores (wildcards). Así mismo, se realizó una búsqueda de literatura gris. La búsqueda de los estudios no se restringió por año de publicación, idioma o país de origen. Se aplicó el filtro humanos y adultos. Se tuvieron en cuenta resúmenes y artículos de texto completo. Para la búsqueda en la base Lilacs (español, portugués e inglés) se utilizaron los términos DeCS.
Selección, síntesis y registro de los estudiosLa primera revisión bibliográfica se realizó por título y resumen por parte de 2 autores de manera ciega; luego de resolver los desacuerdos por consenso durante esta fase de identificación, 2 autores realizaron la revisión por texto completo de manera independiente durante la fase de selección (Software Mendeley Desktop v1.19.2), teniendo en cuenta el cumplimiento de los criterios de elegibilidad. Cualquier desacuerdo entre los revisores se resolvió mediante discusión hasta que se alcanzó el consenso. Posteriormente, 2 autores de forma independiente extrajeron la información de los artículos incluidos, utilizando una base de datos realizada en el software Microsoft Excel® (versión 2013). Se resolvieron las discrepancias y se verificaron las inconsistencias por un tercer autor.
Evaluación de la calidad metodológicaDos autores evaluaron de forma independiente el nivel de evidencia de los estudios aplicando la lista de chequeo Oxford Centre for Evidence-Based Medicine 2011 Levels of Evidence Question21, así como la calidad metodológica con la lista de chequeo del Joanna Briggs Institute22.
Extracción de los datosSe registraron aspectos básicos sociodemográficos de los individuos. El desenlace principal fue la medición del FSNE de todos los individuos (síndrome seco por SS, individuos con síndrome seco no SS y sujetos sanos), detallando la técnica empleada, el tiempo de recogida y la hora en caso de ser mencionada.
Análisis por subgruposNo se realizaron análisis adicionales.
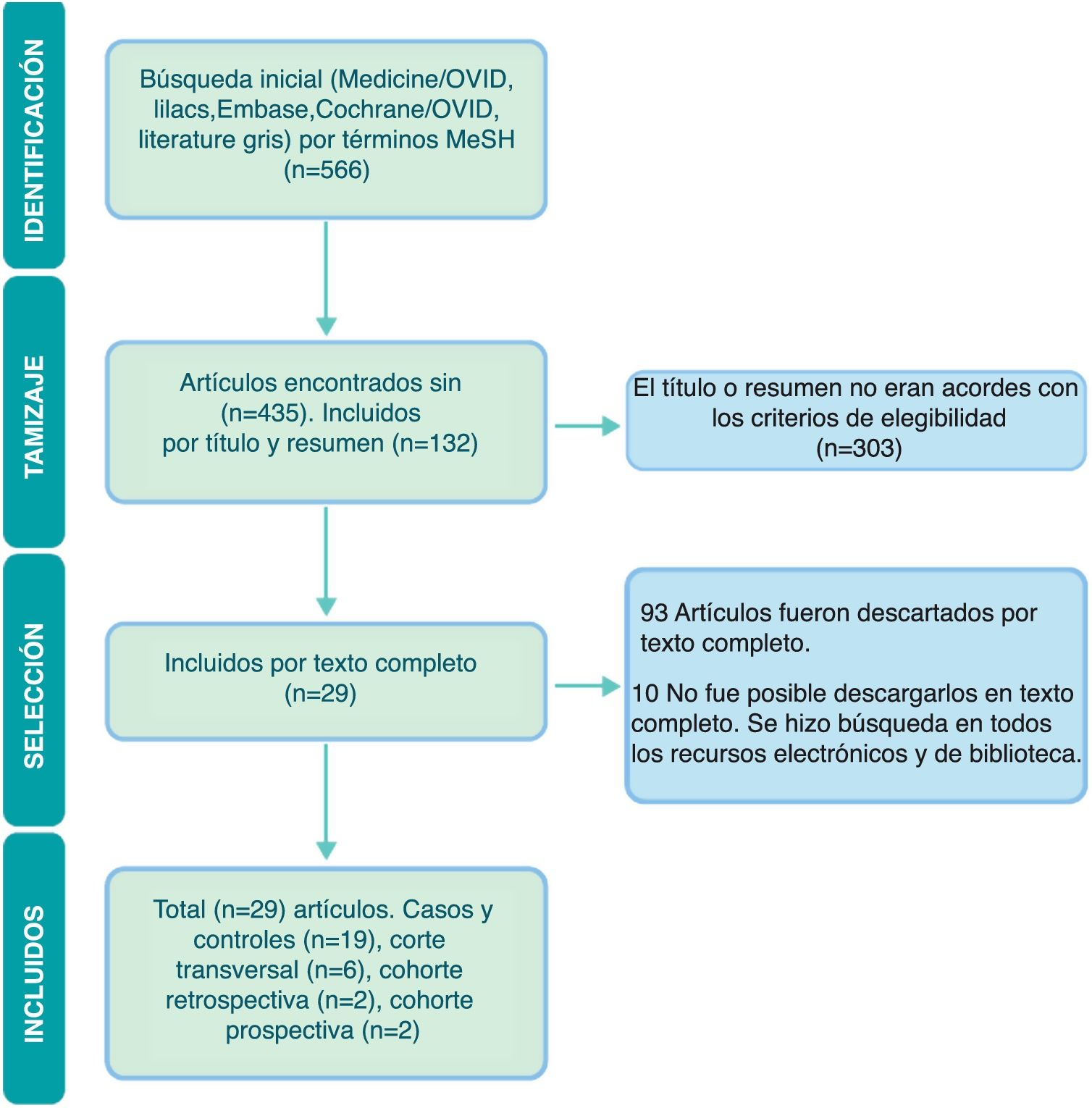
ResultadosUna vez se realizó la búsqueda en bases electrónicas y de la literatura gris, se identificaron un total de 566 artículos. Dos revisores evaluaron los títulos y los resúmenes, tras lo cual se escogieron 130 artículos sin duplicados, y en la segunda revisión realizada por texto completo se seleccionaron 31 artículos, excluyendo 2 resúmenes de los cuales no fue posible obtener la técnica. En la figura 1 se muestra el flujograma PRISMA, que resume los hallazgos de la búsqueda y la selección de los estudios.
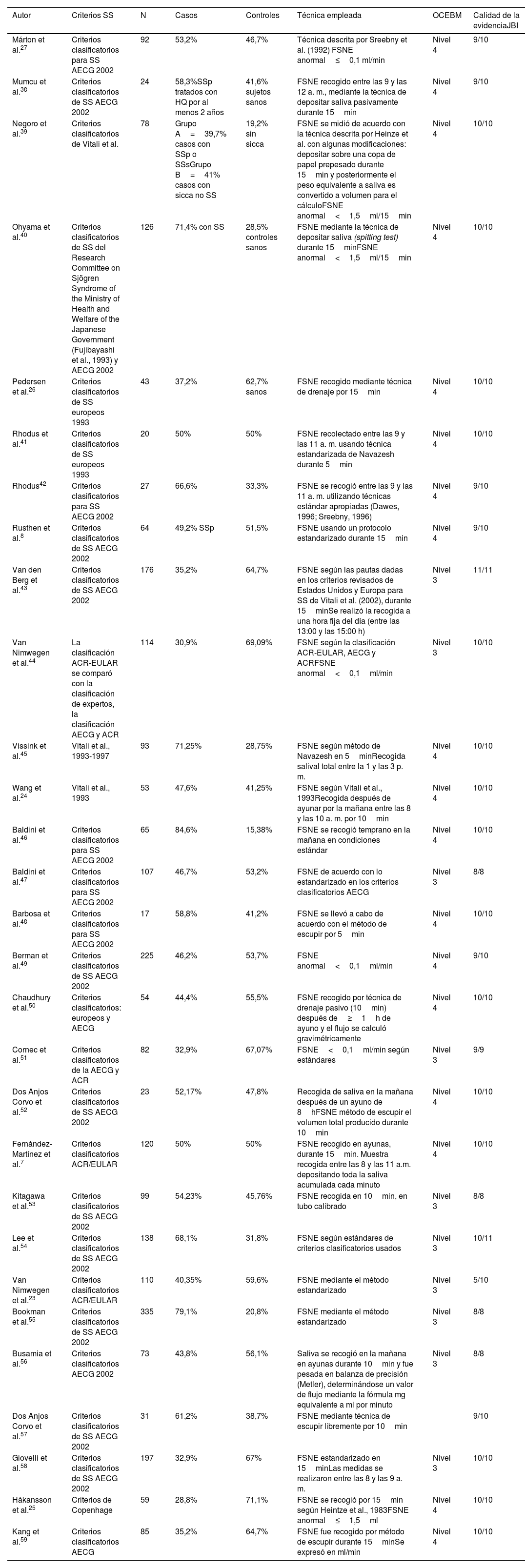
De los 29 artículos finalmente incluidos, se encontraron 19 estudios de casos y controles, 6 estudios de corte transversal, 2 estudios de cohorte retrospectiva y 2 de cohorte prospectiva. En la tabla 1 se muestran las características de los estudios incluidos. El nivel de la evidencia encontrada en la mayoría de los artículos fue 3 o 4 a través de las guías Oxford Centre for Evidence-Based Medicine 2011 Levels of Evidence Question. Todos los estudios tuvieron un riesgo de sesgo bajo, con un porcentaje mayor del 70% de acuerdo con las guías del Joanna Briggs Institute, exceptuando el estudio de Van Nimwegen et al.23, ya que de este, al ser un resumen presentado en un congreso internacional, no fue posible extraer todos los datos.
Características de los estudios incluidos
| Autor | Criterios SS | N | Casos | Controles | Técnica empleada | OCEBM | Calidad de la evidenciaJBI |
|---|---|---|---|---|---|---|---|
| Márton et al.27 | Criterios clasificatorios para SS AECG 2002 | 92 | 53,2% | 46,7% | Técnica descrita por Sreebny et al. (1992) FSNE anormal≤0,1 ml/min | Nivel 4 | 9/10 |
| Mumcu et al.38 | Criterios clasificatorios de SS AECG 2002 | 24 | 58,3%SSp tratados con HQ por al menos 2 años | 41,6% sujetos sanos | FSNE recogido entre las 9 y las 12 a. m., mediante la técnica de depositar saliva pasivamente durante 15min | Nivel 4 | 9/10 |
| Negoro et al.39 | Criterios clasificatorios de Vitali et al. | 78 | Grupo A=39,7% casos con SSp o SSsGrupo B=41% casos con sicca no SS | 19,2% sin sicca | FSNE se midió de acuerdo con la técnica descrita por Heinze et al. con algunas modificaciones: depositar sobre una copa de papel prepesado durante 15min y posteriormente el peso equivalente a saliva es convertido a volumen para el cálculoFSNE anormal<1,5ml/15min | Nivel 4 | 10/10 |
| Ohyama et al.40 | Criterios clasificatorios de SS del Research Committee on Sjögren Syndrome of the Ministry of Health and Welfare of the Japanese Government (Fujibayashi et al., 1993) y AECG 2002 | 126 | 71,4% con SS | 28,5% controles sanos | FSNE mediante la técnica de depositar saliva (spitting test) durante 15minFSNE anormal<1,5ml/15min | Nivel 4 | 10/10 |
| Pedersen et al.26 | Criterios clasificatorios de SS europeos 1993 | 43 | 37,2% | 62,7% sanos | FSNE recogido mediante técnica de drenaje por 15min | Nivel 4 | 10/10 |
| Rhodus et al.41 | Criterios clasificatorios de SS europeos 1993 | 20 | 50% | 50% | FSNE recolectado entre las 9 y las 11 a. m. usando técnica estandarizada de Navazesh durante 5min | Nivel 4 | 10/10 |
| Rhodus42 | Criterios clasificatorios para SS AECG 2002 | 27 | 66,6% | 33,3% | FSNE se recogió entre las 9 y las 11 a. m. utilizando técnicas estándar apropiadas (Dawes, 1996; Sreebny, 1996) | Nivel 4 | 9/10 |
| Rusthen et al.8 | Criterios clasificatorios de SS AECG 2002 | 64 | 49,2% SSp | 51,5% | FSNE usando un protocolo estandarizado durante 15min | Nivel 4 | 9/10 |
| Van den Berg et al.43 | Criterios clasificatorios de SS AECG 2002 | 176 | 35,2% | 64,7% | FSNE según las pautas dadas en los criterios revisados de Estados Unidos y Europa para SS de Vitali et al. (2002), durante 15minSe realizó la recogida a una hora fija del día (entre las 13:00 y las 15:00 h) | Nivel 3 | 11/11 |
| Van Nimwegen et al.44 | La clasificación ACR-EULAR se comparó con la clasificación de expertos, la clasificación AECG y ACR | 114 | 30,9% | 69,09% | FSNE según la clasificación ACR-EULAR, AECG y ACRFSNE anormal<0,1ml/min | Nivel 3 | 10/10 |
| Vissink et al.45 | Vitali et al., 1993-1997 | 93 | 71,25% | 28,75% | FSNE según método de Navazesh en 5minRecogida salival total entre la 1 y las 3 p. m. | Nivel 4 | 10/10 |
| Wang et al.24 | Vitali et al., 1993 | 53 | 47,6% | 41,25% | FSNE según Vitali et al., 1993Recogida después de ayunar por la mañana entre las 8 y las 10 a. m. por 10min | Nivel 4 | 10/10 |
| Baldini et al.46 | Criterios clasificatorios para SS AECG 2002 | 65 | 84,6% | 15,38% | FSNE se recogió temprano en la mañana en condiciones estándar | Nivel 4 | 10/10 |
| Baldini et al.47 | Criterios clasificatorios para SS AECG 2002 | 107 | 46,7% | 53,2% | FSNE de acuerdo con lo estandarizado en los criterios clasificatorios AECG | Nivel 3 | 8/8 |
| Barbosa et al.48 | Criterios clasificatorios para SS AECG 2002 | 17 | 58,8% | 41,2% | FSNE se llevó a cabo de acuerdo con el método de escupir por 5min | Nivel 4 | 10/10 |
| Berman et al.49 | Criterios clasificatorios de SS AECG 2002 | 225 | 46,2% | 53,7% | FSNE anormal<0,1ml/min | Nivel 4 | 9/10 |
| Chaudhury et al.50 | Criterios clasificatorios: europeos y AECG | 54 | 44,4% | 55,5% | FSNE recogido por técnica de drenaje pasivo (10min) después de≥1h de ayuno y el flujo se calculó gravimétricamente | Nivel 4 | 10/10 |
| Cornec et al.51 | Criterios clasificatorios de la AECG y ACR | 82 | 32,9% | 67,07% | FSNE<0,1ml/min según estándares | Nivel 3 | 9/9 |
| Dos Anjos Corvo et al.52 | Criterios clasificatorios de SS AECG 2002 | 23 | 52,17% | 47,8% | Recogida de saliva en la mañana después de un ayuno de 8hFSNE método de escupir el volumen total producido durante 10min | Nivel 4 | 10/10 |
| Fernández-Martínez et al.7 | Criterios clasificatorios ACR/EULAR | 120 | 50% | 50% | FSNE recogido en ayunas, durante 15min. Muestra recogida entre las 8 y las 11 a.m. depositando toda la saliva acumulada cada minuto | Nivel 4 | 10/10 |
| Kitagawa et al.53 | Criterios clasificatorios de SS AECG 2002 | 99 | 54,23% | 45,76% | FSNE recogida en 10min, en tubo calibrado | Nivel 3 | 8/8 |
| Lee et al.54 | Criterios clasificatorios de SS AECG 2002 | 138 | 68,1% | 31,8% | FSNE según estándares de criterios clasificatorios usados | Nivel 3 | 10/11 |
| Van Nimwegen et al.23 | Criterios clasificatorios ACR/EULAR | 110 | 40,35% | 59,6% | FSNE mediante el método estandarizado | Nivel 3 | 5/10 |
| Bookman et al.55 | Criterios clasificatorios de SS AECG 2002 | 335 | 79,1% | 20,8% | FSNE mediante el método estandarizado | Nivel 3 | 8/8 |
| Busamia et al.56 | Criterios clasificatorios AECG 2002 | 73 | 43,8% | 56,1% | Saliva se recogió en la mañana en ayunas durante 10min y fue pesada en balanza de precisión (Metler), determinándose un valor de flujo mediante la fórmula mg equivalente a ml por minuto | Nivel 3 | 8/8 |
| Dos Anjos Corvo et al.57 | Criterios clasificatorios de SS AECG 2002 | 31 | 61,2% | 38,7% | FSNE mediante técnica de escupir libremente por 10min | 9/10 | |
| Giovelli et al.58 | Criterios clasificatorios de SS AECG 2002 | 197 | 32,9% | 67% | FSNE estandarizado en 15minLas medidas se realizaron entre las 8 y las 9 a. m. | Nivel 3 | 10/10 |
| Håkansson et al.25 | Criterios de Copenhage | 59 | 28,8% | 71,1% | FSNE se recogió por 15min según Heintze et al., 1983FSNE anormal≤1,5ml | Nivel 4 | 10/10 |
| Kang et al.59 | Criterios clasificatorios AECG | 85 | 35,2% | 64,7% | FSNE fue recogido por método de escupir durante 15minSe expresó en ml/min | Nivel 4 | 10/10 |
ACR: American College of Rheumatology; ACR-EULAR: American College of Rheumatology/European League Against Rheumatism; AECG: American-European Consensus Group; FSNE: flujo salival no estimulado; HQ: hidroxicloroquina; JBI: Joanna Briggs Institute; OCEM: Oxford Centre for Evidence-Based Medicine 2011 Levels of Evidence Question; SS: síndrome de Sjögren; SSp: síndrome de Sjögren primario; SSs: síndrome de Sjögren secundario.
La población total corresponde aproximadamente a 2.730 pacientes, de los cuales 1.397 son casos, el 27,6% con Sjögren no especificado, el 64,9% con SS primario y el 7,4% con poliautoinmunidad; el 99,5% de los casos eran de sexo femenino. Con respecto al número de controles, fue de 1.333, de los cuales el 29,03% eran sujetos sanos y el 70,96% tenían síndrome seco no Sjögren; el 81,90% correspondía al sexo femenino. El rango de edad de los casos era de 39-63 años24,25 y el de los controles, de 24-69 años de edad25,26.
Las principales técnicas utilizadas se encuentran descritas en la tabla 1 y se agrupan en la tabla 2. En la mayoría de los estudios se describió la hora de la recogida, la medida en mililitros/minuto para determinar el punto de corte en que la prueba se encontraba alterada y el autor en el que se guiaron para realizar la recogida. En este sentido, la mayoría de los estudios utilizan la técnica de Navazesh o aquella validada en los diferentes sets de criterios clasificatorios para SS, los cuales en su mayor parte involucran la técnica de este autor10.
Principales técnicas utilizadas de acuerdo con la revisión sistemática de la literatura
| Número de artículos | Técnica que utilizan |
|---|---|
| 10 | Realizan descripción detallada de toda la técnica (8 siguen los pasos de Navazesh sin hacer mención de los autores) |
| 5 | Informan que utilizaron una técnica estandarizada |
| 6 | Relacionan una técnica descrita previamente por un autor específico (Navazesh, Sreebny, Heinze, Dawes y Priya) |
| 5 | Describen que la técnica utilizada fue la indicada, de acuerdo con los criterios clasificatorios para SS con las que incluyeron a los pacientes (en su mayoría estos criterios clasificatorios utilizan la técnica de Navazesh) |
| 2 | Brindan tiempo y punto de corte en ml/min que clasificó a los pacientes como alterado, sin especificar mayores detalles |
| 1 | Aclaran que no utilizaron una técnica estandarizada |
En el presente estudio se evalúan por primera vez, según nuestro conocimiento, a través de una revisión sistemática de la literatura, las diferentes técnicas utilizadas para la medición del FSNE para diferenciar pacientes con SS de aquellos con xerostomía no asociada a SS y de controles sanos (1.397 SS y 1.333 controles), encontrando diversas técnicas empleadas.
La evaluación objetiva de la producción de saliva a través del FSNE es de crucial importancia, dado que la xerostomía no siempre está asociada a un flujo salival bajo y su ausencia no indica necesariamente una secreción salival adecuada27. La boca seca es un síntoma común y se estima que su incidencia es de aproximadamente el 26 y el 33% en hombres y mujeres, respectivamente, incrementándose con la edad y las entidades comórbidas asociadas28.
Para la evaluación de la función glandular, se describen diferentes métodos invasivos y no invasivos. En el primer caso, el más frecuente es el FSNE o sialometría, esencial para el diagnóstico de hipofunción glandular. Dentro de los criterios clasificatorios para SS (ACR/EULAR) más recientes, se incluye el FSNE, con un puntaje de 1 si se tiene un punto de corte≤0,1ml/min; este se debe realizar en ausencia de uso de medicamentos anticolinérgicos, con un intervalo de tiempo suficiente para tener una medida objetiva6. Existen técnicas invasivas con cánula a glándulas selectivas o con estímulos (parafina, algodón, goma de mascar, ácido cítrico, etc.), que constituyen el flujo salival estimulado, el cual no ha sido objeto de la presente revisión.
La técnica de recolección de FSNE avalada en los diferentes consensos es la de Navazesh y Kumar10, y se debe tener en cuenta que su valor se puede ver influido por factores como los alimentos, los medicamentos, el tabaco, el ciclo circadiano, etc.29. Es llamativo, sin embargo, que al evaluar los recientes criterios de clasificación del SS propuestos por el ACR/EULAR del año 2016, vemos que se sustentan en la metodología descrita por Navazesh et al., quienes evalúan dicha medida en 5min, mas no en 1min, ni en 15min, como se describe en los criterios previos para SS del American-European Consensus Group del año 200211, que han incluido el FSNE, por lo cual, a efectos de ser aplicados con el objetivo de clasificar pacientes con SS, el clínico que los utilice debe convertir la medida de los 5min a 1min. A través de la presente revisión sistemática de la literatura se encontró que esta es una de las técnicas más utilizadas, bien sea porque los autores la detallaban directamente, bien porque hacían referencia a los autores o a los consensos que han utilizado la misma. En la tabla 3 se describen los diferentes pasos para realizar la medición.
Descripción de la técnica estandarizada para la toma de FSNE según Navazesh
| Se recomienda al paciente que se abstenga de ingerir cualquier alimento o bebida (excepto agua) una hora antes de la sesión de prueba. Fumar, mascar chicle y tomar café también está prohibidos durante dicha hora |
| Se indica al paciente que se enjuague la boca varias veces con agua destilada y luego que se relaje durante 5min |
| Se obtendrán medidas de flujo salival en reposo. Esto significa que antes y durante la recogida el paciente debe hacer todo lo posible para minimizar el movimiento, especialmente los movimientos de la boca |
| Para comenzar la recogida debe pedírsele al paciente que trague el remanente de saliva que tiene en su boca |
| Luego debe inclinar la cabeza hacia adelante sobre el tubo de recogida y el embudo, manteniendo la boca ligeramente abierta, permitiendo que la saliva drene dentro del tubo sin volver a tragar la misma durante toda la prueba |
| Debe mantener sus ojos abiertos durante la prueba |
| Al final de la recogida se le preguntará al paciente si tiene algún remanente de saliva en su boca y se le pedirá que la deposite en el tubo de ensayo. Este movimiento lo debe hacer rápido |
Para el examen, debe recogerse la saliva durante 1min de prueba para práctica y desecharla, ya sea en un vaso de plástico o papel. El ensayo real debe durar 5min y la muestra debe guardarse para un análisis más detallado si se indica10,13.
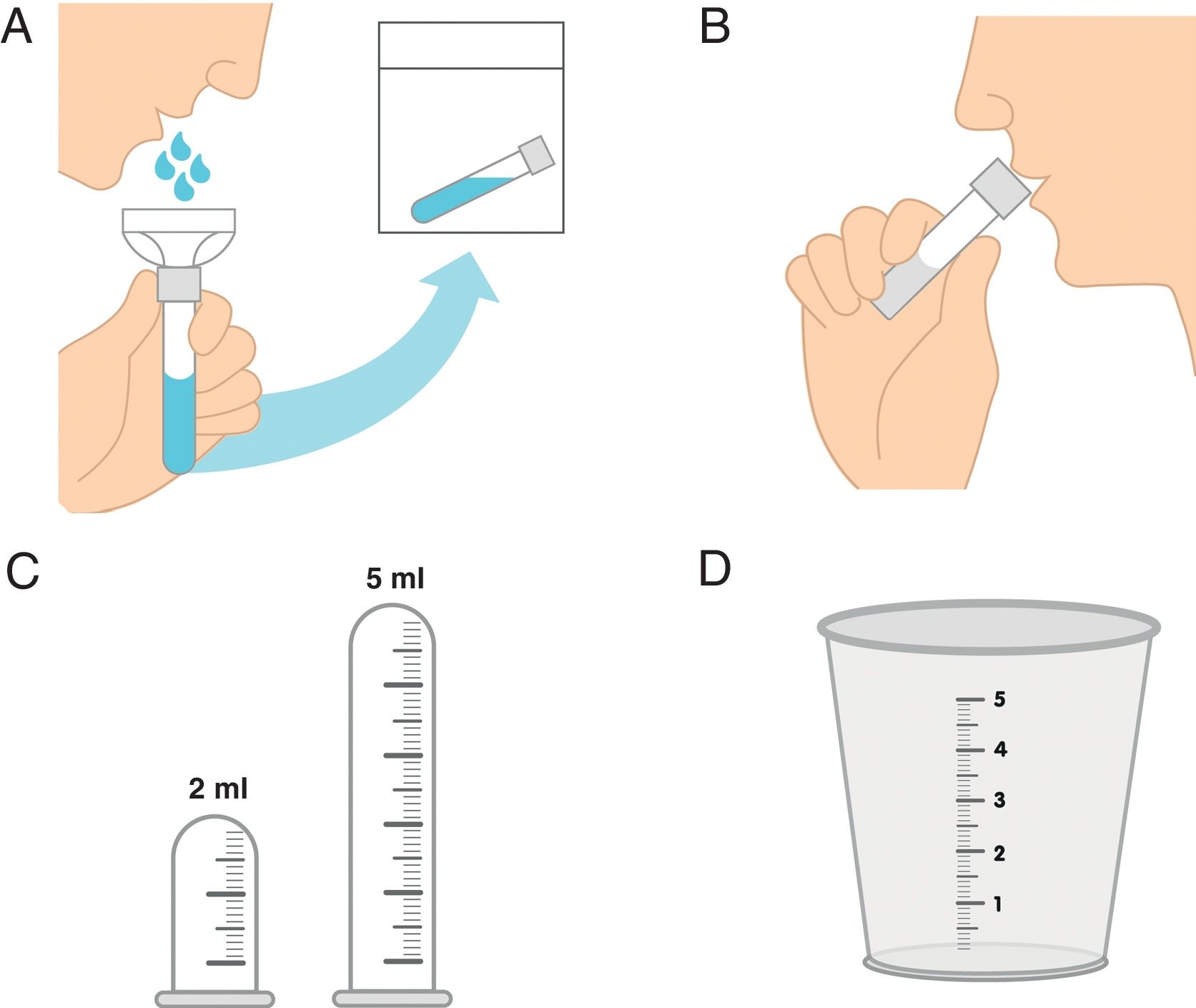
De acuerdo con los resultados de la presente revisión sistemática de la literatura, se describen principalmente 2 técnicas de recogida de saliva: la de drenaje, que es la descrita en la tabla 3, por medio de la cual el paciente permite la salida espontánea de la saliva desde el labio inferior hacia un embudo que comunica con el dispositivo de recogida (vaso o tubo); y la de escupir, en la cual el paciente va acumulando la saliva en el piso de la boca y posteriormente la va escupiendo cada 60s en el tubo colector directamente13. Esta última técnica se recomienda cuando la producción salival es muy baja y se desea minimizar la evaporación de la saliva. En la figura 2 se representa la forma de recogida a través de estas 2 técnicas. Ambos métodos se consideran reproducibles y confiables.
Técnicas de recolección de saliva para la medición de FSNE. A. Técnica de drenaje utilizando embudo que permite el escurrimiento pasivo de la saliva a través del mismo para llegar al dispositivo de recogida. B. Técnica de escupir la saliva recogida en el piso de la boca cada 60s utilizando directamente el dispositivo de recogida. C. Dispositivos de recogida tipo tubo vial o tubo plástico transparente de ensayo (microcentrífuga) graduados, ideal de 2 a 5ml. D. Dispositivo de recogida tipo vaso plástico graduado de precipitado. Algunos autores indican que se podría utilizar el vaso o dispositivo de recogida directamente sin el embudo en la técnica de drenaje pasivo (técnica A).
Existen equipos o kits comerciales para la toma de sialometría, o se pueden utilizar del mismo modo dispositivos graduados para la recogida, como los denominados tubos graduados plásticos (o de microcentrífuga) y vasos plásticos graduados de precipitado, idealmente de boca ancha en el caso de realizar la técnica de escupir, en la cual no se emplea el embudo. Sreebny et al. describen una de las técnicas que fue inicialmente validada para la medición del FSNE y que sigue vigente en la última década, recomendando no utilizar dispositivos de recogida costosos, sino un recipiente plástico que permita medirla30–34. En la tabla 4 se describen las principales indicaciones para la recolección del FSNE que han mencionado otros autores diferentes a Navazesh, entre ellos, Sreebny, Dawes, y Priya y Prathibha35,36.
Principales indicaciones para la realización del FSNE encontradas a través de la revisión sistemática de la literatura
| Hora de la toma | La mayoría de los estudios indican que el mejor momento es realizar la prueba antes de las 11 a. m. Otros estudios recomiendan la toma entre la 1 y las 3 p. m. |
| Tipo de depósito de la saliva | Drenaje pasivo o escupiendo cada cierto intervalo durante el tiempo de toma |
| Dispositivo utilizado | Utilizando embudo (técnica de drenaje) o no utilizándolo (técnica de escupir). Se deposita la saliva en el dispositivo de recogida calibrado: vial o tubo plástico transparente de ensayo (microcentrífuga) o vaso plástico transparente graduadoAlgunos autores indican que se podría utilizar el vaso o dispositivo de recogida directamente sin el embudo en la técnica de drenaje pasivo |
| Duración de la prueba | 5, 10 y hasta 15min |
| Indicaciones previas a la toma | En la mayoría de las técnicas se indica evitar ingerir alimentos, uso de goma de mascar, tabaco, café o alcohol. Algunos también refieren evitar el uso de elementos de higiene oral una hora antesRealizar enjuagues con agua para remover restos de comida antes de la pruebaRetirar prótesis dentales removibles antes de la prueba y evitar procedimientos dentales o de la cavidad oral 24h antes de la prueba |
| Indicaciones especiales durante la prueba | No depositar secreciones de expectoración o nasales durante la prueba, evitando así contaminar la saliva con dichas secrecionesMantener silencio durante el período de la prueba |
| Punto de corte | Un resultado menor de 0,1ml por minuto es considerado como positivo. Esto es el equivalente a 1,5ml en 15min |
| Formas de medición | En la mayoría se mide a través del volumen directamente en el dispositivo (vaso o tubo) de recogida graduadoEn otros se realiza gravimétricamente con dispositivos de recogida prepesados y realizando la conversión posterior de miligramos a mililitros |
Algunos estudios que han comparado los resultados del FSNE evaluado durante 15min en diferentes horas de toma en la mañana recomiendan que para controlar las variaciones en el tiempo de toma de la prueba, se debería realizar siempre en un mismo momento de la mañana, pues si se toma horas más tarde, hacia el mediodía, el resultado puede variar, incrementándose dependiendo del ritmo circadiano29. La variedad en la forma de recoger el FSNE, así como en el tiempo de su toma, se ha descrito igualmente en otras revisiones sistemáticas que abordan otras enfermedades que pueden producir sequedad, como la diabetes mellitus37. Lo anterior pone de manifiesto la importancia de que se realice la toma adecuada de FSNE en pacientes con síntomas secos por los diferentes especialistas involucrados en el manejo y el abordaje diagnóstico de salud oral en el SS, lo cual no solo contribuirá a la clasificación de los pacientes, sino que muy seguramente podrá servir como herramienta de seguimiento clínico.
Existen otros factores adicionales a la hora y la forma de la toma del FSNE que pueden afectar su medición13,14, entre los que se encuentran el grado de hidratación del paciente, su edad, la exposición a la luz, el estímulo olfatorio, el estado de reposo e incluso la estación del año (en países en donde estas se dan), por lo cual, la toma de la forma más sistematizada posible, de acuerdo con las indicaciones estandarizadas, es ideal para minimizar el error.
En nuestra revisión encontramos diferentes debilidades, como el diseño de los estudios, que en su mayoría fueron de corte transversal y casos y controles, de tal modo que el nivel de la evidencia a través de las Oxford Centre for Evidence-Based Medicine 2011 Levels of Evidence Question fue 3 y 4. Esta búsqueda sistemática no se ha registrado en un repositorio de protocolos. Teniendo en cuenta lo anterior, se requieren más investigaciones con tamaños muestrales mayores, que involucren poblaciones de controles más definidas, con una mayor homogeneidad en sus comorbilidades.
Con el presente estudio se pretende sensibilizar a los diferentes especialistas encargados de la salud oral y el abordaje de SS sobre la importancia del uso del FSNE, el cual tiene el mismo peso dentro de los criterios de clasificación actuales para el SS como el test de Schirmer o el test de puntaje de tinción ocular, como propuesta de su uso cotidiano por parte de reumatólogos, especialistas de salud oral, otorrinolaringólogos, etc., tal como se hace de manera más frecuente para el componente ocular en el contexto del diagnóstico de SS.
Los resultados de este trabajo permiten impulsar el estudio de la fisiología salival en síndrome seco por SS y por otras causas, así como favorecer la valoración objetiva de las técnicas para la medición del FSNE tanto en SS como en otras causas de xerostomía diferentes al SS, en estudios venideros. También, motivar su uso para emplearlo en la detección temprana de la hipofunción glandular salival, resaltando su probable bajo costo, validez y reproducibilidad, comprendiendo la importancia de la saliva en el mantenimiento de la salud oral, e implementar medidas y un seguimiento estricto de salud oral para evitar las complicaciones por esta disfunción.
AutoríaMaría Alejandra Martínez-Ceballos y Natalia Aguilera contribuyeron del mismo modo.
FinanciaciónEste trabajo no recibió financiación alguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Daniel Salazar, médico interno, por su colaboración en la fase inicial en la búsqueda bibliográfica.