INTRODUCCIÓN
El paludismo o malaria es una enfermedad producida por parásitos intracelulares del género Plasmodium. Supone un problema epidemiológico y social extraordinariamente serio si se considera que esta enfermedad es la que con mayor frecuencia afecta al hombre. Se calcula que anualmente enferman 500 millones de personas, de las cuales mueren alrededor de 8 millones1.
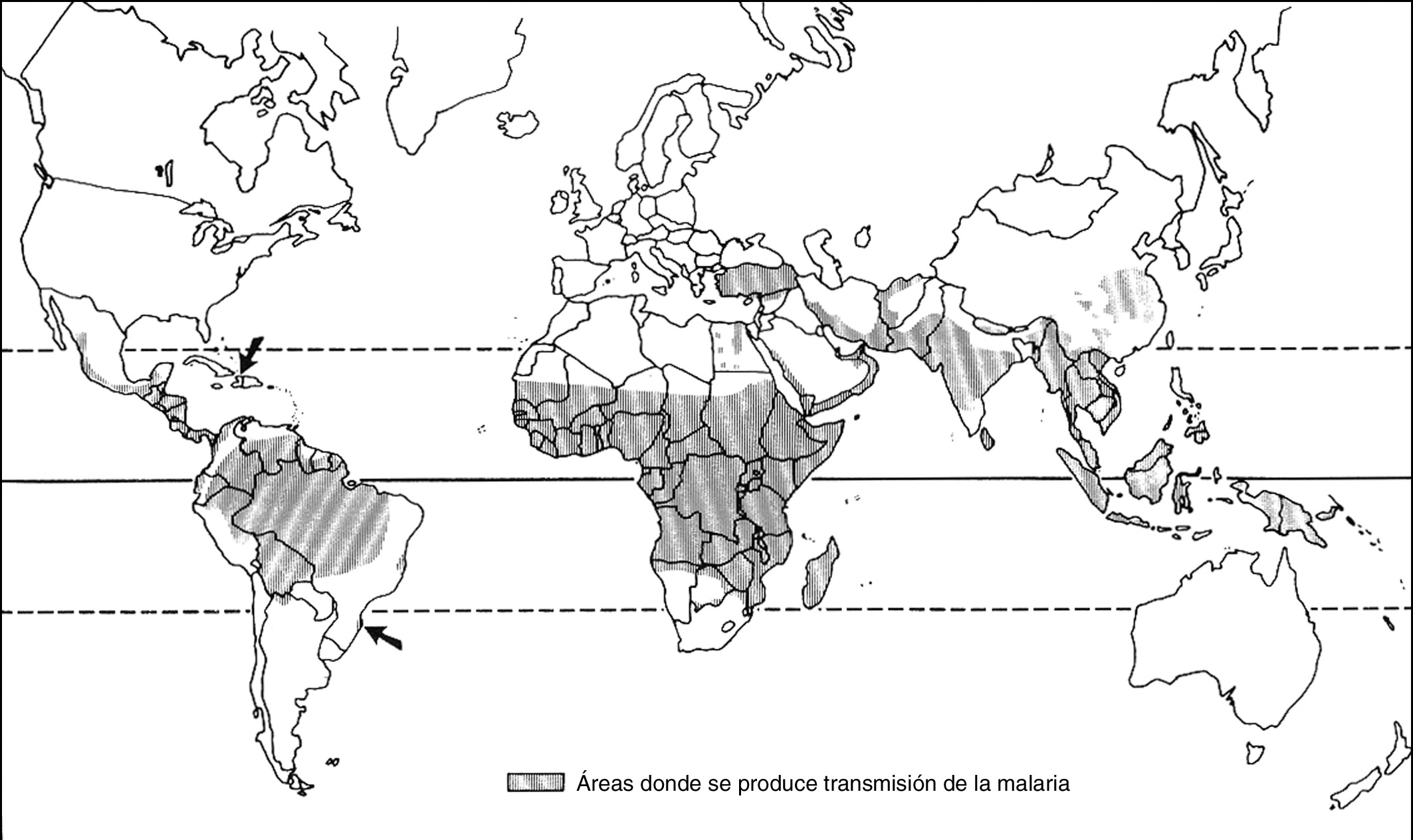
El paludismo es una enfermedad prevalente en la mayor parte de las regiones tropicales del mundo, especialmente en África, aunque también existe una alta incidencia en Asia, Oceanía, Oriente Medio y Turquía. En España se declaran aproximadamente unos 200 casos anuales. Se está convirtiendo en una enfermedad emergente en el mundo occidental debido al aumento de la inmigración y al creciente interés por viajar a áreas donde el paludismo es endémico. En zonas no endémicas de malaria debe sospecharse en todo paciente febril con el antecedente de haber viajado a países en los que se transmite la infección2,3 (fig. 1).
Figura 1. Países en los que se transmite la malaria.
MALARIA Y GESTACIÓN: UN PROBLEMA EMERGENTE EN EL MUNDO OCCIDENTAL
La infección por malaria durante el embarazo es un importante problema de salud pública en las regiones tropicales y subtropicales del mundo. La inmunodepresión secundaria al embarazo hace a la gestante más susceptible de presentar la enfermedad, con consecuencias tanto para ella como para el producto de la gestación. En la mayoría de las áreas endémicas de África, las mujeres embarazadas son el principal grupo de riesgo entre los adultos para contraer la infección. Cada año, al menos 30 millones de mujeres en áreas endémicas de África para la malaria quedan embarazadas3.
Sin embargo, no podemos pensar que es un problema que no atañe al mundo occidental. La creciente inmigración procedente de muchos de estos países hace que cada vez sean más las mujeres que llegan a nuestro entorno en estado de gestación, y con ellas, un nuevo e importante problema médico, epidemiológico y social al que hasta el momento actual no habíamos tenido que enfrentarnos: el binomio malaria y gestación.
Los últimos datos de la Maternidad del Hospital La Paz (año 2002), en Madrid, recogen que entre un 20 y un 25% de los partos anuales son de mujeres inmigrantes, de las cuales, aproximadamente el 15% procede de zonas donde la malaria es endémica.
ETIOLOGÍA Y EPIDEMIOLOGÍA
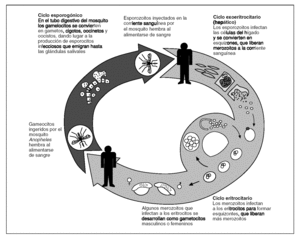
La infección en el ser humano se inicia cuando la hembra del mosquito Anopheles inocula esporozoitos del parásito que permanecen en sus glándulas salivales. Los esporozoitos son transportados por el torrente sanguíneo hasta el hígado del huésped, donde invaden las células del parénquima hepático e inician la fase asexuada del ciclo. Como resultado de esta fase un único esporozoito produce miles de merozoitos, que se liberan al torrente circulatorio al estallar la célula parenquimatosa hepática. En ese momento se inicia la fase sintomática de la infección. En las infecciones por Plasmodium vivax y P. ovale, una parte de las formas intrahepáticas no se divide de manera inmediata, sino que permanece en fase quiescente durante meses o años antes de iniciar su reproducción (hipnozoitos), y es la causa de las recidivas que caracterizan a la infección producida por estas 2 especies.
En el torrente sanguíneo, los merozoitos invaden los glóbulos rojos y se convierten en trofozoitos. Éstos forman esquizontes que dan lugar a más merozoitos. Durante este proceso, algunos merozoitos se convierten en formas sexuales (gametocitos) todavía dentro de los glóbulos rojos. Cuando una hembra del mosquito Anopheles ingiere los gametocitos al alimentarse de sangre, en el tubo digestivo del mosquito se forma un cigoto por la unión de un gametocito hembra y uno macho. El desarrollo del cigoto produce miles de esporozoitos que migran hasta la glándula salival del mosquito, y así se cierra el ciclo del parásito4 (fig. 2).
Figura 2.Ciclo parasitario de la malaria.
La malaria gestacional se ha definido como la presencia de Plasmodium en sangre periférica materna o el hallazgo del parásito en la placenta5.
Las especies del género Plasmodium que afectan al hombre son 4: falciparum, vivax, ovale y malarie. En zonas de alta endemia de malaria, P. falciparum causa hasta el 80% de los casos de malaria gestacional; en zonas donde P. vivax es prevalente, hasta el 40% de los casos de malaria gestacional son producidos por P. falciparum. Por lo tanto, puede afirmarse que la infección malárica en la gestante está producida principalmente por P. falciparum.
El estado de embarazo, con su inmunodepresión secundaria y la presencia en la placenta de receptores como el condroitinsulfato A6 para ligandos de adhesión del parásito, hace a la gestante más susceptible de presentar la enfermedad. Esta susceptibilidad se mantiene hasta unos 60 días después del parto, tiempo que tarda en revertirse la inmunodepresión producida por el embarazo.
La endemicidad y estabilidad de la transmisión de la malaria en la zona donde reside la gestante, así como la paridad, influyen tanto en la incidencia de la malaria como en el espectro clínico y complicaciones de la enfermedad durante el embarazo1,5.
El riesgo de contraer la malaria durante el embarazo es menor en zonas de alta endemia con transmisión estable que en zonas de endemia baja con transmisión inestable.
En zonas de baja endemia o transmisión inestable, las mujeres adultas no han adquirido un grado significativo de inmunidad y con frecuencia enferman cuando se infectan con P. falciparum. En estas áreas, el riesgo de desarrollar una malaria severa para la mujer embarazada es 2-3 veces más alto que para la mujer no embarazada que vive en la misma área. En madres hay mayor tasa de malaria sintomática, anemia, malaria grave, hipoglucemia y muerte materna. Sobre el producto de la gestación se observa más abortos, bajo peso al nacer, muerte fetal e infección congénita.
En las zonas de moderada y alta endemia y transmisión estable (hiperendémicas y holoendémicas), la mayoría de las mujeres adultas han desarrollado la suficiente inmunidad para que la infección por P. falciparum no produzca síntomas clínicos o complicaciones severas. En estas áreas, el principal impacto de la malaria es el desarrollo de anemia en la gestante y la presencia de parásitos en la placenta. Ambas alteraciones podrían afectar al transporte de oxígeno y nutrientes al feto, y contribuir a la restricción del crecimiento intrauterino y al bajo peso al nacimiento. Sin embargo, la enfermedad grave en la madre, la muerte materna, los abortos, los mortinatos y las infecciones congénitas no son complicaciones frecuentes de la infección malárica en estas zonas7.
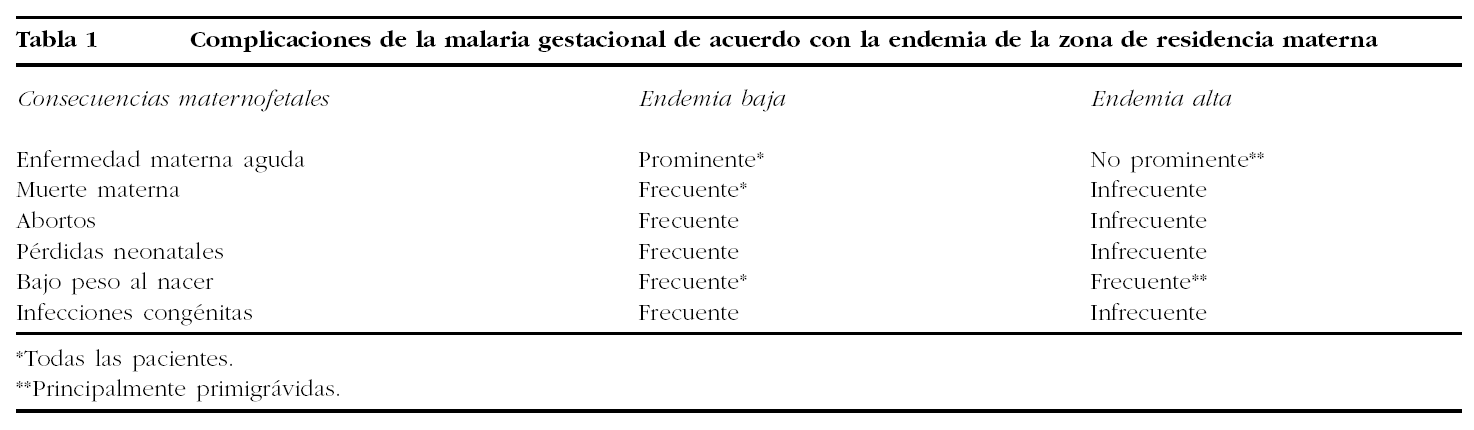
Por tanto, mientras que en las zonas de baja endemia la infección malárica está asociada a una alta morbimortalidad, tanto materna como para el producto de la gestación, en zonas hiperendémicas y holoendémicas, la continua exposición al parásito confiere un cierto grado de inmunidad que hace que la enfermedad severa en la gestante no sea frecuente. Sin embargo, la parasitación de la placenta es común, y la malaria durante la gestación se asocia con el desarrollo de anemia severa y bajo peso al nacimiento (tabla 1).
Con respecto a la paridad, diversos estudios parecen demostrar una mayor incidencia de malaria gestacional durante el primer embarazo, hallazgo que es independiente de la endemia de la zona. La paridad se relaciona también con las complicaciones maláricas, la incidencia de infección de la placenta y las complicaciones del producto de la gestación.
COMPLICACIONES DE LA MALARIA DURANTE EL EMBARAZO
El cuadro de malaria durante el embarazo, especialmente el producido por P. falciparum (causa más frecuente de malaria en la gestante) condiciona un elevado riesgo de complicaciones (malaria cerebral, edema de pulmón, hipoglucemia...), preferentemente en el segundo y tercer trimestres de gestación. La mortalidad de las gestantes por este cuadro asciende hasta el 40%.
Diversos factores de riesgo elevan la probabilidad de desarrollar complicaciones por malaria gestacional: mujeres con baja paridad, raza negra5, positivas al virus de la inmunodeficiencia humana (VIH)8,9, mujeres jóvenes, gestantes cuyo embarazo se produce durante época de alta transmisión y el uso de fármacos de poca eficacia antimalárica.
Las principales complicaciones de la malaria en el embarazo son:
Anemia10: es la complicación que causa una mayor mortalidad materna en países subdesarrollados. Esta complicación es más severa en zonas de endemia baja y transmisión inestable y en primigrávidas.
En zonas de alta endemia, la anemia, a veces severa, puede ser el único síntoma de la infección malárica en la gestante11. La parasitemia en sangre periférica puede ser muy baja, a veces indetectable. Por esta razón, cualquier anemia severa en una mujer embarazada de un área endémica de malaria debería recibir un tratamiento antimalárico adecuado, como parte de su manejo clínico, independientemente del resultado del frotis de sangre periférica o de la ausencia de otros síntomas.
La anemia severa (hemoglobina < 7 g/dl) causa una elevada mortalidad por riesgo de fallo cardíaco y shock materno.
La anemia moderada (hemoglobina 7-10 g/dl) se relaciona con una baja capacidad para tolerar las pérdidas sanguíneas durante el parto y mayor riesgo de infecciones secundarias durante el embarazo y puerperio1.
Por otro lado, la anemia asociada a malaria también tiene repercusión fetal, con aumento de la morbimortalidad, y se identifica como causa importante de bajo peso al nacer.
Varios son los mecanismos que causan la anemia asociada a la malaria durante el embarazo: la hemólisis secundaria a la liberación de los merozoitos, la disminución de la deformabilidad de los glóbulos rojos secundaria a cambios oxidativos en la membrana celular que producen su hemólisis, el impacto de la infección en los precursores medulares, produciendo diseritropoyesis y menor activación de los precursores eritroides en la médula, y un aumento adicional del consumo de folatos por el incremento de la eritropoyesis en un intento de compensar la mayor destrucción de glóbulos rojos5.
Hipoglucemia: es una complicación importante de la infección palúdica, y es 7 veces más frecuente en la gestante malárica que en la paciente no embarazada. La mujer embarazada es propensa ya a presentar hipoglucemia por una hiperinsulinemia fisiológica secundaria a un aumento de la función de las células betapancreáticas. Durante la infección por Plasmodium, se añade a esta situación una disminución de la gluconeogénesis hepática, un aumento del consumo de glucosa por el parásito y el huésped, un incremento adicional en la secreción de insulina producido por el parásito por mecanismos aún poco claros y el uso de fármacos como la quinina y la quinidina, potentes estimuladores de la secreción insulínica pancreática5.
La hipoglucemia en la gestante puede ser asintomática, aunque es frecuente que se presente con alteración del nivel de conciencia o alteración del comportamiento, a menudo con otros síntomas inespecíficos como sudación, visión borrosa, sensación de vértigo, taquicardia, taquipnea, hipotensión e incluso convulsiones en los casos de hipoglucemia severa; en estos casos es necesario descartar otras etiologías, como malaria cerebral o eclampsia.
La hipoglucemia en la gestante puede tener graves consecuencias en el producto de la gestación, como bajo peso al nacer, alteraciones en la frecuencia cardíaca fetal (FCF) o muerte fetal1.
La hipoglucemia asociada a paludismo es frecuente que se acompañe de acidosis láctica, debido a la glucólisis anaerobia que se produce en los tejidos en los que los glóbulos rojos infectados y secuestrados interfieren en la microcirculación, junto a una disminución de la eliminación del lactato hepático. El pronóstico de esta complicación es grave12.
Malaria grave: la hiperparasitemia (> 50.000 parásitos/ml de sangre [el valor de parasitemia se expresa como el número de eritrocitos parasitados en 1.000 células, y esta cifra se convierte posteriormente en el número de eritrocitos parasitados por ml]), la malaria cerebral, la anemia severa, la acidosis láctica, la hipoglucemia, la ictericia, el fracaso renal, la hipertermia (temperatura > 40,5 oC), la hiperemesis, la hemoglobinuria, el edema de pulmón, las alteraciones de la coagulación y el colapso circulatorio suponen un pronóstico ominoso en la infección malárica. La presencia de una o más de estas complicaciones definen la malaria grave.
La hiperparasitemia > 2% debería considerarse como enfermedad severa, y requiere tratamiento parenteral. La hiperparasitemia > 10% requiere ingreso en una unidad de cuidados intensivos y debería considerarse la exanguinotransfusión.
La malaria cerebral se manifiesta como una encefalopatía simétrica difusa que causa un estado de coma arreactivo, con una elevada morbimortalidad en la gestante. Cualquier alteración en el nivel de conciencia se debería considerar como un signo de un posible desarrollo de malaria cerebral.
La activación del sistema de coagulación puede causar una coagulación intravascular diseminada.
La parasitemia elevada, la hemólisis y la hemoglobinuria pueden producir una insuficiencia renal aguda por necrosis tubular, con una alta mortalidad en la fase inicial.
Las complicaciones pulmonares caracterizan también a la malaria grave; el síndrome de distrés respiratorio del adulto y la neumonía son las más frecuentes. El edema de pulmón es una seria complicación de la malaria por P. falciparum, debida generalmente a una alteración en la permeabilidad capilar. Puede ocurrir como consecuencia de una sobrehidratación, pero también puede ocurrir sin un balance positivo de líquidos como un síndrome de distrés respiratorio del adulto. Generalmente, la disnea o la taquipnea son los primeros síntomas, y deberían alertar al clínico de un posible edema pulmonar. En estas pacientes, la ventilación mecánica puede ser difícil en las últimas etapas del embarazo debido al ascenso del diafragma por el útero gestante, por lo que podría estar indicada la finalización de la gestación.
La malaria durante el embarazo tiene también repercusión en el producto de la gestación, debido al deterioro sistémico de la gestante y la afectación placentaria1,2,4,5.
Bajo peso al nacer (BPEG): es la complicación más frecuente y los mecanismos patogénicos que pueden explicarlo son diversos: a) la anemia en la gestante, aun cuando el deterioro placentario sea bajo; b) el secuestro placentario de glóbulos rojos infectados, lo que ocasiona disminución del transporte de oxígeno y nutrientes por engrosamiento de la membrana basal del trofoblasto y microinfartos placentarios; c) las alteraciones hemodinámicas en la circulación uteroplacentaria; d) el parto prematuro (la infección de la placenta por Plasmodium produce un aumento local de citocinas13 que estimula la producción de prostaglandinas y, secundariamente, la actividad del músculo liso uterino), y e) posiblemente una asociación con preeclampsia o procesos similares a la preeclampsia5.
El BPEG es una complicación frecuente de la malaria, tanto en zonas hiperendémicas y holoendémicas con transmisión estable, especialmente en primigrávidas, como en zonas hipoendémicas o con transmisión inestable, independientemente de la paridad de la gestante en estas últimas14. Parece estar mediado por la combinación de 2 factores: la restricción en el crecimiento intrauterino y la prematuridad. No está claro hasta qué punto la prematuridad más que la restricción en el crecimiento intrauterino contribuye al BPEG que se observa en la malaria. Esto se debe a la dificultad para obtener datos fiables de la edad gestacional en las mujeres embarazadas de África, donde la ecografía no es un método disponible habitualmente y donde las gestantes suelen demorar con frecuencia los controles médicos, cuando éstos son posibles.
Sólo un estudio ha usado datos obtenidos de un registro de visitas en una cohorte de mujeres africanas, y ha encontrado una asociación significativa entre la infección crónica de la placenta por el parásito y el parto prematuro. También se ha encontrado una gran asociación entre la infección activa por malaria y un notch bilateral en la onda de flujo de la arteria uterina en gestaciones tardías (32-36 semanas), lo que refuerza la hipótesis de que la infección malárica de la placenta causa alteraciones hemodinámicas en la circulación uteroplacentaria15.
Las evidencias que apoyan un posible vínculo entre la malaria y la preeclampsia proceden de una variación estacional en la incidencia de la preeclampsia coincidiendo con la estación de malaria en áreas con alta transmisión estacional. Algunas descripciones recientes sobre malaria y embarazo incluyen referencias a una seudotoxemia, en la que es característica la hipertensión y la proteinuria1.
Abortos y mortinatos: estas complicaciones presentan una incidencia más alta en embarazadas con inmunidad baja, en zonas de baja endemia o con transmisión inestable y en primigrávidas.
La hiperpirexia aumenta la producción de prostaglandinas, y cuando ésta se presenta en etapas tempranas del embarazo es causa de aborto, ya que las prostaglandinas ejercen una acción excitadora en el músculo uterino. La anemia severa disminuye el aporte de oxígeno a través de la placenta, lo que puede contribuir a la mayor incidencia de abortos en las gestantes que presentan esta complicación.
La interferencia en el flujo placentario producida por la afectación de la placenta por el parásito, la hiperpirexia y la anemia severa son causa de muerte fetal anteparto en la infección malárica5.
Malaria congénita: se define como la presencia de infección en el neonato nacido de madre infectada debido al paso del parásito a través de la placenta. Se presenta entre el 0,3 y el 0,6% de los hijos de mujeres con malaria gestacional en zonas de alta endemia, pero asciende hasta el 10% en zonas de baja endemia.
La malaria congénita parece que se produce por el paso del parásito a través de las vellosidades coriónicas durante el embarazo, especialmente durante el tercer trimestre, o el trabajo del parto.
Como hemos dicho anteriormente, la infección placentaria es más frecuente en zonas de alta endemia, donde paradójicamente es menos frecuente la malaria congénita. Se han planteado diversas hipótesis que intentan explicar estos hallazgos: a) la placenta infectada tiene una mayor actividad fagocítica que limitaría la infección exclusivamente al lado materno; b) mayor paso de anticuerpos protectores al feto, y c) la activación del sistema inmunitario fetal por el paso de glóbulos rojos infectados desde la circulación materna.
En los neonatos de madres inmunes (zonas de alta endemia), la prevalencia de parásitos en sangre del cordón puede alcanzar cifras tan altas como el 10%, aunque en estos casos es raro que se desarrolle una enfermedad clínicamente significativa. En la mayoría de los casos, los parásitos son eliminados rápidamente, probablemente por la adquisición de una inmunidad pasiva (paso de anticuerpos protectores) y la activación del sistema inmunitario de estos fetos, como explicarían las hipótesis anteriores. Sin embargo, informes recientes de zonas del este y oeste de África sugieren que la malaria congénita clínica supone un problema creciente, lo que podría estar relacionado con el aumento de la infección por el VIH. Si ello fuese cierto, éste sería un problema que las autoridades sanitarias tendrían que atajar de inmediato5.
Los hijos de madres no inmunes que no han recibido tratamiento o han recibido tratamiento incompleto para la malaria, pueden presentar una infección generalizada con fiebre, irritabilidad, hepatomegalia y esplenomegalia e ictericia. En estos casos, sería prioritario conseguir eliminar el parásito de la sangre antes del parto si fuese posible para prevenir esta grave complicación.
La anemia y el bajo peso son problemas también frecuentes en niños con malaria congénita. Por todo ello, en toda madre en trabajo de parto que presente infección por malaria, inmediatamente producida la expulsión fetal, se debe tomar una gota gruesa al niño y una muestra de sangre del cordón umbilical para verificar la transmisión madre-niño1.
DIAGNÓSTICO
Debido a la naturaleza inespecífica de los síntomas iniciales, la malaria fácilmente puede confundirse con una enfermedad viral u otros procesos patológicos. En la mujer embarazada, un error en el diagnóstico, con retraso en el inicio del tratamiento específico, puede suponer un importante aumento de la morbimortalidad. Para un diagnóstico temprano de la enfermedad, es necesario incluir la malaria en el diagnóstico diferencial de todo paciente febril que proceda de una región endémica para la malaria.
El diagnóstico específico de la enfermedad requiere la demostración del parásito en sangre periférica mediante gota gruesa o frotis. En la gota gruesa los hematíes son lisados y acumulados en capas, con lo que la posibilidad de detectar parásitos es mayor que con el frotis. Esto es, la gota gruesa es más sensible que el frotis, en el que a veces no es posible detectar bajos grados de parasitemia periférica. Sin embargo, la interpretación de la gota gruesa requiere una cierta experiencia debido a que son frecuentes los artefactos.
En ocasiones es posible detectar pigmento palúdico fagocitado en el interior de los monocitos de sangre periférica o en leucocitos polimorfonucleares, dato que puede indicar infección palúdica si el parásito todavía no es detectable.
Otras veces podemos encontrar el parásito en aspirados de médula ósea a pesar de su ausencia en sangre periférica en repetidos tests.
Dada la gravedad de la enfermedad y la importancia de un retraso en el inicio del tratamiento, en casos con alta sospecha clínica puede ser necesario considerar un tratamiento empírico antimalárico, a pesar de la negatividad en la detección del parásito en sangre periférica.
Existen otros métodos diagnósticos, como tests serológicos, detección del antígeno de Plasmodium y la detección del ADN del parásito mediante PCR (reacción en cadena de la polimerasa), pero actualmente no están disponibles en todos los centros4,16.
MANEJO CLÍNICO DE LA GESTANTE EN FASE AGUDA Y TRATAMIENTO QUIMIOTERAPÉUTICO
Como ya se ha dicho, las mujeres embarazadas con malaria tienen mayor riesgo de tener formas más graves de enfermedad que las mujeres no embarazadas. Por este motivo, cualquier mujer con malaria por P. falciparum durante el embarazo debería ser ingresada en un centro hospitalario para recibir el tratamiento adecuado. Una excepción podrían ser las gestantes con inmunidad previa sin signos de enfermedad severa (este grupo quedaría limitado a las gestantes procedentes de áreas endémicas con moderada o alta transmisión de malaria). Sin embargo, incluso en estas pacientes sería deseable su ingreso hospitalario, al menos hasta eliminar el parásito de sangre periférica.
El resto de las pacientes deben ser consideradas de alto riesgo de presentar una enfermedad severa, y deben ser ingresadas y manejadas por un equipo multidisciplinario, con colaboración del internista, microbiólogo, hematólogo y obstetra. Este grupo de pacientes incluye a todas las mujeres no inmunes que han realizado un viaje a una zona endémica de malaria, incluso en los 12 meses previos al embarazo, y cualquier mujer que haya estado previamente inmunizada pero haya vivido fuera de una zona endémica de malaria durante un tiempo significativo. Este último grupo incluye a muchas inmigrantes del África subsahariana que viven en el mundo occidental pero que retornan a África de forma intermitente.
La glucemia se debe monitorizar periódicamente. Tanto la quinina como la quinidina estimulan la secreción de insulina y pueden exacerbar la hipoglucemia. Así, las pacientes tratadas con quinina intravenosa (i.v.) deberían recibir una infusión continua de dextrosa, calculando 1 g/kg de peso. Por otro lado, la quinidina es cardiotóxica y requiere monitorización electrocardiográfica.
Es importante mantener una correcta hidratación por vía pa adecuado, en ocasiones puede ser necesario medir la presión de enclavamiento en la arteria pulmonar.
Se debe monitorizar la diuresis, procurando que sea superior a 30-50 ml/h.
Se debe hacer análisis periódicos para valorar el grado de anemia y las plaquetas. Una anemia severa (hemoglobina < 7% o hematocrito < 20%) requiere la transfusión de concentrado de hematíes. Las hemorragias espontáneas principalmente se deben a trombocitopenia, y más raramente, a una coagulación intravascular diseminada. Se corrigen con transfusión de sangre fresca y 10 mg i.v. de vitamina K administrada muy lentamente. En pacientes con parasitemia > 10% puede estar indicada la exanguinotransfusión para eliminar el parásito de sangre periférica.
En la gestante es de suma importancia el control de la hiperpirexia. Una temperatura superior a 42 oC puede causar lesiones neurológicas permanentes y en la mujer embarazada desencadenar el trabajo del parto y la pérdida del bienestar fetal (PBF). Se administrará acetaminofén 15 mg/kg vía oral (v.o.) o dipirona 1 ampolla intramuscular (i.m.) y se aplicarán medidas físicas para bajar la fiebre.
La malaria cerebral en la gestante tiene una alta mortalidad y requiere medidas de soporte intensivas, así como tratamiento antimalárico por vía i.v. Se puede usar una única dosis de fenobarbital (3,5-5 mg/kg) para la profilaxis de las convulsiones. En estos casos se debe evitar la heparina y la adrenalina.
La enfermedad severa se puede complicar con un colapso circulatorio (presión arterial [PA] ≤ 80/50 mmHg, cianosis, piel fría, colapso de venas periféricas, pulso rápido y débil). Se asocia con frecuencia a sepsis por gramnegativos, edema de pulmón, acidosis metabólica, deshidratación, hemorragias e infección pulmonar o de vías urinarias. Se debe ordenar plasma o sangre fresca, obtener sin demora cultivos de sangre, orina y líquido cefalorraquídeo, restablecer el volumen con soluciones isotónicas, y si persiste la hipotensión, administrar dopamina a dosis de 3-15 μg/kg/min. Además, se debe iniciar antibioterapia empírica con penicilina cristalina 2 millones de unidades cada 4-6 h y gentamicina 1 mg/kg i.m. o i.v. cada 8 h, hasta obtener los resultados de los cultivos.
Otras medidas de control incluyen nutrición parenteral si no es posible una correcta alimentación oral, control hidroelectrolítico y cambios posturales en pacientes con bajo nivel de conciencia.
El tratamiento específico de la infección incluye diferentes fármacos, y su elección dependerá de la especie del parásito, de la severidad de la enfermedad y de la sensibilidad del parásito a los fármacos antimaláricos. En el tratamiento de la malaria durante el embarazo, también hay que tener en cuenta el efecto de los fármacos en el feto y la gestación.
La cloroquina pertenece a la categoría C de la Food and Drugs Administration (FDA), y se ha asociado a un aumento de las pérdidas fetales pero no a un aumento de las anomalías congénitas. A las dosis recomendadas para el tratamiento y la profilaxis de la malaria, la cloroquina es un fármaco seguro durante la gestación. En alguna ocasión se han reportado casos de parálisis del octavo par y pigmentación de la retina en el feto.
Es el fármaco de elección para el tratamiento de P. falciparum sensible y las especies P. vivax, P. ovale y P. malarie, que son por lo general sensibles a cloroquina. El tratamiento de la infección no complicada se hará por v.o., a dosis de 10 mg/kg, dosis inicial, seguido de 7,5 mg/kg a las 24 y 48 h, máximo 25 mg/kg. En la enfermedad severa, la cloroquina se administrará por vía i.v., 10 mg base/kg en infusión durante 8 h, seguida de 15 mg base/kg en infusión durante 24 h.
La infección por P. vivax y P. ovale se asocia con recaídas, debido a la presencia de formas latentes (hipnozoitos) en el hígado. La primaquina se usa para erradicar estas formas exoeritrocitarias, pero su uso durante el embarazo está contraindicado debido a la deficiencia relativa de glucosa-6-fosfato deshidrogenasa que presenta el feto de forma fisiológica, y que implicaría procesos hemolíticos. Así, la recaída por P. vivax y P. ovale se puede prevenir con cloroquina 600 mg base semanalmente durante el embarazo y la lactancia, y una vez terminada la lactancia, se administrará primaquina 15 mg 2 veces al día durante 2 semanas, previamente se comprobará que la paciente no tiene déficit de glucosa-6-fosfato deshidrogenasa.
Sin embargo, las resistencias de P. falciparum a cloroquina son cada vez mayores, y actualmente se recomienda que todos los casos de malaria por P. falciparum se consideren resistentes a cloroquina, a no ser que se evidencie lo contrario. Por ello, la quinina es el fármaco de elección en la actualidad para el tratamiento de la infección por P. falciparum. Tanto la quinina como la quinidina son fármacos ampliamente usados durante la gestación en la malaria severa o resistente. Pertenecen a la categoría D de la FDA y a dosis altas pueden estimular la contractilidad uterina, motivo por lo que inicialmente fueron usados como abortivos. Sin embargo, cuando se usan durante el segundo y tercer trimestres de la gestación a las dosis recomendadas para el tratamiento de la malaria, no se asocia con un aumento de la actividad uterina, y el mayor riesgo para el parto prematuro es la fiebre y el tratamiento inadecuado de la paciente17. En la actualidad se considera que el beneficio supera a los riesgos potenciales de su uso. Debe administrarse con precaución por el riesgo de producir hipoglucemia y efectos cardiodepresores.
En la enfermedad no severa, se administra por v.o. 10 mg base/kg (máximo 600 mg) cada 8 h durante 5-7 días. Después de 5 días o tras el aclaramiento del parásito, que en ocasiones puede prolongarse durante más tiempo, se puede administrar una dosis única de sulfadoxina-pirimetamina (Fansidar) y suspender la quinina. El Fansidar debe evitarse durante el primer trimestre por el riesgo de teratogenicidad al interferir con el metabolismo del ácido fólico18. También se debería evitar en las últimas fases del embarazo, por el riesgo de la sulfadoxina de producir kernicterus en el recién nacido al desplazar la bilirrubina indirecta de la albúmina fetal. El uso de antifolatos durante la gestación requiere suplementos de ácido fólico19.
En la enfermedad severa, la quinina se administra por vía i.v. en una dosis de ataque de 20 mg/kg infundida en 4 h, y luego una dosis de mantenimiento de 10 mg/kg infundida en 4 h cada 8 h. La clindamicina, a dosis de 10 mg/kg, es una alternativa en zonas de resistencia a la cloroquina y su papel es potenciar la acción de la quinina cuando se combina con ésta. La doxiciclina tiene el mismo papel, pero el uso de tetraciclinas durante el embarazo está contraindicado.
Cuando no está disponible la quinina, podemos sustituirla por gluconato de quinidina.
La malaria importada de Tailandia, Papúa Nueva Guinea y algunas zonas del este de Asia puede ser resistente a la quinina, Fansidar y otros fármacos1. La mefloquina puede tener cierto efecto en estos casos, pero suele recomendarse más en esquemas de quimioprofilaxis y debe evitarse en el primer trimestre de gestación.
Las otras alternativas efectivas para los fracasos en el tratamiento, solos o en combinación con la quinina, son la artemisina y sus derivados20, potentes esquizonticidas hemáticos que producen un rápido efecto en el aclaramiento del parásito. La Organización Mundial de la Salud (OMS) los recomienda actualmente sólo en casos de malaria severa resistente a otros fármacos más seguros durante el embarazo o ante la imposibilidad para obtenerlos y si está en peligro la vida de la madre. Todavía no hay estudios suficientes acerca de la seguridad de la artemisina durante el embarazo, y aunque no se ha asociado con mayor riesgo de efectos sobre el feto o el curso de la gestación21, nuestros conocimientos son aún limitados para poder recomendarlos durante el embarazo.
Nuevas combinaciones de fármacos que pueden ser usados para formas resistentes del parásito son la atovaquona-proguanil (Malarone) y proguanil-dapsona (LAPDAP). Ninguna de estas preparaciones se ha evaluado correctamente para su uso durante el embarazo, aunque hay estudios que se espera hayan concluido en breve1,5,12,16.
CONDUCTA OBSTÉTRICA
Las pacientes con malaria sintomática durante la gestación pueden presentar alteraciones en la FCF sugestivas de una PBF, como taquicardia, disminución de la variabilidad o desaceleraciones. La hipoglucemia puede producir efectos similares. Generalmente no está indicado el parto inmediato, y se debería intentar la estabilización del estado materno e iniciar el tratamiento específico antes de considerar la finalización de la gestación. Las alteraciones de la FCF se resuelven a menudo cuando se logra el control de la fiebre, la hipoglucemia y se inicia el tratamiento antimalárico.
Ya hemos dicho que la malaria puede producir también amenaza de parto prematuro, por lo que es importante descartar esta complicación mediante una monitorización de la dinámica uterina y una exploración vaginal. Si se logra frenar el trabajo del parto, se debe monitorizar el bienestar fetal mediante registros cardiotocográficos (RCTG) periódicos y, ante la presencia de signos que indiquen PBF, finalizar la gestación.
En las gestantes con malaria aguda también puede haber evidencia ultrasonográfica de insuficiencia en la circulación uteroplacentaria, con un notch bilateral en la arteria uterina, oligohidramnios y evidencia de redistribución en la circulación fetal. Estos hallazgos pueden acompañarse de otros signos sugestivos de preeclampsia, como trombocitopenia, aumento del urato sérico y proteinuria significativa.
Estas alteraciones se pueden resolver durante el curso del tratamiento y, en principio, el embarazo podría seguir adelante. Sin embargo, se debe mantener un estrecho control del crecimiento y del bienestar fetal durante el resto de la gestación, y ante la evidencia de PBF o restricción en el crecimiento intrauterino estaría indicada su finalización1.
Son pocos los estudios que hay sobre la conducta obstétrica en la gestante con malaria. Un posible protocolo de actuación sería:
Ecografías periódicas para valorar el crecimiento fetal, y ecografía-Doppler para detectar precozmente una insuficiencia en la circulación uteroplacentaria.
Monitorización fetal no estresante periódica para comprobar el bienestar fetal.
Control de la amenaza de parto prematuro, si se desencadena éste, con tratamiento tocolítico. Valorar la necesidad de maduración pulmonar fetal con corticoides en gestaciones menores de 34 semanas. Sin embargo, las pacientes con malaria cerebral no deberían recibir corticoides, debido al efecto inmunodepresor de éstos y su asociación con un aumento del riesgo de infecciones22,23.
De todos modos, en gestaciones viables, ante la presencia de algún signo que indique PBF, se debe finalizar la gestación24-26 (tabla 2).