Con el aumento de la disponibilidad y calidad técnica de la resonancia magnética (RM), ha ido siendo posible avanzar hacia un diagnóstico más preciso y precoz de enfermedades desmielinizantes como la esclerosis múltiple (EM). Como contrapartida, también ha aumentado el número de hallazgos que pueden llevar a un diagnóstico erróneo de EM y, por tanto, a un tratamiento innecesario. Un estudio norteamericano multicéntrico1 recogió pacientes diagnosticados erróneamente de EM y analizó las posibles causas. Exceptuando las enfermedades del espectro NMO, casi todos los diagnósticos finales (trastornos conversivos, migraña, fibromialgia, etc.) carecían, al igual que la EM, de un biomarcador específico. Hasta un 24% de los pacientes erróneamente diagnosticados lo fueron por un neurólogo especialista en EM, y hasta un 70% recibieron tratamientos modificadores de la enfermedad (en ocasiones con iatrogenia significativa) y mantuvieron el diagnóstico a lo largo de años. Uno de los factores más implicados en el error diagnóstico fue la sobreinterpretación de los hallazgos de RM, que pueden tener múltiples orígenes2. Es por ello que los nuevos criterios de McDonald de 20173 hacen hincapié en la importancia de la clínica, describiendo «red flags» y situaciones en las que prima ser cauteloso en la aplicación de los mismos (pacientes asintomáticos o con una clínica atípica), y recomiendan en estos casos ampliar estudios analíticos y radiológicos4.
Describimos el caso de una mujer de 19 años, migrañosa, sin más síntomas neurológicos previos o actuales, que fue derivada a nuestra unidad de EM por el hallazgo en la RM cerebral (realizada durante el estudio de la migraña) de lesiones de sustancia blanca subcorticales y periventriculares que podían apuntar en su contexto a una EM. La paciente tenía antecedentes de enfermedad de Caroli incompleta (ectasia congénita de vía biliar intrahepática) y síndrome de Laubry-Pezzi (cardiopatía congénita consistente en comunicación interventricular alta e insuficiencia aórtica secundaria). La exploración neurológica era estrictamente normal y no presentaba episodios previos que sugirieran brotes. Se completó el estudio con una punción lumbar, cuyos resultados citobioquímicos e inmunológicos resultaron normales. Ante la duda diagnóstica, se recuperaron las imágenes radiológicas para una revisión detallada (fig. 1). Las lesiones subcorticales eran de aspecto inespecífico y se consideraron un hallazgo incidental en paciente con historia de cefalea5. En cuanto a las lesiones periventriculares, presentaban una menor hiperintensidad en secuencias potenciadas en T2 (isointensas con respecto a la corteza cerebral) y tenían una morfología nodular que protruía sobre los ventrículos laterales, sin captación de contraste. Fueron finalmente orientadas como una heterotopia cortical periventricular. La paciente no confirmó antecedentes familiares de interés. En la reexploración se objetivó hiperlaxitud articular e hipertelorismo.
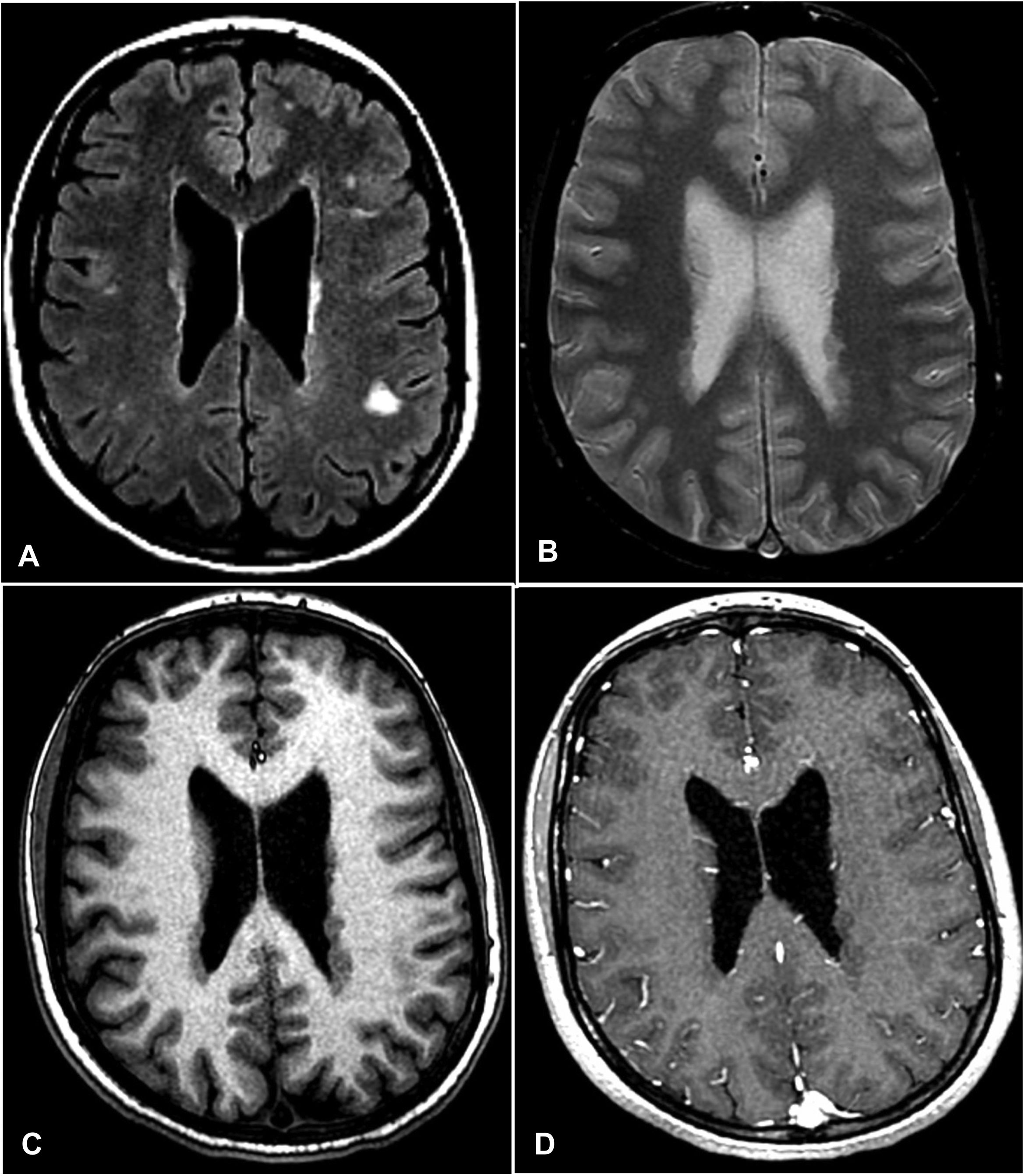
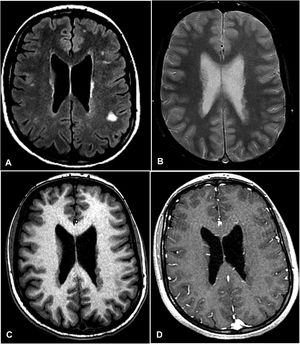
A. Secuencia FLAIR en la que se aprecian hiperintensidades subcorticales y algunas isointensas con la corteza cerebral, visibles también en la secuencia T2 de densidad protónica (B). C. En la secuencia potenciada en T1 se aprecia que las lesiones periventriculares se corresponden con imágenes nodulares isointensas con la corteza cerebral que no se realzan tras la administración de gadolinio (D). Las imágenes periventriculares son altamente indicativas de heterotopia cortical periventricular, mientras que las lesiones subcorticales hiperintensas en FLAIR tienen características inespecíficas y no son concluyentes para el diagnóstico de esclerosis múltiple.
Dadas las múltiples alteraciones congénitas de la paciente, se remitió al Servicio de Genética Clínica. Tras el adecuado asesoramiento genético, un primer estudio mediante array no mostró alteraciones destacables, por lo que se realizó un análisis del exoma clínico, donde se identificó una variante probablemente patogénica en el gen FLNA en heterocigosis, no descrita previamente en la literatura ni en las bases de datos poblacionales. Dicho gen codifica la proteína FLNA – filamina A–, que se une a la actina y a muchos otros ligandos con diversas funciones estructurales celulares6. La variante hallada consiste en una deleción de 4 nucleótidos (c.6981_6984del) en el exón 42 de los 47 totales, que produce presumiblemente un cambio en la pauta de lectura y la aparición de un codón de parada prematuro (p.T2328Ffs*9). Se han descrito variantes patogénicas en el gen FLNA asociadas, entre otras, a displasias valvulares cardiacas7, heterotopia periventricular nodular8 y a síndromes del espectro fenotípico de la osteodisplasia otopalatodigital con características del síndrome de Ehlers-Danlos (hiperlaxitud cutánea e hipermovilidad articular)9,10. Dado que la paciente presentaba dichas manifestaciones, esta variante no descrita fue considerada probablemente patogénica. Dicho gen se transmite siguiendo un patrón de herencia ligado al cromosoma X, por lo que actualmente la madre de la paciente se encuentra pendiente de estudio genético. Se realizó el asesoramiento genético postest incluyendo asesoramiento preconcepcional.
En resumen, presentamos un caso en el que unas lesiones incidentales en una RM cerebral que inicialmente se atribuyeron a un origen desmielinizante inflamatorio resultaron finalmente una heterotopia nodular periventricular, iniciándose así un estudio genético que permitió describir una nueva mutación patogénica en el gen FLNA. Esto es solo un ejemplo de la enorme importancia de la interpretación radiológica de las lesiones de sustancia blanca, así como de su correcta valoración en el contexto clínico propio de cada paciente.